TRELEGY ELLIPTA 100/62.5/25 mcg kullanıma hazır inhilasyon tozu 30 adet Kısa Ürün Bilgisi
{ Flutikazon Froat + Umeklidinyum Bromur + Vilanterol }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
TRELEGY ELLIPTA 100 mcg + 62,5 mcg + 25 mcg kullanıma hazır inhalasyon tozu
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
TRELEGY ELLIPTA her bir dozunda; 100 mikrogram flutikazon furoat,
62,5 mikrogram umeklidinyuma eşdeğer 74,2 mikrogram umeklidinyum bromür, 25 mikrogram vilanterole eşdeğer 40 mikrogram vilanterol trifenatat içerir.
Ağızlıktan çıkan doz;
92 mikrogram flutikazon furoat,
55 mikrogram umeklidinyum (65 mikrogram umeklidinyum bromüre eşdeğer), 22 mikrogram vilanterol (vilanterol trifenatat olarak) içerir.
Yardımcı maddeler
Her bir doz yaklaşık olarak 25 mg laktoz (monohidrat olarak) içerir (inek sütünden elde edilir). Yardımcı maddelerin tam listesi için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Kullanıma hazır inhalasyon tozu.
Bej renkli inhaler kapağı ve dahili bir doz sayacı olan açık gri inhaler (Ellipta) içinde beyaz toz.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Astım
TRELEGY ELLIPTA astımı olan yetişkin hastalarda idame tedavisi olarak endikedir (bkz Bölüm 5.1).
KOAH (Kronik Obstrüktif Akciğer Hastalığı)
TRELEGY ELLIPTA orta ve ağır kronik obstrüktif akciğer hastalığında (KOAH), inhale kortikosteroid ile birlikte uzun etkili β2-agonist kombinasyonu veya uzun etkili β2-agonist ile birlikte uzun etkili muskarinik antagonist kombinasyonu kullanılmasına rağmen yeterli tedavi sağlanamayan hastaların idame tedavisinde semptom kontrolü ve alevlenmelerin engellenmesi için endikedir.
4.2. Pozoloji ve uygulama şekli
Astım
Erişkinler
Astım hastalarına hastalıklarının şiddetine bağlı olarak uygun flutikazon furoat (FF) dozu içeren TRELEGY ELLIPTA dozu verilmelidir; bu doz, her gün aynı saatte günde bir kez TRELEGY ELLIPTA 100/62,5/25 mcg içeren bir inhalasyondur.
Düşük ila orta doz inhale kortikosteroid ile kombinasyon halinde uzun etkili bir muskarinik antagonist ve uzun etkili bir betaagonistine ihtiyaç duyan yetişkinlerde, başlangıç dozu olarak her gün aynı saatte günde bir kez TRELEGY ELLIPTA 100/62,5/25 mcg inhalasyonu düşünülmelidir.
Hastalar aldıkları flutikazon furoat/umeklidinyum/vilanterol dozunun optimal olarak devam etmesini ve yalnızca tıbbi tavsiyeye göre değiştirilmesini sağlamak amacıyla bir sağlık mesleği mensubu tarafından düzenli şekilde tekrar incelenmelidir. Doz etkili semptom kontrolünün sağlandığı en düşük doza titre edilmelidir.
Hastalar flutikazon furoat/vilanterol inhalasyonundan sonraki 15 dakika içinde solunum fonksiyonunda iyileşme yaşamaktadır ve TRELEGY ELLIPTA kullanımında da benzer bir etki beklenmektedir. Ancak, hastalara astım semptomların devamlı kontrolü için ilacı her gün düzenli olarak kullanmaları ve asemptomatik olduklarında bile devam etmeleri gerektiği bildirilmelidir.
İki doz arasındaki sürede semptomlar ortaya çıkarsa, hemen rahatlama sağlamak için inhale kısa etkili bir betaagonisti kullanılmalıdır.
KOAH
Erişkinler
Önerilen ve maksimum doz günün aynı saatinde inhalasyon yoluyla bir kez alınan TRELEGY ELLIPTA için 100/62.5/25 mikrogramdır.
Eğer bir doz atlanırsa, bir sonraki doz ertesi gün aynı saatte uygulanmalıdır.
Uygulama şekli
TRELEGY ELLIPTA sadece inhalasyon yoluyla kullanılır.
Kullanma talimatı:
Aşağıdaki kullanma talimatları 30 dozluk (30 günlük tedarik) Ellipta inhalasyon cihazı içindir; aynı şekilde 14 dozluk (14 günlük tedarik) Ellipta inhalasyon cihazı için de geçerlidir.
Dozun hazırlanması
Doz inhalasyonu yapmaya hazır olduğunuzda kapağı açınız. İnhalasyon cihazı çalkalanmamalıdır.
"Klik" sesi duyana kadar kapağı aşağı doğru tamamen çekiniz. Artık tıbbi ürün kullanıma hazırdır.
Doz sayıcı teyit etmek için geriye doğru 1'er doz saymaktadır. Eğer âklikâ sesi duyulduğunda doz sayacı geri saymazsa, inhalasyon cihazı doz uygulamayacaktır ve danışmak için cihazın bir eczacıya götürülmesi gerekmektedir.
4.3. Kontrendikasyonlar
TRELEGY ELLIPTA içeriğinde bulunan etkin madde veya bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılığı olan hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Akut kullanım için değildir.
TRELEGY ELLIPTA'nın akut bronkospazm epizotlarının tedavisi, akut astım semptomlarının tedavisi ya da akut KOAH alevlenmesinin tedavisi (yani, kurtarma tedavisi olarak) için kullanımını destekleyen klinik veriler yoktur.
Hastalığın kötüleşmesi
Semptomları rahatlatmak için artan kısa etkili bronkodilatör kullanımı, kontrolün bozulduğunu gösterebilir. TRELEGY ELLIPTA ile tedavi sırasında astım ya da KOAH'ın kötüleşmesi durumunda, hastanın ve astım ya da KOAH tedavi rejiminin yeniden değerlendirmesi yapılmalıdır.
Hastalar TRELEGY ELLIPTA tedavisini hekimlerinin gözetimleri olmaksızın kesmemelidir çünkü belirtiler tedaviyi kestikten sonra tekrarlayabilir.
TRELEGY ELLIPTA tedavisi sırasında astımla ilişkili advers olaylar ve alevlenmeler yaşanabilir. Hastalara tedaviye devam etmeleri ama TRELEGY ELLIPTA başlatıldıktan sonra astım semptomlarında kontrol sağlanamazsa veya semptomlar kötüleşirse doktora başvurmaları söylenmelidir.
Paradoksal bronkospazm
Flutikazon furoat/umeklidinyum/vilanterol dozun uygulanmasını takiben ani hırıltılı solunum ve nefes darlığıyla birlikte paradoksal bronkospazm oluşturabilir ve yaşamı tehdit edebilir. TRELEGY ELLIPTA tedavisi paradoksal bronkospazm oluştuğu takdirde derhal kesilmelidir. Hasta değerlendirilmeli ve eğer gerekliyse alternatif tedavi başlanmalıdır.
Kardiyovasküler etkiler
Umeklidinyum ve vilanterol gibi muskarinik reseptör antagonistleri ve sempatomimetiklerin uygulanmasından sonra kardiyak aritmiler (ör. atriyal fibrilasyon ve taşikardi) gibi kardiyovasküler etkiler görülebilir. Bu nedenle, TRELEGY ELLIPTA stabil olmayan veya hayatı tehdit edici kardiyovasküler hastalıkları olanlarda dikkatli kullanılmalıdır.
Karaciğer yetmezliği olan hastalar
Orta şiddetli ve şiddetli karaciğer yetmezliği olan ve TRELEGY ELLIPTA almakta olan hastalarda 100/62,5/25 mcg dozu kullanılmalı ve hastalar kortikosteroidler ile ilişkili sistemik advers reaksiyonlar için izlenmelidir (bkz. Bölüm 5.2).
Sistemik kortikosteroid etkiler
Uzun süreler için reçete edilmiş yüksek dozlar başta olmak üzere, tüm inhale kortikosteroidler ile sistemik etkiler görülebilir. Bu etkilerin, oral kortikosteroidlere kıyasla görülme olasılığı daha düşüktür.
Görme bozukluğu
Sistemik ve topikal kortikosteroid kullanımı ile görme bozukluğu bildirilebilir. Bir hasta bulanık görme ya da diğer görme bozuklukları semptomlarıyla başvurursa, hasta sistemik ve topikal kortikosteroid kullanımından sonra bildirilmiş katarak, glokom veya santral seröz koryoretinopati (CSCR) gibi nadir hastalıkları içerebilecek olası nedenlerin değerlendirilmesi için bir oftalmoloji uzmanına sevk edilmelidir.
Eşlik Eden Koşullar
TRELEGY ELLIPTA konvülziyon bozukluğu veya tirotoksikozu olan hastalarda, beta- adrenerjik agonistlere gereğinden fazla yanıtlı hastalarda dikkatli kullanılmalıdır.
TRELEGY ELLIPTA pulmoner tüberkülozlu veya kronik veya tedavi edilmemiş infeksiyonu olan hastalarda dikkatli verilmelidir.
Antikolinerjik aktivite
TRELEGY ELLIPTA üriner retansiyonu veya dar açılı glokomu olan hastalarda dikkatli kullanılmalıdır. Hastalara akut dar açılı glokomun belirti ve semptomları hakkında bilgi verilmeli ve bu belirti veya semptomların gelişmesi halinde derhal TRELEGY ELLIPTA kullanmayı bırakarak doktorlarını aramaları gerektiği konusunda bilgilendirilmelidir.
KOAH hastalarında pnömoni
Hastaneye yatış gerektiren pnömoni de dahil olmak üzere inhale kortikosteroid alan KOAH hastalarında pnömoni insidansında bir artış gözlenmiştir. Steroid dozundaki artış ile pnömoni riskinde artış olduğuna dair bazı kanıtlar vardır, fakat bu durum tüm çalışmalarda kesin olarak gösterilmemiştir.
İnhale kortikosteroid ürünleri arasında pnömoni riskinin büyüklüğü konusunda sınıf içi farklılıklar ile ilgili kesin klinik kanıtlar yoktur.
Pnömoninin klinik özellikleri KOAH alevlenme semptomları ile benzer olduğundan, hekimler
KOAH hastalarında olası pnömoni gelişimi konusunda dikkatli olmalıdır.
KOAH hastalarında pnömoni risk faktörleri arasında sigara içmek, ileri yaş, düşük vücut kitle indeksi (VKİ) ve ağır KOAH sayılabilir.
Astım hastalarında pnömoni
Yüksek dozlarda inhale kortikosteroid alan astım hastalarında pnömoni insidansındaki artış dışlanamaz. Bu durum flutikazon furoat/vilanterol ile elde edilen klinik deneyime dayanmaktadır; bu deneyime göre, flutikazon furoat/vilanterol 100/25 mcg ve plasebo ile karşılaştırıldığında flutikazon furoat/vilanterol 200/25 mcg dozunda pnömoni riskinde artma eğilimi görülmüştür.
Hipokalemi
Beta-adrenerjik agonistler bazı hastalarda advers kardiyovasküler etkiler yaratabilecek ciddi hipokalemiye yol açabilirler. Serum potasyumunda azalma genellikle geçicidir ve yerine koyma tedavisi gerektirmez.
Klinik çalışmalarda, önerilen terapötik TRELEGY ELLIPTA dozlarında klinik olarak anlamlı hipokalemi etkilerine rastlanmamıştır. TRELEGY ELLIPTA, hipokalemi yapma potansiyeline sahip başka bir tıbbi ürün ile birlikte kullanıldığında dikkatli olunmalıdır (bkz. Bölüm 4.5).
Hiperglisemi
Beta-adrenerjik agonistler bazı hastalarda geçici hiperglisemiye yol açabilir. Klinik çalışmalarda önerilen terapötik flutikazon furoat/umeklidinyum/vilanterol dozlarında plazma glukozu üzerinde klinik olarak anlamlı etkiler gözlenmemiştir. Fakat flutikazon furoat/umeklidinyum/vilanterol kullanımının diyabetik hastalarda kan glukoz seviyelerini yükselttiği bildirilmiştir. Bu nedenle diabetes mellitus hikayesi olan hastalara flutikazon furoat/umeklidinyum/vilanterol reçete ederken bu durum göz önünde bulundurulmalıdır. Diyabetik hastalarda TRELEGY ELLIPTA tedavisi başlandığında plazma glukozu daha yakından izlenmelidir.
Yardımcı maddeler
Bu tıbbi ürün laktoz içermektedir. Galaktoz intoleransı, total laktaz eksikliği ve glukoz-galaktoz malabsorpsiyonu gibi nadir kalıtımsal sorunları olan hastalar bu ilacı kullanmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
İnhale dozlamın ardından elde edilen düşük plazma konsantrasyonlarından dolayı klinik dozlarda flutikazon furoat/umeklidinyum/vilanterole bağlı klinik olarak anlamlı ilaç etkileşimlerinin olası olmadığı düşünülmektedir.
Beta blokerlerle etkileşim
Beta-adrenerjik blokerler vilanterol gibi beta-adrenerjik agonisterin etkilerini zayıflatabilir veya antagonize edebilirler. Eğer beta blokerler gerekliyse, kardiyoselektif beta blokerler tercih edilmelidir, fakat hem selektif hem de non-selektif beta blokerlerin eş zamanlı kullanımlarında dikkatli olunmalıdır.
CYP3A4 inhibitörüyle etkileşim
Flutikazon furoat ve vilanterol, CYP3A4 enziminin aracılık ettiği kapsamlı ilk geçiş metabolizması ile hızlı şekilde vücuttan uzaklaştırılmaktadır.
Güçlü CYP3A4 inhibitörleri (örn., ketokonazol, ritonavir, kobisistat içeren ürünler) ile birlikte uygulandığında, hem flutikazon furoat hem de vilanterole artmış sistemik maruziyet potansiyeli sonucu artmış advers reaksiyonlar potansiyeli bulunduğundan dikkat gösterilmesi tavsiye edilir. Uygulamanın faydası sistemik kortikosteroid advers reaksiyonları açısından artmış riske ağır basmadığı sürece birlikte uygulamadan kaçınılmalıdır; birlikte uygulama durumunda hastalar sistemik kortikosteroid advers reaksiyonları açısından izlenmelidir. Sağlıklı gönüllülerde flutikazon furoat/vilanterol kombinasyonu (184/22 mikrogram) ve ketokonazol (400 miligram, güçlü bir CYP3A4 inhibitörü) ile bir tekrarlanan doz çalışması yürütülmüştür. Birlikte uygulama ortalama flutikazon furoat EAAve Cdeğerlerini sırasıyla %36 ve %33 artırmıştır. Flutikazon furoat maruziyetindeki artış 0-24 saatlik ağırlıklandırılmış ortalama serum kortizolde %27 azalma ile ilişkilendirilmiştir. Birlikte uygulama ortalama vilanterol EAA) ve Cdeğerlerini sırasıyla %65 ve %22 artırmıştır. Vilanterol maruziyetindeki artış kalp hızı veya kan potasyumu üzerinde beta-agonist ile ilişkili sistemik etkilerle ilişkilendirilmemiştir.
CYP2D6 inhibitörleri/CYP2D6 polimorfizmi ile etkileşim
Umeklidinyum sitokrom P450 2D6'nın (CYP2D6) bir substratıdır. Umeklidinyumun kararlı durum farmakokinetiği, CYP2D6 eksikliği olan (zayıf metabolize edenler) sağlıklı gönüllülerde değerlendirilmiştir. Terapötik dozun 8 katından yüksek dozda, umeklidinyum EAA veya Cmaks üzerinde herhangi bir etki gözlenmemiştir. 16 kat yüksek dozda, umeklidinyum EAA'da
1.3 kat artış gözlenmiştir ve umeklidinyum C'ı üzerinde herhangi bir etki gözlenmemiştir. Bu değişikliklerin büyüklüğüne bağlı olarak, flutikazon furoat/umeklidinyum/vilanterol ile CYP2D6 inhibitörlerinin birlikte verilmesinde veya CYP2D6 genetik eksikliği bulunan hastalara (zayıf metabolize edenler) uygulandığında klinik olarak anlamlı bir ilaç etkileşimi beklenmemektedir.
P-glikoprotein inhibitörleri ile etkileşim
Flutikazon furoat, umeklidinyum, ve vilanterol, P-glikoprotein (P-gp) taşıyıcısı substratıdır. Orta düzeyde P-gp inhibitörü verapamilin (günde bir kez 240 mg) umeklidinyum ve vilanterolün kararlı durum farmakokinetiği üzerindeki etkisi sağlıklı gönüllülerde değerlendirilmiştir. Verapamilin umeklidinyum veya vilanterol Cüzerinde etkisi
gözlenmemiştir. Umeklidinyum EAA değerinde yaklaşık 1.4 kat artış gözlenirken vilanterol EAA değerinde değişim gözlenmemiştir. Bu değişikliklerin büyüklüğüne dayanarak flutikazon furoat/umeklidinyum/vilanterolün P-gp inhibitörleriyle birlikte kullanıldığında klinik açıdan anlamlı bir etkileşim beklenmemektedir. Özgül bir P-gp inhibitörü ile flutikazon furoat arasında klinik farmakolojik çalışma yapılmamıştır.
Diğer uzun etkili antimuskarinikler ve uzun etkili beta- adrenerjik agonistler
TRELEGY ELLIPTA ile diğer uzun etkili muskarinik antagonistlerin veya uzun etkili beta- adrenerjik agonistlerin eş zamanlı verilmeleri ile ilgili çalışma yapılmamıştır ve eş zamanlı kullanımları advers reaksiyonları ortaya çıkartabileceği için önerilmez (bkz. Bölüm 4.8 ve Bölüm 4.9).
Hipokalemi
Eş zamanlı metilksantin türevleri, steroidler veya potasyum tutucu olmayan diüretik kullanımı beta-adrenerjik agonisterin olası hipokalemik etkilerini güçlendirebilir. Bu nedenle dikkatli olunmalıdır. (bkz. Bölüm 4.4)
Özel popülasyona ilişkin ek bilgiler
Veri bulunmamaktadır.
Pediyatrik popülasyon
Veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Genel tavsiyeGebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon) uygulayanlarda kullanımına ilişkin herhangi bir veri yoktur.
Gebelik dönemi
Flutikazon furoat/umeklidinyum/vilanterolün gebe kadınlarda kullanımına ilişkin sınırlı veri bulunmaktadır. Hayvanlar üzerinde yapılan çalışmalar, klinik olarak ilgili olmayan maruziyetlerde üreme toksisitesi göstermiştir (bkz. bölüm 5.3).
TRELEGY ELLIPTA gebelik döneminde, sadece anne için beklenen yararları fetüs için olası risklerden fazla olduğunda kullanılmalıdır.
Laktasyon dönemi
Flutikazon furoat/umeklidinyum/vilanterol veya metabolitlerinin insan sütüne geçip geçmediği bilinmemektedir. Fakat diğer kortikosteroidler, muskarinik antagonistler ve beta-adrenerjik agonistler insan sütünde tespit edilmiştir. Yeni doğanlarda/infantlarda bu risk göz ardı edilemez. Emzirmenin bebeğe ve tedavinin anneye yararı dikkate alınarak, emzirmenin kesilmesi veya TRELEGY ELLIPTA tedavisinin kesilmesinden hangisinin yapılması gerektiği konusunda bir karara varılmalıdır.
Üreme yeteneği/Fertilite
Flutikazon furoat/umeklidinyum/vilanterol insanlarda fertilite üzerindeki etkilerine ilişkin veri mevcut değildir. Hayvan çalışmaları flutikazon furoat, umeklidinyum veya vilanterolün erkek veya kadın fertilitesi üzerinde herhangi bir etki oluşturmadığını göstermiştir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Flutikazon furoat/umeklidinyum/vilanterolün araç ve makine kullanımı üzerine bir etkisi yoktur
ya da etkisi göz ardı edilebilir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
TRELEGY ELLIPTA ile en sık bildirilen istenmeyen etkiler nazofarenjit (%7), baş ağrısı (%5) ve üst solunum yolu enfeksiyonu (%2) olmuştur.
TRELEGY ELLIPTA'nın güvenlilik profili, astım üzerinde gerçekleştirilen bir Faz 3 klinik çalışmada ve KOAH üzerinde gerçekleştirilen üç adet Faz 3 klinik çalışmada elde edilen verilere dayanmaktadır. Astım klinik geliştirme programında, toplam 1.623 yetişkin gönüllüdeki advers reaksiyonlar değerlendirilmiştir. KOAH klinik geliştirme programında, toplam 5.589 yetişkin gönüllü advers reaksiyonların birleştirilmiş değerlendirmesine dahil edilmiştir.
TRELEGY ELLIPTA'nın güvenlilik profili, üç adet Faz 3 klinik çalışmadan ve spontan raporlamadan elde edilen verilere dayanmaktadır. KOAH üzerinde gerçekleştirilen ilk çalışma, flutikazon furoat/umeklidinyum/vilanterol 100/62,5/25 mcg'ı 24 haftaya kadar günde bir kez kullanan ve KOAH'ı bulunan 911 hastadan elde edilen güvenlilik verilerini içermiştir ve bu hastaların 210'u flutikazon furoat/umeklidinyum/vilanterol 100/62,5/25 mcg'ı bir aktif komparatör ile birlikte 52 haftaya kadar kullanmıştır (CTT116853, FULFIL çalışması).
KOAH üzerinde gerçekleştirilen ikinci çalışma, flutikazon furoat/umeklidinyum/vilanterol 100/62,5/25 mcg'ı kullanan ve KOAH'ı bulunan 527 hastadan ve flutikazon furoat/vilanterol 100/25 mcg+umeklidinyum 55 mcg kullanan 528 hastadan elde edilen güvenlilik verilerini içermiştir (24 haftaya kadar günde bir kez, 200812 çalışması).
KOAH üzerinde gerçekleştirilen üçüncü çalışma, flutikazon furoat/umeklidinyum/vilanterol 100/62,5/25 mcg'ı iki aktif komparatör ile birlikte 52 haftaya kadar günde bir kez kullanan ve KOAH'ı bulunan 4151 hastadan elde edilen güvenlilik verilerini içermiştir (CTT116855, IMPACT çalışması).
Çalışmalar arasında advers reaksiyon sıklığında farklılık olduğu durumlarda, daha yüksek sıklık
belirtilmiştir.
4.8. İstenmeyen etkiler
Bu çalışmalar sırasında tespit edilen istenmeyen etkiler MedDRA sistem organ sınıflandırmasına göre liste halinde sunulmaktadır.
İstenmeyen etkilerin sınıflandırılması için aşağıdaki sınıflandırma ölçeği kullanılmıştır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Çok yaygın: Nazofarenjit
Yaygın: Pnömoni*, üst solunum yolu enfeksiyonu, bronşit, farenjit, rinit, sinüzit, influenza, ağız ve boğazda kandidiyaz, üriner sistem enfeksiyonu, viral solunum sistemi enfeksiyonu
Bağışıklık sistemi hastalıkları
Seyrek: Anafilaksi, anjiyoödem, ürtiker ve döküntüyü içeren hipersensitivite reaksiyonları
Sinir sistemi hastalıkları Yaygın: Baş ağrısı Yaygın olmayan: Disguzi
Göz hastalıkları
Yaygın olmayan: Bulanık görme (bkz. Bölüm 4.4), glokom, göz ağrısı Seyrek: Göz içi basıncında artış
Kardiyak hastalıklar
Yaygın olmayan: Supraventriküler taşiaritmi, taşikardi, atriyal fibrilasyon
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın: Öksürük, orofarenjiyal ağrı, disfoni
Gastrointestinal hastalıklar Yaygın: Konstipasyon Yaygın olmayan: Ağızda kuruluk
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları
Yaygın: Artralji, sırt ağrısı Yaygın olmayan: Kırıklar
Seçilmiş advers olayların tanımı
*Pnömoni (bkz. Bölüm 4.4) KOAH
İleri evre KOAH hastası olan toplam 1810 hastanın (ortalama post bronkodilatör taraması beklenen FEV'in %45'i, standart sapma (SD) %13) %65'i çalışmaya alınmadan önceki yıl içerisinde orta/şiddetli bir KOAH alevlenmesi geçirmiştir (çalışma CTT116853). TRELEGY ELLIPTA alan hastalarda (20 hasta, %2) budesonid/formoterol (7 hasta, <%1) alan hastalara kıyasla 24 haftaya kadar yüksek pnömoni olayları insidansı vardır. 24 haftaya kadar hastanede yatışı gerektiren pnömoni TRELEGY ELLIPTA alan hastalarda %1 ve budesoonid/formoterol alanlarda <%1 olarak gerçekleşmiştir. TRELEGY ELLIPTA alan 1 hastada ölümcül pnömoni bildirilmiştir. 52 haftaya kadar tedavisine devam edilen 430 kişilik altgrupta pnömoni olaylarının insidansı TRELEGY ELLIPTA ve budesonid/formoterol kollarında eşit (%2) olarak bildirilmiştir. TRELEGY ELLIPTA ile pnömoni insidansı, KOAH için yapılan flutikazon furoat/vilanterol (FF/VI) klinik çalışmalarının flutikazon furoat/vilanterol (FF/VI) 100/25 kolunda görülen insidans ile benzerdir.
Önceki 12 ay içerisinde orta veya şiddetli alevlenme öyküsü olan 10.355 KOAH hastasında (ortalama post bronkodilatör FEVbeklenenin %46'sı, standart sapma (SD) %15) yürütülen 52 haftalık bir çalışmada (çalışma CTT116855), pnömoni insidansı TRELEGY ELLIPTA (n = 4.151) için %8 (312 hasta), flutikazon furoat/vilanterol (n = 4.134) için %7 (282 hasta) ve umeklidinyum/vilanterol (n = 2.070) için %5 (95 hasta) olmuştur. TRELEGY ELLIPTA kullanan 4.151 hastanın 12'sinde (1.000 hasta yılında 3,5), flutikazon furoat/vilanterol kullanan
4.134 hastanın 5'inde (1.000 hasta yılında 1,7) ve umeklidinyum/vilanterol kullanan 2.070 hastanın 5'inde (1.000 hasta yılında 2,9) ölümle sonuçlanan pnömoni gerçekleşmiştir.
Astım
52 haftaya kadar tedavi uygulanan astım hastalarında (çalışma 205715), pnömoni insidansı TRELEGY ELLIPTA 100/62,5/25 mcg için %1 (406 hastada 5), TRELEGY ELLIPTA
200/62,5/25 mcg için <%1'dir (408 hastada 4). Pnömoni insidansı flutikazon furoat/vilanterol 100/25 mcg grubunda (407 hastada 7) ve flutikazon furoat/vilanterol 200/25 mcg grubunda (406 hastada 7) %2'dir. Hastaneye yatış gerektiren pnömoni olaylarının insidansı TRELEGY ELLIPTA ve FF/VI gruplarında benzerdir (tüm gruplarda <%1). Ölümcül pnömoni olayı görülmemiştir.
Pazarlama sonrası verileri
Bağışıklık sistemi hastalıkları
Seyrek: Anafilaksi, anjiyoödem, ürtiker ve döküntüyü içeren hipersensitivite reaksiyonları
Göz hastalıkları
Yaygın olmayan: Bulanık görme (bkz. Bölüm 4.4), glokom, göz ağrısı Seyrek: Göz içi basıncında artış
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
TRELEGY ELLIPTA'nın doz aşımında her bir farmakolojik bileşenin yol açacağı farmakolojik etkiler ile ilişkili bulgu, belirti veya advers etkiler görülecektir (örn., Cushing sendromu, Cushingoid özellikler, adrenal baskılanması, kemik mineral yoğunluğunda azalma, ağız kuruluğu, görsel uyum bozuklukları, taşikardi, aritmiler, titreme, baş ağrısı, çarpıntı, bulantı, hiperglisemi ve hipokalemi).
TRELEGY ELLIPTA'nın doz aşımı için herhangi bir spesifik tedavi mevcut değildir. Doz aşımı görülmesi halinde, gerektiği şekilde uygun izleme önlemleri ile destekleyici tedavi uygulanmalıdır.
Kardiyoselektif beta blokajı, sadece klinik olarak ciddi ve destek tedavilerine yanıt vermeyen belirgin vilanterol doz aşımı etkilerinde düşünülmelidir. Kardiyoselektif beta-bloker tıbbi ürünler bronkospazm öyküsü olan hastalarda dikkatli kullanılmalıdır.
İleri evre tedavi klinik olarak endike ise veya mümkünse ulusal zehirlenme merkezinin
önerilerine göre yürütülmelidir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Solunum sistemi, obstrüktif solunum yolu hastalıkları için ilaçlar, koritkosteroidlerle birlikte üçlü kombinasyon dahil antikolinerjiklerle kombine adrenerjikler ATC kodu: R03AL08
Etki mekanizması
İnhale sentetik kortikosteroid, uzun etkili muskarinik reseptör antagonisti ve uzun etkili beta- adrenerjik agonist (İKS/LAMA/LABA) kombinasyonudur. Oral inhalasyonu takiben umeklidinyum ve vilanterol farklı mekanizmalar ile havayollarında bronkodilatasyon oluşturur ve flutikazon furoat ise enflamasyonu azaltır.
Flutikazon furoat
Flutikazon furoat, potent anti-enflamatuvar etkiye sahip bir kortikosteroiddir. Flutikazon furoat'ın KOAH semptomları üzerindeki etkisine dair kesin mekanizması bilinmemektedir. Kortikosteroidlerin, çoklu hücre tipleri (örn. eozinofiller, makrofajlar, lenfositler) ve mediyatörler (örn. enflamasyonda görülen sitokinler ve kemokinler) üzerinde çok çeşitli etkilere sahip oldukları görülmüştür.
Umeklidinyum
Umeklidinyum uzun etkili muskarinik bir reseptör antagonistidir (ayrıca antikolinerjik olarak da anılır). Umeklidinyum, bronkodilatör aktivitesini, asetilkolinin solunum yolu düz kasındaki muskarinik asetilkolin reseptörlerine bağlanmasını kompetitif olarak inhibe ederek gösterir. Klinik öncesi modellerde akciğerlere doğrudan uygulandığında, in vitro insan M3 muskarinik reseptör alt türünde yavaş reversibilite ve in vivo uzun etki süresi gösterir.
Vilanterol
Vilanterol bir selektif uzun etkili beta-adrenerjik agonistidir (LABA). Vilanterol dahil olmak üzere beta-adrenoseptör agonisti ilaçların farmakolojik etkileri, en azından kısmen de olsa adenozin trifosfatın (ATP) siklik-3â², 5â²-adonezin monofosfata (siklik AMP) dönüşmesinde katalizör görevi gören enzim olan intrasellüler adenilat siklazın stimülasyonu ile ilişkilendirilebilir. Artan siklik AMP düzeyleri bronşiyal düz kasın gevşemesine ve özellikle mast hücreleri olmak üzere hücrelerden ani aşırı duyarlılık mediatörlerinin salıverilmesinin inhibe edilmesine neden olmaktadır.
Farmakodinamik etkiler
Kardiyak elektrofizyoloji
Flutikazon furoat/umeklidinyum/vilanterolün QT intervali üzerindeki etkisi kapsamlı bir QT (TQT) çalışması ile değerlendirilmemiştir. FF/VI ve UMEC/VI için TQT çalışmaları FF, UMEC ve VI'nın klinik dozlarının QT aralığına etkisinin klinik olarak önemli olmadığını göstermiştir.
Flutikazon furoat/umeklidinyum/vilanterole 24 haftaya kadar maruz kalan astım hastası 1.504 gönüllünün veya 52 hafta maruz kalan 360 kişilik altgrubun EKG'sinde QTc intervali üzerinde klinik olarak anlamlı etki gözlenmemiştir.
Flutikazon furoat/umeklidinyum/vilanterole 24 haftaya kadar maruz kalan 911 KOAH hastasının veya 52 hafta maruz kalan210 kişilik altgrubun EKG'sinde QTc intervali üzerinde klinik olarak anlamlı etki gözlenmemiştir
Klinik etkililik ve güvenlilik
Astım
TRELEGY ELLIPTA'nın (FF/UMEC/VI) güvenliliği ve etkililiği, mevcut kombinasyon tedavilerinde (İKS + bir LABA) yeterli astım kontrol sağlanamayan yetişkin gönüllülerde 24 ila 52 haftalık süreler uygulanan bir randomize, çok merkezli, aktif kontrollü, çift kör klinik çalışmada 2.436 gönüllüde incelenmiştir (çalışma 205715, CAPTAIN). Çalışmada TRELEGY ELLIPTA'nın solunum fonksiyonu üzerindeki etkisi, orta ve şiddetli astım alevlenmelerinin yıllık oranı, astım semptom kontrolü ve sağlıkla ilişkili yaşam kalitesi flutikazon furoat/vilanterol (FF/VI) ile karşılaştırılmıştır. Primer sonlanım noktası, 24. haftada dip (trough) 1 saniyedeki Zorlu Ekspiratuar Hacim (FEV) değerinde başlangıca göre değişimdir. Önemli sekonder sonlanım noktası ise orta/şiddetli astım alevlenmelerinin yıllık oranıdır.
Çalışmada şu şekilde 5 haftalık bir hazırlık dönemi/stabilizasyon dönemi uygulanmıştır: inhale kortikosteroid (günde 250 mcg flutikazon propiyonattan daha yüksek veya eşdeğer) + LABA ile mevcut astım tedavilerinde yeterli kontrol sağlanamayan [Astım Kontrolü Testi (ACQ-6)
≥1.5] gönüllüler, günde iki kez flutikazon propiyonat/salmeterol 250/50 mcg ile uygulanan 3 haftalık bir hazırlık dönemine girmiştir. Hazırlık döneminden sonra yeterli kontrol sağlanamamış olan (ACQ-6 ≥1.5) gönüllüler, 2 haftalık bir stabilizasyon dönemi için günde bir kez FF/VI 100/25 mcg dozuna geçirilmiştir. Tüm tedavi gruplarında, bazal demografik özellikler benzerdir.
Taramada, bronkodilatör öncesi öngörülen ortalama FEV%58,5'dir (SS: %12,8); ortalama reversibilite yüzdesi %29,9'dur (SS: %18,1) ve ortalama mutlak reversibilite 0,484 L (SS: 0,274 L) ve ortalama ACQ-6 skoru 2,5'tir (SS: 0,6). 5 haftalık tedavisiz dönem/stabilizasyon döneminde, gönüllüler hem solunum fonksiyonunda (trough FEViyileşmesi 0,287 L) hem de astım kontrolünde (ortalama ACQ-6 skorunda 0,6 düşüş) önemli iyileşmeler görmüştür. Bu iyileşmelere karşın, gönüllülerin büyük bölümü (%93) iyi kontrole ulaşamamıştır (ortalama skor ACQ-6 1,9) ve bu da ek tedaviye ihtiyaç duyulduğunu göstermiştir. Randomizasyonda, bronkodilatör öncesi öngörülen ortalama FEV%68,2'dir (SS: %14,8).
5 haftalık hazırlık dönemi/stabilizasyon döneminden sonra, uygun gönüllüler günde bir kez TRELEGY ELLIPTA 100/62,5/25 mcg (N=406), TRELEGY ELLIPTA 200/62,5/25 mcg (N=408), TRELEGY ELLIPTA 100/31.25/25 mcg (N=405), TRELEGY ELLIPTA 200/31,25
/25 mcg (N=404), FF/VI 100/25 mcg (N=407) veya FF/VI 200/25 mcg (N=406) inhalasyonuna atanmıştır. Çalışmada 4 farklı TRELEGY ELLIPTA dozu incelense de burada, astım tedavisinde önerilen dozlar olan TRELEGY ELLIPTA 100/62,5/25 mcg ve TRELEGY ELLIPTA 200/62,5/25 mcg sonuçları gösterilmektedir. Etkililik incelemesinde, solunum fonksiyonu olmayan sonlanım noktası analizlerine TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) ve FF/VI (100/252 ve 200/25 mcg) arasında önceden belirlenen havuz karşılaştırmalar dahil edilmiştir.
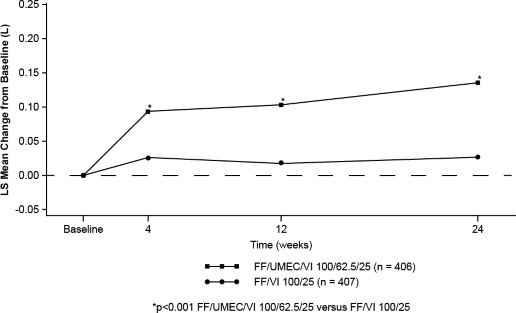
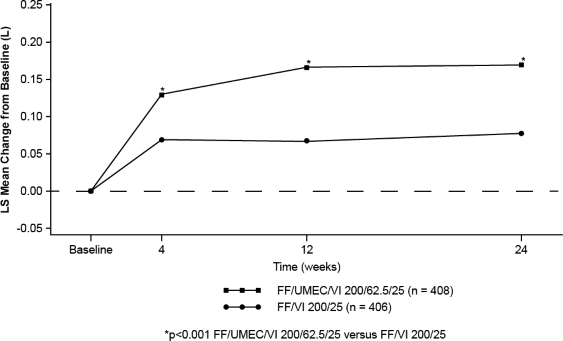
24. haftada başlangıca göre trough FEV'deki değişimde (primer etkililik sonlanım noktası), TRELEGY ELLIPTA 100/62,5/25 ve TRELEGY ELLIPTA 200/62,5/25 mcg dozlarında
FF/VI 100/25 ve FF/VI 200/25 mikrogram ile karşılaştırıldığında akciğer fonksiyonlarında istatistiksel açıdan anlamlı iyileşmeler görülmüştür (bkz. Tablo 1, Şekil 1 & 2).
Tablo 1. Solunum fonksiyonu sonlanım noktaları (Çalışma 205715)
| FF/VI 100/25 (N=407) | TRELEGY ELLIPTA 100/62,5/25 (N=406) | FF/VI 200/25 (N=406) | TRELEGY ELLIPTA 200/62,5/25 (N=408) |
Trough FEV(L), 24. Hafta | ||||
Başlangıca göre LS ortalama değişim (SE) | 0,024 (0,0157) | 0,134 (0,0155) | 0,076 (0,0156) | 0,168 (0,0155) |
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | Referans | 0,11 | --- | --- |
100/25 |
| 0,066; 0,153 p<0,001 |
|
|
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
p-değeri |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | --- | --- | Referans | 0,092 |
200/25 |
|
|
| 0,049; 0.135 |
Tedavi farkı |
|
|
| p<0,001 |
%95 GA |
|
|
|
|
p-değeri |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı | --- | Referans | --- | 0,034 |
Trelegy Ellipta |
|
|
| -0,009; 0,077 |
100/62,5/25 |
|
|
|
|
Tedavi farkı |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | --- | 0,059 | Referans | --- |
200/25 |
| 0,015; 0,102 |
|
|
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | Referans | --- | --- | 0,143 |
100/25 |
|
|
| 0,1; 0,187 |
Tedavi farkı |
|
|
|
|
95% GA |
|
|
|
|
FEV, dozdan 3 saat sonra (L), 24. Hafta | ||||
Başlangıca göre LS ortalama değişim | 0,132 (0,016) | 0,243 (0,0158) | 0,168 (0,0159) | 0,286 (0,0158) |
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı | Referans | 0,111 | --- | --- |
FF/VI 100/25 |
| 0,067; 0,155 |
|
|
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | --- | --- | Referans | 0,118 |
200/25 |
|
|
| 0,074; 0,162 |
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı | --- | Referans | --- | 0,044 |
Trelegy Ellipta |
|
|
| 0; 0,087 |
100/62,5/25 |
|
|
|
|
Tedavi farkı |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı | --- | 0,075 | Referans | --- |
FF/VI 200/25 |
| 0,031; 0,119 |
|
|
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | Referans | --- | --- | 0,155 |
100/25 |
|
|
| 0,11; 0,199 |
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
GA=güven aralığı; FEV=1 saniyedeki zorlu ekspiratuar hacim; L=litre; LS=en küçük kare; N=tedavi amaçlı popülasyondaki sayı; SE=standart hata | ||||
Şekil 1. TRELEGY ELLIPTA 100/62,5/25'in başlangıca göre LS ortalama değişimi (trough FEV(L)'de)
Şekil 2. TRELEGY ELLIPTA 200/62,5/25'in başlangıca göre LS ortalama değişimi (trough FEV(L)'de)
Orta/şiddetli astım alevlenmeleri 52 haftalık bir tedavi döneminde incelenmiştir (bkz. Tablo 2). Bir orta astım alevlenmesi, astım semptomlarında veya solunum fonksiyonlarında kötüleşme veya astım tedavisinde geçici bir değişime neden olan (örn. İKS'de artış) ama şiddetli alevlenme kriterlerini karşılamayan kurtarma bronkodilatör kullanımında artış olarak tanımlanmıştır. Şiddetli astım alevlenmesi, en az 3 gün boyunca sistemik kortikosteroid kullanımı (veya en azından idame dozunun 2 katına çıkarılması) gereken bir kötüleşme veya sistemik kortikosteroid gerektiren astım nedeniyle hastaneye yatış veya acil servis ziyareti olarak tanımlanmıştır. Havuz analizinde, orta/şiddetli alevlenmelerin yıllık oranı TRELEGY ELLIPTA tedavisinde (100/62,5/25 ve 200/62,5/25 mcg) FF/VI ile karşılaştırıldığında (100/25 ve 200/25 mcg) sayısal olarak daha düşüktür (%13 düşüş oranı; %95 GA; -5,2; 28,1). Orta-
/şiddetli alevlenmelerin yıllık oranı için havuz haline getirilmemiş karşılaştırmaların tanımlayıcı analizi de sunulmaktadır.
Tablo 2. Orta/şiddetli alevlenmelerin yıllık oranı (52 haftaya kadar) (Çalışma 205715)
| FF/VI 100/25 (N=407) | TRELEGY ELLIPTA 100/62,5/25 (N=406) | FF/VI 200/25 (N=406) | TRELEGY ELLIPTA 200/62,5/25 (N=408) |
Ortalama Yıllık Oran | 0,87 | 0,68 | 0,57 | 0,55 |
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | Referans | %21,8 | --- | --- |
100/25 |
| -1,1; 39,5 |
|
|
Oran Düşüşü (%) |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | --- | --- | Referans | %3,2 |
200/25 |
|
|
| -28,2; 27 |
Oran Düşüşü (%) |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı Trelegy | --- | Referans | --- | %19,1 |
Ellipta 100/62,5/25 Oran |
|
|
| -6,4; 38,5 |
Düşüşü (%) |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | --- | %-19.6 | Referans | --- |
200/25 |
| -57,2; 9 |
|
|
Oran Değişimi (%) |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | Referans | --- | --- | %36,7 |
100/25 Oran Düşüşü (%) |
|
|
| 17,6; 51,5 |
%95 GA |
|
|
|
|
GA=güven aralığı; N=tedavi amaçlı popülasyondaki sayı | ||||
Ayrıca, şiddetli astım alevlenmeleri de incelenmiştir. Tanımlayıcı bir havuz analizinde, FF/VI ile karşılaştırıldığında (100/25 ve 200/25 mcg) TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) için şiddetli alevlenmelerin ortalama yıllık oranında fark gözlemlenmemiştir (oranda %2,6 düşüş; %95 GA: -26,2; 24,9). Şiddetli alevlenmelerin ortalama yıllık oranları TRELEGY ELLIPTA 100/62,5/25 mcg ve TRELEGY ELLIPTA 200/62,5/25 mcg için
sırasıyla 0,41 ve 0,23'tür. Şiddetli alevlenmelerin ortalama yıllık oranı FF/VI 100/25 mcg ve FF/VI 200/25 mcg için sırasıyla 0,38 ve 0,26'dır.
Hasta semptomları ve sağlıkla ilişkili yaşam kalitesi ACQ, Astımda Solunum Semptomlarının Değerlendirmesi (E-RS: Astım) ve St. George Solunum Anketi (SGRQ) kullanılarak değerlendirilmiştir. Tanımlayıcı bir havuz analizinde, 24. Haftada ACQ-7 yanıt veren hasta oranı TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) için %63, FF/VI için (100/25 ve 200/25 mcg) için ise %55'tir (OR: 1,43; %95 GA: 1,16; 1,76) (bkz. Tablo 3). Havuz haline getirilmemiş tedavi karşılaştırmalarının da tanımlayıcı analizleri sunulmaktadır.
Tablo 3. Astım Kontrol Testi (ACQ)-7 sonuçları, 24. Hafta (Çalışma 205715)
| FF/VI 100/25 (N=407) | TRELEGY ELLIPTA 100/62,5/25 (N=406) | FF/VI 200/25 (N=406) | TRELEGY ELLIPTA 200/62,5/25 (N=408) |
Yanıt Verenler (%) | %52 | %62 | %58 | %64 |
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | Referans | 1,59 | --- | --- |
100/25 |
| 1,18; 2,13 |
|
|
Olasılık Oranı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | --- | --- | Referans | 1,28 |
200/25 |
|
|
| 0,95; 1,72 |
Olasılık Oranı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı | --- | Referans | --- | 1,08 |
TRELEGY ELLIPTA |
|
|
| 0,80; 1,45 |
100/62,5/25 |
|
|
|
|
Olasılık Oranı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | --- | 1,19 | Referans | --- |
200/25 |
| 0,88; 1,60 |
|
|
Olasılık Oranı %95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | Referans | --- | --- | 1,71 |
100/25 |
|
|
| 1,27; 2,3 |
Olasılık Oranı |
|
|
|
|
%95 GA |
|
|
|
|
GA=güven aralığı; N=tedavi amaçlı popülasyondaki sayı | ||||
24. haftada ACQ-5 (ACQ-7'deki semptomlarla ilgili 5 sorudan oluşur) yanıt veren hasta oranları ACQ-7 sonuçlarına benzerdir. Havuz haline getirilmiş tanımlayıcı bir analizde, 24. Haftada ACQ-5 yanıt veren hasta oranı TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) için
%64 ve FF/VI (100/25 ve 200/25 mcg) için %60'tır (OR: 1,23; %95 GA: 1; 1,52).
Havuz haline getirilmemiş bir tanımlayıcı analizde, 24. Haftada ACQ-5 yanıt veren hasta oranı TRELEGY ELLIPTA 100/62,5/25 mcg için %63 iken, FF/VI 100/25 mcg için %58'dir (OR: 1,28; %95 GA: 0,96; 1,72). ACQ-5 yanıt veren hasta oranı TRELEGY ELLIPTA 200/62,5/25
mcg için %66 iken, FF/VI 200/25 mcg için %62'dir (OR: 1,19; %95 GA: 0,88; 1,6).
Havuz haline getirilmiş bir tanımlayıcı analizde, E-RS: Astım yanıt veren hasta oranı (skorda başlangıca göre ≥2 düşüş olarak tanımlanmıştır) TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) için %45, FF/VI (100/25 ve 200/25 mcg) için %41'dir (OR: 1,18; %95 GA:
0,96; 1,45) (21.-24. Haftalar).
Havuz haline getirilmemiş bir tanımlayıcı analizde, E-RS: Astım yanıt veren hasta oranı TRELEGY ELLIPTA 100/62,5/25 mcg için %42, FF/VI 100/25 mcg için %38'dir (OR: 1,22,
%95 GA: 0,91; 1,63) (21.-24. Haftalar). E-RS: Astım yanıt veren hasta oranı TRELEGY ELLIPTA 200/62,5/25 mcg için %47, FF/VI 200/25 mcg için %44'tür (OR: 1,15; %95 GA: 0,86; 1,53) (21.-24. Haftalar).
Havuz haline getirilmiş bir tanımlayıcı analizde, 24. Haftada SGRQ yanıt veren hasta oranı (skorda başlangıca göre ≥4 düşüş olarak tanımlanmıştır) TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) için %69, FF/VI (100/25 ve 200/25 mcg) için %66'dır (OR: 1,14, %95 GA:
0,92; 1,42).
Havuz haline getirilmemiş bir tanımlayıcı analizde, 24. Haftada SGRQ yanıt veren hasta oranı TRELEGY ELLIPTA 100/62,5/25 mcg için %68, FF/VI 100/25 mcg için %64'tür (OR: 1,22,
%95 GA: 0,93; 1,7). SGRQ yanıt veren hasta oranı 24. Haftada TRELEGY ELLIPTA
200/62,5/25 mcg için %69, FF/VI 200/25 mcg için %68'dir (OR: 1,04; %95 GA: 0,76; 1,41).
Kronik Obstrüktif Akciğer Hastalığı
Klinik olarak KOAH tanısı konmuş hastaların tedavisinde günde 1 kez kullanılan TRELEGY ELLIPTA'nın (100/62,5/25 mikrogram) etkililiği iki aktif kontrollü çalışma ile bir benzer etkililik çalışmasında değerlendirilmiştir. Her üç çalışma da hastaların ≥10 CAT skoru ile semptomatik olmaları ve çalışmaya girmeden önceki en az üç ayda KOAH idame tedavisi görüyor olmaları gerektiren çok merkezli, randomize, çift-kör çalışmalardır.
FULFIL (CTT116853), TRELEGY ELLIPTA (100/62.5/25 mikrogram) ile günde 2 kez alınan 400/12 mikrogram budenosid/formoterolün (BUD/FOR) karşılaştırıldığı, belirli hasta altgrubunda (n=430) 52 haftaya kadar uzatılan 24 haftalık bir çalışmadır (N=1.810). Taramada, ortalama bronkodilatör sonrası FEVöngörülenin %45'i olup, hastaların %65'i geçmiş yılda bir veya daha fazla orta şiddette/şiddetli alevlenme öyküsü bildirmiştir.
IMPACT (CTT116855), TRELEGY ELLIPTA (100/62.5/25 mikrogram) ile 100/25
mikrogram flutikazon furoat/vilanterol (FF/VI) ve 62.5/25 mikrogram umeklidinyum/ vilanterolün (UMEC/VI) karşılaştırıldığı, 52 haftalık bir çalışmadır (N=10.355). Taramada, ortalama bronkodilatör sonrası FEVöngörülenin %46'sı olup, hastaların %99'u geçmiş yılda bir veya daha fazla orta şiddette/şiddetli alevlenme öyküsü bildirmiştir.
FULFIL ve IMPACT çalışmalarında, çalışmaya girişte bildirilen en yaygın KOAH ilacı kombinasyonları İKS + LABA + LAMA (FULFIL %28, IMPACT %34), İKS + LABA (FULFIL %29, IMPACT %26), LAMA + LABA (FULFIL %10, IMPACT %8) ve LAMA'dır
(FULFIL %9, IMPACT %7). Bu hastalar aynı zamanda diğer KOAH ilaçlarını alıyor olabilir
(örn. mukolitikler veya lökotrien reseptör antagonistleri).
Çalışma 200812, önceki 12 ayda orta veya şiddetli alevlenme öyküsü olan hastalarda TRELEGY ELLIPTA (100/62.5/25 mikrogram) kullanımı ile günde bir kez multi-inhaler tedavisi olarak birlikte kullanılan FF/VI (100/25 mikrogram) + UMEC (62.5 mikrogram)'ın karşılaştırıldığı, 24 haftalık bir çalışmadır (N=1.055).
Solunum fonksiyonu
FULFIL çalışmasında TRELEGY ELLIPTA'nın bronkodilatör etkileri tedavinin ilk gününden itibaren belirginleşmiş ve 24 haftalık tedavi döneminde (FEV'de başlangıca göre değişiklikler 1. günde 90-222 mL ve 24. haftada 160-339 mL'dir). korunmuştur. TRELEGY ELLIPTA, solunum fonksiyonunda (başlangıç trough FEVdeğerinin 24. haftadaki değişimine göre tanımlanmıştır) istatistik olarak anlamlı (p<0,001) düzelme göstermiştir (bkz. Tablo 4) ve 52. haftaya kadar devam eden hasta alt grubunda bu düzelme sürekli olmuştur.
Tablo 4. FULFIL'de solunum fonksiyonu sonlanım noktası
| TRELEGY ELLIPTA (N=911) | BUD/FOR (N=899) | Tedavi farkı (%95 GA) |
| BUD/FOR ile karşılaştırma | ||
24. Haftada çukur FEV(L), başlangıca göre LS ortalama değişikliği (SE) | 0,142 (0,0083) | -0,029 (0,0085) | 0,171 0,148, 0,194 |
FEV= 1 saniyede zorlu ekspiratuar hacim; L = litre; LS = en küçük kareler; SE = standart hata; N = tedavi amaçlı popülasyon sayısı; GA = güven aralığı
IMPACT çalışmasında, FF/VI ve UMEC/VI ile 52 haftalık süre boyunca karşılaştırıldığında TRELEGY ELLIPTA solunum fonksiyonunda istatistik olarak anlamlı (p<0,001) düzelme sağlamıştır (bkz. Tablo 5).
Tablo 5. IMPACT çalışmasında solunum fonksiyonu sonlanım noktası
| TRELEGY ELLIPTA (N=4.151) | FF/VI (N=4.134) | UMEC/VI (N=2.070) | Tedavi farkı %95 GA | |
TRELEGY ile FF/VI karşılaştırması | TRELEGY ile UMEC/VI karşılaştırması | ||||
52. haftada trough | 0,094 | -0,003 | 0,04 | 0,097 | 0,054 |
FEV(L), başlangıca | (0,004) | (0,004) | (0,006) | 0,085, 0,109 | 0,039, 0,069 |
göre LS ortalama |
|
|
|
|
|
değişikliği (SE) |
|
|
|
|
|
FEV= 1 saniyede zorlu ekspiratuar hacim; L = litre; LS = en küçük kareler; SE = standart hata; N = tedavi amaçlı popülasyon sayısı; GA = güven aralığı
Çalışma 200812'de, 24. haftada trough FEV'in başlangıca göre düzelmesi açısından iki inhaler ile birlikte kullanılan FF/VI+UMEC ile karşılaştırıldığında TRELEGY ELLIPTA benzer etkililikte olmuştur. Önceden belirlenmiş olan benzer etkililik sınırı 50 mL'dir.
FF/UMEC/VI ile tedavi UMEC/VI ile karşılaştırıldığında, tedavi başlangıcı ve bitimine ilişkin veriler dahil olmak üzere tüm nedenlere bağlı mortalite riskini % 27,7 ile önemli ölçüde azaltmıştır (52. haftada hayati durum hastaların % 99,6'sında doğrulanmıştır) (bkz. Tablo 6). FF/UMEC/VI, FF/VI ile karşılaştırıldığında tüm nedenlere bağlı mortalite riskindeki azalma % 11,3'tür. Ancak bu sonuç istatiksel olarak anlamlı bulunmamıştır.
Tablo 6. Tüm nedenlere bağlı mortalitede azalma (CTT116855)
Tedavi |
n | Komparatör ile karşılaştırıldığında risk oranı (%95 GA) |
Riskteki azalma (%95 GA) |
p değeri |
FF/UMEC/VI | 4.151 |
|
|
|
UMEC/VI | 2.070 | 0,72 | %27,7 | 0,042 |
|
| (0,53, 0,99) | (1,2, 47,1) |
|
FF/VI | 4.134 | 0,89 | %11,3 | 0,387 |
|
| (0,67, 1,16) | (-16,5, 32,5) |
|
GA=güven aralığı | ||||
Tedavi sırasında tüm nedenlere bağlı mortalite analizleri de yapılmış ve yukarıdaki sonuçlarla tutarlı sonuçlar elde edilmiştir. FF/UMEC/VI ile tedavi UMEC/VI ile karşılaştırıldığında, tedavi sırasında tüm nedenlere bağlı mortalite riskini %42,1 (%95 GA: 11,9, 61,9; p=0,011) ile önemli ölçüde azaltmıştır. FF/UMEC/VI, FF/VI ile karşılaştırıldığında tüm nedenlere bağlı mortalite riskindeki azalma % 5,5'tir. Ancak bu sonuç istatiksel olarak anlamlı bulunmamıştır.
Alevlenmeler
IMPACT çalışmasında, 52 hafta süresince TRELEGY ELLIPTA yıllık orta/şiddetli alevlenmelerde istatistik olarak anlamlı (p<0,001) azalma sağlamıştır (FF/VI ile karşılaştırıldığında %15 (%95 GA: 10, 20) azalma (oran: hasta yılında 0,91'e karşılık 1,07
olay); UMEC/VI ile karşılaştırıldığında %25 (%95 GA: 19, 30) azalma (oran: hasta yılında
0,91'e karşılık 1,21 olay)). FULFIL çalışmasında, 24 haftalık verilere göre, TRELEGY ELLIPTA orta/şiddetli alevlenmelerde istatistik olarak anlamlı (p=0,002) azalma sağlamıştır (BUD/FOR ile karşılaştırıldığında %35 (%95 GA: 14, 51) azalma).
IMPACT çalışmasında, TRELEGY ELLIPTA ilk orta/şiddetli alevlenmeye kadar geçen süreyi uzatmış ve ilk alevlenmeye kadar geçen zamana göre ölçülen orta/şiddetli alevlenme riskinde anlamlı bir azalma (p<0,001) sağlamıştır (FF/VI ile karşılaştırıldığında %14,8 (%95 GA: 9,3, 19,9) azalma; UMEC/VI ile karşılaştırıldığında %16,0 (%95 GA: 9,4, 22,1) azalma). FULFIL çalışmasında, 24 hafta süresince TRELEGY ELLIPTA orta/şiddetli alevlenme riskinde istatistik olarak anlamlı azalma sağlamıştır (BUD/FOR ile karşılaştırıldığında %33; %95 GA 12, 48; p=0,004).
IMPACT çalışmasında, FF/VI ile karşılaştırıldığında TRELEGY ELLIPTA yıllık şiddetli alevlenmelerin (örn. hastaneye yatış gerektiren veya ölümle sonuçlanan) oranını %13 azaltmıştır (%95 GA: -1, 24; p=0,064). UMEC/VI ile karşılaştırıldığında TRELEGY ELLIPTA yıllık şiddetli alevlenmelerin oranını istatistik olarak anlamlı (%34) azaltmıştır (%95 GA: 22, 44; p<0,001).
Sağlıkla-İlişkili Yaşam Kalitesi
TRELEGY ELLIPTA, St. George Solunum Anketi (SQRQ) toplam skoru'na göre ölçülen Sağlıkla İlişkili Yaşam Kalitesi'nde istatistik olarak anlamlı gelişme sağlamıştır: FULFIL çalışmasında (24. hafta) BUD/FOR ile karşılaştırıldığında -2,2 ünite, %95 GA: -3,5, -1,0;
IMPACT çalışmasında (52. hafta) FF/VI ile karşılaştırıldığında -1,8 ünite, %95 GA: -2,4, -1,1
ve UMEC/VI ile karşılaştırıldığında -1,8 ünite, %95 GA: -2,6, -1,0.
TRELEGY ELLIPTA alan hastaların daha yüksek bir yüzdesinde SGRQ toplam skorunda istatistik olarak anlamlı gelişme görülmüştür: FULFIL çalışmasında 24. haftada BUD/FOR ile karşılaştırıldığında sırasıyla %50 ve %41, yanıt alma ve yanıt alamama olasılık oranı (OR) (1,41; %95 GA: 1,16, 1,70); IMPACT çalışmasında 52. haftada FF/VI ve UMEC/VI ile
karşılaştırıldığında sırasıyla %42, %34 ve %34, FF/VI'e karşı OR 1,41, GA: 1,29, 1,155 ve
UMEC/VI'e karşı OR 1,41, %95 GA: 1,26, 1,57; tüm tedavi karşılaştırmaları istatistik olarak anlamlıdır (p<0,001).
FULFIL çalışmasında 24. haftada, KOAH Değerlendirme Testi (CAT) cevabı alınan hastaların (başlangıç değerinin 2 ünite veya daha fazla altında olarak tanımlanmıştır) oranı, TRELEGY ELLIPTA ile tedavi edilen hastalarda BUD/FOR'a göre istatistik olarak anlamlı (p<0,001) daha yüksek bulunmuştur (%53'e karşılık %45; OR 1,44; %95 GA: 1,19, 1,75). IMPACT çalışmasında 52. haftada, CAT cevabı alınan hastaların oranı, TRELEGY ELLIPTA ile tedavi edilen hastalarda (%42) FF/VI'e (%37; OR 1,24; %95 GA: 1,14, 1,36) ve UMEC/VI'e (%36;
OR 1,28; %95 GA: 1,15, 1,43) göre istatistik olarak anlamlı (p<0,001) daha yüksek
bulunmuştur.
Semptom Kontrolü
Nefes darlığı, FULFIL çalışmasında 24. haftada ve IMPACT çalışmasında 52. haftada (hasta alt grubu, n=5.058) Geçici Dispne Endeksi (TDI) odak skoru ile ölçülmüştür. FULFIL çalışmasında TDI'ye göre (en az 1 ünite olarak tanımlanmıştır) cevap alınan hastaların oranı, TRELEGY ELLIPTA ile tedavi edilen hastalarda BUD/FOR'a göre istatistik olarak anlamlı (p<0,001) daha yüksek bulunmuştur (%61'e karşılık %51; OR 1,61; %95 GA: 1,33, 1,95). IMPACT çalışmasında da cevap alınan hastaların oranı, TRELEGY ELLIPTA için istatistik olarak anlamlı (p<0,001) daha yüksek bulunmuştur: FF/VI ile karşılaştırıldığında %29 (OR
1,36; %95 GA: 1,19, 1,55) ve UMEC/VI ile karşılaştırıldığında %30 (OR 1,33; %95 GA: 1,13,
1,57).
FULFIL çalışmasında, KOAH'ın Respiratuvar Belirtilerini Değerlendirmede kullanılan solunum belirtileri (E-RS: KOAH) ile değerlendirildiğinde, TRELEGY ELLIPTA günlük KOAH semptomlarında BUD/FOR ile karşılaştırıldığında iyileşme sağlamıştır (başlangıç değerinden 2 ünite veya daha yüksek azalma). 21-24. hafta süresince cevap alınanların oranı TRELEGY ELLIPTA'da BUD/FOR ile karşılaştırıldığında istatistik olarak anlamlı (p<0,001) daha yüksek bulunmuştur (sırasıyla %47 ve %37; OR 1,59; %95 GA: 1,30, 1,94).
Kurtarıcı İlaç Kullanımı
FULFIL çalışmasında, TRELEGY ELLIPTA BUD/FOR ile karşılaştırıldığında, 1 ila 24. haftalar arasında kurtarıcı inhaler kullanımını istatistik olarak anlamlı (p<0,001) derecede azaltmıştır (tedavi farkı: günde -0,2 olay; %95 GA: -0,3, -0,1).
IMPACT çalışmasında, TRELEGY ELLIPTA FF/VI ve UMEC/VI ile karşılaştırıldığında, her 4 haftalık zaman periyodunda kurtarıcı inhaler kullanımını istatistik olarak anlamlı (p<0,001) derecede azaltmıştır. 49-52. haftalarda, tedavi farkı FF/VI ile karşılaştırıldığında -0,28 (%95 GA: -0,37, -0,19), UMEC/VI ile karşılaştırıldığında -0,30 (%95 GA: -0,41, -0,19) olmuştur.
Gece uyanmaları
IMPACT çalışmasında, TRELEGY ELLIPTA, 49 ile 52. haftalarda KOAH nedenli gece uyanmalarını istatistik olarak anlamlı azaltmıştır: FF/VI ile karşılaştırıldığında -0,05 (%95 GA:
-0,08, -0,01; p=0,005), UMEC/VI ile karşılaştırıldığında -0,10 (%95 GA: -0,14, -0,05; p<0,001). UMEC/VI için diğer tüm zaman noktalarında (p<0,001) ve FF/VI için ikisi hariç tüm zaman noktalarında (p≤0,021) istatistik olarak anlamlı azalma gözlemlenmiştir.
Pediyatrik popülasyon
Avrupa İlaç Ajansı KOAH'da TRELEGY ELLIPTA ile yapılan çalışmalardaki bulguların, pediyatrik popülasyonun tüm alt gruplarında sunulması zorunluluğunu kaldırmıştır (pediyatrik kullanıma ilişkin bilgiler için bkz. bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerSağlıklı gönüllülere flutikazon furoat, umeklidinyum ve vilanterol kombinasyon olarak tek bir inhalerden inhalasyon yoluyla uygulandığında, her bir bileşenin farmakokinetiği, her bir etkin maddenin flutkazon furoat/ vilanterol kombinasyonu ya da umeklidinyum/ vilanterol kombinasyonu veya monoterapi umeklidinyum olarak uygulandığında gözlendiği gibi olmuştur.
Flutikazon furoat, umeklidinyum ve vilanterolün astım hastası gönüllülerdeki sistemik maruziyetini değerlendirmek için popülasyon farmakokinetik (FK) analizleri gerçekleştirilmiştir. Bu analizlerde, bir inhalasyon cihazında FF/UMEC/VI'den (100/62,5/25 mcg ve 200/62,5/25 mcg) sonra (üçlü kombinasyon) flutikazon furoat ve vilanterolün sistemik ilaç düzeylerinde (kararlı durum Cve AUC), 100 mcg ve 200 mcg dozlarında FF/VI ile ikili kombinasyon uygulamasından sonra gözlemlenen düzeylerin aralığındadır; bir inhalasyon cihazında FF/UMEC/VI uygulamasından sonra 62,5 mcg umeklidinyumun sistemik maruziyeti, monoterapi olarak 62,5 mcg umeklidinyum uygulamasından sonra gözlemlenen aralıktadır.
FF/UMEC/VI için popülasyon FK analizleri 821 KOAH hastasından alınan kombine FK verileriyle yapılmıştır. FF/UMEC/VI'nin tek bir inhalerle (üçlü kombinasyon) verilmesini takiben FF, UMEC ve VI için sistemik ilaç seviyeleri (kararlı durum Cve EAA), FF/VI + UMEC iki inhaler şeklinde kullanımı, ikili kombinasyonları (FF/VI ve UMEC/VI) ve bunun yanı sıra tek inhalerde ayrı ayrı (FF, UMEC ve VI) verilmelerini takiben gözlenen aralıkta olmuştur. FF/VI ile FF/UMEC/VI karşılaştırıldığında kovaryans analizi FF görünen klerensinin daha yüksek (%42) olduğunu göstermiştir; ancak bu klinik açıdan ilgili bulunmamıştır.
Emilim:
Flutikazon furoat
Sağlıklı gönüllülere inhalasyon yoluyla flutikazon furoat/umeklidinyum/vilanterol uygulanmasını takiben, flutikazon furoat C15. dakikada oluşmuştur. Flutikazon furoat/vilanterol inhalasyon yoluyla uygulandığında, başlıca dozun akciğere ulaşan kısmının emilimine bağlı olarak ve ihmal edilebilir oral emilimle birlikte flutikazonun mutlak biyoyararlılığı %15.2 olmuştur. Tekrarlayan flutikazon furoat /vilanterol dozlarını takiben 6 gün içinde birikim 1.6 katına kadar çıkarken kararlı duruma ulaşılmıştır.
Umeklidinyum
Flutikazon furoat/umeklidinyum/vilanterolün sağlıklı gönüllülere inhale edilerek uygulanmasını takiben, C5 dakikada oluşmuştur. İnhale umeklidinyumun mutlak biyoyararlanımı, oral emilimden gelen önemsiz düzeyde katkı ile dozun ortalama %13'üdür. İnhale umeklidinyumun yinelenen dozlamını takiben, kararlı durum, 1.5-2 katı birikim ile 7-10 gün arasında elde edilmiştir.
Vilanterol
Sağlıklı gönüllülere inhalasyon yoluyla flutikazon furoat/umeklidinyum/vilanterol uygulanmasını takiben, vilanterol C7. dakikada oluşmuştur. İnhale vilanterolun biyoyararlılığı %27 olup oral absorpsiyon ihmal edilebilir seviyede olmuştur. Tekrarlayan umeklidinyum/vilanterol dozlarını takiben 6 gün içinde birikim 1.5 katına kadar çıkarken kararlı duruma ulaşılmıştır.
Dağılım:
Flutikazon furoat
Flutikazon furoatın dozunun sağlıklı gönüllülere intravenöz verilmesini takiben, kararlı durumda ortalama dağılım hacmi 661 litre olmuştur. Flutikazon furoatın eritrositlerle ilişkisi düşüktür. İn vitro plazma proteinine bağlanma oranı insan plazmasında yüksek olup ortalama
>%99.6 olmuştur.
Umeklidinyum
Sağlıklı gönüllülere intravenöz uygulamayı takiben, ortalama dağılım hacmi 86 litredir. İnsan plazmasındaki in vitro plazma proteinine bağlanma oranı ortalama %89'dur.
Vilanterol
Vilanterolun sağlıklı gönüllülere intravenöz uygulanmasını takiben, kararlı durumda ortalama dağılım hacmi 165 litre olmuştur. Vilanterolun eritrositlerle ilişkisi düşüktür. İn vitro plazma proteinine bağlanma oranı insan plazmasında ortalama %94 olmuştur.
Biyotransformasyon:
Flutikazon furoat
İn vitro çalışmalar flutikazon furoatın başlıca sitokrom P450 3A4 (CYP3A4) tarafından metabolize edildiğini ve P-gp taşıyıcı için bir substrat olduğunu göstermiştir. Flutikazon furoat için başlıca metabolik yol S-fluorometil karbotioat grubunun hidrolizi ile kortikosteroid etkinliğin anlamlı olarak azaldığı metabolitlerin oluşmasıdır. Metabolitlerin sistemik olarak maruz kalınan seviyesi düşüktür.
Umeklidinyum
İn vitro çalışmalar, umeklidinyumun daha çok sitokrom P450 2D6 (CYP2D6) tarafından metabolize edildiğini ve P-glikoprotein (P-gp) transporteri için bir substrat olduğunu göstermiştir. Umeklidinyum için primer metabolik yollar, oksidatif (hidroksilasyon, O- dealkilasyon) ve bunu takiben konjugasyonu (glukuronidasyon vb.) olup, düşük farmakolojik aktivite içeren ya da farmakolojik aktivitesi olmayan bir dizi metabolitle sonuçlanmıştır. Sistemik metabolit maruziyeti düşüktür.
Vilanterol
İn vitro çalışmalar vilanterolun başlıca sitokrom P450 3A4 (CYP3A4) tarafından metabolize edildiğini ve P-gp taşıyıcı için bir substrat olduğunu göstermiştir. Vilanterol için başlıca metabolik yol O-dealkilasyondur ve bu yolla beta- ve beta- adrenerjik agonist etkinliği azalmış bir dizi metabolit oluşur. İnsan radyoaktif etiket çalışmasında vilaterolun oral yolla alınmasını takiben plazma metabolik profilleri, yüksek ilk geçiş metabolizması ile uyumludur. Metabolitlerin sistemik olarak maruz kalınan seviyesi düşüktür.
Eliminasyon:
Flutikazon furoat
Flutikazon furoat/vilanterol kombinasyonunun inhalasyon yoluyla uygulanmasını takiben flutikazon furoatın aşikar plazma eliminasyon yarı ömrü ortalama 24 saat olmuştur. İntravenöz uygulanmasını takiben eliminasyon fazı yarı ömrü 15.1 saat bulunmuştur. İntravenöz uygulanmasını takiben plazma klerensi 65.4 litre/saat olarak belirlenmiştir. İntravenöz uygulanan dozun %2'si idrarla atılmıştır. Oral alımını takiben, flutikazon furoat insanda başlıca metabolize edilerek elimine edilmiştir ve metabolitleri neredeyse yalnızca feçesle atılırken geri kazanılan radyoaktif dozun <%1'i idrarla atılmıştır.
Umeklidinyum
10 gün boyunca uygulanan inhale uygulamayı takiben umeklidinyum plazma eliminasyon yarı ömrü ortalama 19 saat olup etkin maddenin %3'ü ila %4'ü kararlı durumda idrarda değişmeden atılmıştır. İntravenöz uygulamayı takiben plazma klerensi 151 litre/saattir. İntravenöz uygulamayı takiben, uygulanan radyoaktif işaretli dozun yaklaşık %58'i dışkı ile ve yaklaşık verilen dozun %22'si idrarla atılır. İntravenöz dozlamı takiben ilaçla ilgili maddelerin dışkı ile atılması, safraya salımı göstermiştir. Oral alımı takiben radyoaktif işaretli dozun %92'si primer olarak dışkı ile atılır. Oral olarak alınan dozun %1'den daha azı (geri kazanılan radyoaktivitenin
%1'i) idrarla atılmıştır ve bu da oral uygulamayı takiben önemsiz düzeyde emilim olduğunu göstermiştir.
Vilanterol
Vilanterolün plazma yarılanma ömrü, 10 gün inhalasyonu takiben günde ortalama 11 saattir. İntravenöz kullanımı takiben vilanterolün plazmadan temizlenmesi 108 litre/saat idi. Radyoaktif işaretli vilanterolün oral alımını takiben radyo aktif işaretli %70 kısım idrarda, %30 kısım dışkıda atılır. Vilanterolün birincil eliminasyonu metabolize olduktan sonra metabolitlerinin idrar ve dışkı ile atılmasıdır.
Doğrusallık/Doğrusal olmayan durum:
Veri bulunmamaktadır.
Hastalardaki karakteristik özellikler Geriyatrik popülasyon
Yaşın flutikazon furoat, umeklidinyum ve vilanterolün farmakokinetiği üzerindeki etkileri popülasyon farmakokinetik analizinde değerlendirilmiştir. Dozda düzenleme gerektiren klinik açıdan ilgili etkiler gözlenmemiştir.
Böbrek yetmezliği
Flutikazon furoat/umeklidinyum/vilanterolün etkisi böbrek yetmezliği olan hastalarda değerlendirilmemiştir. Fakat flutikazon furoat/vilanterol ve umeklidinyum/vilanterol çalışmaları yapılmıştır ve flutikazon furoat, umeklidinyum veya vilanterol sistemik maruziyetlerinde herhangi bir artış olduğuna dair kanıt bulunmamıştır. Şiddetli böbrek yetmezliği bulunan hastalar ve sağlıklı gönüllüler arasında in vitro protein bağlama çalışmaları gerçekleştirilmiş ve değişen protein bağlanma profili görüldüğüne dair herhangi bir kanıt saptanmamıştır.
Hemodiyalizin etkileri çalışılmamıştır.
Karaciğer yetmezliği
Flutikazon furoat/umeklidinyum/vilanterolün etkisi hepatik bozukluğu olan gönüllülerde değerlendirilmemiştir. Öte yandan, flutikazon furoat/vilanterol ve umeklidinyum/vilanterol ile çalışmalar yürütülmüştür.
TRELEGY ELIPTA'nın flutikazon furoat/vilanterol bileşeni tüm şiddetlerden hepatik bozukluğu olan hastalarda değerlendirilmiştir (Child-Pugh A, B veya C). Flutikazon furoat için, orta şiddette hepatik bozukluğu olan hastalar üç kata kadar daha yüksek sistemik maruziyet göstermiştir (FF 184 mikrogram); bu nedenle şiddetli hepatik bozukluğu olan hastalar dozun yarısını almıştır (FF 92 mikrogram). Bu dozda, sistemik maruziyet üzerinde etkiler gözlenmemiştir. Bu nedenle orta şiddette ila şiddetli hepatik bozuklukta dikkat gösterilmesi tavsiye edilmekle birlikte, hepatik fonksiyon temelinde hiçbir spesifik doz düzenlemesi önerilmemektedir. Vilanterole sistemik maruziyette anlamlı bir artış görülmemiştir.
Orta şiddette hepatik bozukluğu olan hastalar umeklidinyum veya vilanterole sistemik maruziyette bir artış kanıtı göstermemiştir (Cve EAA). Umeklidinyum şiddetli hepatik bozukluğu olan hastalarda değerlendirilmemiştir.
Diğer Özel Popülasyonlar
Irk, cinsiyet ve kilonun flutikazon furoat, umeklidinyum ve vilanterol farmakokinetikleri üzerindeki etkileri popülasyon farmakokinetik analiziyle de değerlendirilmiştir.
Astım popülasyonu farmakokinetik analizlerinde (flutikazon furoat için 1,265 gönüllü; vilanterol için 1,263 gönüllü; umeklidinyum için 634 gönüllü,) demografik ortak değişkenlerin (ırk/etnik köken, yaş, cinsiyet, ağırlık) flutikazon furoat, umeklidinyum ve vilanterolün farmakokinetiği üzerindeki etkisi değerlendirilmiştir. KOAH popülasyonu için yapılan bir farmakokinetik analizde (n=821) demografik ortak değişkenlerin (ırk/etnik köken, yaş, cinsiyet, ağırlık) flutikazon furoat, umeklidinyum ve vilanterolün farmakokinetiği üzerindeki etkisi değerlendirilmiştir. Böbrek ve karaciğer yetmezliği ayrı çalışmalarla değerlendirilmiştir.
FF/UMEC/VI (100/62,5/25 mcg ve 200/62,5/25 mcg) ile ilgili popülasyon farmakokinetik verileri sağlayan 92 Asyalı astım hastası gönüllüde (Japon, Doğu Asyalı ve Güneydoğu Asyalı), kararlı durumdaki vilanterol Ctahminleri Doğu Asyalı olmayan gönüllülere göre yaklaşık 3 kat daha yüksektir. Astımlı gönüllülerde ırkın flutikazon furoat veya umeklidinyumun farmakokinetik parametreleri üzerinde etkisi olmamıştır.
Tek bir inhaler ile FF/UMEK/VI alan 113 KOAH'lı, Doğu Asyalı (Japon ve Doğu Asyalı) hastada (hastaların %27'si), flutikazon furoat EAA, Kafkas ırkına kıyasla ortalama %30 oranında daha yüksek olmuştur. Ancak, bu popülasyondaki daha yüksek sistemik maruziyet, serum ve idrarda FF-kaynaklı kortizol azalması sınırının altındadır ve klinik olarak anlamlı değerlendirilmemektedir. KOAH hastalarında umeklidinyum veya vilanterolün farmakokinetik parametre hesaplamasındaki ırkın etkisi yoktur.
Flutikazon furoat, umeklidinyum veya vilanterol sistemik maruziyetinde, ırk, cinsiyet veya kiloya göre doz ayarlamasını gerektirecek klinik olarak anlamlı farklılık görülmemiştir.
Zayıf CYP2D6 metabolize edicilere ilişkin bir çalışma, sistemik umeklidinyum maruziyeti üzerinde CYP2D6 genetik polimorfizminin klinik olarak anlamlı herhangi bir etki oluşturmadığını göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Klinik öncesi çalışmalarda flutikazon furoat, umeklidinyum ya da vilanterol ile görülen farmakolojik ve toksikolojik etkiler, tipik olarak glukokortikosteroidler ya da beta-agonistleri ile ilişkilendirilen etkiler olmuştur. Köpeklere yapılan vilanterol, umeklidinyum ve flutikazon furoat kombinasyon uygulaması herhangi bir anlamlı yeni toksisiteye yol açmamıştır veya tek başına flutikazon furoat, umeklidinyum veya vilanterol ile ilişkili major bir alevlenmeye yol açmamıştır.
Genotoksisite ve karsinojenisite
Flutikazon furoat
Flutikazon furoat standart çalışmalarda genotoksik değilken, EAA'ya göre insanda günlük 92 mikrogram flutikazon furoat dozuna göre sıçanlarda ya da farelerde sırasıyla 1,4 ve 2,9 kat maruziyetlerde gerçekleştirilen yaşam boyu inhalasyon çalışmalarında da karsinojenik olmamıştır.
Umeklidinyum
Umeklidinyum standart çalışmalarda genotoksik değildir ve EAA'ya göre maksimum insan klinik maruziyet dozunun sırasıyla ≥20 veya ≥17 katı dozlara (günlük 55 mikrogram umeklidinyum dozu) fare ve sıçanların ömür boyu maruziyet düzeylerindeki yaşam boyu inhalasyon çalışmalarında karsinojenik olmamıştır.
Vilanterol
Vilanterolün (alfa fenilsinamat gibi) ve trifenilasetik asit genotoksik değildir ve vilanterolün (trifenatat olarak) insanlar için genotoksik bir risk oluşturmadığını göstermektedir. Diğer betaagonistlerine yönelik bulgularla tutarlı olarak, yaşam boyu inhalasyon çalışmalarında vilanterol trifenatat dişi sıçan ve fare üreme yolunda ve sıçan hipofiz bezinde proliferatif etkilere yol açmıştır. Sıçanlarda veya farelerde tümör insidansında sırasıyla 0,9 veya 22 kat maruz kalınması tümör insidansında artışa yol açmaz (insanların vilanterole klinik maruziyetinde EAA günlük 22 mikrogram doz temel olarak alındığında).
Üreme toksisitesi
Flutikazon furoat, umeklidinyum ve vilanterolün sıçanlarda erkek veya kadın üreme sistemlerine herhangi bir advers etkisi yoktur.
Flutikazon furoat
Flutikazon furoat, sıçanlarda ya da tavşanlarda teratojenik değildi fakat sıçanlarda gelişimi geciktirmiş ve maternal olarak toksik dozlarda tavşanlarda aborsiyona neden olmuştur. EAA'a göre, 200 mikrogram günlük dozunda insan klinik maruziyetinin 3 katı maruziyet düzeylerinde sıçanlarda gelişim üzerinde herhangi bir etki oluşmamıştır. Flutikazon furoat sıçanlarda pre- veya post-natal gelişim üzerinde herhangi bir istenmeyen etki oluşturmamıştır.
Umeklidinyum
Umeklidinyum sıçanlar veya tavşanlarda teratojenik olmamıştır. 180 mikrogram/kg/gün (EAA'ya göre insanın günlük 55 mikrogram umeklidinyum dozuna klinik maruziyetinin yaklaşık 61 katı) dozu verilen annelerde yapılan bir post natal çalışmada, sıçanlara yapılan subkütan umeklidinyum uygulaması, annede daha düşük vücut ağırlığı artışı ve besin tüketimi ile sonuçlanmıştır ve yavrunun vücut ağırlığını sütten kesmeden önce hafifçe azaltmıştır.
Vilanterol
Vilanterol, sıçanlarda teratojenik olmamıştır. Tavşanlarda gerçekleştirilen inhalasyon çalışmalarında, vilanterol, diğer betaagonistleri ile birlikte görülenlere benzer etkilere yol açmıştır (yarık damak, açık göz kapağı, sternebral füzyon ve ekstremite fleksürleri/ malrotasyon). Subkütan olarak uygulandığından, EAA'ya göre önerilen maksimum insan dozundakinin 62 katı maruziyet düzeylerinde (günlük 22 mikrogram doz) herhangi bir etki oluşmamıştır. Vilanterol sıçanlarda pre- veya post-natal gelişim üzerinde herhangi bir istenmeyen etki oluşturmamıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Laktoz monohidrat (inek sütünden elde edilir) Magnezyum stearat.
6.2. Geçimsizlikler
Bilinen bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
24 ay.
Tepsi açıldıktan sonraki raf ömrü: 6 hafta.
6.4. Saklamaya yönelik özel tedbirler
30 °C altındaki oda sıcaklığında nemden korunarak saklanmalıdır.
İnhaleri buzdolabında saklanacak ise kullanılmadan önce oda sıcaklığına gelmesi için 1 saat
beklenmelidir.
İnhaleri nemden korumak için kapalı tepsi içinde muhafaza edilmelidir ve ancak ilk kez kullanılmaya başlanılacağı zaman aluminyum kutu açılıp inhaler kutudan çıkarılmalıdır.
Tepsiden çıkartıldıktan sonraki 6 hafta süresince kullanılabilir.
İnhalerin üzerinde ayrılan bölüme kullanım süresi dolum tarihi yazılmalıdır. Tarih, inhaler
tepsiden çıkarıldığı anda yazılmalıdır.
6.5. Ambalajın niteliği ve içeriği
TRELEGY ELLIPTA inhaler, nem çekici paket içeren bir tepsi içerisinde ambalajlanmış olan, açık gri renkli bir gövde, bej renkli bir inhaler kapağı ve bir doz sayacından oluşmaktadır. Tepsi, sıyırılarak açılan bir folyo kapak ile kapatılmıştır.
İnhalasyon cihazı polipropilen, yüksek yoğunluklu polietilen, polioksimetilen, polibütilen tereftalat, akrilonitril bütadien stiren, polikarbonat ve paslanmaz çelikten oluşan çok bileşenli bir cihazdır.
İnhalasyon cihazı toplamda 14 veya 30 doz uygulayan iki alüminyum folyo lamine blister şerit içerir (14 veya 30 günlük tedarik). Bir şeritteki her bir blister flutikazon furoat içerir, diğer şeritteki her bir blister umeklidinyum (bromür olarak) ve vilanterol (trifenatat olarak) içerir.
Ticari takdim şekilleri: 14 ve 30 dozluk tekli ambalaj ve 90 (3 x 30) dozluk çoklu ambalaj. Tüm ticari takdim şekilleri pazara sunulmamış olabilir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
İnhalasyon sonrası hastalar ağızlarını su ile çalkalamalı ve suyu yutmamalıdır. Ellipta inhalasyon cihazı önceden dağıtılmış dozları içerir ve kullanıma hazırdır.
İnhalasyon cihazı nemi azaltmak üzere kurutucu kese içeren bir tepside ambalajlanır. Kurutucu kese atılmalı ve açılmamalı, yenilmemeli veya solunmamalıdır. Hastaya dozu inhale etmeye hazır olana kadar tepsiyi açmaması tavsiye edilmelidir.
İnhalasyon cihazı kapalı tepsiden ilk kez çıkarıldığında âkapalı' pozisyonda olacaktır. âAtılmaâ tarihi inhalasyon cihazı etiketinde ve kartonda bırakılmış boşluğa yazılmalıdır. Tarih inhalasyon cihazı tepsiden çıkarılır çıkarılmaz ilave edilmelidir. âAtılmaâ tarihi tepsinin açılma tarihinden sonra 6 haftadır. Bu tarihten sonra, inhalasyon cihazı daha fazla kullanılmamalıdır. Tepsi ilk açılma sonrasında atılabilir.
İnhalasyon cihazı kapağı açılırsa ve tıbbi ürün inhale edilmeden kapatılırsa, doz zayi olacaktır. Zayi olan doz inhalasyon cihazı içinde güvenli bir şekilde saklanacaktır, ancak artık inhale edilemez.
Kazayla ekstra ilaç ya da bir inhalasyonda çift doz almak mümkün değildir. Kullanımına ilişkin ilave talimatlar aşağıda verilmektedir.
Kullanma Talimatı
TRELEGY ELLIPTA ilk kez kullanılmaya başlanıldığında düzgün çalıştığının kontrol edilmesi ve özel bir yöntemle kullanıma hazırlanması gerekmemektedir. Sadece aşağıdaki talimatlara uyulmalıdır.
Tepsi kapağı
Karton kutu
İnhaler
Kullanma talimatı
Nem çekici
Tepsi
TRELEGY ELLIPTA ambalajı aşağıdaki içeriklerden oluşur:

Nem çekici
İnhalasyon cihazı bir tepsi içinde ambalajlanmıştır. Dozunuzu almaya hazır olana kadar tepsinin kapağını açmayınız. İnhalasyon cihazınızı kullanmaya hazır olduğunuzda, tepsiyi açmak için tepsi kapağını soyunuz. Tepside nemi azaltmak için bir nem çekici paket bulunmaktadır. Bu nem çekici paketi atınız; nem çekici paketi açmayınız, yemeyiniz veya solumayınız.
İnhaleri kapatılmış tepsiden çıkardığınızda, 'kapalı' pozisyonda olacaktır. Bir doz ilaç inhale etmeye hazır olana kadar inhaleri açmayınız. 'Son kullanma tarihi'ni inhalasyon cihazının etiketine ve kartonda bunun için ayrılmış olan yere yazınız. Son kullanma tarihi, tepsiyi açtığınız tarihten 6 hafta sonrasıdır. Bu tarihten sonra inhalasyon cihazı kullanılmamalıdır. Ambalaj açıldıktan sonra tepsi atılabilir.
Aşağıda verilen inhaler kullanma talimatları 30 dozluk (30 günlük tedarik) veya 14 dozluk (14 günlük tedarik) inhaler için kullanılabilir.
Başlamadan önce bu kullanma talimatlarını okuyunuz.
Eğer ilacı inhale etmeden, kapağı açıp kapatırsanız, bir doz harcanmış olur. Harcanan doz inhalerin içerisinde güvenle tutulur fakat artık kullanılamaz. Bir inhalasyonda yanlışlıkla ilave ilaç veya çift doz almak mümkün değildir.
Doz sayacı
Bu sayaç, inhaler içinde kaç doz ilaç kaldığını gösterir.
İnhaler kullanılmaya başlanmadan önce, tam olarak 30 dozu gösterir.
İnhaler kapağı her açıldığında 1 doz
eksilir.
10 dozdan az kaldığında, doz sayacının yarısı kırmızı olarak görünür.
Son dozu kullandıktan sonra, doz sayacının yarısı kırmızı olarak görünür ve 0 sayısını gösterir. İnhaler artık boştur.
Eğer bundan sonra inhaler kapağı açılırsa, doz sayacı yarı kırmızıdan tamamen kırmızıya dönecektir.
İnhaler kapağı İnhaler kapağı her açıldığında, ilaçtan bir doz hazırlanır
14 dozlu inhalasyon cihazı için, 10'dan az doz kaldığında doz sayacı yarı kırmızı görünecek, son doz kullanıldıktan sonra ise 0 rakamıyla birlikte yarı kırmızı görünecektir. Kapak tekrar açılırsa, doz sayacı tamamen kırmızı görünecektir.
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Geri Ödeme Kodu | A17448 |
| Satış Fiyatı | 1119.75 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 1119.75 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522553532 |
| Etkin Madde | Flutikazon Froat + Umeklidinyum Bromur + Vilanterol |
| ATC Kodu | R03AL08 |
| Birim Miktar | 100+62,5+25 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 30 |
| Solunum Sistemi > Adrenerjikler (İnhalan) |
| İthal ( ref. ülke : Ingiltere ) ve Beşeri bir ilaçdır. |