TRELEGY ELLIPTA 100/62.5/25 mcg kullanıma hazır inhilasyon tozu 30 adet Farmakolojik Özellikler
{ Flutikazon Froat + Umeklidinyum Bromur + Vilanterol }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Solunum sistemi, obstrüktif solunum yolu hastalıkları için ilaçlar, koritkosteroidlerle birlikte üçlü kombinasyon dahil antikolinerjiklerle kombine adrenerjikler ATC kodu: R03AL08
Etki mekanizması
İnhale sentetik kortikosteroid, uzun etkili muskarinik reseptör antagonisti ve uzun etkili beta- adrenerjik agonist (İKS/LAMA/LABA) kombinasyonudur. Oral inhalasyonu takiben umeklidinyum ve vilanterol farklı mekanizmalar ile havayollarında bronkodilatasyon oluşturur ve flutikazon furoat ise enflamasyonu azaltır.
Flutikazon furoat
Flutikazon furoat, potent anti-enflamatuvar etkiye sahip bir kortikosteroiddir. Flutikazon furoat'ın KOAH semptomları üzerindeki etkisine dair kesin mekanizması bilinmemektedir. Kortikosteroidlerin, çoklu hücre tipleri (örn. eozinofiller, makrofajlar, lenfositler) ve mediyatörler (örn. enflamasyonda görülen sitokinler ve kemokinler) üzerinde çok çeşitli etkilere sahip oldukları görülmüştür.
Umeklidinyum
Umeklidinyum uzun etkili muskarinik bir reseptör antagonistidir (ayrıca antikolinerjik olarak da anılır). Umeklidinyum, bronkodilatör aktivitesini, asetilkolinin solunum yolu düz kasındaki muskarinik asetilkolin reseptörlerine bağlanmasını kompetitif olarak inhibe ederek gösterir. Klinik öncesi modellerde akciğerlere doğrudan uygulandığında, in vitro insan M3 muskarinik reseptör alt türünde yavaş reversibilite ve in vivo uzun etki süresi gösterir.
Vilanterol
Vilanterol bir selektif uzun etkili beta-adrenerjik agonistidir (LABA). Vilanterol dahil olmak üzere beta-adrenoseptör agonisti ilaçların farmakolojik etkileri, en azından kısmen de olsa adenozin trifosfatın (ATP) siklik-3â², 5â²-adonezin monofosfata (siklik AMP) dönüşmesinde katalizör görevi gören enzim olan intrasellüler adenilat siklazın stimülasyonu ile ilişkilendirilebilir. Artan siklik AMP düzeyleri bronşiyal düz kasın gevşemesine ve özellikle mast hücreleri olmak üzere hücrelerden ani aşırı duyarlılık mediatörlerinin salıverilmesinin inhibe edilmesine neden olmaktadır.
Farmakodinamik etkiler
Kardiyak elektrofizyoloji
Flutikazon furoat/umeklidinyum/vilanterolün QT intervali üzerindeki etkisi kapsamlı bir QT (TQT) çalışması ile değerlendirilmemiştir. FF/VI ve UMEC/VI için TQT çalışmaları FF, UMEC ve VI'nın klinik dozlarının QT aralığına etkisinin klinik olarak önemli olmadığını göstermiştir.
Flutikazon furoat/umeklidinyum/vilanterole 24 haftaya kadar maruz kalan astım hastası 1.504 gönüllünün veya 52 hafta maruz kalan 360 kişilik altgrubun EKG'sinde QTc intervali üzerinde klinik olarak anlamlı etki gözlenmemiştir.
Flutikazon furoat/umeklidinyum/vilanterole 24 haftaya kadar maruz kalan 911 KOAH hastasının veya 52 hafta maruz kalan210 kişilik altgrubun EKG'sinde QTc intervali üzerinde klinik olarak anlamlı etki gözlenmemiştir
Klinik etkililik ve güvenlilik
Astım
TRELEGY ELLIPTA'nın (FF/UMEC/VI) güvenliliği ve etkililiği, mevcut kombinasyon tedavilerinde (İKS + bir LABA) yeterli astım kontrol sağlanamayan yetişkin gönüllülerde 24 ila 52 haftalık süreler uygulanan bir randomize, çok merkezli, aktif kontrollü, çift kör klinik çalışmada 2.436 gönüllüde incelenmiştir (çalışma 205715, CAPTAIN). Çalışmada TRELEGY ELLIPTA'nın solunum fonksiyonu üzerindeki etkisi, orta ve şiddetli astım alevlenmelerinin yıllık oranı, astım semptom kontrolü ve sağlıkla ilişkili yaşam kalitesi flutikazon furoat/vilanterol (FF/VI) ile karşılaştırılmıştır. Primer sonlanım noktası, 24. haftada dip (trough) 1 saniyedeki Zorlu Ekspiratuar Hacim (FEV) değerinde başlangıca göre değişimdir. Önemli sekonder sonlanım noktası ise orta/şiddetli astım alevlenmelerinin yıllık oranıdır.
Çalışmada şu şekilde 5 haftalık bir hazırlık dönemi/stabilizasyon dönemi uygulanmıştır: inhale kortikosteroid (günde 250 mcg flutikazon propiyonattan daha yüksek veya eşdeğer) + LABA ile mevcut astım tedavilerinde yeterli kontrol sağlanamayan [Astım Kontrolü Testi (ACQ-6)
≥1.5] gönüllüler, günde iki kez flutikazon propiyonat/salmeterol 250/50 mcg ile uygulanan 3 haftalık bir hazırlık dönemine girmiştir. Hazırlık döneminden sonra yeterli kontrol sağlanamamış olan (ACQ-6 ≥1.5) gönüllüler, 2 haftalık bir stabilizasyon dönemi için günde bir kez FF/VI 100/25 mcg dozuna geçirilmiştir. Tüm tedavi gruplarında, bazal demografik özellikler benzerdir.
Taramada, bronkodilatör öncesi öngörülen ortalama FEV%58,5'dir (SS: %12,8); ortalama reversibilite yüzdesi %29,9'dur (SS: %18,1) ve ortalama mutlak reversibilite 0,484 L (SS: 0,274 L) ve ortalama ACQ-6 skoru 2,5'tir (SS: 0,6). 5 haftalık tedavisiz dönem/stabilizasyon döneminde, gönüllüler hem solunum fonksiyonunda (trough FEViyileşmesi 0,287 L) hem de astım kontrolünde (ortalama ACQ-6 skorunda 0,6 düşüş) önemli iyileşmeler görmüştür. Bu iyileşmelere karşın, gönüllülerin büyük bölümü (%93) iyi kontrole ulaşamamıştır (ortalama skor ACQ-6 1,9) ve bu da ek tedaviye ihtiyaç duyulduğunu göstermiştir. Randomizasyonda, bronkodilatör öncesi öngörülen ortalama FEV%68,2'dir (SS: %14,8).
5 haftalık hazırlık dönemi/stabilizasyon döneminden sonra, uygun gönüllüler günde bir kez TRELEGY ELLIPTA 100/62,5/25 mcg (N=406), TRELEGY ELLIPTA 200/62,5/25 mcg (N=408), TRELEGY ELLIPTA 100/31.25/25 mcg (N=405), TRELEGY ELLIPTA 200/31,25
/25 mcg (N=404), FF/VI 100/25 mcg (N=407) veya FF/VI 200/25 mcg (N=406) inhalasyonuna atanmıştır. Çalışmada 4 farklı TRELEGY ELLIPTA dozu incelense de burada, astım tedavisinde önerilen dozlar olan TRELEGY ELLIPTA 100/62,5/25 mcg ve TRELEGY ELLIPTA 200/62,5/25 mcg sonuçları gösterilmektedir. Etkililik incelemesinde, solunum fonksiyonu olmayan sonlanım noktası analizlerine TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) ve FF/VI (100/252 ve 200/25 mcg) arasında önceden belirlenen havuz karşılaştırmalar dahil edilmiştir.
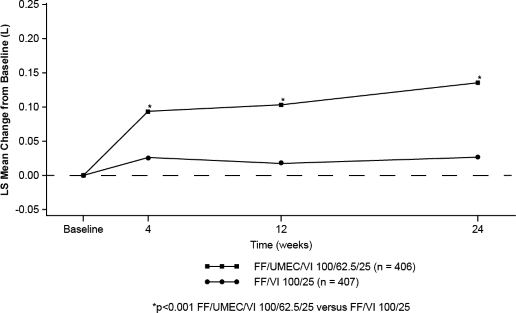
24. haftada başlangıca göre trough FEV'deki değişimde (primer etkililik sonlanım noktası), TRELEGY ELLIPTA 100/62,5/25 ve TRELEGY ELLIPTA 200/62,5/25 mcg dozlarında
FF/VI 100/25 ve FF/VI 200/25 mikrogram ile karşılaştırıldığında akciğer fonksiyonlarında istatistiksel açıdan anlamlı iyileşmeler görülmüştür (bkz. Tablo 1, Şekil 1 & 2).
Tablo 1. Solunum fonksiyonu sonlanım noktaları (Çalışma 205715)
| FF/VI 100/25 (N=407) | TRELEGY ELLIPTA 100/62,5/25 (N=406) | FF/VI 200/25 (N=406) | TRELEGY ELLIPTA 200/62,5/25 (N=408) |
Trough FEV(L), 24. Hafta | ||||
Başlangıca göre LS ortalama değişim (SE) | 0,024 (0,0157) | 0,134 (0,0155) | 0,076 (0,0156) | 0,168 (0,0155) |
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | Referans | 0,11 | --- | --- |
100/25 |
| 0,066; 0,153 p<0,001 |
|
|
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
p-değeri |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | --- | --- | Referans | 0,092 |
200/25 |
|
|
| 0,049; 0.135 |
Tedavi farkı |
|
|
| p<0,001 |
%95 GA |
|
|
|
|
p-değeri |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı | --- | Referans | --- | 0,034 |
Trelegy Ellipta |
|
|
| -0,009; 0,077 |
100/62,5/25 |
|
|
|
|
Tedavi farkı |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | --- | 0,059 | Referans | --- |
200/25 |
| 0,015; 0,102 |
|
|
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | Referans | --- | --- | 0,143 |
100/25 |
|
|
| 0,1; 0,187 |
Tedavi farkı |
|
|
|
|
95% GA |
|
|
|
|
FEV, dozdan 3 saat sonra (L), 24. Hafta | ||||
Başlangıca göre LS ortalama değişim | 0,132 (0,016) | 0,243 (0,0158) | 0,168 (0,0159) | 0,286 (0,0158) |
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı | Referans | 0,111 | --- | --- |
FF/VI 100/25 |
| 0,067; 0,155 |
|
|
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | --- | --- | Referans | 0,118 |
200/25 |
|
|
| 0,074; 0,162 |
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı | --- | Referans | --- | 0,044 |
Trelegy Ellipta |
|
|
| 0; 0,087 |
100/62,5/25 |
|
|
|
|
Tedavi farkı |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı | --- | 0,075 | Referans | --- |
FF/VI 200/25 |
| 0,031; 0,119 |
|
|
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | Referans | --- | --- | 0,155 |
100/25 |
|
|
| 0,11; 0,199 |
Tedavi farkı |
|
|
|
|
%95 GA |
|
|
|
|
GA=güven aralığı; FEV=1 saniyedeki zorlu ekspiratuar hacim; L=litre; LS=en küçük kare; N=tedavi amaçlı popülasyondaki sayı; SE=standart hata | ||||
Şekil 1. TRELEGY ELLIPTA 100/62,5/25'in başlangıca göre LS ortalama değişimi (trough FEV(L)'de)
Şekil 2. TRELEGY ELLIPTA 200/62,5/25'in başlangıca göre LS ortalama değişimi (trough FEV(L)'de)
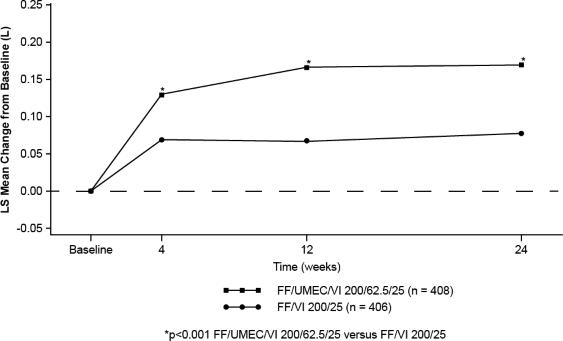
Orta/şiddetli astım alevlenmeleri 52 haftalık bir tedavi döneminde incelenmiştir (bkz. Tablo 2). Bir orta astım alevlenmesi, astım semptomlarında veya solunum fonksiyonlarında kötüleşme veya astım tedavisinde geçici bir değişime neden olan (örn. İKS'de artış) ama şiddetli alevlenme kriterlerini karşılamayan kurtarma bronkodilatör kullanımında artış olarak tanımlanmıştır. Şiddetli astım alevlenmesi, en az 3 gün boyunca sistemik kortikosteroid kullanımı (veya en azından idame dozunun 2 katına çıkarılması) gereken bir kötüleşme veya sistemik kortikosteroid gerektiren astım nedeniyle hastaneye yatış veya acil servis ziyareti olarak tanımlanmıştır. Havuz analizinde, orta/şiddetli alevlenmelerin yıllık oranı TRELEGY ELLIPTA tedavisinde (100/62,5/25 ve 200/62,5/25 mcg) FF/VI ile karşılaştırıldığında (100/25 ve 200/25 mcg) sayısal olarak daha düşüktür (%13 düşüş oranı; %95 GA; -5,2; 28,1). Orta-
/şiddetli alevlenmelerin yıllık oranı için havuz haline getirilmemiş karşılaştırmaların tanımlayıcı analizi de sunulmaktadır.
Tablo 2. Orta/şiddetli alevlenmelerin yıllık oranı (52 haftaya kadar) (Çalışma 205715)
| FF/VI 100/25 (N=407) | TRELEGY ELLIPTA 100/62,5/25 (N=406) | FF/VI 200/25 (N=406) | TRELEGY ELLIPTA 200/62,5/25 (N=408) |
Ortalama Yıllık Oran | 0,87 | 0,68 | 0,57 | 0,55 |
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | Referans | %21,8 | --- | --- |
100/25 |
| -1,1; 39,5 |
|
|
Oran Düşüşü (%) |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | --- | --- | Referans | %3,2 |
200/25 |
|
|
| -28,2; 27 |
Oran Düşüşü (%) |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı Trelegy | --- | Referans | --- | %19,1 |
Ellipta 100/62,5/25 Oran |
|
|
| -6,4; 38,5 |
Düşüşü (%) |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | --- | %-19.6 | Referans | --- |
200/25 |
| -57,2; 9 |
|
|
Oran Değişimi (%) |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | Referans | --- | --- | %36,7 |
100/25 Oran Düşüşü (%) |
|
|
| 17,6; 51,5 |
%95 GA |
|
|
|
|
GA=güven aralığı; N=tedavi amaçlı popülasyondaki sayı | ||||
Ayrıca, şiddetli astım alevlenmeleri de incelenmiştir. Tanımlayıcı bir havuz analizinde, FF/VI ile karşılaştırıldığında (100/25 ve 200/25 mcg) TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) için şiddetli alevlenmelerin ortalama yıllık oranında fark gözlemlenmemiştir (oranda %2,6 düşüş; %95 GA: -26,2; 24,9). Şiddetli alevlenmelerin ortalama yıllık oranları TRELEGY ELLIPTA 100/62,5/25 mcg ve TRELEGY ELLIPTA 200/62,5/25 mcg için
sırasıyla 0,41 ve 0,23'tür. Şiddetli alevlenmelerin ortalama yıllık oranı FF/VI 100/25 mcg ve FF/VI 200/25 mcg için sırasıyla 0,38 ve 0,26'dır.
Hasta semptomları ve sağlıkla ilişkili yaşam kalitesi ACQ, Astımda Solunum Semptomlarının Değerlendirmesi (E-RS: Astım) ve St. George Solunum Anketi (SGRQ) kullanılarak değerlendirilmiştir. Tanımlayıcı bir havuz analizinde, 24. Haftada ACQ-7 yanıt veren hasta oranı TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) için %63, FF/VI için (100/25 ve 200/25 mcg) için ise %55'tir (OR: 1,43; %95 GA: 1,16; 1,76) (bkz. Tablo 3). Havuz haline getirilmemiş tedavi karşılaştırmalarının da tanımlayıcı analizleri sunulmaktadır.
Tablo 3. Astım Kontrol Testi (ACQ)-7 sonuçları, 24. Hafta (Çalışma 205715)
| FF/VI 100/25 (N=407) | TRELEGY ELLIPTA 100/62,5/25 (N=406) | FF/VI 200/25 (N=406) | TRELEGY ELLIPTA 200/62,5/25 (N=408) |
Yanıt Verenler (%) | %52 | %62 | %58 | %64 |
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | Referans | 1,59 | --- | --- |
100/25 |
| 1,18; 2,13 |
|
|
Olasılık Oranı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | --- | --- | Referans | 1,28 |
200/25 |
|
|
| 0,95; 1,72 |
Olasılık Oranı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı | --- | Referans | --- | 1,08 |
TRELEGY ELLIPTA |
|
|
| 0,80; 1,45 |
100/62,5/25 |
|
|
|
|
Olasılık Oranı |
|
|
|
|
%95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
100/62,5/25'e karşı FF/VI | --- | 1,19 | Referans | --- |
200/25 |
| 0,88; 1,60 |
|
|
Olasılık Oranı %95 GA |
|
|
|
|
TRELEGY ELLIPTA |
|
|
|
|
200/62,5/25'e karşı FF/VI | Referans | --- | --- | 1,71 |
100/25 |
|
|
| 1,27; 2,3 |
Olasılık Oranı |
|
|
|
|
%95 GA |
|
|
|
|
GA=güven aralığı; N=tedavi amaçlı popülasyondaki sayı | ||||
24. haftada ACQ-5 (ACQ-7'deki semptomlarla ilgili 5 sorudan oluşur) yanıt veren hasta oranları ACQ-7 sonuçlarına benzerdir. Havuz haline getirilmiş tanımlayıcı bir analizde, 24. Haftada ACQ-5 yanıt veren hasta oranı TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) için
%64 ve FF/VI (100/25 ve 200/25 mcg) için %60'tır (OR: 1,23; %95 GA: 1; 1,52).
Havuz haline getirilmemiş bir tanımlayıcı analizde, 24. Haftada ACQ-5 yanıt veren hasta oranı TRELEGY ELLIPTA 100/62,5/25 mcg için %63 iken, FF/VI 100/25 mcg için %58'dir (OR: 1,28; %95 GA: 0,96; 1,72). ACQ-5 yanıt veren hasta oranı TRELEGY ELLIPTA 200/62,5/25
mcg için %66 iken, FF/VI 200/25 mcg için %62'dir (OR: 1,19; %95 GA: 0,88; 1,6).
Havuz haline getirilmiş bir tanımlayıcı analizde, E-RS: Astım yanıt veren hasta oranı (skorda başlangıca göre ≥2 düşüş olarak tanımlanmıştır) TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) için %45, FF/VI (100/25 ve 200/25 mcg) için %41'dir (OR: 1,18; %95 GA:
0,96; 1,45) (21.-24. Haftalar).
Havuz haline getirilmemiş bir tanımlayıcı analizde, E-RS: Astım yanıt veren hasta oranı TRELEGY ELLIPTA 100/62,5/25 mcg için %42, FF/VI 100/25 mcg için %38'dir (OR: 1,22,
%95 GA: 0,91; 1,63) (21.-24. Haftalar). E-RS: Astım yanıt veren hasta oranı TRELEGY ELLIPTA 200/62,5/25 mcg için %47, FF/VI 200/25 mcg için %44'tür (OR: 1,15; %95 GA: 0,86; 1,53) (21.-24. Haftalar).
Havuz haline getirilmiş bir tanımlayıcı analizde, 24. Haftada SGRQ yanıt veren hasta oranı (skorda başlangıca göre ≥4 düşüş olarak tanımlanmıştır) TRELEGY ELLIPTA (100/62,5/25 ve 200/62,5/25 mcg) için %69, FF/VI (100/25 ve 200/25 mcg) için %66'dır (OR: 1,14, %95 GA:
0,92; 1,42).
Havuz haline getirilmemiş bir tanımlayıcı analizde, 24. Haftada SGRQ yanıt veren hasta oranı TRELEGY ELLIPTA 100/62,5/25 mcg için %68, FF/VI 100/25 mcg için %64'tür (OR: 1,22,
%95 GA: 0,93; 1,7). SGRQ yanıt veren hasta oranı 24. Haftada TRELEGY ELLIPTA
200/62,5/25 mcg için %69, FF/VI 200/25 mcg için %68'dir (OR: 1,04; %95 GA: 0,76; 1,41).
Kronik Obstrüktif Akciğer Hastalığı
Klinik olarak KOAH tanısı konmuş hastaların tedavisinde günde 1 kez kullanılan TRELEGY ELLIPTA'nın (100/62,5/25 mikrogram) etkililiği iki aktif kontrollü çalışma ile bir benzer etkililik çalışmasında değerlendirilmiştir. Her üç çalışma da hastaların ≥10 CAT skoru ile semptomatik olmaları ve çalışmaya girmeden önceki en az üç ayda KOAH idame tedavisi görüyor olmaları gerektiren çok merkezli, randomize, çift-kör çalışmalardır.
FULFIL (CTT116853), TRELEGY ELLIPTA (100/62.5/25 mikrogram) ile günde 2 kez alınan 400/12 mikrogram budenosid/formoterolün (BUD/FOR) karşılaştırıldığı, belirli hasta altgrubunda (n=430) 52 haftaya kadar uzatılan 24 haftalık bir çalışmadır (N=1.810). Taramada, ortalama bronkodilatör sonrası FEVöngörülenin %45'i olup, hastaların %65'i geçmiş yılda bir veya daha fazla orta şiddette/şiddetli alevlenme öyküsü bildirmiştir.
IMPACT (CTT116855), TRELEGY ELLIPTA (100/62.5/25 mikrogram) ile 100/25
mikrogram flutikazon furoat/vilanterol (FF/VI) ve 62.5/25 mikrogram umeklidinyum/ vilanterolün (UMEC/VI) karşılaştırıldığı, 52 haftalık bir çalışmadır (N=10.355). Taramada, ortalama bronkodilatör sonrası FEVöngörülenin %46'sı olup, hastaların %99'u geçmiş yılda bir veya daha fazla orta şiddette/şiddetli alevlenme öyküsü bildirmiştir.
FULFIL ve IMPACT çalışmalarında, çalışmaya girişte bildirilen en yaygın KOAH ilacı kombinasyonları İKS + LABA + LAMA (FULFIL %28, IMPACT %34), İKS + LABA (FULFIL %29, IMPACT %26), LAMA + LABA (FULFIL %10, IMPACT %8) ve LAMA'dır
(FULFIL %9, IMPACT %7). Bu hastalar aynı zamanda diğer KOAH ilaçlarını alıyor olabilir
(örn. mukolitikler veya lökotrien reseptör antagonistleri).
Çalışma 200812, önceki 12 ayda orta veya şiddetli alevlenme öyküsü olan hastalarda TRELEGY ELLIPTA (100/62.5/25 mikrogram) kullanımı ile günde bir kez multi-inhaler tedavisi olarak birlikte kullanılan FF/VI (100/25 mikrogram) + UMEC (62.5 mikrogram)'ın karşılaştırıldığı, 24 haftalık bir çalışmadır (N=1.055).
Solunum fonksiyonu
FULFIL çalışmasında TRELEGY ELLIPTA'nın bronkodilatör etkileri tedavinin ilk gününden itibaren belirginleşmiş ve 24 haftalık tedavi döneminde (FEV'de başlangıca göre değişiklikler 1. günde 90-222 mL ve 24. haftada 160-339 mL'dir). korunmuştur. TRELEGY ELLIPTA, solunum fonksiyonunda (başlangıç trough FEVdeğerinin 24. haftadaki değişimine göre tanımlanmıştır) istatistik olarak anlamlı (p<0,001) düzelme göstermiştir (bkz. Tablo 4) ve 52. haftaya kadar devam eden hasta alt grubunda bu düzelme sürekli olmuştur.
Tablo 4. FULFIL'de solunum fonksiyonu sonlanım noktası
| TRELEGY ELLIPTA (N=911) | BUD/FOR (N=899) | Tedavi farkı (%95 GA) |
| BUD/FOR ile karşılaştırma | ||
24. Haftada çukur FEV(L), başlangıca göre LS ortalama değişikliği (SE) | 0,142 (0,0083) | -0,029 (0,0085) | 0,171 0,148, 0,194 |
FEV= 1 saniyede zorlu ekspiratuar hacim; L = litre; LS = en küçük kareler; SE = standart hata; N = tedavi amaçlı popülasyon sayısı; GA = güven aralığı
IMPACT çalışmasında, FF/VI ve UMEC/VI ile 52 haftalık süre boyunca karşılaştırıldığında TRELEGY ELLIPTA solunum fonksiyonunda istatistik olarak anlamlı (p<0,001) düzelme sağlamıştır (bkz. Tablo 5).
Tablo 5. IMPACT çalışmasında solunum fonksiyonu sonlanım noktası
| TRELEGY ELLIPTA (N=4.151) | FF/VI (N=4.134) | UMEC/VI (N=2.070) | Tedavi farkı %95 GA | |
TRELEGY ile FF/VI karşılaştırması | TRELEGY ile UMEC/VI karşılaştırması | ||||
52. haftada trough | 0,094 | -0,003 | 0,04 | 0,097 | 0,054 |
FEV(L), başlangıca | (0,004) | (0,004) | (0,006) | 0,085, 0,109 | 0,039, 0,069 |
göre LS ortalama |
|
|
|
|
|
değişikliği (SE) |
|
|
|
|
|
FEV= 1 saniyede zorlu ekspiratuar hacim; L = litre; LS = en küçük kareler; SE = standart hata; N = tedavi amaçlı popülasyon sayısı; GA = güven aralığı
Çalışma 200812'de, 24. haftada trough FEV'in başlangıca göre düzelmesi açısından iki inhaler ile birlikte kullanılan FF/VI+UMEC ile karşılaştırıldığında TRELEGY ELLIPTA benzer etkililikte olmuştur. Önceden belirlenmiş olan benzer etkililik sınırı 50 mL'dir.
FF/UMEC/VI ile tedavi UMEC/VI ile karşılaştırıldığında, tedavi başlangıcı ve bitimine ilişkin veriler dahil olmak üzere tüm nedenlere bağlı mortalite riskini % 27,7 ile önemli ölçüde azaltmıştır (52. haftada hayati durum hastaların % 99,6'sında doğrulanmıştır) (bkz. Tablo 6). FF/UMEC/VI, FF/VI ile karşılaştırıldığında tüm nedenlere bağlı mortalite riskindeki azalma % 11,3'tür. Ancak bu sonuç istatiksel olarak anlamlı bulunmamıştır.
Tablo 6. Tüm nedenlere bağlı mortalitede azalma (CTT116855)
Tedavi |
n | Komparatör ile karşılaştırıldığında risk oranı (%95 GA) |
Riskteki azalma (%95 GA) |
p değeri |
FF/UMEC/VI | 4.151 |
|
|
|
UMEC/VI | 2.070 | 0,72 | %27,7 | 0,042 |
|
| (0,53, 0,99) | (1,2, 47,1) |
|
FF/VI | 4.134 | 0,89 | %11,3 | 0,387 |
|
| (0,67, 1,16) | (-16,5, 32,5) |
|
GA=güven aralığı | ||||
Tedavi sırasında tüm nedenlere bağlı mortalite analizleri de yapılmış ve yukarıdaki sonuçlarla tutarlı sonuçlar elde edilmiştir. FF/UMEC/VI ile tedavi UMEC/VI ile karşılaştırıldığında, tedavi sırasında tüm nedenlere bağlı mortalite riskini %42,1 (%95 GA: 11,9, 61,9; p=0,011) ile önemli ölçüde azaltmıştır. FF/UMEC/VI, FF/VI ile karşılaştırıldığında tüm nedenlere bağlı mortalite riskindeki azalma % 5,5'tir. Ancak bu sonuç istatiksel olarak anlamlı bulunmamıştır.
Alevlenmeler
IMPACT çalışmasında, 52 hafta süresince TRELEGY ELLIPTA yıllık orta/şiddetli alevlenmelerde istatistik olarak anlamlı (p<0,001) azalma sağlamıştır (FF/VI ile karşılaştırıldığında %15 (%95 GA: 10, 20) azalma (oran: hasta yılında 0,91'e karşılık 1,07
olay); UMEC/VI ile karşılaştırıldığında %25 (%95 GA: 19, 30) azalma (oran: hasta yılında
0,91'e karşılık 1,21 olay)). FULFIL çalışmasında, 24 haftalık verilere göre, TRELEGY ELLIPTA orta/şiddetli alevlenmelerde istatistik olarak anlamlı (p=0,002) azalma sağlamıştır (BUD/FOR ile karşılaştırıldığında %35 (%95 GA: 14, 51) azalma).
IMPACT çalışmasında, TRELEGY ELLIPTA ilk orta/şiddetli alevlenmeye kadar geçen süreyi uzatmış ve ilk alevlenmeye kadar geçen zamana göre ölçülen orta/şiddetli alevlenme riskinde anlamlı bir azalma (p<0,001) sağlamıştır (FF/VI ile karşılaştırıldığında %14,8 (%95 GA: 9,3, 19,9) azalma; UMEC/VI ile karşılaştırıldığında %16,0 (%95 GA: 9,4, 22,1) azalma). FULFIL çalışmasında, 24 hafta süresince TRELEGY ELLIPTA orta/şiddetli alevlenme riskinde istatistik olarak anlamlı azalma sağlamıştır (BUD/FOR ile karşılaştırıldığında %33; %95 GA 12, 48; p=0,004).
IMPACT çalışmasında, FF/VI ile karşılaştırıldığında TRELEGY ELLIPTA yıllık şiddetli alevlenmelerin (örn. hastaneye yatış gerektiren veya ölümle sonuçlanan) oranını %13 azaltmıştır (%95 GA: -1, 24; p=0,064). UMEC/VI ile karşılaştırıldığında TRELEGY ELLIPTA yıllık şiddetli alevlenmelerin oranını istatistik olarak anlamlı (%34) azaltmıştır (%95 GA: 22, 44; p<0,001).
Sağlıkla-İlişkili Yaşam Kalitesi
TRELEGY ELLIPTA, St. George Solunum Anketi (SQRQ) toplam skoru'na göre ölçülen Sağlıkla İlişkili Yaşam Kalitesi'nde istatistik olarak anlamlı gelişme sağlamıştır: FULFIL çalışmasında (24. hafta) BUD/FOR ile karşılaştırıldığında -2,2 ünite, %95 GA: -3,5, -1,0;
IMPACT çalışmasında (52. hafta) FF/VI ile karşılaştırıldığında -1,8 ünite, %95 GA: -2,4, -1,1
ve UMEC/VI ile karşılaştırıldığında -1,8 ünite, %95 GA: -2,6, -1,0.
TRELEGY ELLIPTA alan hastaların daha yüksek bir yüzdesinde SGRQ toplam skorunda istatistik olarak anlamlı gelişme görülmüştür: FULFIL çalışmasında 24. haftada BUD/FOR ile karşılaştırıldığında sırasıyla %50 ve %41, yanıt alma ve yanıt alamama olasılık oranı (OR) (1,41; %95 GA: 1,16, 1,70); IMPACT çalışmasında 52. haftada FF/VI ve UMEC/VI ile
karşılaştırıldığında sırasıyla %42, %34 ve %34, FF/VI'e karşı OR 1,41, GA: 1,29, 1,155 ve
UMEC/VI'e karşı OR 1,41, %95 GA: 1,26, 1,57; tüm tedavi karşılaştırmaları istatistik olarak anlamlıdır (p<0,001).
FULFIL çalışmasında 24. haftada, KOAH Değerlendirme Testi (CAT) cevabı alınan hastaların (başlangıç değerinin 2 ünite veya daha fazla altında olarak tanımlanmıştır) oranı, TRELEGY ELLIPTA ile tedavi edilen hastalarda BUD/FOR'a göre istatistik olarak anlamlı (p<0,001) daha yüksek bulunmuştur (%53'e karşılık %45; OR 1,44; %95 GA: 1,19, 1,75). IMPACT çalışmasında 52. haftada, CAT cevabı alınan hastaların oranı, TRELEGY ELLIPTA ile tedavi edilen hastalarda (%42) FF/VI'e (%37; OR 1,24; %95 GA: 1,14, 1,36) ve UMEC/VI'e (%36;
OR 1,28; %95 GA: 1,15, 1,43) göre istatistik olarak anlamlı (p<0,001) daha yüksek
bulunmuştur.
Semptom Kontrolü
Nefes darlığı, FULFIL çalışmasında 24. haftada ve IMPACT çalışmasında 52. haftada (hasta alt grubu, n=5.058) Geçici Dispne Endeksi (TDI) odak skoru ile ölçülmüştür. FULFIL çalışmasında TDI'ye göre (en az 1 ünite olarak tanımlanmıştır) cevap alınan hastaların oranı, TRELEGY ELLIPTA ile tedavi edilen hastalarda BUD/FOR'a göre istatistik olarak anlamlı (p<0,001) daha yüksek bulunmuştur (%61'e karşılık %51; OR 1,61; %95 GA: 1,33, 1,95). IMPACT çalışmasında da cevap alınan hastaların oranı, TRELEGY ELLIPTA için istatistik olarak anlamlı (p<0,001) daha yüksek bulunmuştur: FF/VI ile karşılaştırıldığında %29 (OR
1,36; %95 GA: 1,19, 1,55) ve UMEC/VI ile karşılaştırıldığında %30 (OR 1,33; %95 GA: 1,13,
1,57).
FULFIL çalışmasında, KOAH'ın Respiratuvar Belirtilerini Değerlendirmede kullanılan solunum belirtileri (E-RS: KOAH) ile değerlendirildiğinde, TRELEGY ELLIPTA günlük KOAH semptomlarında BUD/FOR ile karşılaştırıldığında iyileşme sağlamıştır (başlangıç değerinden 2 ünite veya daha yüksek azalma). 21-24. hafta süresince cevap alınanların oranı TRELEGY ELLIPTA'da BUD/FOR ile karşılaştırıldığında istatistik olarak anlamlı (p<0,001) daha yüksek bulunmuştur (sırasıyla %47 ve %37; OR 1,59; %95 GA: 1,30, 1,94).
Kurtarıcı İlaç Kullanımı
FULFIL çalışmasında, TRELEGY ELLIPTA BUD/FOR ile karşılaştırıldığında, 1 ila 24. haftalar arasında kurtarıcı inhaler kullanımını istatistik olarak anlamlı (p<0,001) derecede azaltmıştır (tedavi farkı: günde -0,2 olay; %95 GA: -0,3, -0,1).
IMPACT çalışmasında, TRELEGY ELLIPTA FF/VI ve UMEC/VI ile karşılaştırıldığında, her 4 haftalık zaman periyodunda kurtarıcı inhaler kullanımını istatistik olarak anlamlı (p<0,001) derecede azaltmıştır. 49-52. haftalarda, tedavi farkı FF/VI ile karşılaştırıldığında -0,28 (%95 GA: -0,37, -0,19), UMEC/VI ile karşılaştırıldığında -0,30 (%95 GA: -0,41, -0,19) olmuştur.
Gece uyanmaları
IMPACT çalışmasında, TRELEGY ELLIPTA, 49 ile 52. haftalarda KOAH nedenli gece uyanmalarını istatistik olarak anlamlı azaltmıştır: FF/VI ile karşılaştırıldığında -0,05 (%95 GA:
-0,08, -0,01; p=0,005), UMEC/VI ile karşılaştırıldığında -0,10 (%95 GA: -0,14, -0,05; p<0,001). UMEC/VI için diğer tüm zaman noktalarında (p<0,001) ve FF/VI için ikisi hariç tüm zaman noktalarında (p≤0,021) istatistik olarak anlamlı azalma gözlemlenmiştir.
Pediyatrik popülasyon
Avrupa İlaç Ajansı KOAH'da TRELEGY ELLIPTA ile yapılan çalışmalardaki bulguların, pediyatrik popülasyonun tüm alt gruplarında sunulması zorunluluğunu kaldırmıştır (pediyatrik kullanıma ilişkin bilgiler için bkz. bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerSağlıklı gönüllülere flutikazon furoat, umeklidinyum ve vilanterol kombinasyon olarak tek bir inhalerden inhalasyon yoluyla uygulandığında, her bir bileşenin farmakokinetiği, her bir etkin maddenin flutkazon furoat/ vilanterol kombinasyonu ya da umeklidinyum/ vilanterol kombinasyonu veya monoterapi umeklidinyum olarak uygulandığında gözlendiği gibi olmuştur.
Flutikazon furoat, umeklidinyum ve vilanterolün astım hastası gönüllülerdeki sistemik maruziyetini değerlendirmek için popülasyon farmakokinetik (FK) analizleri gerçekleştirilmiştir. Bu analizlerde, bir inhalasyon cihazında FF/UMEC/VI'den (100/62,5/25 mcg ve 200/62,5/25 mcg) sonra (üçlü kombinasyon) flutikazon furoat ve vilanterolün sistemik ilaç düzeylerinde (kararlı durum Cve AUC), 100 mcg ve 200 mcg dozlarında FF/VI ile ikili kombinasyon uygulamasından sonra gözlemlenen düzeylerin aralığındadır; bir inhalasyon cihazında FF/UMEC/VI uygulamasından sonra 62,5 mcg umeklidinyumun sistemik maruziyeti, monoterapi olarak 62,5 mcg umeklidinyum uygulamasından sonra gözlemlenen aralıktadır.
FF/UMEC/VI için popülasyon FK analizleri 821 KOAH hastasından alınan kombine FK verileriyle yapılmıştır. FF/UMEC/VI'nin tek bir inhalerle (üçlü kombinasyon) verilmesini takiben FF, UMEC ve VI için sistemik ilaç seviyeleri (kararlı durum Cve EAA), FF/VI + UMEC iki inhaler şeklinde kullanımı, ikili kombinasyonları (FF/VI ve UMEC/VI) ve bunun yanı sıra tek inhalerde ayrı ayrı (FF, UMEC ve VI) verilmelerini takiben gözlenen aralıkta olmuştur. FF/VI ile FF/UMEC/VI karşılaştırıldığında kovaryans analizi FF görünen klerensinin daha yüksek (%42) olduğunu göstermiştir; ancak bu klinik açıdan ilgili bulunmamıştır.
Emilim:
Flutikazon furoat
Sağlıklı gönüllülere inhalasyon yoluyla flutikazon furoat/umeklidinyum/vilanterol uygulanmasını takiben, flutikazon furoat C15. dakikada oluşmuştur. Flutikazon furoat/vilanterol inhalasyon yoluyla uygulandığında, başlıca dozun akciğere ulaşan kısmının emilimine bağlı olarak ve ihmal edilebilir oral emilimle birlikte flutikazonun mutlak biyoyararlılığı %15.2 olmuştur. Tekrarlayan flutikazon furoat /vilanterol dozlarını takiben 6 gün içinde birikim 1.6 katına kadar çıkarken kararlı duruma ulaşılmıştır.
Umeklidinyum
Flutikazon furoat/umeklidinyum/vilanterolün sağlıklı gönüllülere inhale edilerek uygulanmasını takiben, C5 dakikada oluşmuştur. İnhale umeklidinyumun mutlak biyoyararlanımı, oral emilimden gelen önemsiz düzeyde katkı ile dozun ortalama %13'üdür. İnhale umeklidinyumun yinelenen dozlamını takiben, kararlı durum, 1.5-2 katı birikim ile 7-10 gün arasında elde edilmiştir.
Vilanterol
Sağlıklı gönüllülere inhalasyon yoluyla flutikazon furoat/umeklidinyum/vilanterol uygulanmasını takiben, vilanterol C7. dakikada oluşmuştur. İnhale vilanterolun biyoyararlılığı %27 olup oral absorpsiyon ihmal edilebilir seviyede olmuştur. Tekrarlayan umeklidinyum/vilanterol dozlarını takiben 6 gün içinde birikim 1.5 katına kadar çıkarken kararlı duruma ulaşılmıştır.
Dağılım:
Flutikazon furoat
Flutikazon furoatın dozunun sağlıklı gönüllülere intravenöz verilmesini takiben, kararlı durumda ortalama dağılım hacmi 661 litre olmuştur. Flutikazon furoatın eritrositlerle ilişkisi düşüktür. İn vitro plazma proteinine bağlanma oranı insan plazmasında yüksek olup ortalama
>%99.6 olmuştur.
Umeklidinyum
Sağlıklı gönüllülere intravenöz uygulamayı takiben, ortalama dağılım hacmi 86 litredir. İnsan plazmasındaki in vitro plazma proteinine bağlanma oranı ortalama %89'dur.
Vilanterol
Vilanterolun sağlıklı gönüllülere intravenöz uygulanmasını takiben, kararlı durumda ortalama dağılım hacmi 165 litre olmuştur. Vilanterolun eritrositlerle ilişkisi düşüktür. İn vitro plazma proteinine bağlanma oranı insan plazmasında ortalama %94 olmuştur.
Biyotransformasyon:
Flutikazon furoat
İn vitro çalışmalar flutikazon furoatın başlıca sitokrom P450 3A4 (CYP3A4) tarafından metabolize edildiğini ve P-gp taşıyıcı için bir substrat olduğunu göstermiştir. Flutikazon furoat için başlıca metabolik yol S-fluorometil karbotioat grubunun hidrolizi ile kortikosteroid etkinliğin anlamlı olarak azaldığı metabolitlerin oluşmasıdır. Metabolitlerin sistemik olarak maruz kalınan seviyesi düşüktür.
Umeklidinyum
İn vitro çalışmalar, umeklidinyumun daha çok sitokrom P450 2D6 (CYP2D6) tarafından metabolize edildiğini ve P-glikoprotein (P-gp) transporteri için bir substrat olduğunu göstermiştir. Umeklidinyum için primer metabolik yollar, oksidatif (hidroksilasyon, O- dealkilasyon) ve bunu takiben konjugasyonu (glukuronidasyon vb.) olup, düşük farmakolojik aktivite içeren ya da farmakolojik aktivitesi olmayan bir dizi metabolitle sonuçlanmıştır. Sistemik metabolit maruziyeti düşüktür.
Vilanterol
İn vitro çalışmalar vilanterolun başlıca sitokrom P450 3A4 (CYP3A4) tarafından metabolize edildiğini ve P-gp taşıyıcı için bir substrat olduğunu göstermiştir. Vilanterol için başlıca metabolik yol O-dealkilasyondur ve bu yolla beta- ve beta- adrenerjik agonist etkinliği azalmış bir dizi metabolit oluşur. İnsan radyoaktif etiket çalışmasında vilaterolun oral yolla alınmasını takiben plazma metabolik profilleri, yüksek ilk geçiş metabolizması ile uyumludur. Metabolitlerin sistemik olarak maruz kalınan seviyesi düşüktür.
Eliminasyon:
Flutikazon furoat
Flutikazon furoat/vilanterol kombinasyonunun inhalasyon yoluyla uygulanmasını takiben flutikazon furoatın aşikar plazma eliminasyon yarı ömrü ortalama 24 saat olmuştur. İntravenöz uygulanmasını takiben eliminasyon fazı yarı ömrü 15.1 saat bulunmuştur. İntravenöz uygulanmasını takiben plazma klerensi 65.4 litre/saat olarak belirlenmiştir. İntravenöz uygulanan dozun %2'si idrarla atılmıştır. Oral alımını takiben, flutikazon furoat insanda başlıca metabolize edilerek elimine edilmiştir ve metabolitleri neredeyse yalnızca feçesle atılırken geri kazanılan radyoaktif dozun <%1'i idrarla atılmıştır.
Umeklidinyum
10 gün boyunca uygulanan inhale uygulamayı takiben umeklidinyum plazma eliminasyon yarı ömrü ortalama 19 saat olup etkin maddenin %3'ü ila %4'ü kararlı durumda idrarda değişmeden atılmıştır. İntravenöz uygulamayı takiben plazma klerensi 151 litre/saattir. İntravenöz uygulamayı takiben, uygulanan radyoaktif işaretli dozun yaklaşık %58'i dışkı ile ve yaklaşık verilen dozun %22'si idrarla atılır. İntravenöz dozlamı takiben ilaçla ilgili maddelerin dışkı ile atılması, safraya salımı göstermiştir. Oral alımı takiben radyoaktif işaretli dozun %92'si primer olarak dışkı ile atılır. Oral olarak alınan dozun %1'den daha azı (geri kazanılan radyoaktivitenin
%1'i) idrarla atılmıştır ve bu da oral uygulamayı takiben önemsiz düzeyde emilim olduğunu göstermiştir.
Vilanterol
Vilanterolün plazma yarılanma ömrü, 10 gün inhalasyonu takiben günde ortalama 11 saattir. İntravenöz kullanımı takiben vilanterolün plazmadan temizlenmesi 108 litre/saat idi. Radyoaktif işaretli vilanterolün oral alımını takiben radyo aktif işaretli %70 kısım idrarda, %30 kısım dışkıda atılır. Vilanterolün birincil eliminasyonu metabolize olduktan sonra metabolitlerinin idrar ve dışkı ile atılmasıdır.
Doğrusallık/Doğrusal olmayan durum:
Veri bulunmamaktadır.
Hastalardaki karakteristik özellikler Geriyatrik popülasyon
Yaşın flutikazon furoat, umeklidinyum ve vilanterolün farmakokinetiği üzerindeki etkileri popülasyon farmakokinetik analizinde değerlendirilmiştir. Dozda düzenleme gerektiren klinik açıdan ilgili etkiler gözlenmemiştir.
Böbrek yetmezliği
Flutikazon furoat/umeklidinyum/vilanterolün etkisi böbrek yetmezliği olan hastalarda değerlendirilmemiştir. Fakat flutikazon furoat/vilanterol ve umeklidinyum/vilanterol çalışmaları yapılmıştır ve flutikazon furoat, umeklidinyum veya vilanterol sistemik maruziyetlerinde herhangi bir artış olduğuna dair kanıt bulunmamıştır. Şiddetli böbrek yetmezliği bulunan hastalar ve sağlıklı gönüllüler arasında in vitro protein bağlama çalışmaları gerçekleştirilmiş ve değişen protein bağlanma profili görüldüğüne dair herhangi bir kanıt saptanmamıştır.
Hemodiyalizin etkileri çalışılmamıştır.
Karaciğer yetmezliği
Flutikazon furoat/umeklidinyum/vilanterolün etkisi hepatik bozukluğu olan gönüllülerde değerlendirilmemiştir. Öte yandan, flutikazon furoat/vilanterol ve umeklidinyum/vilanterol ile çalışmalar yürütülmüştür.
TRELEGY ELIPTA'nın flutikazon furoat/vilanterol bileşeni tüm şiddetlerden hepatik bozukluğu olan hastalarda değerlendirilmiştir (Child-Pugh A, B veya C). Flutikazon furoat için, orta şiddette hepatik bozukluğu olan hastalar üç kata kadar daha yüksek sistemik maruziyet göstermiştir (FF 184 mikrogram); bu nedenle şiddetli hepatik bozukluğu olan hastalar dozun yarısını almıştır (FF 92 mikrogram). Bu dozda, sistemik maruziyet üzerinde etkiler gözlenmemiştir. Bu nedenle orta şiddette ila şiddetli hepatik bozuklukta dikkat gösterilmesi tavsiye edilmekle birlikte, hepatik fonksiyon temelinde hiçbir spesifik doz düzenlemesi önerilmemektedir. Vilanterole sistemik maruziyette anlamlı bir artış görülmemiştir.
Orta şiddette hepatik bozukluğu olan hastalar umeklidinyum veya vilanterole sistemik maruziyette bir artış kanıtı göstermemiştir (Cve EAA). Umeklidinyum şiddetli hepatik bozukluğu olan hastalarda değerlendirilmemiştir.
Diğer Özel Popülasyonlar
Irk, cinsiyet ve kilonun flutikazon furoat, umeklidinyum ve vilanterol farmakokinetikleri üzerindeki etkileri popülasyon farmakokinetik analiziyle de değerlendirilmiştir.
Astım popülasyonu farmakokinetik analizlerinde (flutikazon furoat için 1,265 gönüllü; vilanterol için 1,263 gönüllü; umeklidinyum için 634 gönüllü,) demografik ortak değişkenlerin (ırk/etnik köken, yaş, cinsiyet, ağırlık) flutikazon furoat, umeklidinyum ve vilanterolün farmakokinetiği üzerindeki etkisi değerlendirilmiştir. KOAH popülasyonu için yapılan bir farmakokinetik analizde (n=821) demografik ortak değişkenlerin (ırk/etnik köken, yaş, cinsiyet, ağırlık) flutikazon furoat, umeklidinyum ve vilanterolün farmakokinetiği üzerindeki etkisi değerlendirilmiştir. Böbrek ve karaciğer yetmezliği ayrı çalışmalarla değerlendirilmiştir.
FF/UMEC/VI (100/62,5/25 mcg ve 200/62,5/25 mcg) ile ilgili popülasyon farmakokinetik verileri sağlayan 92 Asyalı astım hastası gönüllüde (Japon, Doğu Asyalı ve Güneydoğu Asyalı), kararlı durumdaki vilanterol Ctahminleri Doğu Asyalı olmayan gönüllülere göre yaklaşık 3 kat daha yüksektir. Astımlı gönüllülerde ırkın flutikazon furoat veya umeklidinyumun farmakokinetik parametreleri üzerinde etkisi olmamıştır.
Tek bir inhaler ile FF/UMEK/VI alan 113 KOAH'lı, Doğu Asyalı (Japon ve Doğu Asyalı) hastada (hastaların %27'si), flutikazon furoat EAA, Kafkas ırkına kıyasla ortalama %30 oranında daha yüksek olmuştur. Ancak, bu popülasyondaki daha yüksek sistemik maruziyet, serum ve idrarda FF-kaynaklı kortizol azalması sınırının altındadır ve klinik olarak anlamlı değerlendirilmemektedir. KOAH hastalarında umeklidinyum veya vilanterolün farmakokinetik parametre hesaplamasındaki ırkın etkisi yoktur.
Flutikazon furoat, umeklidinyum veya vilanterol sistemik maruziyetinde, ırk, cinsiyet veya kiloya göre doz ayarlamasını gerektirecek klinik olarak anlamlı farklılık görülmemiştir.
Zayıf CYP2D6 metabolize edicilere ilişkin bir çalışma, sistemik umeklidinyum maruziyeti üzerinde CYP2D6 genetik polimorfizminin klinik olarak anlamlı herhangi bir etki oluşturmadığını göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Klinik öncesi çalışmalarda flutikazon furoat, umeklidinyum ya da vilanterol ile görülen farmakolojik ve toksikolojik etkiler, tipik olarak glukokortikosteroidler ya da beta-agonistleri ile ilişkilendirilen etkiler olmuştur. Köpeklere yapılan vilanterol, umeklidinyum ve flutikazon furoat kombinasyon uygulaması herhangi bir anlamlı yeni toksisiteye yol açmamıştır veya tek başına flutikazon furoat, umeklidinyum veya vilanterol ile ilişkili major bir alevlenmeye yol açmamıştır.
Genotoksisite ve karsinojenisite
Flutikazon furoat
Flutikazon furoat standart çalışmalarda genotoksik değilken, EAA'ya göre insanda günlük 92 mikrogram flutikazon furoat dozuna göre sıçanlarda ya da farelerde sırasıyla 1,4 ve 2,9 kat maruziyetlerde gerçekleştirilen yaşam boyu inhalasyon çalışmalarında da karsinojenik olmamıştır.
Umeklidinyum
Umeklidinyum standart çalışmalarda genotoksik değildir ve EAA'ya göre maksimum insan klinik maruziyet dozunun sırasıyla ≥20 veya ≥17 katı dozlara (günlük 55 mikrogram umeklidinyum dozu) fare ve sıçanların ömür boyu maruziyet düzeylerindeki yaşam boyu inhalasyon çalışmalarında karsinojenik olmamıştır.
Vilanterol
Vilanterolün (alfa fenilsinamat gibi) ve trifenilasetik asit genotoksik değildir ve vilanterolün (trifenatat olarak) insanlar için genotoksik bir risk oluşturmadığını göstermektedir. Diğer betaagonistlerine yönelik bulgularla tutarlı olarak, yaşam boyu inhalasyon çalışmalarında vilanterol trifenatat dişi sıçan ve fare üreme yolunda ve sıçan hipofiz bezinde proliferatif etkilere yol açmıştır. Sıçanlarda veya farelerde tümör insidansında sırasıyla 0,9 veya 22 kat maruz kalınması tümör insidansında artışa yol açmaz (insanların vilanterole klinik maruziyetinde EAA günlük 22 mikrogram doz temel olarak alındığında).
Üreme toksisitesi
Flutikazon furoat, umeklidinyum ve vilanterolün sıçanlarda erkek veya kadın üreme sistemlerine herhangi bir advers etkisi yoktur.
Flutikazon furoat
Flutikazon furoat, sıçanlarda ya da tavşanlarda teratojenik değildi fakat sıçanlarda gelişimi geciktirmiş ve maternal olarak toksik dozlarda tavşanlarda aborsiyona neden olmuştur. EAA'a göre, 200 mikrogram günlük dozunda insan klinik maruziyetinin 3 katı maruziyet düzeylerinde sıçanlarda gelişim üzerinde herhangi bir etki oluşmamıştır. Flutikazon furoat sıçanlarda pre- veya post-natal gelişim üzerinde herhangi bir istenmeyen etki oluşturmamıştır.
Umeklidinyum
Umeklidinyum sıçanlar veya tavşanlarda teratojenik olmamıştır. 180 mikrogram/kg/gün (EAA'ya göre insanın günlük 55 mikrogram umeklidinyum dozuna klinik maruziyetinin yaklaşık 61 katı) dozu verilen annelerde yapılan bir post natal çalışmada, sıçanlara yapılan subkütan umeklidinyum uygulaması, annede daha düşük vücut ağırlığı artışı ve besin tüketimi ile sonuçlanmıştır ve yavrunun vücut ağırlığını sütten kesmeden önce hafifçe azaltmıştır.
Vilanterol
Vilanterol, sıçanlarda teratojenik olmamıştır. Tavşanlarda gerçekleştirilen inhalasyon çalışmalarında, vilanterol, diğer betaagonistleri ile birlikte görülenlere benzer etkilere yol açmıştır (yarık damak, açık göz kapağı, sternebral füzyon ve ekstremite fleksürleri/ malrotasyon). Subkütan olarak uygulandığından, EAA'ya göre önerilen maksimum insan dozundakinin 62 katı maruziyet düzeylerinde (günlük 22 mikrogram doz) herhangi bir etki oluşmamıştır. Vilanterol sıçanlarda pre- veya post-natal gelişim üzerinde herhangi bir istenmeyen etki oluşturmamıştır.
 Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir. |
 Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur.
Tiroid Kanseri
En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Geri Ödeme Kodu | A17448 |
| Satış Fiyatı | 1119.75 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 1119.75 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522553532 |
| Etkin Madde | Flutikazon Froat + Umeklidinyum Bromur + Vilanterol |
| ATC Kodu | R03AL08 |
| Birim Miktar | 100+62,5+25 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 30 |
| Solunum Sistemi > Adrenerjikler (İnhalan) |
| İthal ( ref. ülke : Ingiltere ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |