TREMFYA 100 mg/ml enjeksiyonluk çözelti içeren kullanıma hazır kalem (1 kalem) Kısa Ürün Bilgisi
{ Guselkumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
TREMFYA 100 mg/mL enjeksiyonluk çözelti içeren kullanıma hazır enjektör Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her 1 mL kullanıma hazır enjektör 100 mg guselkumab içerir.
Rekombinant DNA teknolojisi ile Çin Hamster Over (CHO) hücrelerinde üretilen guselkumab, -tamamen insan immünoglobulin G1 lamda (IgG1λ) monoklonal antikorudur (mAb).
Yardımcı maddeler
Yardımcı maddelerin tam listesi için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti (enjeksiyon).
Çözelti berrak ve renksiz ila açık sarı renktedir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Plak tip psoriasis
TREMFYA sistemik tedavilere aday olan ve konvansiyonel sistemik tedavilere (örneğin siklosporin, metotreksat veya fototerapi) yanıt vermeyen, bunların kontrendike olduğu veya bu tedavileri tolere edemeyen erişkin hastalarda orta ile şiddetli plak tip psoriasis tedavisinde endikedir.
Psoriatik artrit
TREMFYA, önceki hastalık modifiye edici antiromatizmal ilaç (DMARD) tedavisine yetersiz yanıt veren ya da bu tedaviyi tolere edemeyen aktif psoriatik artriti (PsA) olan erişkin hastaların tedavisinde tek başına veya metotreksat (MTX) ile kombine kullanımda endikedir (bkz. Bölüm 5.1).
4.2. Pozoloji ve uygulama şekli
Bu ilaç, endike olduğu hastalıkların teşhis ve tedavisinde deneyimli bir hekimin yönlendirmesi ve gözetimi altında kullanılmak üzere tasarlanmıştır.
Pozoloji/uygulama sıklığı ve süresi:
Plak tip psoriasis
Tavsiye edilen doz, 0 ve 4. haftalarda subkutan enjeksiyon ile 100 mg, ardından 8 haftada bir (q8w) idame dozudur.
16 haftanın sonunda tedaviye hiç yanıt vermeyen hastalarda tedavinin kesilmesi değerlendirilmelidir.
Psoriatik artrit
Tavsiye edilen doz, 0 ve 4. haftalarda subkutan enjeksiyon ile 100 mg, ardından 8 haftada bir idame dozudur. Klinik karara göre eklem hasarı için yüksek risk taşıyan hastalarda, 4 haftada bir (q4w) 100 mg doz düşünülebilir (bkz. Bölüm 5.1).
24 haftalık tedavinin sonunda tedaviye hiç yanıt vermeyen hastalarda tedavinin sonlandırılması değerlendirilmelidir.
Uygulama şekli:
TREMFYA, subkutan yoldan uygulanır. Mümkünse psoriasis gözlenen deri alanlarını enjeksiyon bölgesi olarak kullanmaktan kaçınılmalıdır.
Hekimin uygun olacağına karar vermesi halinde ve subkutan enjeksiyon tekniği konusunda gerekli eğitimin verilmesinden sonra, hastalar TREMFYA'yı kendi kendine enjekte edebilir. Ancak hekim hastaların uygun şekilde tıbbi açıdan takip edilmesini sağlamalıdır. Hastalara, Kullanma Talimatı'ndaki uygulama şekline uygun olarak çözeltinin tamamını enjekte etmeleri söylenmelidir.
Uygulama öncesinde ilacın hazırlanmasına ilişkin talimatlar için Bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/ Karaciğer yetmezliği
TREMFYA, bu hasta popülasyonlarında araştırılmamıştır. Doz önerisi yapılamamaktadır. Guselkumabın eliminasyonu hakkında daha fazla bilgi için, bkz. Bölüm 5.2.
Geriyatrik popülasyon
Herhangi bir doz ayarlaması gerekli değildir (bkz. Bölüm 5.2). 65 yaş ve üzeri hastalarda sınırlı bilgi mevcuttur; 75 yaş ve üzeri hastalarda ise bilgiler çok sınırlıdır (bkz. Bölüm 5.2).
Pediyatrik popülasyon
TREMFYA'nın güvenliliği ve etkililiği 18 yaşın altındaki çocuklarda ve ergenlerde henüz belirlenmemiştir. Bu konuda veri bulunmamaktadır.
4.3. Kontrendikasyonlar
Guselkumab veya yardımcı maddelerden (bkz. Bölüm 6.1) herhangi birine ciddi aşırı duyarlılığı olduğu bilinen hastalarda ve klinik olarak önemli aktif enfeksiyon (örneğin, aktif tüberküloz bkz. Bölüm 4.4) varlığında kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Enfeksiyonlar
Guselkumab enfeksiyon riskini artırabilir. Klinik olarak önemli aktif enfeksiyonu olan hastalarda, enfeksiyon düzelene ya da uygun şekilde tedavi edilene dek tedaviye başlanmamalıdır.
Guselkumab ile tedavi edilen hastalara, klinik olarak önemli kronik veya akut bir enfeksiyonun bulgu veya belirtileri ortaya çıkarsa hekime danışmaları tavsiye edilmelidir. Eğer bir hastada klinik olarak önemli veya ciddi bir enfeksiyon gelişirse ya da hasta standart tedaviye yanıt vermiyorsa, hasta yakından izlenmeli ve enfeksiyon düzelene dek tedavi kesilmelidir.
Tüberküloz için ön tedavi değerlendirmesi
Tedaviye başlanmadan önce hastalar tüberküloz (TB) enfeksiyonu açısından değerlendirilmelidir. Guselkumab alan hastalar, tedavi süresince ve sonrasında, aktif tüberküloz bulgu ve belirtileri açısından yakından izlenmelidir. Yeterli tedaviyi aldığı doğrulanamayan, gizli veya aktif tüberküloz öyküsü olan hastalarda tedaviye başlanmadan önce antitüberküloz tedavi de düşünülmelidir.
Hipersensitivite
Pazarlama sonrası dönemde anafilaksi dahil ciddi hipersensitivite reaksiyonları bildirilmiştir (bkz. Bölüm 4.8). Ürtiker ve dispne vakaları dahil olmak üzere, guselkumab tedavisinden birkaç gün sonra bazı vakalar ortaya çıkmıştır. Ciddi bir aşırı duyarlılık reaksiyonu ortaya çıkması halinde, derhal guselkumab tedavisi bırakılmalı ve uygun tedaviye başlanmalıdır.
Karaciğer transaminaz yükseklikleri
Psoriatik artrit klinik çalışmalarında, guselkumab q4w ile tedavi edilen hastaların karaciğer enzim yüksekliği insidansında guselkumab q8w ya da plasebo ile tedavi edilen hastalara kıyasla bir artış gözlenmiştir (bkz. Bölüm 4.8).
Psoriatik artritte TREMFYA q4w reçete edilirken, başlangıçta ve sonrasında rutin hasta yönetimine göre karaciğer enzimlerinin değerlendirilmesi önerilmektedir. alanin aminotransferaz [ALT] veya aspartat aminotransferaz [AST] artışları gözlenmesi ve ilaçla indüklenen karaciğer hasarından şüphelenilmesi durumunda, bu tanı ekarte edilene kadar tedavi geçici olarak durdurulmalıdır.
Aşılar
Tedaviye başlanmadan önce mevcut aşılama kılavuzlarına uygun olarak tüm gerekli aşıların tamamlanması düşünülmelidir. Guselkumab ile tedavi edilen hastalarda aynı anda canlı aşılar kullanılmamalıdır. Canlı veya inaktif aşılara verilen yanıt hakkında hiçbir veri mevcut değildir. Canlı viral veya canlı bakteriyel aşılama yapılmadan önce, tedaviye son dozdan itibaren en az 12 hafta süreyle ara verilmelidir. Aşılamadan en az 2 hafta sonra TREMFYA ile tedaviye devam edilebilir. Reçeteyi yazan hekim, ek bilgi ve aşılama sonrası immünosupresif ilaçların eşzamanlı kullanımına ilişkin yönlendirme için söz konusu aşının Kısa Ürün Bilgileri'ne başvurmalıdır.
İzlenebilirlik
Biyoteknolojik tıbbi ürünlerin izlenebilirliğini geliştirmek için, uygulanan ürünün ismi ve seri numarası açık bir şekilde kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
CYP450 substratları ile etkileşimler
Orta şiddetli ila şiddetli plak psoriasis hastalarında yürütülen Faz 1 çalışmada, tek bir guselkumab dozunu takiben midazolam, S-varfarin, omeprazol, dekstrometorfan ve kafeinin sistemik maruziyetlerinde (Cve EAA) klinik olarak ilgili değişimler gözlenmemiş ve
guselkumab ile çeşitli CYP enzim substratları (CYP3A4, CYP2C9, CYP2C19, CYP2D6 ve CYP1A2) arasında ilaç etkileşimlerinin beklenmediğini göstermiştir. Guselkumab ile CYP450 substratları birlikte uygulanırken, doz ayarı yapılmasına gerek yoktur.
Eşzamanlı immünosupresif tedavi veya fototerapi
Psoriasis çalışmalarında, guselkumabın, biyolojik ürünler de dahil olmak üzere, immünosupresanlar veya fototerapi ile birlikte uygulandığı durumdaki etkililiği ve güvenliliği değerlendirilmemiştir.
Özel popülasyonlara ilişkin ek bilgiler
Özel popülasyonlara ilişkin herhangi bir etkileşim çalışması yürütülmemiştir.
Pediyatrik popülasyon
Pediyatrik popülasyona ilişkin herhangi bir etkileşim çalışması yürütülmemiştir.
4.6. Gebelik ve laktasyon
Gebelik Kategorisi:B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeline sahip kadınlar tedavi süresince ve tedaviyi takip eden en az 12 hafta boyunca etkili doğum kontrol yöntemleri kullanmalıdır.
Gebelik dönemi
Guselkumabın gebe kadınlarda kullanımına ilişkin veri mevcut değildir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik/embriyonal/fetal gelişim/doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Bölüm 5.3). Önlem olarak, TREMFYA'nın gebelik sırasında kullanılmasından kaçınılmalıdır.
Laktasyon dönemi
Guselkumabın anne sütüne geçip geçmediği bilinmemektedir. . İnsan IgG antikorlarının doğumdan sonraki ilk birkaç günde anne sütüne geçtiği ve kısa süre sonra konsantrasyonlarının azaldığı bilindiğinden, bu dönemde emzirilen bebeğe yönelik risk ekarte edilemez. Emzirmenin kesilip kesilmeyeceğine veya TREMFYA tedavisinden uzak durulup durulmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve tedavinin emziren anne açısından
faydası dikkate alınmalıdır. Guselkumabın hayvan (sinomolgus maymunu) sütüne geçmesi hakkında bilgiler için, bkz. Bölüm 5.3.
Üreme yeteneği/Fertilite
Guselkumabın insan fertilitesi üzerindeki etkisi değerlendirilmemiştir. Hayvanlar üzerinde yapılan çalışmalar, fertilite ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
TREMFYA'nın araç ya da makine kullanma becerisi üzerine etkisi yoktur ya da ihmal edilebilecek düzeydedir.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Psoriasis ve psöriatik artrit klinik çalışmalarında hastaların yaklaşık %14'ünde görülen en yaygın advers reaksiyon solunum yolu enfeksiyonları olmuştur.
Advers reaksiyonların tablolaştırılmış listesi
Tablo 1'de psoriasis ve psoriatik artrit klinik çalışmalarında görülen ve pazarlama sonrası deneyimde elde edilen advers reaksiyonlar liste halinde verilmektedir. Advers reaksiyonlar MedDRA Sistem Organ Sınıfına göre sıklıklar aşağıdaki düzene göre tanımlanmıştır: çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1000 ila < 1/100); nadir (≥ 1/10.000 ila < 1/1000); çok nadir (< 1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 1: Advers reaksiyonların listesi
Sistem Organ Sınıfı | Sıklık | Advers Reaksiyonlar |
Enfeksiyonlar ve enfestasyonlar | Çok yaygın | Solunum yolu enfeksiyonu |
Yaygın olmayan | Herpessimpleks enfeksiyonları | |
Yaygın olmayan | Tinea enfeksiyonları | |
Yaygın olmayan | Gastroenterit | |
Bağışıklık sistem hastalıkları | Yaygın olmayan | Hipersensitivite |
Yaygın olmayan | Anafilaksi | |
Sinir sistemi hastalıkları | Yaygın | Baş ağrısı |
Gastrointestinal hastalıklar | Yaygın | Diyare |
Deri ve deri altı dokusu hastalıkları | Yaygın olmayan | Ürtiker |
Yaygın olmayan | Döküntü | |
Kas-iskelet bozukluklarıve bağ dokusu ve kemik hastalıkları | Yaygın | Artralji |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Yaygın | Enjeksiyon bölgesi reaksiyonları |
Araştırmalar | Yaygın | Transaminaz artışı |
Yaygın olmayan | Nötrofil sayısında azalma |
Seçilmiş advers reaksiyonlara ilişkin açıklamalar
Transaminaz artışı
İki Faz III psoriatik artrit klinik çalışmasında, plasebo kontrollü dönem boyunca, advers olaylar olarak transaminaz artışları ( ALT artışı, AST artışı, hepatik enzim artışı, transaminazların artışı, anormal karaciğer fonksiyon testi, hipertransaminazemiyi içerir) (Guselkumab ile tedavi edilen gruplarda (q4w grubunda %8,6 ve q8w grubunda %8,3) plasebo grubuna (%4,6) kıyasla daha sık bildirilmiştir. 1 yıl boyunca, advers olaylar olarak transaminazların artışı (yukarıdaki gibi) q4w grubunda hastaların %12,9'unda ve q8w grubunda hastaların %11,7'sinde raporlanmıştır.
Laboratuvar değerlendirmelerine göre, çoğu transaminaz (ALT ve AST) artışı ≤ 3 x normalin üst sınırıydı (NÜS). Transaminazların > 3 ila ≤ 5 x NÜS ve > 5 x NÜS'ye artışları düşük sıklıkta olup guselkumab q8w grubuna kıyasla guselkumab q4w grubunda daha sık meydana gelmiştir (Tablo 2). İki yıllık Faz III psoriatik artrit klinik çalışmasının sonuna kadar, şiddete ve tedavi grubuna göre benzer bir sıklık paterni gözlenmiştir.
Tablo 2:İki Faz III psoriatik artrit klinik çalışmasında başlangıç sonrası transaminaz artışları olan hastaların sıklığı
| 24. Haftaya kadar | 1 Yılın Sonuna Kadar | |||
Plasebo N=370 | guselkumab 100 mg q8w N=373 | guselkumab 100 mg q4w N=371 | guselkumab 100 mg q8w N=373 | guselkumab 100 mg q4w N=371 | |
ALT | |||||
>1 ila ≤ 3 x NÜS | %30 | %28,2 | %35 | %33,5 | %41,2 |
>3 ila ≤ 5 x NÜS | %1,4 | %1,1 | %2,7 | %1,6 | %4,6 |
>5 x NÜS | %0,8 | %0,8 | %1,1 | %1,1 | %1,1 |
AST | |||||
>1 ila ≤ 3 x NÜS | %20 | %18,8 | %21,6 | %22,8 | %27,8 |
>3 ila ≤ 5 x NÜS | %0,5 | %1,6 | %1,6 | %2,9 | %3,8 |
>5 x NÜS | %1,1 | %0,5 | %1,6 | %0,5 | %1,6 |
![]()
başlangıçta plaseboya randomize edilen ve guselkumaba geçiş yapan hastalar dahil edilmemiştir
![]()
Psoriasis klinik çalışmalarında 1 yıl boyunca guselkumab q8w dozu için gözlenen transaminaz artışları sıklığı (ALT ve AST), psoriatik artrit klinik çalışmalarında guselkumab q8w dozu ile gözlenene benzer olmuştur. Beş yıla kadar, transaminaz yüksekliği insidansı guselkumab tedavisinin yıl sayısına göre artış göstermemiştir. Transaminaz artışlarının çoğu ≤ 3 x NÜS'dür.
Çoğu durumda, transaminaz artışı geçici olup, tedavinin bırakılmasına yol açmamıştır.
Nötrofil sayısında azalma
İki Faz III psoriatik artrit klinik çalışmasında, plasebo kontrollü dönem boyunca advers olay olarak azalmış nötrofil sayımı guselkumab ile tedavi edilen grupta (%0,9) plasebo grubuna (%0) kıyasla daha sık bildirilmiştir. 1 yıl boyunca, advers olay olarak nötrofil sayısındaki azalma, guselkumab ile tedavi edilen hastaların %0,9'unda raporlanmıştır. Çoğu vakada, kandaki nötrofil sayımında azalma hafif, geçici ve enfeksiyonla ilişkisiz olmuş ve tedavinin sonlandırılmasına yol açmamıştır.
Gastroenterit
İki Faz III psoriasis klinik çalışmasının plasebo kontrollü dönemi boyunca gastroenterit guselkumab ile tedavi edilen grupta (% 1,1) plasebo grubuna (% 0,7) göre daha sık ortaya
çıkmıştır. 264. Haftaya kadar, guselkumab ile tedavi edilen tüm hastaların %5,8'inde gastroenterit bildirilmiştir. Gastroenterit advers olayları ciddi olmayıp, 264. Haftayakadar guselkumab tedavisinin bırakılmasına yol açmamıştır. Psoriatik artrit klinik çalışmalarında plasebo kontrollü dönem boyunca gözlenen gastroenterit oranları, psoriasis klinik çalışmalarında gözlenen oranlara benzerdir.
Enjeksiyon bölgesi reaksiyonları
İki Faz III psoriasis klinik çalışmasında 48. Hafta itibariyle, guselkumab enjeksiyonlarının % 0,7'si ve plasebo enjeksiyonlarının % 0,3'ü enjeksiyon bölgesi reaksiyonları ile ilişkili olmuştur. 264. Hafta itibariyle, guselkumab enjeksiyonlarının %0,4'ü enjeksiyon bölgesi reaksiyonları ile ilişkili olmuştur. Enjeksiyon bölgesi reaksiyonları genel olarak hafif ila orta şiddetli olmuş; hiçbiri şiddetli olmamış ve bir tanesi guselkumab tedavisinin bırakılmasına yol açmıştır.
İki Faz III psoriatik artrit klinik çalışmasında, 24. Haftaya kadar 1 veya daha fazla enjeksiyon bölgesi reaksiyonu bildirilen hastaların sayısı düşük ve plasebo grubuna kıyasla guselkumab gruplarında biraz daha yüksek olmuştur; guselkumab q8w grubunda 5 (1,3%), q4w grubunda 4 (%1,1) hasta ve plasebo grubunda 1 (%0,3) hasta. Psoriatik artrit klinik çalışmalarının plasebo kontrollü döneminde, enjeksiyon bölgesi reaksiyonu nedeniyle bir hastanın guselkumab tedavisi sonlandırılmıştır. 1 yıl boyunca, 1 veya daha fazla enjeksiyon bölgesi reaksiyonları gösteren hastaların oranı guselkumab q8w ve q4w gruplarında sırasıyla %1,6 ve %2,4'tür. Genel olarak, psoriatik artrit klinik çalışmalarında plasebo kontrollü dönem boyunca gözlenen enjeksiyon bölgesi reaksiyonları ile ilişkili enjeksiyon oranı psoriasis klinik çalışmalarında gözlenen oranlara benzerdi.
İmmünojenisite
Guselkumabın immünojenisitesi hassas ve ilaç toleranslı bir immün analiz kullanılarak değerlendirilmiştir. Psoriasis ve psoriatik artrit hastalarında birleştirilmiş Faz II ve Faz III analizlerde, 52 haftaya kadar olan tedavi süresinde guselkumab ile tedavi edilen hastaların
%5'inde (n=145) anti-ilaç antikorları gelişmiştir. Anti-ilaç antikorları gelişen hastaların yaklaşık %8 (n=12)'sinde nötralize edici olarak sınıflandıran antikorlar gelişmiştir; bu da, guselkumab ile tedavi edilen tüm hastaların % 0,4'üne denk gelir. Psoriasis hastalarının birleştirilmiş Faz III analizlerinde, 264. haftaya kadar olan tedavi süresinde guselkumab ile tedavi edilen hastaların yaklaşık %15'inde anti-ilaç antikorları gelişmiştir. Anti-ilaç antikorları gelişen hastaların yaklaşık %5'inde nötralizan olarak sınıflandırılan antikorlar mevcuttur ve bu oran guselkumab ile tedavi edilen tüm hastaların %0,76'sına eşittir. Anti-ilaç antikorları daha
düşük etkililik ya da enjeksiyon bölgesi reaksiyonlarının gelişimi ile ilişkili olmamıştır.
Şüpheli advers reaksiyonların bildirilmesi
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr, e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Klinik çalışmalarda, 987 mg'a (10 mg/kg) kadar dozlarda tek intravenöz guselkumab dozları sağlıklı gönüllülere ve 300 mg'a kadar tek subkutan guselkumab dozları plak psoriasis hastalarına uygulandığında doz sınırlayıcı toksisite görülmemiştir. Doz aşımı durumunda, hasta advers reaksiyonlara ilişkin bulgu ve belirtiler açısından izlenmeli ve hastaya uygun semptomatik tedavi zaman geçirilmeden uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmunosupresanlar, interlökin inhibitörleri ATC kodu: L04AC16 Etki mekanizması
Guselkumab, interlökin 23 (IL23) proteinine yüksek özgünlük ve afinite ile seçici olarak bağlanan bir insan IgG1λ monoklonal antikorudur (mAb). IL-23, enflamatuar ve immün yanıtlarda rol oynayan bir sitokindir. Guselkumab, IL-23'ün reseptörüne bağlanmasını engelleyerek IL-23'e bağlı hücre sinyal iletimini ve proenflamatuar sitokin salımını inhibe eder. Plak psoriasis hastalarının cildinde IL-23 düzeylerinde artış görülür. İn vitro modellerde, guselkumabın hücre yüzeyi IL-23 reseptörü ile etkileşimini engelleyerek IL-23'ün biyoaktivitesini inhibe edip, IL-23-aracılı sinyal iletimi, aktivasyon ve sitokin kaskadlarını bozduğu gösterilmiştir. Guselkumab plak psoriasis ve psoriatik artritte IL-23 sitokin yolağını bloke ederek klinik etkisini gösterir.
Farmakodinamik etkiler
Faz I çalışmada, plak psoriasis hastalarının lezyonel cilt biyopsilerinden elde edilen mRNA analizlerinde gösterildiği gibi guselkumab ile tedavi 12. haftada başlangıca göre azalmış IL- 23/Th17 yolağı genlerinin ekspresyonuna ve psoriasis ilişkili gen ekspresyon profillerine neden
olmuştur. Aynı Faz I çalışmada, guselkumab ile tedavi, 12. haftada histolojik psoriasis ölçümlerinde, epidermal kalınlık ve T hücre yoğunluğunda görülen azalmalar dahil gelişmelere neden olmuştur. Ek olarak, Faz II ve Faz III plak tip psoriasis çalışmalarında guselkumab ile tedavi edilen hastaların serum IL-17A, IL-17F ve IL-22 düzeylerinde plaseboya kıyasla azalma gözlenmiştir. Bu sonuçlar, plak psoriasiste guselkumab tedavisi ile gözlenen klinik yarar ile uyumludur.
Faz III çalışmalarda yer alan psoriatik artrit hastalarında, başlangıçta serumdaki akut faz proteinleri C-reaktif protein, serum amiloid A ve IL-6 düzeylerinde ve Th17 efektör sitokinler IL-17A, IL-17F ve IL-22 düzeyleri yüksekliği mevcuttu. Guselkumab, tedaviye başlanmasından sonraki 4 hafta içinde bu proteinlerin düzeylerini azaltmıştır. Guselkumab 24. Haftada bu protein düzeylerini başlangıca göre ve plaseboya kıyasla daha da azaltmıştır.
Klinik etkililik ve güvenlilik Plak tip psoriasis
Guselkumabın etkililik ve güvenliliği, üç randomize, çift kör, aktif kontrollü Faz III çalışmada fototerapi veya sistemik tedavi için aday olan orta ila şiddetli plak psoriasisli yetişkin hastalarda değerlendirilmiştir.
VOYAGE 1 ve VOYAGE 2
İki çalışma (VOYAGE 1 ve VOYAGE 2), 1829 yetişkin hastada plasebo ve adalimumab karşısında guselkumab tedavisinin etkililik ve güvenliliğini değerlendirmiştir. Guselkumab grubuna randomize edilen hastalara (N=825) 0 ve 4. haftalarda, ondan sonra 48. haftaya kadar (VOYAGE 1) ve 20. haftaya kadar (VOYAGE 2) 8 haftada bir (q8w) 100 mg verildi. Adalimumab grubuna randomize edilen hastalara (N=582), 0. haftada 80 mg ve 1. haftada 40 mg, ardından 48. haftaya kadar (VOYAGE 1) ve 23. haftaya kadar (VOYAGE 2) iki haftada bir (q2w) 40 mg verildi. İki çalışmada da, plasebo grubuna randomize edilen hastalara (N=422) 16 ve 20. haftalarda, ondan sonra 8 haftada bir 100 mg guselkumab verildi. VOYAGE 1'de, 0. Haftada adalimumab alacak şekilde randomize edilenler de dahil olmak üzere, tüm hastalar 52. Haftada 8 haftada bir (q8w) açık etiketli guselkumab almaya başladılar. VOYAGE 2'de, 0. haftada guselkumab grubuna randomize edilen ve 28. haftada Psoriasis Alan Şiddet İndeksi (PASI) 90 yanıtı elde edilen hastalar, 8 haftada bir guselkumab ile tedaviye devam edecek (idame tedavisi) ya da plasebo alacak şekilde (bırakma tedavisi) yeniden randomize edildi. Bırakma tedavisi alan hastalar, 28. Hafta PASI düzelmesinde en az %50 kayıp yaşadıklarında guselkumab tedavisine yeniden başladılar (tedavi tekrarındaki dozlar, 4 hafta sonra ve daha sonrasında 8 haftada bir). 0. Haftada adalimumab alacak şekilde randomize edilen PASI 90
yanıtı elde edilmeyen hastalara 28 ve 32. Haftalarda ve ondan sonra 8 haftada bir guselkumab verilmeye başlandı. VOYAGE 2'de, 76. Haftada tüm hastalara 8 haftada bir olmak üzere açık etiketli guselkumab verilmeye başlandı.
VOYAGE 1 ve 2 çalışmalarında, sırasıyla medyan % 22 ve % 24'lük vücut yüzey alanı (VYAVYA), her iki çalışma için medyan 19'luk başlangıç PASI puanı, medyan 14 ve 14,5'lik dermatoloji yaşam kalitesi indeksi (DYKİ) puanı, hastaların % 25 ve % 23'ü için şiddetli olarak değerlendirilen başlangıçtaki araştırmacının genel değerlendirmesi (IGA) puanı ve hastaların
% 19 ve % 18'inde psoriatik artrit öyküsü ile başlangıçtaki hastalık özellikleri çalışma popülasyonları arasında uyumluydu.
VOYAGE 1 ve 2 çalışmalarına alınan tüm hastaların sırasıyla % 32'si ve % 29'u daha önce hiç konvansiyonel sistemik ve biyolojik tedavi almamış, % 54'ü ve % 57'si daha önce fototerapi almış ve % 62'si ve % 64'ü daha önce konvansiyonel sistemik tedavi almıştı. Her iki çalışmada, en az bir anti-tümör nekroz faktörü alfa (TNFα) ajanı alan % 11 ve bir anti-IL-12/IL-23 ajanı alan yaklaşık % 10 olmak üzere hastaların % 21'i daha önce biyolojik tedavi almıştı.
Guselkumabın genel cilt hastalığı, bölgesel hastalık (saçlı deri, el ve ayaklar ve tırnaklar) ve yaşam kalitesi ile hasta bildirimli sonuçlar bakımından etkililiği değerlendirildi. VOYAGE 1 ve 2 çalışmalarının ortak primer sonlanım noktaları 16. haftada IGA puanı temiz veya minimal (IGA 0/1) olarak gelişim gösteren ve PASI 90 yanıtı elde edilen hastaların oranıydı (bkz. Tablo 2).
Genel cilt hastalığı
Guselkumab ile tedavi, 16. haftada plaseboya ve adalimumaba kıyasla ve 24 ve 48. haftalarda adalimumaba kıyasla, hastalık aktivitesi ölçeklerinde anlamlı düzelmeler gösterdi. Çalışmanın primer ve majör sekonder sonlanım noktalarına yönelik temel etkililik sonuçları Tablo 3'te gösterilmektedir.
Tablo 3: VOYAGE 1 ve VOYAGE 2'de görülen klinik yanıtların özeti
| Hasta sayısı (%) | |||||
VOYAGE 1 | VOYAGE 2 | |||||
Plasebo (N=174) | guselkumab (N=329) | adalimumab (N=334) | Plasebo (N=248) | guselkumab (N=496) | adalimumab (N=248) | |
16. Hafta |
|
|
|
|
|
|
PASI 75 | 10 (5,7) | 300 (91,2) | 244 (73,1) | 20 (8,1) | 428 (86,3) | 170 (68,5) |
PASI 90 | 5 (2,9) | 241 (73,3) | 166 (49,7) | 6 (2,4) | 347 (70) | 116 (46,8) |
PASI 100 | 1 (0,6) | 123 (37,4) | 57 (17,1) | 2 (0,8) | 169 (34,1) | 51 (20,6) |
IGA 0/1 | 12 (6,9) | 280 (85,1) | 220 (65,9) | 21 (8,5) | 417 (84,1) | 168 (67,7) |
IGA 0 | 2 (1,1) | 157 (47,7) | 88 (26,3) | 2 (0,8) | 215 (43,3) | 71 (28,6) |
24. Hafta |
|
|
|
|
|
|
PASI 75 | - | 300 (91,2) | 241 (72,2) | - | 442 (89,1) | 176 (71) |
PASI 90 | - | 264 (80,2) | 177 (53) | - | 373 (75,2) | 136 (54,8) |
PASI 100 | - | 146 (44,4) | 83 (24,9) | - | 219 (44,2) | 66 (26,6) |
IGA 0/1 | - | 277 (84,2) | 206 (61,7) | - | 414 (83,5) | 161 (64,9) |
IGA 0 | - | 173 (52,6) | 98 (29,3) | - | 257 (51,8) | 78 (31,5) |
48. Hafta |
|
|
|
|
|
|
PASI 75 | - | 289 (87,8) | 209 (62,6) | - | - | - |
PASI 90 | - | 251 (76,3) | 160 (47,9) | - | - | - |
PASI 100 | - | 156 (47,4) | 78 (23,4) | - | - | - |
IGA 0/1 | - | 265 (80,5) | 185 (55,4) | - | - | - |
IGA 0 | - | 166 (50,5) | 86 (25,7) | - | - | - |
Zaman içerisinde yanıt
Guselkumab, plaseboya kıyasla 2. hafta kadar erken bir sürede PASI puanında anlamlı derecede daha yüksek gelişme yüzdesiyle hızlı etkililik başlangıcı sergiledi (p<0,001). PASI 90 yanıtı elde eden hastaların yüzdesi, 8. haftadan itibaren guselkumab için adalimumab karşısında sayısal olarak yüksek olup, aradaki fark 20. hafta civarında maksimuma ulaştı (VOGAYE 1 ve 2) ve 48. haftanın sonuna kadar korundu (VOYAGE 1) (bkz. Şekil 1).
Şekil 1: VOYAGE 1'de vizite göre 48 hafta boyunca PASI 90 yanıtına ulaşan gönüllülerin yüzdesi (0. haftada randomize edilen gönüllüler)
Percent of Subjects (%)
Week
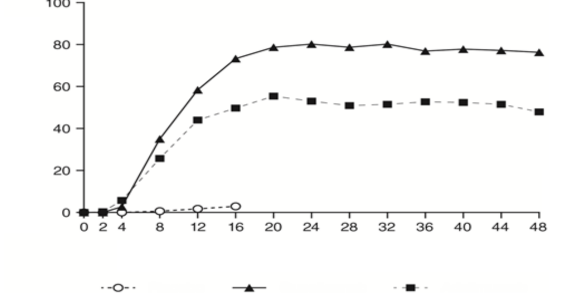
Gönüllülerin Yüzdesi (%)
Hafta
Placebo (n=174)
Guselkumab (n=329)
Adalimumab (n=334)
VOYAGE 1'de, sürekli guselkumab tedavisi alan hastalarda, PASI 90 yanıt oranı 52. Haftadan
252. Haftaya kadar korunmuştur. 0. Haftada adalimumaba randomize edilip 52. Haftada
guselkumaba geçiş yapan hastalarda, PASI 90 yanıt oranı 52. Haftadan 76. Haftaya kadar artmış, daha sonrasında ise 252. Haftaya kadar korunmuştur (bkz. Şekil 2).
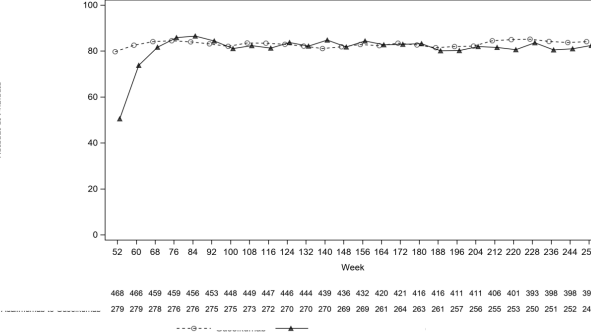
Şekil 2: VOYAGE 1'de açık etiketli fazda vizit bazında PASI 90 yanıtına ulaşan gönüllülerin yüzdesi
Guselkumabın etkililik ve güvenliliği, yaş, cinsiyet, ırk, vücut ağırlığı, plakların yeri, başlangıçtaki PASI şiddeti, eşzamanlı psoriatik artrit ve biyolojik tedavi öyküsü dikkate alınmaksızın ortaya konmuştur. Guselkumab, daha önce konvansiyonel sistemik tedavi almamış, daha önce biyolojik tedavi almamış ve daha önce biyolojik tedavi almış hastalarda etkililik sergilemiştir.
VOYAGE 2'de, 28. haftada tedaviyi bırakan hastaların % 36,8'ine kıyasla 48. haftada guselkumab idame tedavisi alan % 88,6 oranındaki hastada PASI 90 yanıtı gözlenmiştir (p<0,001). Guselkumab tedavisi bırakıldıktan 4 hafta sonra kadar erken bir sürede PASI 90 yanıtının kaybolduğu gözlenmiş ve PASI 90 yanıtının kaybolmasına kadar geçen medyan süre yaklaşık 15 hafta olmuştur. Tedavi kesilip daha sonra yeniden guselkumab almaya başlayan hastaların %80'inin, yeniden tedaviye başlandıktan 20 hafta sonra yapılan değerlendirmede, PASI 90 yanıtını yeniden elde ettikleri görülmüştür.
VOYAGE 2'de, adalimumab tedavisine randomize edilen ve 28. haftada PASI 90 yanıtı elde edemeyen 112 hastanın , 20 ve 44 haftalık guselkumab tedavisinden sonra, sırasıyla %66'sı ve
%76'sı PASI 90 yanıtı elde etmiştir . Ayrıca, guselkumab tedavisine randomize edilen ve 28. haftada PASI 90 yanıtı edemeyen 95 hastanın, guselkumab tedavisine ilave 20 ve 44 hafta
devam ettikten sonra sırasıyla %36'sı ve %41'i PASI 90 yanıtı elde etmiştir. Adalimumab grubundan guselkumab grubuna geçiş yapan hastalarda yeni güvenlilik bulguları gözlenmemiştir.
Bölgesel hastalık
VOYAGE 1 ve 2'de, plasebo ile tedavi edilen hastalara kıyasla guselkumab ile tedavi edilen hastalarda 16. haftada saçlı deriyle ilgili Araştırmacının Global Değerlendirmesi [ss-IGA], El ve/veya Ayaklarla ilgili Hekimin Global Değerlendirmesi [hf-PGA], Tırnakla ilgili Hekimin Global Değerlendirmesi [f-PGA] ve Tırnak Psoriasisi Şiddet İndeksi [NAPSI] ile ölçülen saçlı deri, el ve ayak ve tırnak psoriasisinde anlamlı gelişmeler görülmüştür (p<0,001, Tablo 4). Guselkumab, 24. Haftada (VOYAGE 1 ve 2) ve 48. haftada (VOYAGE 1) saçlı deri ve el ve ayak psoriasisi bakımından adalimumab karşısında üstünlük göstermiştir (24. haftada [VOYAGE 2] ve 48. haftada [VOYAGE 1] el ve ayak psoriasisi için p<0,05, bunun dışında p≤0,001).
Tablo 4: VOYAGE 1 ve VOYAGE 2'de görülen bölgesel hastalık yanıtlarının özeti | |||||||
|
| VOYAGE 1 |
|
| VOYAGE 2 |
|
|
| Plasebo | guselkumab | adalimumab | Plasebo | guselkumab |
| adalimumab |
ss-IGA (N) | 145 | 277 | 286 | 202 | 408 |
| 194 |
ss-IGA 0/1, n (%) | |||||||
16. Hafta | 21 (14,5) | 231 (83,4) | 201 (70,3) | 22 (10,9) | 329 (80,6) |
| 130 (67) |
hf-PGA (N) | 43 | 90 | 95 | 63 | 114 |
| 56 |
hf-PGA 0/1, n (%) | |||||||
16. Hafta | 6 (14) | 66 (73,3) | 53 (55,8) | 9 (14,3) | 88 (77,2) |
| 40 (71,4) |
f-PGA (N) | 88 | 174 | 173 | 123 | 246 |
| 124 |
f-PGA 0/1, n (%) | |||||||
16. Hafta |
|
| 18 (14,6) |
|
|
| |
| 14 (15,9) | 68 (39,1) | 88 (50,9) | 128 (52) |
| 74 (59,7) | |
NAPSI (N) | 99 | 194 | 191 | 140 | 280 |
| 140 |
Yüzde Gelişme, ortalama (SS) | |||||||
16. Hafta | -0,9 (57,9) | 34,4 (42,4) | 38,0 (53,9) | 1,8 (53,8) | 39,6 (45,6) |
| 46,9 (48,1) |
Sağlıkla ilgili yaşam kalitesi / Hasta bildirimli sonuçlar
VOYAGE 1 ve 2'de, 16. haftada plaseboya kıyasla guselkumab ile tedavi edilen hastalarda Dermatoloji Yaşam Kalite İndeksi (DLQI) ile ölçülen sağlıkla ilgili yaşam kalitesi ve Psoriasis
Belirti ve Bulgu Günlüğü (PSSD) ile ölçülen hasta bildirimli psoriasis belirtileri (kaşıntı, ağrı, yanma, batma ve cilt gerginliği) ve bulgularında (ciltte kuruluk, çatlama, soyulma, dökülme veya pullanma, kızarıklık ve kanama) anlamlı derecede daha fazla iyileşme göstermiştir (Tablo 5). Hasta bildirimli sonuçlarda gözleneniyileşme bulguları, 24 hafta (VOYAGE 1 ve 2) ve 48 hafta (VOYAGE 1) boyunca korundu. VOYAGE 1'de, sürekli guselkumab alan hastalarda bu iyileşmeler açık etiketli fazda 252. Haftaya kadar korunmuştur (Tablo 6).
Tablo 5: VOYAGE 1 ve VOYAGE 2'de hasta bildirimli sonuçların özeti | ||||||
| VOYAGE 1 |
|
| VOYAGE 2 |
|
|
| Plasebo |
guselkumab | adalimumab | Plasebo |
guselkumab | adalimumab |
DLQI, başlangıç puanı olan gönüllüler |
170 |
322 |
328 |
248 |
495 |
247 |
Başlangıca göre değişim, ortalama (standart sapma) | ||||||
16. Hafta | -0,6 (6,4) |
-11,2 (7,2) | -9,3 (7,8) | -2,6 (6,9) |
-11,3 (6,8) | -9,7 (6,8) |
PSSD Belirti puanı, başlangıç puanı > 0 olan gönüllüler |
129 |
248 |
273 |
198 |
410 |
200 |
Belirti puanı=0, n (%) | ||||||
16. Hafta | 1 (0,8) |
67 (27) | 45 (16,5) | 0 |
112 (27,3) | 30 (15) |
PSSD Bulgu puanı, başlangıç puanı > 0 olan gönüllüler |
129 |
248 |
274 |
198 |
411 |
201 |
Bulgu puanı=0, n (%) | ||||||
16. Hafta | 0 | 50 (20,2) | 32 (11,7) | 0 | 86 (20,9) | 21 (10,4) |
Tablo 6: VOYAGE 1'de açık etiketli fazda hasta tarafından bildirilen sonuçların özeti
| guselkumab | adalimumab-guselkumab | ||||
76. Hafta | 156. Hafta | 252. Hafta | 76. Hafta | 156. Hafta | 252. Hafta | |
Başlangıçta DLQI puanı > 1,n | 445 | 420 | 374 | 264 | 255 | 235 |
DLQI puanı 0/1 olan gönüllüler | 337 (%75,7) | 308 (%73,3) | 272 (%72,7) | 198 (%75) | 190 (%74,5) | 174 (%74) |
PSSD Belirti Puanı, |
347 |
327 |
297 |
227 |
218 |
200 |
Belirti puanı = 0, n (%) | 136 (%39,2) | 130 (%39,8) | 126 (%42,4) | 99 (%43,6) | 96 (%44) | 96 (%48) |
PSSD Bulgu puanı, başlangıç puanı > 0 olan gönüllüler |
347 |
327 |
297 |
228 |
219 |
201 |
Bulgu puanı = 0, n (%) | 102 (%29,4) | 94 (%28,7) | 98 (%33) | 71 (%31,1) | 69 (%31,5) | 76 (%37,8) |
VOYAGE 2'de, guselkumab ile tedavi edilen hastalarda, 36 maddeli Kısa Form (SF-36) sağlık anketi, Hastane Anksiyete ve Depresyon Ölçeği (HADS) ve Çalışma Kısıtlılıkları Anketi (WLQ) ile 16. haftada ölçülen sağlıkla ilgili yaşam kalitesi, anksiyete, depresyon ve çalışma kısıtlılığı ölçümlerinde plasebo ile karşılaştırıldığında başlangıca göre anlamlı derecede daha fazla iyileşme görülmüştür. SF-36, HADS ve WLQ puanlarındaki iyileşmelerin tümü 48 haftaya kadar ve açık uçlu fazda 28. haftada idame tedavisine randomize edilen hastalarda 252. haftaya kadar korunmuştur.
NAVIGATE
NAVIGATE çalışmasında, guselkumabın 16. haftada ustekinumaba yetersiz yanıt veren hastalardaki (yani IGA ≥2 olarak tanımlanan ‘temiz' veya ‘minimal' yanıt vermeyen hastalar) etkililiği araştırılılmıştır. Tüm hastalara (N=871) 0 ve 4. haftalarda açık etiketli ustekinumab (45 mg ≤100 kg ve 90 mg >100 kg) verilmiştir. 16. haftada, IGA puanı ≥2 olan 268 hasta ustekinumab tedavisine devam edecek (N=133) (q12w) ya da 16 ve 20. Haftalarda ve ondan sonra 8 haftada bir guselkumab tedavisi alacak (N=135) şekilde randomize edilmiştir. Randomize edilen hastaların başlangıç özellikleri VOYAGE 1 ve 2'de gözlenenlere benzer olmuştur.
Randomizasyondan sonra, primer sonlanım noktası hastaların 0/1 IGA puanı elde ettiği ve ≥2 derecelik gelişme yaşadığı 12. ve 24. Haftalar arasındaki randomizasyon sonrası vizit sayısıydı. Hastalar, toplam dört vizit için dört haftalık aralıklarla muayene edilmiştir. Randomizasyon sırasında ustekinumaba yetersiz yanıt veren hastalar arasında, guselkumab tedavisine geçiş yapan hastalarda etkililik bakımından ustekinumab tedavisine devam eden hastalara kıyasla anlamlı derecede daha fazla iyileşme gözlenmiştir. Randomizasyondan 12 ila24 hafta sonra,
guselkumab alan hastalarda ≥2 puanlık iyileşme ile 0/1'lik IGA puanı ustekinumab alan hastalardan iki kat daha sık görülmüştür (ortalama 1,5 karşısında 0,7 vizit, p< 0,001). Ek olarak, randomizasyondan 12 hafta sonra ustekinumaba kıyasla guselkumab ile tedavi edilen daha fazla sayıda hastada 0/1'lik IGA puanı ve ≥2 derecelik iyileşme (% 31,1 karşısında % 14,3; p=0,001) ve PASI 90 yanıtı (% 48 karşısında % 23; p<0,001) gözlenmiştir. Guselkumab ve ustekinumab ile tedavi edilen hastalar arasındaki yanıt oranı farklılıkları, randomizasyondan 4 hafta sonra kadar erken bir sürede gözlenmiştir (sırasıyla % 11,1 ve % 9) ve randomizasyondan 24 hafta sonra maksimum düzeye ulaşmıştır (Şekil 3). Ustekinumab tedavisinden guselkumab tedavisine geçiş yapan hastalarda yeni güvenlilik bulguları gözlenmemiştir.
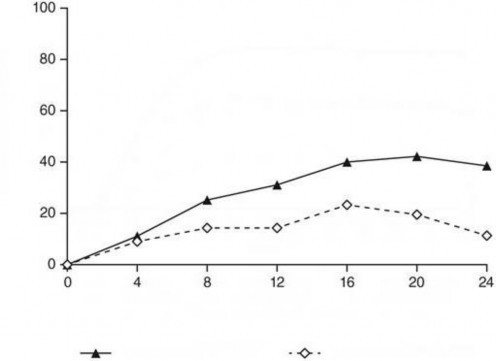
Randimizasyondan Sonraki Hafta
Guselkumab (n=135)
Ustekinumab (n=133)
Şekil 3: NAVIGATE çalışmasında randomizasyondan sonra vizit bazında 0. haftadan 24. haftaya kadar IGA puanında en az 2 derecelik iyileşme ile temiz (0) veya minimal (1) IGA puanına ulaşan hasta yüzdesi
ECLIPSE
Guselkumabın etkililik ve güvenliliği, çift kör bir çalışmada da secukinumab ile karşılaştırmalı olarak araştırılmıştır. Hastalar guselkumab tedavisine (N=534; 0 ve 4. Haftalarda ve daha sonrasında 8 haftada bir 100 mg) veya secukinumab tedavisine (N=514; 0, 1, 2, 3, 4. Haftalarda ve daha sonrasında 4 haftada bir 300 mg) randomize edilmiştir. Her iki tedavi grubunda, son doz 44. Haftada verilmiştir.
Başlangıç hastalık özellikleri; medyan VYA %20, medyan PASI puanı 18 ve IGA puanı hastaların %24'ü için şiddetli olmak üzere orta ila şiddetli bir plak psoriasis popülasyonu için uyumluydu.
Primer sonlanım noktası olarak 48. Haftadaki PASI 90 yanıtı ile ölçüldüğünde, guselkumab secukinumab karşısında üstünlük göstermiştir (%70 karşısında %84,5, p < 0,001). Karşılaştırmalı PASI yanıt oranları Tablo 7'de gösterilmektedir.
Tablo 7: ECLIPSE çalışmasında PASI yanıt oranları
| Hasta sayısı (%) | |
| guselkumab (N=534) | secukinumab (N=514) |
Primer Sonlanım Noktası |
|
|
48. Haftada PASI 90 yanıtı | 451 (%84,5) | 360 (%70) |
Major Sekonder Sonlanım Noktaları |
|
|
Hem 12 hem de 48. Haftada PASI 75 yanıtı | 452 (%84,6) | 412 (%80,2) |
12. Haftada PASI 75 yanıtı | 477 (%89,3) | 471 (%91,6) |
12. Haftada PASI 90 yanıtı | 369 (%69,1) | 391 (%76,1) |
48. Haftada PASI 100 yanıtı | 311 (%58,2) | 249 (%48,4) |
üstünlük için p < 0,001
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Sağlıklı gönüllülerde 100 mg'lık tek subkutan guselkumab enjeksiyonunu takiben ortalama (±SS) maksimum serum konsantrasyonu (C) dozdan yaklaşık 5,5 gün sonra 8,09±3,68 mcg/mL'ye ulaşmıştır.
0 ve 4. haftalarda ve ondan sonra 8 haftada bir 100 mg subkutan guselkumab uygulamalarını takiben 20. haftaya kadar kararlı durum serum dip guselkumab konsantrasyonlarına ulaşılmıştır. İki Faz III çalışmada plak tip psoriasisli hastalarda ortalama (±SS) kararlı durum dip serum guselkumab konsantrasyonları 1,15±0,73 mcg/mL ve 1,23±0,84 mcg/mL olmuştur.
Guselkumabın psoriatik artritli hastalardaki farmakokinetiği, psoriasisli hastalardakine benzerdi. 0 ve 4. Haftalarda ve sonrasında 8 haftada bir 100 mg guselkumab subkütan yoldan uygulandığında, ortalama kararlı durum dip serum guselkumab konsantrasyonu yaklaşık 1,2 mcg/mL olarak bulunmuştur. 4 haftada bir 100 mg guselkumab subkütan yoldan uygulandığında, ortalama kararlı durum dip serum guselkumab konsantrasyonu yaklaşık 3,8 mcg/mL olarak bulunmuştur.
Sağlıklı gönüllülerde, 100 mg'lık tek subkutan enjeksiyonu takiben guselkumabın mutlak biyoyararlanımı yaklaşık % 49 olarak hesaplanmıştır.
Dağılım:
Sağlıklı gönüllülerde tek intravenöz uygulamayı takiben terminal faz (V) sırasında medyan dağılım hacmi çalışmalar genelinde 7 ila 10 L aralığında olmuştur.
Biyotransformasyon:
Guselkumabın metabolizma yolu henüz kesin olarak karakterize edilmemiştir. Bir insan IgG monoklonal antikoru olarak guselkumabın, endojen IgG ile aynı şekilde katabolik yolaklar aracılığıyla küçük peptidlere ve amino asitlere parçalanması beklenmektedir.
Eliminasyon:
Sağlık gönüllülerde tek intravenöz uygulamayı takiben medyan sistemik klirens (CL) çalışmalar genelinde günde 0,288 ila 0,479 L aralığında olmuştur. Çalışmalarda guselkumabın ortalama yarılanma ömrü (T) sağlıklı gönüllülerde yaklaşık 17 gün ve plak psoriasis hastalarında 15 ila 18 gün olmuştur.
Popülasyon farmakokinetiği analizleri, eşzamanlı NSAİİ, oral kortikosteroid ve metotreksat gibi csDMARD kullanımının guselkumabın klirensini etkilemediğini göstermiştir.
Doğrusallık/Doğrusal olmayan durum:
Sağlıklı gönüllüler veya plak psoriasis hastalarında guselkumaba sistemik maruziyet (Cve EAA), 10 mg ila 300 mg arasında değişen dozlar subkutan yoldan tek seferde enjekte edildikten sonra yaklaşık olarak dozla orantılı biçimde artmıştır.
Hastalardaki karakteristik özellikler
Geriyatrik popülasyon:
Yaşlı hastalarda spesifik çalışmalar gerçekleştirilmemiştir. Faz III klinik çalışmalarda Guselkumab ile tedavi edilen ve popülasyon farmakokinetiği analizine dahil edilen 1384 plak psoriasis hastasının, 4'ü 75 yaş veya üzeri olmak üzere 70'i 65 yaş veya üzeri hastalardı. Faz III klinik çalışmalarda guselkumab ile tedavi edilen 746 psoriatik artrit hastasının toplam 38'i 65 yaş veya üzerindeydi ve 75 yaş veya üzerinde olan hiç hasta yoktu.
Plak tip psoriasis ve psoriatik artrit hastalarında gerçekleştirilen popülasyon farmakokinetiği analizleri, ≥65 yaş hastaların hesaplanmış CL/F değerinde <65 yaş hastalara göre belirgin farklılıklar göstermemiş ve yaşlı hastalar için doz ayarlamasına gerek olmadığını ortaya koymuştur.
Böbrek/Karaciğer yetmezliği
Böbrek veya karaciğer yetmezliğinin guselkumabın farmakokinetiği üzerindeki etkisini belirlemek içinspesifik çalışmalar gerçekleştirilmemiştir. Bir IgG monoklonal antikoru olan bozulmamış guselkumabın renal eliminasyonunun düşük ve önemsiz miktarda olması
beklenmektedir; benzer şekilde, IgG monoklonal antikorları esas olarak intrasellüler katabolizma aracılığıyla elimine olduğundan, karaciğer yetmezliğinin guselkumabın klirensini etkilemesi beklenmemektedir.
5.3. Klinik öncesi güvenlilik verileri
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Histidin
Histidin monohidroklorür monohidrat Polisorbat 80
Sukroz Enjeksiyonluk su
6.2. Geçimsizlikler
Herhangi bir geçimsizlik çalışması yapılmadığından başka tıbbi ürünlerle karıştırılmamalıdır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
2ºC - 8ºC arası sıcaklıklarda (buzdolabında) saklayınız. Dondurmayınız. Kullanıma hazır enjektörü ışıktan korumak için dış kutusunda saklayınız.
6.5. Ambalajın niteliği ve içeriği
Otomatik iğne siperi içerisine monte edilmiş sabit iğneli ve iğne kılıflı kullanıma hazır cam enjektör içerisinde 1 mL çözelti.
TREMFYA, bir adet kullanıma hazır enjektör içeren paketlerde sunulur.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanıma hazır enjektör buzdolabından çıkartıldıktan sonra, kullanıma hazır enjektör dış kartonunun içinde bırakılır ve TREMFYA'yı enjekte etmeden önce 30 dakika boyunca oda sıcaklığına gelmesi beklenir. Kullanıma hazır enjektör çalkalanmamalıdır.
Kullanmadan önce kullanıma hazır enjektörün görsel incelemesi önerilir. Çözelti berrak, renksiz ila açık sarı renkte olmalıdır ve az miktarda küçük beyaz veya şeffaf partiküller içerebilir. Çözeltide bulanıklaşma, renk değişikliği veya büyük partiküller görülürse, TREMFYA kullanılmamalıdır.
Her paket, kullanıma hazır enjektörün hazırlanması ve uygulanmasını ayrıntılı olarak tanımlayan bir ‘Kullanma Talimatı' ile birlikte verilir.
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmelikâ€lerine uygun olarak imha edilmelidir.
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Pankreas Kanseri Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Satış Fiyatı | 45693.86 TL [ 1 Aug 2025 ] |
| Önceki Satış Fiyatı | 45693.86 TL [ 28 Jul 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699593000003 |
| Etkin Madde | Guselkumab |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |