TREMFYA 100 mg/ml enjeksiyonluk çözelti içeren kullanıma hazır kalem (1 kalem) Farmakolojik Özellikler
{ Guselkumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: İmmunosupresanlar, interlökin inhibitörleri ATC kodu: L04AC16 Etki mekanizması
Guselkumab, interlökin 23 (IL23) proteinine yüksek özgünlük ve afinite ile seçici olarak bağlanan bir insan IgG1λ monoklonal antikorudur (mAb). IL-23, enflamatuar ve immün yanıtlarda rol oynayan bir sitokindir. Guselkumab, IL-23'ün reseptörüne bağlanmasını engelleyerek IL-23'e bağlı hücre sinyal iletimini ve proenflamatuar sitokin salımını inhibe eder. Plak psoriasis hastalarının cildinde IL-23 düzeylerinde artış görülür. İn vitro modellerde, guselkumabın hücre yüzeyi IL-23 reseptörü ile etkileşimini engelleyerek IL-23'ün biyoaktivitesini inhibe edip, IL-23-aracılı sinyal iletimi, aktivasyon ve sitokin kaskadlarını bozduğu gösterilmiştir. Guselkumab plak psoriasis ve psoriatik artritte IL-23 sitokin yolağını bloke ederek klinik etkisini gösterir.
Farmakodinamik etkiler
Faz I çalışmada, plak psoriasis hastalarının lezyonel cilt biyopsilerinden elde edilen mRNA analizlerinde gösterildiği gibi guselkumab ile tedavi 12. haftada başlangıca göre azalmış IL- 23/Th17 yolağı genlerinin ekspresyonuna ve psoriasis ilişkili gen ekspresyon profillerine neden
olmuştur. Aynı Faz I çalışmada, guselkumab ile tedavi, 12. haftada histolojik psoriasis ölçümlerinde, epidermal kalınlık ve T hücre yoğunluğunda görülen azalmalar dahil gelişmelere neden olmuştur. Ek olarak, Faz II ve Faz III plak tip psoriasis çalışmalarında guselkumab ile tedavi edilen hastaların serum IL-17A, IL-17F ve IL-22 düzeylerinde plaseboya kıyasla azalma gözlenmiştir. Bu sonuçlar, plak psoriasiste guselkumab tedavisi ile gözlenen klinik yarar ile uyumludur.
Faz III çalışmalarda yer alan psoriatik artrit hastalarında, başlangıçta serumdaki akut faz proteinleri C-reaktif protein, serum amiloid A ve IL-6 düzeylerinde ve Th17 efektör sitokinler IL-17A, IL-17F ve IL-22 düzeyleri yüksekliği mevcuttu. Guselkumab, tedaviye başlanmasından sonraki 4 hafta içinde bu proteinlerin düzeylerini azaltmıştır. Guselkumab 24. Haftada bu protein düzeylerini başlangıca göre ve plaseboya kıyasla daha da azaltmıştır.
Klinik etkililik ve güvenlilik Plak tip psoriasis
Guselkumabın etkililik ve güvenliliği, üç randomize, çift kör, aktif kontrollü Faz III çalışmada fototerapi veya sistemik tedavi için aday olan orta ila şiddetli plak psoriasisli yetişkin hastalarda değerlendirilmiştir.
VOYAGE 1 ve VOYAGE 2
İki çalışma (VOYAGE 1 ve VOYAGE 2), 1829 yetişkin hastada plasebo ve adalimumab karşısında guselkumab tedavisinin etkililik ve güvenliliğini değerlendirmiştir. Guselkumab grubuna randomize edilen hastalara (N=825) 0 ve 4. haftalarda, ondan sonra 48. haftaya kadar (VOYAGE 1) ve 20. haftaya kadar (VOYAGE 2) 8 haftada bir (q8w) 100 mg verildi. Adalimumab grubuna randomize edilen hastalara (N=582), 0. haftada 80 mg ve 1. haftada 40 mg, ardından 48. haftaya kadar (VOYAGE 1) ve 23. haftaya kadar (VOYAGE 2) iki haftada bir (q2w) 40 mg verildi. İki çalışmada da, plasebo grubuna randomize edilen hastalara (N=422) 16 ve 20. haftalarda, ondan sonra 8 haftada bir 100 mg guselkumab verildi. VOYAGE 1'de, 0. Haftada adalimumab alacak şekilde randomize edilenler de dahil olmak üzere, tüm hastalar 52. Haftada 8 haftada bir (q8w) açık etiketli guselkumab almaya başladılar. VOYAGE 2'de, 0. haftada guselkumab grubuna randomize edilen ve 28. haftada Psoriasis Alan Şiddet İndeksi (PASI) 90 yanıtı elde edilen hastalar, 8 haftada bir guselkumab ile tedaviye devam edecek (idame tedavisi) ya da plasebo alacak şekilde (bırakma tedavisi) yeniden randomize edildi. Bırakma tedavisi alan hastalar, 28. Hafta PASI düzelmesinde en az %50 kayıp yaşadıklarında guselkumab tedavisine yeniden başladılar (tedavi tekrarındaki dozlar, 4 hafta sonra ve daha sonrasında 8 haftada bir). 0. Haftada adalimumab alacak şekilde randomize edilen PASI 90
yanıtı elde edilmeyen hastalara 28 ve 32. Haftalarda ve ondan sonra 8 haftada bir guselkumab verilmeye başlandı. VOYAGE 2'de, 76. Haftada tüm hastalara 8 haftada bir olmak üzere açık etiketli guselkumab verilmeye başlandı.
VOYAGE 1 ve 2 çalışmalarında, sırasıyla medyan % 22 ve % 24'lük vücut yüzey alanı (VYAVYA), her iki çalışma için medyan 19'luk başlangıç PASI puanı, medyan 14 ve 14,5'lik dermatoloji yaşam kalitesi indeksi (DYKİ) puanı, hastaların % 25 ve % 23'ü için şiddetli olarak değerlendirilen başlangıçtaki araştırmacının genel değerlendirmesi (IGA) puanı ve hastaların
% 19 ve % 18'inde psoriatik artrit öyküsü ile başlangıçtaki hastalık özellikleri çalışma popülasyonları arasında uyumluydu.
VOYAGE 1 ve 2 çalışmalarına alınan tüm hastaların sırasıyla % 32'si ve % 29'u daha önce hiç konvansiyonel sistemik ve biyolojik tedavi almamış, % 54'ü ve % 57'si daha önce fototerapi almış ve % 62'si ve % 64'ü daha önce konvansiyonel sistemik tedavi almıştı. Her iki çalışmada, en az bir anti-tümör nekroz faktörü alfa (TNFα) ajanı alan % 11 ve bir anti-IL-12/IL-23 ajanı alan yaklaşık % 10 olmak üzere hastaların % 21'i daha önce biyolojik tedavi almıştı.
Guselkumabın genel cilt hastalığı, bölgesel hastalık (saçlı deri, el ve ayaklar ve tırnaklar) ve yaşam kalitesi ile hasta bildirimli sonuçlar bakımından etkililiği değerlendirildi. VOYAGE 1 ve 2 çalışmalarının ortak primer sonlanım noktaları 16. haftada IGA puanı temiz veya minimal (IGA 0/1) olarak gelişim gösteren ve PASI 90 yanıtı elde edilen hastaların oranıydı (bkz. Tablo 2).
Genel cilt hastalığı
Guselkumab ile tedavi, 16. haftada plaseboya ve adalimumaba kıyasla ve 24 ve 48. haftalarda adalimumaba kıyasla, hastalık aktivitesi ölçeklerinde anlamlı düzelmeler gösterdi. Çalışmanın primer ve majör sekonder sonlanım noktalarına yönelik temel etkililik sonuçları Tablo 3'te gösterilmektedir.
Tablo 3: VOYAGE 1 ve VOYAGE 2'de görülen klinik yanıtların özeti
| Hasta sayısı (%) | |||||
VOYAGE 1 | VOYAGE 2 | |||||
Plasebo (N=174) | guselkumab (N=329) | adalimumab (N=334) | Plasebo (N=248) | guselkumab (N=496) | adalimumab (N=248) | |
16. Hafta |
|
|
|
|
|
|
PASI 75 | 10 (5,7) | 300 (91,2) | 244 (73,1) | 20 (8,1) | 428 (86,3) | 170 (68,5) |
PASI 90 | 5 (2,9) | 241 (73,3) | 166 (49,7) | 6 (2,4) | 347 (70) | 116 (46,8) |
PASI 100 | 1 (0,6) | 123 (37,4) | 57 (17,1) | 2 (0,8) | 169 (34,1) | 51 (20,6) |
IGA 0/1 | 12 (6,9) | 280 (85,1) | 220 (65,9) | 21 (8,5) | 417 (84,1) | 168 (67,7) |
IGA 0 | 2 (1,1) | 157 (47,7) | 88 (26,3) | 2 (0,8) | 215 (43,3) | 71 (28,6) |
24. Hafta |
|
|
|
|
|
|
PASI 75 | - | 300 (91,2) | 241 (72,2) | - | 442 (89,1) | 176 (71) |
PASI 90 | - | 264 (80,2) | 177 (53) | - | 373 (75,2) | 136 (54,8) |
PASI 100 | - | 146 (44,4) | 83 (24,9) | - | 219 (44,2) | 66 (26,6) |
IGA 0/1 | - | 277 (84,2) | 206 (61,7) | - | 414 (83,5) | 161 (64,9) |
IGA 0 | - | 173 (52,6) | 98 (29,3) | - | 257 (51,8) | 78 (31,5) |
48. Hafta |
|
|
|
|
|
|
PASI 75 | - | 289 (87,8) | 209 (62,6) | - | - | - |
PASI 90 | - | 251 (76,3) | 160 (47,9) | - | - | - |
PASI 100 | - | 156 (47,4) | 78 (23,4) | - | - | - |
IGA 0/1 | - | 265 (80,5) | 185 (55,4) | - | - | - |
IGA 0 | - | 166 (50,5) | 86 (25,7) | - | - | - |
Zaman içerisinde yanıt
Guselkumab, plaseboya kıyasla 2. hafta kadar erken bir sürede PASI puanında anlamlı derecede daha yüksek gelişme yüzdesiyle hızlı etkililik başlangıcı sergiledi (p<0,001). PASI 90 yanıtı elde eden hastaların yüzdesi, 8. haftadan itibaren guselkumab için adalimumab karşısında sayısal olarak yüksek olup, aradaki fark 20. hafta civarında maksimuma ulaştı (VOGAYE 1 ve 2) ve 48. haftanın sonuna kadar korundu (VOYAGE 1) (bkz. Şekil 1).
Şekil 1: VOYAGE 1'de vizite göre 48 hafta boyunca PASI 90 yanıtına ulaşan gönüllülerin yüzdesi (0. haftada randomize edilen gönüllüler)
Percent of Subjects (%)
Week
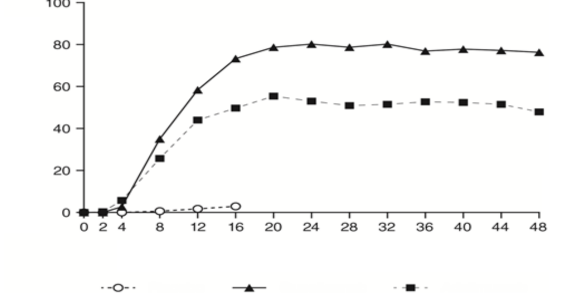
Gönüllülerin Yüzdesi (%)
Hafta
Placebo (n=174)
Guselkumab (n=329)
Adalimumab (n=334)
VOYAGE 1'de, sürekli guselkumab tedavisi alan hastalarda, PASI 90 yanıt oranı 52. Haftadan
252. Haftaya kadar korunmuştur. 0. Haftada adalimumaba randomize edilip 52. Haftada
guselkumaba geçiş yapan hastalarda, PASI 90 yanıt oranı 52. Haftadan 76. Haftaya kadar artmış, daha sonrasında ise 252. Haftaya kadar korunmuştur (bkz. Şekil 2).
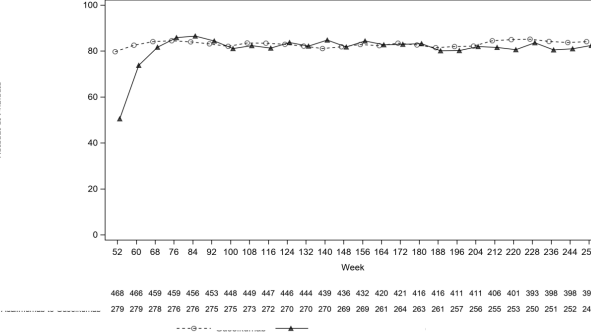
Şekil 2: VOYAGE 1'de açık etiketli fazda vizit bazında PASI 90 yanıtına ulaşan gönüllülerin yüzdesi
Guselkumabın etkililik ve güvenliliği, yaş, cinsiyet, ırk, vücut ağırlığı, plakların yeri, başlangıçtaki PASI şiddeti, eşzamanlı psoriatik artrit ve biyolojik tedavi öyküsü dikkate alınmaksızın ortaya konmuştur. Guselkumab, daha önce konvansiyonel sistemik tedavi almamış, daha önce biyolojik tedavi almamış ve daha önce biyolojik tedavi almış hastalarda etkililik sergilemiştir.
VOYAGE 2'de, 28. haftada tedaviyi bırakan hastaların % 36,8'ine kıyasla 48. haftada guselkumab idame tedavisi alan % 88,6 oranındaki hastada PASI 90 yanıtı gözlenmiştir (p<0,001). Guselkumab tedavisi bırakıldıktan 4 hafta sonra kadar erken bir sürede PASI 90 yanıtının kaybolduğu gözlenmiş ve PASI 90 yanıtının kaybolmasına kadar geçen medyan süre yaklaşık 15 hafta olmuştur. Tedavi kesilip daha sonra yeniden guselkumab almaya başlayan hastaların %80'inin, yeniden tedaviye başlandıktan 20 hafta sonra yapılan değerlendirmede, PASI 90 yanıtını yeniden elde ettikleri görülmüştür.
VOYAGE 2'de, adalimumab tedavisine randomize edilen ve 28. haftada PASI 90 yanıtı elde edemeyen 112 hastanın , 20 ve 44 haftalık guselkumab tedavisinden sonra, sırasıyla %66'sı ve
%76'sı PASI 90 yanıtı elde etmiştir . Ayrıca, guselkumab tedavisine randomize edilen ve 28. haftada PASI 90 yanıtı edemeyen 95 hastanın, guselkumab tedavisine ilave 20 ve 44 hafta
devam ettikten sonra sırasıyla %36'sı ve %41'i PASI 90 yanıtı elde etmiştir. Adalimumab grubundan guselkumab grubuna geçiş yapan hastalarda yeni güvenlilik bulguları gözlenmemiştir.
Bölgesel hastalık
VOYAGE 1 ve 2'de, plasebo ile tedavi edilen hastalara kıyasla guselkumab ile tedavi edilen hastalarda 16. haftada saçlı deriyle ilgili Araştırmacının Global Değerlendirmesi [ss-IGA], El ve/veya Ayaklarla ilgili Hekimin Global Değerlendirmesi [hf-PGA], Tırnakla ilgili Hekimin Global Değerlendirmesi [f-PGA] ve Tırnak Psoriasisi Şiddet İndeksi [NAPSI] ile ölçülen saçlı deri, el ve ayak ve tırnak psoriasisinde anlamlı gelişmeler görülmüştür (p<0,001, Tablo 4). Guselkumab, 24. Haftada (VOYAGE 1 ve 2) ve 48. haftada (VOYAGE 1) saçlı deri ve el ve ayak psoriasisi bakımından adalimumab karşısında üstünlük göstermiştir (24. haftada [VOYAGE 2] ve 48. haftada [VOYAGE 1] el ve ayak psoriasisi için p<0,05, bunun dışında p≤0,001).
Tablo 4: VOYAGE 1 ve VOYAGE 2'de görülen bölgesel hastalık yanıtlarının özeti | |||||||
|
| VOYAGE 1 |
|
| VOYAGE 2 |
|
|
| Plasebo | guselkumab | adalimumab | Plasebo | guselkumab |
| adalimumab |
ss-IGA (N) | 145 | 277 | 286 | 202 | 408 |
| 194 |
ss-IGA 0/1, n (%) | |||||||
16. Hafta | 21 (14,5) | 231 (83,4) | 201 (70,3) | 22 (10,9) | 329 (80,6) |
| 130 (67) |
hf-PGA (N) | 43 | 90 | 95 | 63 | 114 |
| 56 |
hf-PGA 0/1, n (%) | |||||||
16. Hafta | 6 (14) | 66 (73,3) | 53 (55,8) | 9 (14,3) | 88 (77,2) |
| 40 (71,4) |
f-PGA (N) | 88 | 174 | 173 | 123 | 246 |
| 124 |
f-PGA 0/1, n (%) | |||||||
16. Hafta |
|
| 18 (14,6) |
|
|
| |
| 14 (15,9) | 68 (39,1) | 88 (50,9) | 128 (52) |
| 74 (59,7) | |
NAPSI (N) | 99 | 194 | 191 | 140 | 280 |
| 140 |
Yüzde Gelişme, ortalama (SS) | |||||||
16. Hafta | -0,9 (57,9) | 34,4 (42,4) | 38,0 (53,9) | 1,8 (53,8) | 39,6 (45,6) |
| 46,9 (48,1) |
Sağlıkla ilgili yaşam kalitesi / Hasta bildirimli sonuçlar
VOYAGE 1 ve 2'de, 16. haftada plaseboya kıyasla guselkumab ile tedavi edilen hastalarda Dermatoloji Yaşam Kalite İndeksi (DLQI) ile ölçülen sağlıkla ilgili yaşam kalitesi ve Psoriasis
Belirti ve Bulgu Günlüğü (PSSD) ile ölçülen hasta bildirimli psoriasis belirtileri (kaşıntı, ağrı, yanma, batma ve cilt gerginliği) ve bulgularında (ciltte kuruluk, çatlama, soyulma, dökülme veya pullanma, kızarıklık ve kanama) anlamlı derecede daha fazla iyileşme göstermiştir (Tablo 5). Hasta bildirimli sonuçlarda gözleneniyileşme bulguları, 24 hafta (VOYAGE 1 ve 2) ve 48 hafta (VOYAGE 1) boyunca korundu. VOYAGE 1'de, sürekli guselkumab alan hastalarda bu iyileşmeler açık etiketli fazda 252. Haftaya kadar korunmuştur (Tablo 6).
Tablo 5: VOYAGE 1 ve VOYAGE 2'de hasta bildirimli sonuçların özeti | ||||||
| VOYAGE 1 |
|
| VOYAGE 2 |
|
|
| Plasebo |
guselkumab | adalimumab | Plasebo |
guselkumab | adalimumab |
DLQI, başlangıç puanı olan gönüllüler |
170 |
322 |
328 |
248 |
495 |
247 |
Başlangıca göre değişim, ortalama (standart sapma) | ||||||
16. Hafta | -0,6 (6,4) |
-11,2 (7,2) | -9,3 (7,8) | -2,6 (6,9) |
-11,3 (6,8) | -9,7 (6,8) |
PSSD Belirti puanı, başlangıç puanı > 0 olan gönüllüler |
129 |
248 |
273 |
198 |
410 |
200 |
Belirti puanı=0, n (%) | ||||||
16. Hafta | 1 (0,8) |
67 (27) | 45 (16,5) | 0 |
112 (27,3) | 30 (15) |
PSSD Bulgu puanı, başlangıç puanı > 0 olan gönüllüler |
129 |
248 |
274 |
198 |
411 |
201 |
Bulgu puanı=0, n (%) | ||||||
16. Hafta | 0 | 50 (20,2) | 32 (11,7) | 0 | 86 (20,9) | 21 (10,4) |
Tablo 6: VOYAGE 1'de açık etiketli fazda hasta tarafından bildirilen sonuçların özeti
| guselkumab | adalimumab-guselkumab | ||||
76. Hafta | 156. Hafta | 252. Hafta | 76. Hafta | 156. Hafta | 252. Hafta | |
Başlangıçta DLQI puanı > 1,n | 445 | 420 | 374 | 264 | 255 | 235 |
DLQI puanı 0/1 olan gönüllüler | 337 (%75,7) | 308 (%73,3) | 272 (%72,7) | 198 (%75) | 190 (%74,5) | 174 (%74) |
PSSD Belirti Puanı, |
347 |
327 |
297 |
227 |
218 |
200 |
Belirti puanı = 0, n (%) | 136 (%39,2) | 130 (%39,8) | 126 (%42,4) | 99 (%43,6) | 96 (%44) | 96 (%48) |
PSSD Bulgu puanı, başlangıç puanı > 0 olan gönüllüler |
347 |
327 |
297 |
228 |
219 |
201 |
Bulgu puanı = 0, n (%) | 102 (%29,4) | 94 (%28,7) | 98 (%33) | 71 (%31,1) | 69 (%31,5) | 76 (%37,8) |
VOYAGE 2'de, guselkumab ile tedavi edilen hastalarda, 36 maddeli Kısa Form (SF-36) sağlık anketi, Hastane Anksiyete ve Depresyon Ölçeği (HADS) ve Çalışma Kısıtlılıkları Anketi (WLQ) ile 16. haftada ölçülen sağlıkla ilgili yaşam kalitesi, anksiyete, depresyon ve çalışma kısıtlılığı ölçümlerinde plasebo ile karşılaştırıldığında başlangıca göre anlamlı derecede daha fazla iyileşme görülmüştür. SF-36, HADS ve WLQ puanlarındaki iyileşmelerin tümü 48 haftaya kadar ve açık uçlu fazda 28. haftada idame tedavisine randomize edilen hastalarda 252. haftaya kadar korunmuştur.
NAVIGATE
NAVIGATE çalışmasında, guselkumabın 16. haftada ustekinumaba yetersiz yanıt veren hastalardaki (yani IGA ≥2 olarak tanımlanan ‘temiz' veya ‘minimal' yanıt vermeyen hastalar) etkililiği araştırılılmıştır. Tüm hastalara (N=871) 0 ve 4. haftalarda açık etiketli ustekinumab (45 mg ≤100 kg ve 90 mg >100 kg) verilmiştir. 16. haftada, IGA puanı ≥2 olan 268 hasta ustekinumab tedavisine devam edecek (N=133) (q12w) ya da 16 ve 20. Haftalarda ve ondan sonra 8 haftada bir guselkumab tedavisi alacak (N=135) şekilde randomize edilmiştir. Randomize edilen hastaların başlangıç özellikleri VOYAGE 1 ve 2'de gözlenenlere benzer olmuştur.
Randomizasyondan sonra, primer sonlanım noktası hastaların 0/1 IGA puanı elde ettiği ve ≥2 derecelik gelişme yaşadığı 12. ve 24. Haftalar arasındaki randomizasyon sonrası vizit sayısıydı. Hastalar, toplam dört vizit için dört haftalık aralıklarla muayene edilmiştir. Randomizasyon sırasında ustekinumaba yetersiz yanıt veren hastalar arasında, guselkumab tedavisine geçiş yapan hastalarda etkililik bakımından ustekinumab tedavisine devam eden hastalara kıyasla anlamlı derecede daha fazla iyileşme gözlenmiştir. Randomizasyondan 12 ila24 hafta sonra,
guselkumab alan hastalarda ≥2 puanlık iyileşme ile 0/1'lik IGA puanı ustekinumab alan hastalardan iki kat daha sık görülmüştür (ortalama 1,5 karşısında 0,7 vizit, p< 0,001). Ek olarak, randomizasyondan 12 hafta sonra ustekinumaba kıyasla guselkumab ile tedavi edilen daha fazla sayıda hastada 0/1'lik IGA puanı ve ≥2 derecelik iyileşme (% 31,1 karşısında % 14,3; p=0,001) ve PASI 90 yanıtı (% 48 karşısında % 23; p<0,001) gözlenmiştir. Guselkumab ve ustekinumab ile tedavi edilen hastalar arasındaki yanıt oranı farklılıkları, randomizasyondan 4 hafta sonra kadar erken bir sürede gözlenmiştir (sırasıyla % 11,1 ve % 9) ve randomizasyondan 24 hafta sonra maksimum düzeye ulaşmıştır (Şekil 3). Ustekinumab tedavisinden guselkumab tedavisine geçiş yapan hastalarda yeni güvenlilik bulguları gözlenmemiştir.
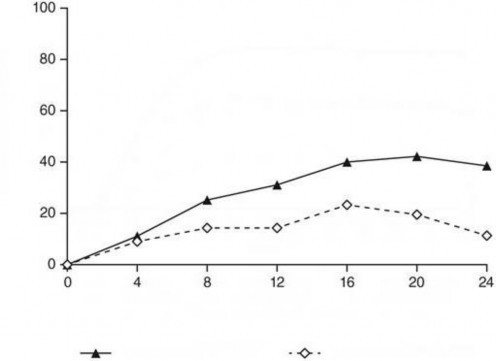
Randimizasyondan Sonraki Hafta
Guselkumab (n=135)
Ustekinumab (n=133)
Şekil 3: NAVIGATE çalışmasında randomizasyondan sonra vizit bazında 0. haftadan 24. haftaya kadar IGA puanında en az 2 derecelik iyileşme ile temiz (0) veya minimal (1) IGA puanına ulaşan hasta yüzdesi
ECLIPSE
Guselkumabın etkililik ve güvenliliği, çift kör bir çalışmada da secukinumab ile karşılaştırmalı olarak araştırılmıştır. Hastalar guselkumab tedavisine (N=534; 0 ve 4. Haftalarda ve daha sonrasında 8 haftada bir 100 mg) veya secukinumab tedavisine (N=514; 0, 1, 2, 3, 4. Haftalarda ve daha sonrasında 4 haftada bir 300 mg) randomize edilmiştir. Her iki tedavi grubunda, son doz 44. Haftada verilmiştir.
Başlangıç hastalık özellikleri; medyan VYA %20, medyan PASI puanı 18 ve IGA puanı hastaların %24'ü için şiddetli olmak üzere orta ila şiddetli bir plak psoriasis popülasyonu için uyumluydu.
Primer sonlanım noktası olarak 48. Haftadaki PASI 90 yanıtı ile ölçüldüğünde, guselkumab secukinumab karşısında üstünlük göstermiştir (%70 karşısında %84,5, p < 0,001). Karşılaştırmalı PASI yanıt oranları Tablo 7'de gösterilmektedir.
Tablo 7: ECLIPSE çalışmasında PASI yanıt oranları
| Hasta sayısı (%) | |
| guselkumab (N=534) | secukinumab (N=514) |
Primer Sonlanım Noktası |
|
|
48. Haftada PASI 90 yanıtı | 451 (%84,5) | 360 (%70) |
Major Sekonder Sonlanım Noktaları |
|
|
Hem 12 hem de 48. Haftada PASI 75 yanıtı | 452 (%84,6) | 412 (%80,2) |
12. Haftada PASI 75 yanıtı | 477 (%89,3) | 471 (%91,6) |
12. Haftada PASI 90 yanıtı | 369 (%69,1) | 391 (%76,1) |
48. Haftada PASI 100 yanıtı | 311 (%58,2) | 249 (%48,4) |
üstünlük için p < 0,001
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Sağlıklı gönüllülerde 100 mg'lık tek subkutan guselkumab enjeksiyonunu takiben ortalama (±SS) maksimum serum konsantrasyonu (C) dozdan yaklaşık 5,5 gün sonra 8,09±3,68 mcg/mL'ye ulaşmıştır.
0 ve 4. haftalarda ve ondan sonra 8 haftada bir 100 mg subkutan guselkumab uygulamalarını takiben 20. haftaya kadar kararlı durum serum dip guselkumab konsantrasyonlarına ulaşılmıştır. İki Faz III çalışmada plak tip psoriasisli hastalarda ortalama (±SS) kararlı durum dip serum guselkumab konsantrasyonları 1,15±0,73 mcg/mL ve 1,23±0,84 mcg/mL olmuştur.
Guselkumabın psoriatik artritli hastalardaki farmakokinetiği, psoriasisli hastalardakine benzerdi. 0 ve 4. Haftalarda ve sonrasında 8 haftada bir 100 mg guselkumab subkütan yoldan uygulandığında, ortalama kararlı durum dip serum guselkumab konsantrasyonu yaklaşık 1,2 mcg/mL olarak bulunmuştur. 4 haftada bir 100 mg guselkumab subkütan yoldan uygulandığında, ortalama kararlı durum dip serum guselkumab konsantrasyonu yaklaşık 3,8 mcg/mL olarak bulunmuştur.
Sağlıklı gönüllülerde, 100 mg'lık tek subkutan enjeksiyonu takiben guselkumabın mutlak biyoyararlanımı yaklaşık % 49 olarak hesaplanmıştır.
Dağılım:
Sağlıklı gönüllülerde tek intravenöz uygulamayı takiben terminal faz (V) sırasında medyan dağılım hacmi çalışmalar genelinde 7 ila 10 L aralığında olmuştur.
Biyotransformasyon:
Guselkumabın metabolizma yolu henüz kesin olarak karakterize edilmemiştir. Bir insan IgG monoklonal antikoru olarak guselkumabın, endojen IgG ile aynı şekilde katabolik yolaklar aracılığıyla küçük peptidlere ve amino asitlere parçalanması beklenmektedir.
Eliminasyon:
Sağlık gönüllülerde tek intravenöz uygulamayı takiben medyan sistemik klirens (CL) çalışmalar genelinde günde 0,288 ila 0,479 L aralığında olmuştur. Çalışmalarda guselkumabın ortalama yarılanma ömrü (T) sağlıklı gönüllülerde yaklaşık 17 gün ve plak psoriasis hastalarında 15 ila 18 gün olmuştur.
Popülasyon farmakokinetiği analizleri, eşzamanlı NSAİİ, oral kortikosteroid ve metotreksat gibi csDMARD kullanımının guselkumabın klirensini etkilemediğini göstermiştir.
Doğrusallık/Doğrusal olmayan durum:
Sağlıklı gönüllüler veya plak psoriasis hastalarında guselkumaba sistemik maruziyet (Cve EAA), 10 mg ila 300 mg arasında değişen dozlar subkutan yoldan tek seferde enjekte edildikten sonra yaklaşık olarak dozla orantılı biçimde artmıştır.
Hastalardaki karakteristik özellikler
Geriyatrik popülasyon:
Yaşlı hastalarda spesifik çalışmalar gerçekleştirilmemiştir. Faz III klinik çalışmalarda Guselkumab ile tedavi edilen ve popülasyon farmakokinetiği analizine dahil edilen 1384 plak psoriasis hastasının, 4'ü 75 yaş veya üzeri olmak üzere 70'i 65 yaş veya üzeri hastalardı. Faz III klinik çalışmalarda guselkumab ile tedavi edilen 746 psoriatik artrit hastasının toplam 38'i 65 yaş veya üzerindeydi ve 75 yaş veya üzerinde olan hiç hasta yoktu.
Plak tip psoriasis ve psoriatik artrit hastalarında gerçekleştirilen popülasyon farmakokinetiği analizleri, ≥65 yaş hastaların hesaplanmış CL/F değerinde <65 yaş hastalara göre belirgin farklılıklar göstermemiş ve yaşlı hastalar için doz ayarlamasına gerek olmadığını ortaya koymuştur.
Böbrek/Karaciğer yetmezliği
Böbrek veya karaciğer yetmezliğinin guselkumabın farmakokinetiği üzerindeki etkisini belirlemek içinspesifik çalışmalar gerçekleştirilmemiştir. Bir IgG monoklonal antikoru olan bozulmamış guselkumabın renal eliminasyonunun düşük ve önemsiz miktarda olması
beklenmektedir; benzer şekilde, IgG monoklonal antikorları esas olarak intrasellüler katabolizma aracılığıyla elimine olduğundan, karaciğer yetmezliğinin guselkumabın klirensini etkilemesi beklenmemektedir.
5.3. Klinik öncesi güvenlilik verileri
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Satış Fiyatı | 45693.86 TL [ 17 Mar 2025 ] |
| Önceki Satış Fiyatı | 45693.86 TL [ 7 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699593000003 |
| Etkin Madde | Guselkumab |
| ATC Kodu | L04AC16 |
| Birim Miktar | 100 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |