TREVICTA 525 mg I.M. enjeksiyon için uzun salımlı süspansiyon içeren kullanıma hazır enjektör Farmakolojik Özellikler
{ Paliperidon }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Psikoleptikler, diğer antipsikotikler ATC kodu: N05AX13
TREVICTA (+) ve (-)-paliperidonun rasemik bir karışımını içerir.
Etki mekanizması
Paliperidon, monoamin etkileri selektif olarak bloke eden bir ajanıdır ve geleneksel nöroleptiklerden farklı farmakolojik özelliklere sahiptir. Paliperidon serotonerjik 5-HT2 ve dopaminerjik D2 reseptörlerine güçlü bir şekilde bağlanır. Ayrıca paliperidon, alfa 1 adrenerjik reseptörleri ve biraz daha az düzeyde H1 histaminerjik ve alpha 2 adrenerjik reseptörleri bloke eder. (+) ve (-) paliperidon enantiyomerlerinin farmakolojik aktivitesi kalitatif ve kantitatif olarak benzerlik gösterir.
Paliperidon, kolinerjik reseptörlere bağlanmaz. Paliperidon, şizofreni belirtilerini hafiflettiği düşünülen güçlü bir D2-antagonisti olmakla beraber; geleneksel nöroleptiklerden daha az katalepsiye yol açar ve motor fonksiyonları daha düşük oranda azaltır. Merkezi sinir sisteminde santral serotonerjik antagonizmaya hakim olması, paliperidonun ekstrapiramidal yan etkilere yol açma eğilimini azaltabilir.
Klinik etkililik
TREVICTA'nın en az 4 ay süreyle 1 aylık enjektabl paliperidon palmitat ve son iki dozu aynı yitilik ile yeterli düzeyde tedavi edilmiş olan gönüllülerde şizofreninin idame tedavisi için etkililiği, uzun dönemli randomize, çift kör, plasebo kontrollü bir tedavi bırakma çalışmasında ve uzun dönemli, çift kör, aktif kontrollü bir non-inferiority çalışmasında değerlendirilmiştir. Her iki çalışmada da birincil sonuç relapsa dayalı olmuştur.
Uzun dönemli randomize tedavi bırakma çalışmasında, şizofreni için DSM-IV kriterlerini karşılayan 506 yetişkin gönüllü açık etiketli geçiş fazına kaydedilmiş ve 17 hafta süreyle (5. ve 9. haftalarda doz ayarlamaları yapılmıştır) deltoid veya gluteal kasına esnek dozlarda uygulanan 1 aylık enjektabl paliperidon palmitat ile tedavi edilmiştir (50-150 mg). Daha sonra, açık etiketli
stabilizasyon fazında toplam 379 gönüllüye deltoid veya gluteal kasından tek bir TREVICTA dozu uygulanmıştır (doz, son 1 aylık paliperidon palmitat dozunun 3,5 katıdır). On iki haftalık stabilizasyon fazının sonunda klinik açıdan stabil olduğu kabul edilen gönüllüler, değişken süreli bir çift kör fazda TREVICTA veya plaseboya 1:1 oranında randomize edilmiştir (TREVICTA dozu stabilizasyon fazında alınan son dozun aynısıdır; bu doz çift kör faz süresince sabit kalmıştır). Bu dönemde, belirti açısından stabil olan 305 gönüllü relaps, erken bırakma veya çalışma sonuna kadar TREVICTA (n=160) veya plasebo (n=145) tedavisine devam edecek şekilde randomize edilmiştir. Birincil etkinlik değişkeni, ilk relapsa kadar geçen süredir. 283 gönüllü randomize edildiği ve 42 relaps olayı gözlendiği zaman gerçekleştirilen önceden planlanmış ara bir analiz temel alınarak çalışma sonlandırılmıştır.
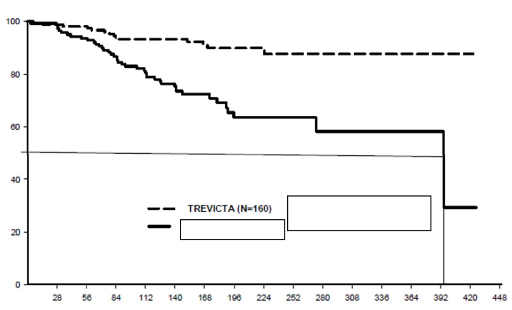
Nüks görülmeyen bireylerin tahmini oranı
Final analizi (N=305) temel alınarak, çift kör faz sırasında plasebo grubundaki 42 gönüllü (%29) ve TREVICTA grubundaki 14 gönüllü (%8,8) bir relaps deneyimlemiştir. Tehlike oranı 3,81 olmuş (%95 GA: 2,08, 6,99) ve plasebo karşısında TREVICTA ile relaps riskinde %74 oranında bir azalma olduğu görülmüştür. Tedavi grubuna göre relapsa kadar geçen süre bir Kaplan-Meier eğrisiyle Şekil 1'de gösterilmektedir. İki tedavi grubu arasında relapsa kadar geçen sürede TREVICTA lehinde anlamlı bir farklılık (p<0,0001) vardı. Plasebo grubundaki (medyan 395 gün) relapsa kadar geçen süre, TREVICTA grubuna ait değerden anlamlı derecede daha kısaydı (relaps yaşayan gönüllü oranının [%8,8] düşük olması sebebiyle medyan değer tahmin edilememektedir).
Randamizasyondan beri geçen süre (gün)
![]()
Randamizasyondan beri geçen süre (gün)
Şekil 1. Zamana karşı relapsı kıyaslayan Kaplan-Meier Grafiği â Final Analizi
Non-inferiority çalışmasında, şizofreni için DSM-IV kriterlerini karşılayan akut olarak hasta olan 1429 gönüllü (başlangıçtaki ortalama PANSS toplam skoru: 85,7) açık etiketli faza kaydedilerek, 17 hafta süreyle 1 aylık enjektabl paliperidon palmitat ile tedavi edilmiştir. 5. ve
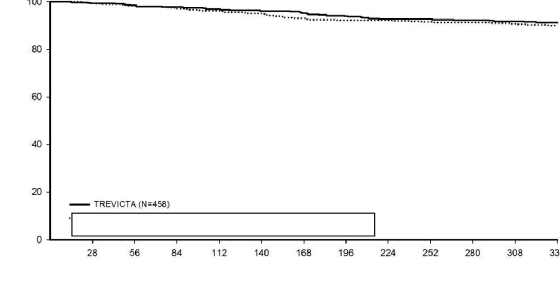
Randomizasyondan beri geçen süre (gün)
Nüks görülmeyen bireylerin tahmini oranı
9. hafta enjeksiyonlarında doz ayarlaması yapılabilir (50 mg, 75 mg, 100 mg veya 150 mg) ve enjeksiyon bölgesi deltoid veya gluteal olabilirdi. 14. ve 17. haftalarda randomizasyon kriterlerini karşılayan 1016 gönüllü 48 hafta süreyle her ay 1 aylık enjektabl paliperidon palmitat enjeksiyonlarını almaya devam etmek veya 1 aylık enjektabl paliperidon palmitatın 9. ve 13. haftalardaki dozunun 3,5 katı bir dozda TREVICTA tedavisine geçiş yapmak için 1:1 oranında randomize edilmiştir. Gönüllülere, her 3 ayda bir TREVICTA ve körlük özelliğini sürdürmek için diğer aylarda enjektabl plasebo ilaç verilmiştir. Çalışmanın birincil etkinlik sonlanım noktası, Kaplan-Meier 48 haftalık tahminine göre 48 haftalık çift kör fazın sonunda relaps yaşamamış olan gönüllülerin yüzdesidir (TREVICTA: %91,2, 1 aylık enjektabl paliperidon palmitat: %90). İki grupta da relapsa kadar geçen medyan süre, relaps yaşayan gönüllü oranının düşük olması nedeniyle değerlendirilememiştir. Tedavi grupları arasındaki fark (%95 GA) %1,2 (-% 2,7, % 5,1) olmuş, - % 10'luk marja dayanan non-inferiority kriterini karşılamıştır. Dolayısıyla, TREVICTA tedavi grubu 1 aylık enjektabl paliperidon palmitat ile en azından eşdeğerlik sergilemiştir. Açık etiketli stabilizasyon fazında gözlenmiş olan, Kişisel ve Sosyal Performans ölçeği (PSP) ile ölçülen işlevsel düzelmeler, çift kör fazda her iki tedavi grubunda da devam etmiştir.
Şekil 2: TREVICTA ve 1 aylık enjektabl paliperidon palmitatı karşılaştıran relapsa kadar geçen Kaplan-Meier süre grafiği
Her iki çalışmada da elde edilen etkililik sonuçları, popülasyon alt grupları (cinsiyet, yaş ve ırk) arasında tutarlı olmuştur.
Pediatrik popülasyon
Pediatrik kullanıma ilişkin bilgiler için Bölüm 4.2'ye bakınız.
5.2. Farmakokinetik özellikler
Genel ÖzelliklerEmilim:
Sudaki çözünürlüğü son derece düşük olan 3 aylık paliperidon palmitat formülasyonu, intramüsküler enjeksiyondan sonra paliperidona hidrolize olup sistemik dolaşıma girmeden önce yavaşça çözünür. Etkin maddenin salınımı 1. gün kadar erken başlar ve 18 ay kadar uzun süre devam eder.
Bu paragrafta sunulan veriler, popülasyon farmakokinetiği analizine dayanmaktadır. İntramüsküler yoldan uygulanan tek bir TREVICTA dozundan sonra, paliperidonun plazma konsantrasyonları 30-33 günlük medyan sürede (T) yavaş yavaş artarak maksimum plazma konsantrasyonlarına ulaşmıştır. Deltoid kasına 175-525 mg dozlarda intramüsküler TREVICTA enjeksiyonu ile gluteal kasına enjeksiyon ile görülenden ortalama %11-12 oranında daha yüksek bir Cdeğeri gözlenmiştir. TREVICTA'nın salınım profili ve dozlama rejimi, uzatılmış terapötik konsantrasyonlara yol açar. TREVICTA uygulamasını takiben toplam paliperidon maruziyeti, 175-525 mg doz aralığında dozla orantılı ve Ciçin neredeyse dozla orantılı olmuştur. TREVICTA dozu için ortalama kararlı durum tepe:vadi oranı, gluteal uygulamadan sonra 1,6 ve deltoid uygulamadan sonra 1,7 olarak bulunmuştur.
TREVICTA uygulamasından sonra, paliperidonun (+) ve (-) enantiyomerleri karşılıklı dönüşerek, EAA (+):(-) oranı yaklaşık 1,7-1,8'e ulaşmıştır.
Dağılım:
Rasemik paliperidon plazma proteinlerine %74 oranında bağlanır.
Biyotransformasyon:
Oral hızlı salınımlı C-paliperidon ile yapılan bir çalışmada, 1 mg hızlı salınımlı C-paliperidon tek bir dozda uygulandıktan sonra, dozun %59'u idrarda değişmeden atılmış, paliperidonun geniş ölçüde karaciğerde metabolize edilmediğine işaret edilmiştir. In vivo olarak dört metabolik yolak tanımlanmış, bunların hiçbiri dozun %10'undan fazlasını oluşturmamıştır: dealkilasyon, hidroksilasyon, dehidrojenasyon ve benzisoksazol bölünmesi. In vitro çalışmalar paliperidon metabolizmasında CYP2D6 ve CYP3A4'ün rol oynadığını düşündürmüş olsa da,
bu izozimlerin paliperidon metabolizmasında anlamlı bir rol oynadığına dair herhangi bir in vivo kanıt bulunmamaktadır. Popülasyon farmakokinetiği analizlerinde, CYP2D6 substratlarının yoğun ve zayıf metabolizörleri arasında oral paliperidon uygulamasından sonra paliperidonun görünür klirensi açısından belirgin bir farklılık gözlenmemiştir İnsan karaciğer mikrozomlarının kullanıldığı in vitro çalışmalar, paliperidonun CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5 gibi sitokrom P450 izoenzimleri tarafından metabolize edilen ilaçların metabolizmasını önemli ölçüde inhibe etmediğini göstermektedir.
In vitro çalışmalarda, paliperidonun bir P-gp substratı ve yüksek konsantrasyonlarda P-gp'nin zayıf bir inhibitörü olduğu gösterilmiştir. In vivo veriler mevcut değildir ve klinik ilişkisi bilinmemektedir.
Popülasyon farmakokinetiği analizine göre, 175-525 mg doz aralığında TREVICTA uygulamasını takiben paliperidonun medyan görünür yarılanma ömrü, deltoid enjeksiyonlarından sonra 84-95 gün ve gluteal enjeksiyonlardan sonra 118-139 gün olarak bulunmuştur.
Eliminasyon:
Uygulanan radyoaktivitenin yaklaşık %80'i idrarda ve %11'i dışkıda saptanmıştır.
Diğer paliperidon formülasyonları ile uzun etkili 3 aylık paliperidon palmitat enjeksiyonu karşılaştırılması
TREVICTA, 3 aylık bir süre için paliperidon uygulamak için tasarlanmış iken; 1 aylık paliperidon palmitat enjeksiyonu aylık olarak uygulanmaktadır. TREVICTA, 1 aylık paliperidon palmitat enjeksiyonunun karşılık gelen dozundan 3,5 kat daha yüksek dozlarda (bkz. Bölüm 4.2) uygulandığında, 1 aylık paliperidon palmitat enjeksiyonunun karşılık gelen aylık dozları ve paliperidon uzatılmış salınımlı tabletlerin karşılık gelen günlük dozları ile elde edilenlere benzer paliperidon maruziyetleri ile sonuçlanmıştır. TREVICTA için maruziyet aralığı, paliperidon uzatılmış salınımlı tabletlerin onaylanmış doz yitiliklerine yönelik maruziyet aralığı dahilindedir.
Doğrusallık / doğrusal olmayan durum:
TREVICTA uygulamasını takiben toplam paliperidon maruziyeti, 75'den - 525 mg'lık doz aralığının üzerinde, paliperidon Cve eğri altındaki alan deltoid ve gluteal enjeksiyon bölgelerinin yanı sıra genel olarak doz ile orantılı olarak artmıştır.
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği:
Paliperidon geniş ölçüde karaciğerde metabolize edilmemektedir. TREVICTA karaciğer yetmezliği olan hastalarda incelenmemiş olmasına rağmen, hafif veya orta şiddetli karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmemektedir. Orta şiddetli karaciğer yetmezliği olan (Child-Pugh sınıf B) gönüllülere oral paliperidon uygulandığında, serbest paliperidonun plazma konsantrasyonları sağlıklı gönüllülerdeki düzeylere benzerlik göstermiştir. Paliperidon, şiddetli karaciğer yetmezliği olan hastalarda araştırılmamıştır.
Böbrek yetmezliği:
TREVICTA, böbrek yetmezliği olan hastalarda sistematik olarak araştırılmamıştır. Paliperidon 3 mg uzatılmış salınımlı tabletin tek bir oral dozunun atılımı, değişken derecelerde böbrek fonksiyonuna sahip gönüllülerde incelenmiştir. Paliperidonun eliminasyonu, azalan tahmini kreatinin klirensi ile azalmıştır. Toplam paliperidon klirensi, hafif böbrek yetmezliği (CrCl = 50 ila < 80 mL/dk) olan gönüllülerde ortalama %32, orta şiddetli böbrek yetmezliği (CrCl = 30 ila
< 50 mL/dk) olan gönüllülerde %64 ve şiddetli böbrek yetmezliği (CrCl = 10 ila < 30 mL/dk) olan gönüllülerde %71 oranında azalmış; sağlıklı gönüllüler ile karşılaştırıldığında maruziyette (EAA) sırasıyla 1,5, 2,6 ve 4,8 kat ortalama artışa karşılık gelmiştir.
Yaşlılarda:
Popülasyon farmakokinetiği analizinde, yaşa bağlı farmakokinetik farklılıklara dair bir kanıt görülmemiştir.
Vücut kitle indeksi (VKİ)/vücut ağırlığı:
Fazla kilolu ve obez gönüllülerde daha düşük Cdeğeri gözlenmiştir. TREVICTA ile görünür kararlı durumda, vadi konsantrasyonlar normal, fazla kilolu ve obez gönüllüler arasında benzer olmuştur.
Irk:
Popülasyon farmakokinetiği analizinde, ırka bağlı farmakokinetik farklılıklara dair bir kanıt görülmemiştir.
Cinsiyet:
Popülasyon farmakokinetiği analizinde, cinsiyete bağlı farmakokinetik farklılıklara dair bir kanıt görülmemiştir.
Sigara kullanım durumu:
İnsan karaciğer enzimlerinin kullanıldığı in vitro çalışmalara göre paliperidon bir CYP1A2 substratı değildir; dolayısıyla sigara kullanımının paliperidon farmakokinetiği üzerinde bir etkisi olmamalıdır. Sigara kullanımının paliperidon farmakokinetiği üzerindeki etkisi TREVICTA ile araştırılmamıştır. Oral paliperidon uzatılmış salınımlı tabletlere ilişkin verilere dayalı bir popülasyon farmakokinetiği analizinde, paliperidon maruziyetinin sigara içenlerde içmeyenlerden biraz daha düşük olduğu görülmüştür. Bu farklılığın, klinik ile ilişkili olmadığı düşünülmektedir.
5.3. Klinik öncesi güvenlilik verileri
Intramüsküler paliperidon palmitatın (1 aylık formülasyon) ve oral paliperidonun sıçanlara ve köpeklere uygulandığı tekrarlı doz toksisite çalışmalarında, sedasyon ve meme bezleri ile genital organlar üzerinde prolaktin aracılı etkiler gibi çoğunlukla farmakolojik etkiler görülmüştür. Paliperidon palmitat tedavisi uygulanan hayvanlarda, intramüsküler enjeksiyon bölgesinde enflamatuvar reaksiyon gözlenmiştir. Nadiren apse oluşumu görülmüştür.
Sıçanlar ve insanlarda yaygın şekilde paliperidona dönüştürülen oral risperidon ile yürütülen sıçan üreme çalışmalarında, yavruların doğum kilosu ve sağkalımı üzerinde advers etkiler meydana gelmiştir. Paliperidon palmitat, maksimum tavsiye edilen 525 mg dozda insanlardaki maruziyet düzeyinin 2,2 katına karşılık gelen en yüksek doza (160 mg/kg/gün) kadar gebe sıçanlara intramüsküler yoldan uygulandığında, embriyotoksisite veya malformasyon gözlenmemiştir. Gebe hayvanlara uygulanan diğer dopamin antagonistleri, yavruların öğrenme ve motor gelişimi üzerinde olumsuz etkilere yol açmıştır.
Paliperidon palmitat ve paliperidon genotoksik etki sergilememiştir. Sıçanlar ve farelerde risperidon ile yapılan oral karsinojenisite çalışmalarında, hipofiz bezi adenomları (farelerde), endokrin pankreas adenomları (sıçanlarda) ve meme bezi adenomlarında (her iki türde de) artışlar görülmüştür. İntramüsküler olarak enjekte edilen paliperidon palmitatın karsinojenik potansiyeli sıçanlarda değerlendirilmiştir. Dişi sıçanlarda, ayda 10, 30 ve 60 mg/kg dozlarda meme bezi adenokarsinomlarında istatistiksel olarak anlamlı bir artış meydana gelmiştir. Erkek sıçanlarda ise, maksimum tavsiye edilen insan dozunun (525 mg) 0,6 ve 1,2 katı olan ayda 30 ve 60 mg/kg dozlarda meme bezi adenomları ve karsinomlarında istatistiksel olarak anlamlı bir artış gözlenmiştir. Bu tümörler uzun süren dopamin Dantagonizması ve hiperprolaktinemi ile ilgili olabilir. Kemirgenlerde görülen bu tümör bulgularının insanlara yönelik risk ile ilişkisi bilinmemektedir.
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır.
Asperger Sendromu
Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde,
gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Geri Ödeme Kodu | A16767 |
| Satış Fiyatı | 15505.16 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 22606.86 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699593950117 |
| Etkin Madde | Paliperidon |
| ATC Kodu | N05AX13 |
| Birim Miktar | 525 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Sinir Sistemi > Antipsikotikler > Paliperidon |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |