TRUXIMA 500 mg/50 ml IV infüzyon için konsantre çözelti içeren flakon Farmakolojik Özellikler
{ Rituksimab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Antineoplastik ajanlar, monoklonal antikorlar ATC kodu: L01FA01
Bu ürün bir biyobenzer ilaçtır. Etki mekanizması
Rituximab spesifik olarak bir non-glikolize fosfoprotein olan CD20 adlı transmembran
antijenine bağlanan kimerik fare/insan monoklonal antikorudur. Bu antijen pre-B ve olgun B lenfositlerinde bulunur. Tüm B hücreli Hodgkin-dışı lenfomaların (NHL) >%95'inde bu antijen eksprese edilir.
CD20 hem normal hem de malignan B hücrelerinde bulunur ancak hematopoetik kök hücrelerde, pro-B hücrelerde, normal plazma hücrelerinde veya diğer normal dokuda bulunmaz. Antikora bağlandıktan sonra CD20 hücre içine alınmaz veya hücre membranından çevreye yayılmaz. CD20 plazmada serbest antijen olarak dolaşmaz ve dolayısıyla antikora bağlanmak için yarışmaz.
Rituximabın Fab alanı, B lenfositlerdeki CD20 antijenine bağlanır ve Fc alanı B hücresinin lizisine yol açan bağışıklığı etkileyen işlevleri başlatır. Etki-aracılı hücre yıkımındaki olası mekanizmalar C1q bağlanması sonucunda oluşan komplemana bağımlı sitotoksisite (CDC), granülositlerin, makrofajların ve NK hücrelerinin yüzeyindeki Fcγ reseptörlerinin bir veya daha fazlası aracılığıyla oluşan antikora bağımlı hücresel sitotoksisite (ADCC)'dir. B lenfositleri üzerindeki CD20 antijenine rituximab bağlanmasının apoptoz yoluyla hücre ölümünü indüklediği ortaya konmuştur.
Periferdeki B hücre sayısı ilk rituximab dozundan sonra normalin altına düşer. Hematolojik malignite tedavisi gören hastalarda B hücrelerinin normal düzeyine dönmesi tedavinin 6. ayı içinde başlar, bazı hastalarda daha uzun sürse bile, genellikle tedavi tamamlandıktan sonraki 12 ay içinde de normal düzeylere döner (indüksiyon tedavisinden sonra medyan düzelme süresi 23 aya kadar uzayabilir). Romatoid artrit hastalarında, 14 gün arayla verilen iki 1.000 mg rituximab infüzyonunun ardından periferik kandaki B hücrelerinin hemen tükendiği gözlenmiştir. Rituximab monoterapi veya metotreksat ile birlikte kombine olarak uygulandığında periferik
kan B hücrelerinin sayısı 24. haftadansonraartmayabaşlarve hastaların büyük çoğunluğunda
40. haftada eski sayıya döndüğünü gösteren işaretler gözlenmiştir. Hastaların küçük bir kısmında son rituximab dozundan sonraki 2 yıla kadar veya daha uzun süre devam eden periferik B hücre sayısı tükenmesi olmuştur.
Granülomatoz polianjitis ve mikroskobik polianjitis hastalarında, iki haftalık 375 mg/m rituximab infüzyonu sonrasında periferik kan B hücreleri 10 hücre/µL'nin altına düşmüştür ve 6 ay boyunca hastaların çoğunda aynı seviyede kalmıştır. Hastaların çoğunluğu (%81) 12. ayda B hücrelerinin 10 hücre/µL seviyesinin üzerinde sayılarla tekrar artmaya başladığına dair işaretler göstermiştir, bu oran 18. ay itibariyle hastaların %87'sine yükselmiştir.
Hodgkin-dışı lenfoma ve kronik lenfosittik lösemide klinik deneyim Foliküler lenfoma
Monoterapi
Başlangıç tedavisi, haftada bir uygulama, toplam 4 doz
Asıl çalışmada, nüksetmiş veya kemorezistan düşük evreli ya da foliküler B hücreli NHL'ye sahip 166 hastaya haftada bir, toplam dört doz olarak i.v. infüzyon halinde 375 mg/m rituximab verilmiştir. Tedavi meyilli (ITT) popülasyonunda genel yanıt oranı (GYO) %48 (GA%41 -
%56) olup tam yanıt (TY) oranı %6 ve kısmi yanıt (KY) oranı %42 olarak gerçekleşmiştir. Yanıt veren hastalarda hastalığın ilerlemesine kadar geçen medyan süre (TTP) 13 aydır. Yapılan bir alt-grup analizinde GYO, IWF B, C ve D histolojik alt-tiplerinde IWF A alt-tipine kıyasla daha yüksek (%58'e karşılık %12), en büyük lezyonu <5 cm olan hastalarda, >7 cm olan hastalara kıyasla daha yüksek (%53'e karşılık %38) ve kemorezistan nüks grubu ile karşılaştırıldığında kemoduyarlı nüks hastalarında (yanıt süresi <3 ay olarak tanımlanır) daha yüksek (%22'ye karşılık %50) bulunmuştur. Önceden otolog kemik iliği transplantasyonu (OKİT) ile tedavi edilmiş hastalarda GYO %78 iken, OKİT tedavisi görmeyenlerde %43 olmuştur. Yaş, cinsiyet, lenfoma evresi, başlangıçtaki tanı, büyük hacimli hastalık varlığı ya da yokluğu, normal ya da yüksek LDH düzeyleri veya ekstranodal hastalık varlığının rituximaba karşı verilen yanıt üzerinde istatistik olarak anlamlılık (Fischer'in exact testi) taşıyan bir etkisi bulunmamaktadır. Yanıt oranları ile kemik iliği tutulumu arasında istatistiksel olarak anlamlı bir bağıntı kaydedilmiştir. Kemik iliği tutulumu olan hastaların %40'ı yanıt verirken, kemik iliği tutulumu olmayan hastaların %59'u yanıt vermiştir (p=0,0186). Histolojik tip, başlangıçta bcl-2 pozitifliği, son kemoterapiye karşı direnç ve büyük hacimli hastalık faktörlerinin prognostik faktörler olarak tanımlandığı kademeli lojistik regresyon analizi bu bulguyu desteklememiştir.
Başlangıç tedavisi, haftada bir uygulama, toplam 8 doz
Çok merkezli, tek kollu bir çalışmada nüksetmiş veya kemorezistan, düşük evreli veya foliküler B hücreli NHL'si olan 37 hastaya, toplam sekiz doz olacak şekilde, i.v. infüzyon yoluyla haftada bir kere 375 mg/m rituximab verilmiştir. GYO %57 (GA%41 - %73; TY %14, KY
%43) ve medyan TTP 19,4 ay (5,3 ila 38,9 ay aralığında) bulunmuştur. Başlangıç tedavisi, büyük hacimli hastalık, haftada bir uygulama, toplam 4 doz
Üç çalışmanın bir araya getirilmiş verilerinde, nüksetmiş veya kemorezistan, büyük hacimli
hastalık (tek lezyon ≥ 10 cm çapında) özelliklerini taşıyan düşük evreli veya foliküler B hücreli NHL'si olan 39 hastaya toplam dört doz, haftada bir kere 375 mg/m rituximab, i.v. infüzyon yoluyla verilmiştir. GYO %36 (GA%21-%51; TY %3, KY %33) ve yanıt veren hastalarda medyan TTP 9,6 ay olmuştur (4,5 ila 26,8 ay aralığında).
Tekrarlanan tedavi, haftada bir uygulama, toplam 4 doz
Çok-merkezli, tek-kollu bir çalışmada, önceki bir rituximab küründe objektif klinik yanıt alınan, nüksetmiş veya kemorezistan düşük evreli veya foliküler B hücreli NHL'si olan 58 hasta toplam dört doz, haftada bir kere, i.v. infüzyon yoluyla 375 mg/m rituximab ile yeniden tedavi edilmiştir. Hastaların üçü çalışmaya kaydolmadan önce iki seans rituximab tedavisi gördüğünden, bunlara çalışmada üçüncü bir seans uygulanmıştır. Çalışmada iki hasta, iki kez yeniden tedavi edilmiştir. Çalışmadaki 60 yeniden tedavi vakasında, yanıt veren hastalar için GYO %38 (GA%26-%51; TY %10, KY %28) ve yanıt veren hastalarda projekte edilen ortalama TTP, 17,8 ay (5,4 ila 26,6 ay aralığında) olmuştur. Bu değerler, önceki rituximab küründe elde edilen sonuçlar (12,4 ay) ile olumlu yönde karşılaştırılabilir niteliktedir.
Başlangıç tedavisi, kemoterapi ile kombinasyon halinde
Randomize, açık-etiketli bir çalışmada, daha önce tedavi görmemiş foliküler lenfoması olan 322 hasta, 8 kür, her 3 haftada bir CVP kemoterapisi (siklofosfamid 750 mg/m, 1. gün maksimum 2 mg doza kadar, vinkristin 1,4 mg/m ve 1-5. gün arasında prednizolon 40 mg/m/gün) ya da CVP ile kombinasyon halinde rituximab 375 mg/m (R-CVP) alacak şekilde randomize edilmiştir. Rituximab her tedavi siklusunun ilk gününde uygulanmıştır. Toplam 321 hasta (162 R-CVP, 159 CVP) tedavi görmüş ve etkililik bakımından analiz edilmiştir. Hastaların medyan takip süresi 53 aydır. R-CVP, primer sonlanma noktası olan tedavi başarısızlığına kadar geçen süre açısından CVP'ye göre önemli bir üstünlük sağlamıştır (27 aya karşılık 6,6 ay, p < 0,0001, log-sıra testi). Tümör cevabı bulunan hastaların oranı (TY, TYo, KY), R-CVP grubunda (%80,9) CVP grubundan (%57,2) önemli oranda daha yüksek olmuştur (p< 0,0001, Ki-Kare testi). R-CVP ile yapılan tedavi, hastalık ilerlemesi veya ölüme kadar geçen süreyi belirgin bir şekilde artırmıştır (33,6 ay ve l4,7 ay) (p < 0,0001, log-sıra testi). R- CVP grubunda medyan yanıt süresi 37,7 ayken, CVP grubunda bu süre 13,5 ay olarak bulunmuştur (p < 0,0001, log-sıra testi).
Genel sağkalım açısından tedavi grupları arasındaki farklılık güçlü bir klinik yarar göstermiştir (p=0,029, katmanlı log-sıra testi): 53. aydaki sağkalım oranları R-CVP grubunda %80,9 iken, CVP grubunda %71,1 'dir.
CVP dışındaki kemoterapi rejimleriyle (CHOP, MCP, CHVP/Interferon-α) yapılan diğer 3 randomize çalışmadan elde edilen sonuçlar yanıt oranlarında ve zamana bağlı parametrelerde olduğu gibi genel sağkalımda da belirgin iyileşmeler göstermiştir. Bu dört çalışmadan elde edilen anahtar sonuçlar aşağıda Tablo 8'de özetlenmektedir.
Tablo 8: Rituximabın foliküler lenfomada farklı kemoterapi rejimleriyle yararlarının değerlendirildiği dört faz III randomize çalışmadan elde edilen anahtar sonuçların özeti
Çalışma | Tedavi, N | Medyan Takip Süresi, ay |
GYO, % |
TY, % | Medyan TTF/PFS/ EFS ay | OS oranları, % |
|
|
|
|
| Medyan TTP: | 53 ay |
M39021 | CVP, 159 R-CVP, 162 | 53 | 57 81 | 10 41 | 14,7 33,6 | 71,1 80,9 |
|
|
|
|
| p <0,0001 | p=0,029 |
GLSG'00 |
CHOP, 205 |
|
|
| Medyan TTF: | 18 ay 90 |
| R-CHOP, 223 |
| 96 | 20 | Ulaşılamamıştır p < 0,001 | 95 p = 0,016 |
|
|
|
|
| Medyan PFS: | 48 ay |
OSHO-39 | MCP, 96 R-MCP, 105 | 47 | 75 92 | 25 50 | 28,8 Ulaşılamamıştır | 74 87 |
|
|
|
|
| p < 0,0001 | p = 0,0096 |
FL2000 | CHVP-IFN, 183
R-CHVP-IFN, 175 |
42 |
85
94 |
49 76 | Medyan EFS: 36 Ulaşılamamıştır p<0,0001 | 42 ay 84 91 p=0,029 |
GYO: Genel yanıt oranı TY: Tam yanıt
EFS: Olaysız sağkalım
TTP: Progresyona veya ölüme kadar geçen süre PFS: Progresyonsuz sağkalım
TTF: Tedavinin başarısızlığına kadar geçen süre
OS oranları: Analizler zamanında genel sağkalım oranları
İdame tedavisi
Daha önce tedavi uygulanmamış foliküler lenfoma
Prospektif, açık etiketli, uluslararası, çok-merkezli bir faz III çalışmada daha önce tedavi uygulanmamış ileri seviye foliküler lenfoması olan 1.193 hasta, araştırmacının tercihine göre R-CHOP (n=881), R-CVP (n=268) veya R-FCM (n=44) ile indüksiyon tedavisi almıştır. Toplam 1.078 hasta indüksiyon tedavisine yanıt vermiş, bu hastalardan 1.018'i rituximab idame tedavisine (n=505) veya gözlem grubuna (n=513) randomize edilmiştir. İki tedavi grubu, başlangıçtaki özellikler ve hastalık durumu açısından iyi dengelenmiştir. Rituximab idame tedavisi, hastalık progresyonuna kadar veya maksimum iki yıl boyunca 2 ayda bir 375 mg/m vücut yüzey alanı dozunda tek rituximab infüzyonundan oluşmuştur.
Randomizasyondan itibaren 25 aylık medyan gözlem süresinde yapılan, önceden belirlenmiş bir primer analiz sırasında rituximab idame tedavisi, önceden tedavi edilmemiş foliküler lenfoma hastalarında gözlem grubuna kıyasla, araştırmacı tarafından değerlendirilen progresyonsuz sağkalım (PFS) primer sonlanım noktasında klinik olarak tedaviyle alakalı ve istatistiksel olarak anlamlı iyileşme sağlamıştır (Tablo 9).
Primer analizde rituximab ile idame tedaviden elde edilen anlamlı yarar ayrıca sekonder sonlanım noktaları olan olaysız sağkalım (EFS), bir sonraki anti-lenfoma tedavisine kadar geçen süre (TNLT), bir sonraki kemoterapiye kadar geçen süre (TNCT) ve genel yanıt oranında (GYO) da görülmüştür (Tablo 9).
Çalışmadaki hastaların uzun süreli takibinden (medyan takip 9 yıl) elde edilen veriler rituximabın idame tedavisinin PFS, EFS, TNLT ve TNCT açısından uzun süreli yararını doğrulamıştır (Tablo 9).
Tablo 9: Protokolde tanımlanmış primer analizlerde ve 9 yıllık medyan takip (sonuç analizi) sonrasında rituximabın idame tedavisinin etkililik sonuçlarının gözlem grubu ile karşılaştırılmasına genel bakış
| Primer analiz (medyan takip: 25 ay) | Son analiz (medyan takip: 9 yıl) | ||
| Gözlem N=513 | Rituximab N=505 | Gözlem N=513 | Rituximab N=505 |
Primer etkililik | ||||
Progresyonsuz sağkalım | NR NR | 4,06 yıl 10,49 yıl | ||
(medyan) |
|
| ||
log-sıra p değeri | <0,0001 | <0,0001 | ||
risk oranı (%95 GA) | 0,50 (0,39, 0,64) | 0,61 (0,52, 0,73) | ||
risk azalması | %50 | %39 | ||
Sekonder etkililik | ||||
Genel sağkalım (medyan) | NR NR | NR NR | ||
log-sıra p değeri | 0,7246 | 0,7948 | ||
risk oranı (%95 GA) | 0,89 (0,45, 1,74) | 1,04 (0,77, 1,40) | ||
risk azalması | %11 | %-6 | ||
Olaysız sağkalım (medyan) | 38 ay NR | 4,04 yıl 9,25 yıl | ||
log-sıra p değeri | <0,0001 | <0,0001 | ||
risk oranı (%95 GA) | 0,54 (0,43, 0,69) | 0,64 (0,54, 0,76) | ||
risk azalması | %46 | %36 | ||
TNLT (medyan) | NR NR | 6,11 yıl NR | ||
log-sıra p değeri | 0,0003 | <0,0001 | ||
risk oranı (%95 GA) | 0,61 (0,46, 0,80) | 0,66 (0,55, 0,78) | ||
risk azalması | %39 | %34 | ||
TNCT (medyan) | NR NR | 9,32 yıl NR | ||
log-sıra p değeri | 0,0011 | 0,0004 | ||
risk oranı (%95 GA) | 0,60 (0,44, 0,82) | 0,71 (0,59, 0,86) | ||
risk azalması | %40 | %39 | ||
Genel Yanıt Oranı* | %55 %74 | %61 %79 | ||
Ki-kare testi p değeri | <0,0001 | <0,0001 | ||
Olasılık oranı (%95 GA) | 2,33 (1,73, 3,15) | 2,43 (1,84, 3,22) | ||
Tam yanıt (TY/TYo) oranı* | %48 %67 | %53 %67 | ||
Ki-kare testi p değeri | <0,0001 | <0,0001 | ||
Olasılık oranı (%95 GA) | 2,21 (1,65, 2,94) | 2,34 (1,80, 3,03) | ||
*İdame/gözlem sonunda; son analiz sonuçları 73 aylık medyan takip süresine dayanmaktadır. GA: güven aralığı; NR: klinik veri kesimi zamanında ulaşılamamıştır; TNCT: sonraki kemoterapiye kadar geçen süre; TNLT: sonraki anti-lenfoma tedavisine kadar geçen süre.
Rituximab idame tedavisi, önceden tanımlanmış tüm test edilen alt gruplarda tutarlı yarar sağlamıştır: cinsiyet (erkek, kadın), yaş (<60, ≥60), FLIPI skoru (≤1, 2 veya ≥3), indüksiyon tedavisi (R-CHOP, R-CVP veya R-FCM) ve indüksiyon tedavisine verilen yanıtın niteliğinden (TY/TYo veya KY) bağımsızdır. İdame tedavinin yararına ilişkin eksplatuar analizler, yaşlı hastalarda (>70 yaş) etkinin daha az belirgin olduğunu göstermiştir ancak örneklem sayısı azdır.
Relaps/refrakter foliküler lenfoma
Prospektif, açık etiketli, uluslararası, çok-merkezli bir faz III çalışmada 465 relaps/refrakter foliküler lenfoma hastası, CHOP(siklofosfamid,doksorubisin, vinkristin, prednizolon; n=231)
veya rituximab + CHOP (R-CHOP, n=234) ile yapılan indüksiyon tedavisine ilk basamakta randomize edilmiştir. İki tedavi grubu, başlangıç karakteristiklerine ve hastalık durumuna göre iyi dengelenmiştir. İndüksiyon tedavisinden sonra tam ya da kısmi remisyon sağlanan toplam 334 hasta, ikinci aşamada rituximab idame tedavisi (n=167) veya gözlem koluna (n=167) randomize edilmiştir. Rituximab idame tedavisi, maksimum iki sene süresince ya da hastalık ilerleyene kadar, üç ayda bir 375 mg/m vücut yüzey alanı dozunda verilen tek rituximab uygulamasından ibarettir.
Son etkililik analizi, çalışmanın her iki bölümüne randomize edilen tüm hastaları içerir. İndüksiyon fazına randomize edilen hastaların 31 aylık medyan gözlem süresi sonunda, R- CHOP'un, CHOP ile kıyaslandığında relaps/refrakter foliküler lenfoma hastalarının klinik sonuçlarını belirgin olarak iyileştirdiği görülmüştür (Bkz. Tablo 10).
Tablo 10: İndüksiyon fazı: CHOP ile R-CHOP'un karşılaştırmalı etkililik sonuçlarına genel bakış (31 aylık medyan gözlem süresi)
| CHOP | R-CHOP | p değeri | Risk Azaltımı |
Primer Etkililik GYO TY KY |
%74 %16 %58 |
%87 %29 %58 |
0,0003 0,0005 0,9449 | Yok Yok Yok |
Çalışmanın idame fazına randomize edilen hastalar için medyan gözlem süresi, idame randomizasyonundan itibaren 28 aydır. Rituximab ile idame tedavisi, sadece gözlem koluna kıyasla, primer sonlanma noktası olan PFS'de (idame randomizasyonundan nükse, hastalık ilerlemesine ya da ölüme kadar olan süre) klinik olarak anlamlı ve istatistiksel olarak belirgin düzelme ile sonuçlanmıştır (p<0,000l, log-sıra testi). Medyan PFS, rituximab idame kolunda 42,2 ayken gözlem kolunda 14,3 aydır. Cox regresyon analizi kullanıldığında, hastalık ilerlemesi ya da ölüm riski, rituximab idame tedavisi ile gözleme göre %61 oranında azalmıştır (GA; %45-%72). 12 ayda Kaplan-Meier yöntemiyle hesaplanan progresyonsuz oranlar, rituximab idame grubunda %78 iken gözlem grubunda %57'dir. Genel sağkalım analizi, rituximab idamesinin, gözleme göre belirgin fayda sağladığını kanıtlamıştır (p=0,0039 log-sıra testi). Rituximab idame tedavisi, ölüm riskini %56 azaltmıştır (GA; %22-%75).
Tablo 11: İdame fazı: Rituximab ile gözlem gruplarının karşılaştırmalı etkililik sonuçlarına genel bakış (28 aylık medyan gözlem süresi)
Etkililik Parametresi | Olaya Kadar Medyan Sürenin (ay) Kaplan-Meier Yöntemiyle Hesaplanması |
Risk Azaltımı | ||
Gözlem (N=167) | Rituximab (N=167) | Log-sıra p değeri | ||
Progresyonsuz sağkalım (PFS) | 14,3 | 42,2 | <0,0001 | %61 |
Genel sağkalım (OS) | NR | NR | 0,0039 | %56 |
Yeni lenfoma tedavisine kadar geçen süre | 20,1 | 38,8 | <0,0001 | %50 |
Hastalıksız sağkalım | 16,5 | 53,7 | 0,0003 | %67 |
Alt Grup Analizi PFS CHOP R-CHOP TY KY OS CHOP R-CHOP |
11,6 22,1 14,3 14,3
NR NR |
37,5 51,9 52,8 37,8
NR NR |
<0,0001 0,0071 0,0008 <0,0001
0,0348 0,0482 |
%71 %46 %64 %54
%55 %56 |
NR: ulaşılamamıştır; : sadece TY'ye ulaşan hastalar için
Rituximab idame tedavisinin faydası, indüksiyon rejimi (CHOP ya da R-CHOP) ya da indüksiyon tedavisine verilen yanıtların niteliğiyle (TY ya da KY) ilgili olmaksızın tüm alt gruplarda analiz edilmiştir (Tablo 11). Rituximab idame tedavisi, CHOP indüksiyon tedavisine yanıt veren hastalarda (medyan PFS 37,5 aya karşılık 11,6 ay, p<0,0001) olduğu kadar R-CHOP indüksiyon tedavisine yanıt veren hastalarda da (medyan PFS 51,9 aya karşılık 22,1 ay, p=0,0071) medyan PFS'yi önemli ölçüde uzatmıştır. Alt gruplar küçük olsa da, rituximab idame tedavisi genel sağkalım açısından hem CHOP'a yanıt veren hastalarda hem de R-CHOP'a yanıt veren hastalarda klinik açıdan anlamlı fayda sağlamıştır, bu gözlemi doğrulamak için daha uzun süreli takip gereklidir.
Yetişkinlerde diffüz büyük B hücreli Hodgkin-dışı lenfoma (DBBHL)
Randomize, açık etiketli bir çalışmada, diffüz büyük B hücreli lenfoması olan önceden tedavi görmemiş, yaşları 60 ile 80 arası değişen 399 yaşlı hastaya, sekiz siklus boyunca her üç haftada bir standart CHOP kemoterapisi (1. günde siklofosfamid 750 mg/m, doksorubisin 50 mg/m,
1. gün maksimum 2 mg'a kadar, vinkristin 1,4 mg/m ve 1-5. günlerde prednizolon 40 mg/m/gün) veya 375 mg/m rituximab + CHOP (R-CHOP) verilmiştir. Rituximab tedavi siklusunun birinci gününde uygulanmıştır.
Nihai etkililik analizi randomize edilen tüm hastaları (197 CHOP, 202 R-CHOP) kapsamıştır ve ortalama izleme süresi yaklaşık 31 aydır. İki tedavi grubu, başlangıç düzeyi özellikleri ve hastalık durumu bakımından iyi dengelenmiştir. Nihai analiz, R-CHOP tedavisinin olaysız geçen sağkalım süresini (primer etkililik parametresi, buradaki olaylar ölüm, nüks veya lenfoma ilerlemesi ya da yeni bir anti-lenfoma tedavisinin tesis edilmesidir) önemli oranda uzattığını doğrulamıştır (p=0,0001). Medyan olaysız sağkalım süresine ilişkin Kaplan-Meier tahminlerine göre, CHOP kolundaki 13 ay ile, R-CHOP kolunda 35 ayın karşılaştırılması riskin %41 azaldığını göstermektedir. 24. ayda, genel sağkalıma ilişkin tahminler CHOP kolundaki
%57,4'lük orana kıyasla R-CHOP kolunda %68,2 olarak bulunmuştur. Medyan 60 aylık izleme süresi ile gerçekleştirilen daha sonraki bir genel sağkalım süresi analizi, R-CHOP tedavisinin CHOP tedavisinden daha yararlı olduğunu doğrulamış (p=0,0071) ve riskin %32 azaldığını göstermiştir.
Tüm sekonder parametrelerin analizi (yanıt oranları, progresyonsuz sağkalım, hastalıksız sağkalım, yanıt süresi), CHOP ile karşılaştırıldığında R-CHOP tedavisinin etkisini doğrulamıştır. 8. siklustan sonra tam yanıt oranı, R-CHOP grubunda %76,2 ve CHOP grubunda
%62,4 bulunmuştur (p=0,0028). Hastalığın ilerleme riski %46 ve nüks riski %51 oranında azaltılmıştır.
Tüm hasta alt gruplarında (cinsiyet, yaş, yaşa göre ayarlanmış IPI, Ann Arbor evresi, ECOG, β2 Mikroglobulin, LDH, albümin, B semptomları, büyük hacimli hastalık, ekstranodal bölgeler, kemik iliği tutulumu), olaysız sağkalım ve genel sağkalıma ilişkin risk oranları (R-CHOP'a karşılık CHOP) sırasıyla 0,83 ve 0,95'den daha az bulunmuştur. Yaşa göre ayarlanmış IPI'ye göre R-CHOP hem yüksek hem de düşük risk taşıyan hastalarda, sonuçta ulaşılan iyileşme düzeyiyle ilişkili bulunmuştur.
Klinik laboratuvar bulguları
İnsan anti-fare antikoru (HAMA) açısından değerlendirilen 67 hastanın hiçbiri için yanıt bildirilmemiştir. İlaca karşı antikor (ADA) açısından değerlendirilen 356 hastanın %1,1'i (4 hasta) pozitif çıkmıştır.
Kronik lenfositik lösemi
Açık-etiketli randomize iki çalışmada, daha önce tedavi görmemiş toplam 817 KLL hastası ve 552 relaps/refrakter KLL hastası, 6 siklus için 4 haftada bir FC kemoterapi (fludarabin 25 mg/m, siklofosfamid 250 mg/m, 1-3. günler) veya FC ile kombinasyon halinde rituximab (R- FC) alacak şekilde randomize edilmiştir. Rituximab, ilk siklus sırasında kemoterapiden bir gün önce 375 mg/m dozunda ve sonraki her tedavi siklusunun 1. gününde 500 mg/m dozunda uygulanmıştır. Relaps/refrakter KLL'de önceden monoklonal antikorlar ile tedavi edilmiş veya fludarabin ya da herhangi bir nükleozid analoğuna refrakter olan hastalar (en az 6 ay için kısmi remisyon gösterememe başarısızlığı olarak tanımlanmıştır) çalışmaya dahil edilmemiştir. Etkililik için birinci basamak çalışmasında (Tablo 12a) ve (Tablo 12b) toplam 810 hasta (403 R-FC, 407 FC), relaps/refrakter çalışmasında da (Tablo 13) 552 hasta (276 R-FC, 276 FC) analiz edilmiştir.
Birinci basamak çalışmasında 48,1 aylık medyan gözlem süresinden sonra medyan PFS, R- FC grubunda 55 ay ve FC grubunda 33 ay olmuştur (p<0,0001, log-sıra testi). Genel sağkalım analizi, yalnızca FC kemoterapisi kullanılan kola göre, R-FC kolu için anlamlı bir fayda göstermiştir (p=0,0319, log-sıra testi) (Tablo 12a). PFS açısından fayda, başlangıçtaki hastalık riskine göre (yani Binet A-C evreleri) (Tablo 12b) analiz edilen hasta alt gruplarının çoğunda tutarlı olarak gözlenmiştir.
Tablo 12a: Kronik lenfositik löseminin birinci basamak tedavisi
Tek başına FC'ye kıyasla rituximab+FC için etkililik sonuçlarına genel bakış – 48,1 aylık medyan gözlem süresi
Etkililik parametresi | Olaya kadar geçen medyan süre için Kaplan-Meier tahmini (Ay) | Risk azaltımı | ||
FC (N=409) | R-FC (N=408) | Log-sıra p değeri | ||
Progresyonsuz sağkalım (PFS) | 32,8 | 55,3 | <0,0001 | %45 |
Genel sağkalım | NR | NR | 0,0319 | %27 |
Olaysız sağkalım | 31,3 | 51,8 | <0,0001 | %44 |
Yanıt oranı (TY, nKY veya KY) TY oranları | %72,6
%16,9 | %85,8
%36 | <0,0001
<0,0001 | n.a.
n.a. |
Yanıt süresi* | 36,2 | 57,3 | <0,0001 | %44 |
Hastalıksız sağkalım (DFS)** |
|
|
|
%31 |
Yeni tedaviye kadar geçen süre | 47,2 | 69,7 | <0,0001 | %42 |
Yanıt oranı ve TY oranları Ki-kare Testi kullanılarak analiz edilmiştir. NR: ulaşılmadı; n.a.: geçerli değildir.
*: Yalnızca TY, nKY veya KY elde edilen hastalar için geçerlidir.
**: Yalnızca TY elde edilen hastalar için geçerlidir.
Tablo 12b: Kronik lenfositik löseminin birinci basamak tedavisi
Binet evresine göre (ITT) progresyonsuz sağkalım tehlike oranı - medyan gözlem süresi 48,1 ay
Progresyonsuz sağkalım (PFS) | Hasta sayısı | Tehlike Oranı (%95 GA) | p-değeri (Wald testi, ayarlanmamış) | |
FC | R-FC | |||
Binet evre A | 22 | 18 | 0,39 (0,15; 0,98) | 0,0442 |
Binet evre B | 259 | 263 | 0,52 (0,41; 0,66) | <0,0001 |
Binet evre C | 126 | 126 | 0,68 (0,49; 0,95) | 0,0224 |
GA: Güven aralığı
Relaps/refrakter çalışmasında, R-FC grubunda medyan progresyonsuz sağkalım (primer sonlanım noktası) 30,6 ay iken FC grubunda 20,6 aydır (p=0,0002, log-sıra testi). PFS açısından fayda, başlangıçtaki hastalık riskine göre analiz edilen hasta alt gruplarının neredeyse hepsinde gözlenmiştir. R-FC kolunda FC koluna kıyasla, genel sağkalımda (OS) az fakat anlamlı olmayan bir artış bildirilmiştir.
Tablo 13: Relaps/refrakter kronik lenfositik löseminin tedavisi - Tek başına FC'ye kıyasla rituximab-FC için etkililik sonuçlarına genel bakış (medyan gözlem süresi 25,3 ay)
Etkililik Parametresi | Olaya Kadar Geçen Medyan Süre için Kaplan-Meier Tahmini (Ay) | Risk azaltımı | ||
FC (N=276) | R-FC (N=276) | Log-sıra p değeri | ||
Progresyonsuz sağkalım (PFS) | 20,6 | 30,6 | 0,0002 | %35 |
Genel sağkalım | 51,9 | ulaşılamadı | 0,2874 | %17 |
Olaysız sağkalım | 19,3 | 28,7 | 0,0002 | %36 |
Yanıt oranı (TY, nKY veya KY) | %58,0 | %69,9 | 0,0034 | uygulanabilir değil |
TY oranları | %13,0 | %24,3 | 0,0007 | uygulanabilir değil |
Yanıt süresi* | 27,6 | 39,6 | 0,0252 | %31 |
Hastalıksız sağkalım | 42,2 | 39,6 | 0,8842 | %-6 |
(DFS)** |
|
|
|
|
Yeni KLL tedavisine kadar geçen süre | 34,2 | ulaşılamadı | 0,0024 | %35 |
Yanıt oranı ve TY oranları Ki-kare Testi kullanılarak analiz edilmiştir.
*: Yalnızca TY, nKY, KY elde edilen hastalar için geçerlidir.
**: Yalnızca TY elde edilenhastalariçingeçerlidir.
Önceden tedavi edilmemiş ve/veya relaps/refrakter KLL hastalarının tedavisinde diğer kemoterapi rejimleriyle (CHOP, FCM, PC, PCM, bendamustin ve kladribin dahil) kombinasyon halinde rituximab kullanılan diğer destekleyici çalışmalardan elde edilen sonuçlar, hafif yükselmiş toksisiteye (özellikle miyelotoksisite) rağmen, PFS oranları açısından faydalı yüksek genel yanıt oranları ortaya koymuştur. Bu çalışmalar rituximabın herhangi bir kemoterapi ile kullanımını desteklemektedir.
Daha önce rituximab ile tedavi edilmiş yaklaşık 180 hastaya ait veriler klinik faydayı ortaya koymuştur (TY dahil) ve bu veriler rituximab ile yeniden tedaviyi destekler niteliktedir.
Pediyatrik popülasyon
Daha önce tedavi edilmemiş ileri evre CD20 pozitif DBBHL/BL/BAL/BLL'li olan pediyatrik hastalarda rituximab ile birlikte veya rutiximab olmaksızın Lenfoma Malign B (LMB) kemoterapi (kortikosteroidler, vinkristin, siklofosfamid, yüksek-doz metotreksat, sitarabin, doksorubisin, etoposid ve üçlü ilaç [metotreksat/sitarabin/kortikosteroid] intratekal terapi) için çok merkezli, açık-etiketli, randomize bir çalışma yapılmıştır. İleri evre, yükselmiş LDH seviyesi (“B-yüksekâ€) [LDH > yetişkin normal değerlerinin geleneksel üst sınırının iki katı (> Nx2)] ile beraber evre III ya da herhangi bir evre IV veya BAL olarak tanımlanmıştır. Hastalar LMB kemoterapi veya LMB şemasına göre LMB kemoterapisi ile kombine altı i.v. rituximab infüzyonunu (iki indüksiyon kürünün her birinde iki tane ve iki konsolidasyon kürünün her birinde bir tane) 375 mg/m BSA dozunda almak üzere randomize edilmiştir. Toplamda randomize edilmiş 328 hasta etkililik analizlerine dahil edilmiştir, bu hastalar içinde LMB kemoterapi ile kombine rituximab alan bir hasta 3 yaşın altındaydı.
İki tedavi kolu, LMB (LMB kemoterapisi) ve R-LMB (rituximab ile LMB kemoterapisi), temel özellikler açısından iyi dengelenmişti. Hastaların medyan yaşı LMB kolunda ve R-LMB kolunda sırasıyla 7 ve 8 yıldı. Hastaların yaklaşık yarısı (LMB kolunda %50,6 ve R-LMB kolunda %49,4) Grup B'deydi, her iki kolda %39,6'sı Grup C1'deydi ve LMB ve R-LMB kolları için sırasıyla %9,8'i ve %11'i Grup C3'deydi. Murphy evrelemesine göre, hastaların çoğu ya BL evre III (LMB kolunda %45,7 ve R-LMB kolunda %43,3) ya da BAL, SSS negatifti (LMB kolunda %21,3 ve R-LMB kolunda %24,4). Hastaların yarısından azında (her iki kolda da %45,1) kemik iliği tutulumu vardı ve hastaların çoğunda (LMB kolunda %72,6 ve R-LMB kolunda %73,2) SSS tutulumu yoktu. Primer etkililik sonlanım noktası Olaysız Sağkalım'dı (EFS), burada olay, hangisi önce meydana gelirse gelsin, hastalık ilerlemesi, relaps, ikinci malignite, herhangi bir sebepten ölüm veya ikinci CYVE küründen sonra canlı hücre kaldığının saptanması ile doğrulanan tedaviye yanıt-olmaması durumlarının meydana gelmesi olarak tanımlanmıştı. Sekonder etkililik sonlanım noktaları ise Genel Sağkalım ve Tam Remisyon olmuştur.
Yaklaşık 1 yıllık medyan takip süresinde, önceden tanımlanmış ara analizlerde, EFS primer sonlanım noktasında klinik olarak alakalı düzelmeler görülmüştür; 1-yıllık oran tahminleri R- LMB kolunda %94,2 (%95 GA, %88,5 - %97,2) olurken LMB kolunda %81,5 (%95 GA, %73
- %87,8) ve ayarlanmış Cox Risk Regresyonu (HR) 0,33 (%95 GA, 0,14 – 0,79) olmuştur. Bağımsız Veri İzleme Komisyonu'nun bu sonuca dayanan tavsiyesi üzerine, randomizasyon durdurulmuş ve LMB kolundaki hastaların rituximab almak üzere geçiş yapmalarına izin verilmiştir.
Randomize edilmiş 328 hastada primer etkililik analizleri yapılmıştır, medyan takip süresi 3,1 yıldır. Sonuçlar Tablo 14'te açıklanmaktadır.
Tablo 14: Primer etkililik sonuçlarına genel bakış (ITT popülasyonu)
Analiz | LMB (N=164) | R-LMB (N=164) |
Olaysız Sağkalım (EFS) | 28 olay | 10 olay |
Tek-yönlü log-sıra test p-değeri 0,0006 | ||
Ayarlanmış Cox HR 0,32 (%90 GA: 0,17; 0,58) | ||
3-yıl EFS oranları | %82,3 (%95 GA: %75,7; %87,5) | %93,9 (%95 GA: %89,1; %96,7) |
Genel Sağkalım (OS) | 20 ölüm | 8 ölüm |
Tek-yönlü log-sıra test p-değeri 0,0061 | ||
Ayarlanmış Cox HR 0,36 (%95 GA: 0,16; 0,81) | ||
3-yıl OS oranları | %87,3 (%95 GA: %81,2; %91,6) | %95,1 (%95 GA: %90,5; %97,5) |
Tam Remisyon oranı | %93,6 (%95 GA: %88,2; %97) | %94 (%95 GA: %88,8; %97,2) |
Primer etkililik analizi, rituximab ilave edilmiş LMB kemoterapisinin tek başına LMB kemoterapisine göre EFS avantajını göstermiştir; ulusal grup, histoloji ve terapötik grup için ayarlanmış Cox regresyon analizinden elde edilen EFS HR 0,32 (%90 GA: 0,17 – 0,58) olmuştur. İki tedavi grubunda Tam Remisyon elde eden hastaların sayısında büyük bir fark olmasada, LMB kemoterapisine rituximab ilavesinin sekonder sonlanım noktası olan Genel Sağkalım üzerine faydası da gösterilmiştir; OS HR 0,36 (%95 GA: 0,16 – 0,81) olmuştur.
Avrupa İlaç Ajansı, foliküler lenfoma ve KLL'li pediyatrik popülasyonun tüm alt gruplarında ve doğumdan altı aylığa kadar olan yaş aralığındaki CD20 pozitif diffüz büyük B-hücreli lenfomalı hastalarda rituximab ile yapılmış çalışmaların sonuçlarını sunma yükümlülüğünden fergat etmiştir. Pediyatrik kullanım bilgisi için Bkz. Bölüm 4.2.
Romatoid artritte klinik deneyim
TNF inhibitörlerine yeterli bir yanıt vermeyen hastalarda romatoid artritin belirti ve bulgularının hafifletilmesinde rituximabın etkililiği ve güvenliliği pivotal, randomize, kontrollü, çift kör, çok merkezli bir çalışmada gösterilmiştir (Çalışma 1).
Çalışma l'de bir veya daha fazla TNF inhibitörü ile yapılan tedaviye yeterli yanıt vermeyen veya tolerans göstermeyen 517 hasta değerlendirilmiştir. Amerikan Romatoloji Birliği (ACR) kriterlerine göre teşhis edilmiş aktif romatoid artriti olan hastalar uygun hastalar olarak değerlendirilmiştir. Rituximab, 15 gün arayla iki i.v. infüzyon şeklinde uygulanmıştır. Hastalar, MTX ile kombinasyon halinde 2x1.000 mg intravenöz rituximab infüzyonu veya plasebo almışlardır. Tüm hastalara eş zamanlı olarak ilk infüzyondan sonraki 2-7. gün arasında 60 mg oral prednizon ve 8-14. gün arasında 30 mg oral prednizon verilmiştir. Primer sonlanım noktası,
24. haftada ACR20 yanıtına ulaşılan hasta oranı olmuştur. Hastalar, 56. ve 104. haftada radyografik değerlendirme yapılmak suretiyle uzun dönem sonlanım noktaları için 24 haftadan daha uzun bir süre takip edilmiştir. Bu süre zarfında aslen plasebo grubundaki hastaların %81'i, açık etiketli bir uzatma çalışmasıprotokolüçerçevesinde,24.ve 56. haftalar arasında rituximab
almıştır.
Erken artriti olan hastalarda (önceden metotreksat ile tedavi görmemiş hastalar ile metotreksata yeterli yanıt vermeyen ancak henüz TNF-alfa inhibitörleri ile tedavi edilmemiş hastalar) rituximab ile yapılan çalışmalar buna ilişkin primer sonlanım noktalarını karşılamıştır. Uzun dönem rituximab tedavisi ile ilgili güvenlilik verileri özellikle malignite ve PML gelişme riski açısından yeterli olmadığından rituximab bu hastalarda endike değildir.
Hastalık aktivitesi bulguları
Metotreksat ile kombinasyon şeklinde rituximab uygulaması, tek başına metotreksat ile tedavi edilen hastalar ile karşılaştırıldığında ACR skorunda en az %20'lik bir iyileşmeye ulaşan hasta oranını anlamlı düzeyde arttırmıştır (Tablo 15). Tüm geliştirme çalışmaları boyunca tedavi faydasının yaş, cinsiyet, vücut yüzey alanı, ırk, daha önceden alınan tedavi sayısı veya hastalık durumundan bağımsız olarak benzer olduğu bulunmuştur.
ACR yanıtının her bir unsuru (hassas ve şişmiş eklem sayısı, hasta ve doktor global değerlendirmesi, yeti yitimi indeksi skoru (HAQ), ağrı değerlendirmesi ve C-Reaktif Proteinleri (mg/dL)) için de klinik ve istatistiksel olarak anlamlı iyileşme bildirilmiştir.
Tablo 15: Çalışma 1'de primer sonlanım noktasındaki klinik yanıt sonuçları (ITT popülasyonu)
| Sonuç†| Plasebo+MTX | Rituximab+MTX (2 x 1.000 mg) |
Çalışma 1 |
| N= 201 | N= 298 |
| ACR20 | 36 (%18) | 153 (%51)*** |
ACR50 | 11 (%5) | 80 (%27)*** | |
ACR70 | 3 (%1) | 37 (%12)*** | |
| EULAR Yanıt (İyi/Orta) | 44 (%22) | 193 (%65)*** |
| DAS'taki Ortalama Değişiklik | -0,34 | -1,83*** |
Primer zaman noktasında plasebo+metotreksattan anlamlı farklılık: ***p≤0,000l
Metotreksat ile kombinasyon şeklinde rituximab ile tedavi edilen hastalarda, tek başına metotreksat ile tedavi edilen hastalara kıyasla hastalık aktivite skorunda (DAS28) anlamlı oranda daha fazla bir azalma görülmüştür (Tablo 15). Benzer şekilde, tek başına metotreksat ile tedavi edilen hastalar ile karşılaştırıldığında, rituximab ve metotreksat uygulanan rituximab tedavi grubu hastalarında iyi ila orta derecede Avrupa Romatizma ile Savaş Derneği (EULAR) yanıtına ulaşanların sayısı anlamlı oranda daha fazla olmuştur (Tablo 15).
Radyografik yanıt
Yapısal eklem hasarı radyografik olarak değerlendirilmiş ve modifiye Toplam Sharp Skorunda (mTSS) ve bunun bileşenleri olan erozyon skoru ve eklem boşluğunda daralma skorunda değişiklik olarak ifade edilmiştir.
Bir veya birden fazla TNF inhibitör tedavisine yeterli yanıt vermeyen ya da tolerans göstermeyen hastalarda yürütülen Çalışma l'de, aslen tek başına metotreksat alan hastalarla kıyaslandığında metotreksat ile kombinasyon şeklinde rituximab uygulaması ile 56. haftada anlamlı oranda daha az radyografikprogresyonmeydanageldiği gösterilmiştir. Aslen tek
başına metotreksat alan hastaların %81'i 16-24. haftalar arasında ya da uzatma araştırmasında
56. haftadan önce kurtarma tedavisi olarak rituximab almıştır. Aslen rituximab/MTX tedavisi alan hastaların daha yüksek bir oranında 56 hafta boyunca eroziv progresyona rastlanmamıştır (Tablo 16).
Tablo 16: 1 yıldaki radyografik sonuçlar (mlTT popülasyonu)
| Plasebo+MTX | Rituximab+MTX 2 x 1.000 mg |
Çalışma 1 | (n=184) | (n=273) |
Başlangıca göre ortalama değişiklik: |
|
|
Modifiye Toplam Sharp skoru | 2,30 | 1,01* |
Erozyon skoru | 1,32 | 0,60* |
Eklem boşluğunda daralma skoru | 0,98 | 0,41** |
Radyografik değişiklik görülmeyen hasta oranı | %46 | %53, NS |
Eroziv değişiklik görülmeyen hasta oranı | %52 | %60, NS |
Çalışma l'de orijinal olarak plasebo+MTX'e randomize edilmiş 150 hasta, bir yıl boyunca en az bir kür RTX+MTX almıştır.
*p<0,05, **p<0,001. Kısaltma: NS, anlamlı değil.
Ayrıca, uzun dönemde progresif eklem hasarı oranında azalma gözlenmiştir. Çalışma l'de 2 yılda yapılan radyografik analiz, tek başına metotreksat ile karşılaştırıldığında metotreksat ile kombinasyon şeklinde rituximab alan hastalarda yapısal eklem hasarı progresyonunda anlamlı bir azalma olduğunu ve ayrıca 2 yıl boyunca eklem hasarı progresyonu görülmeyen hasta oranının anlamlı oranda daha yüksek seyrettiğini göstermiştir.
Fiziksel fonksiyonlar ve yaşam kalitesi sonuçları
Tek başına metotreksat ile tedavi edilen hastalar ile karşılaştırıldığında rituximab ile tedavi edilen hastalarda yeti yitimi indeksi (HAQ-DI) ve yorgunluk (FACIT-Yorgunluk) skorlarında anlamlı azalmalar gözlenmiştir. Ayrıca HAQ-DI'da (her bir toplam skorda >0,22 düzeyinde azalma olarak tanımlanmış) klinik olarak anlamlı en küçük değişim (MCID) gösteren rituximab ile tedavi edilmiş hasta oranı, tek başına metotreksat alan hastalar arasında görülenden daha fazladır (Tablo 17).
SF-36'nın hem fiziksel sağlık skoru (PHS) hem de mental sağlık skorunda (MHS) anlamlı bir iyileşme ile birlikte sağlık ile ilişkili yaşam kalitesinde anlamlı bir iyileşme görülmüştür. Ayrıca bu skorlar için MCID'ye ulaşan hasta oranı anlamlı düzeyde daha fazla olmuştur (Tablo 17).
Tablo 17: Çalışma 1'de 24. haftada fiziksel fonksiyon ve yaşam kalitesi sonuçları
Sonuç†| Plasebo+MTX | Rituximab+MTX (2 x 1.000 mg) |
HAQ-DI'da ortalama değişiklik % HAQ-DI MCID | n=201
0,1 %20 | n=298
-0,4*** %51 |
FACIT-T'de ortalama değişiklik | -0,5 | -9,1*** |
| n=197 | n=294 |
SF-36 PHS'de ortalama değişiklik | 0,9 | 5,8*** |
% SF-36 PHS MCID | %13 | %48*** |
SF-36 MHS'de ortalama değişiklik | 1,3 | 4,7** |
% SF-36 MHS MCID | %20 | %38* |
†24 haftadaki sonuçlar
Primer zaman noktasında plasebodan anlamlı farklılık: *p<0,05, **p<0,001, ***p≤0,0001 MCID HAQ-DI ≥0,22, MCID SF-36 PHS>5,42, MCID SF-36 MHS>6,33
Otoantikor (RF ve/veya anti-CCP) seropozitif hastalarda etkililik
Metotreksat ile kombinasyon şeklinde rituximab ile tedavi edilmiş Romatoid Faktör (RF) ve/veya anti-siklik sitrülinlenmiş peptid (anti-CCP) açısından seropozitif hastalar, bunların her ikisi açısından negatif olan hastalara kıyasla yanıtta artış göstermişlerdir.
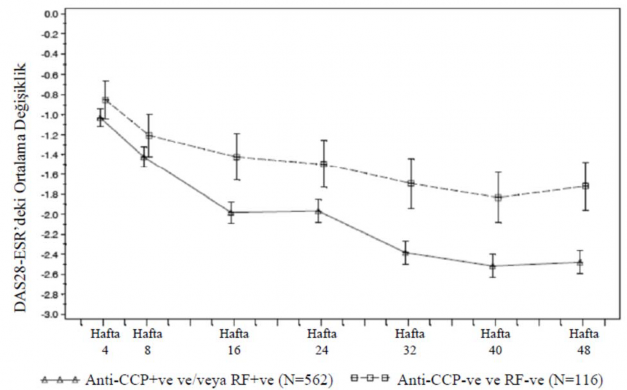
Rituximab ile tedavi edilen hastalarda etkililik sonuçları, tedaviye başlamadan önce antikor durumuna dayanılarak analiz edilmiştir. 24. haftada başlangıçta RF ve/veya anti-CCP için seropozitif olan hastalar, seronegatif hastalara kıyasla ACR20 ve 50 yanıtlarına ulaşma ihtimalinde anlamlı bir artış göstermiştir (p=0,0312 ve p=0,0096) (Tablo 18). Bu bulgular 48. haftada tekrarlanmıştır, burada otoantikor seropozitifliği ACR70'e ulaşma olasılığını da önemli ölçüde arttırmıştır. 48. haftada seropozitif hastaların seronegatif hastalara kıyasla ACR yanıtlarına ulaşma ihtimali 2-3 kat daha fazla olmuştur. Ayrıca seropozitif hastalarda, seronegatif hastalara kıyasla DAS28-ESR'de anlamlı oranda daha fazla bir azalma görülmüştür (Şekil 1).
Tablo 18: Başlangıçtaki otoantikor durumuna göre etkililiğin özeti
| 24. hafta | 48. hafta | ||
| Seropozitif (n=514) | Seronegatif (n=106) | Seropozitif (n=506) | Seronegatif (n=101) |
ACR20 (%) | 62,3* | 50,9 | 71,1* | 51,5 |
ACR50 (%) | 32,7* | 19,8 | 44,9** | 22,8 |
ACR70 (%) | 12,1 | 5,7 | 20,9* | 6,9 |
EULAR Yanıtı (%) | 74,8* | 62,9 | 84,3* | 72,3 |
DAS28-ESR'de ortalama değişiklik | -1,97** | -1,50 | -2,48*** | -1,72 |
Anlamlı düzeyler *p<0,05, **p<0,001, ***p<0,0001 olarak tanımlanmıştır.
Şekil 1: Başlangıçtaki otoantikor durumuna dayanılarak başlangıca göre DAS28- ESR'deki değişiklik
Çoklu tedavi kürleri ile uzun dönem etkililik
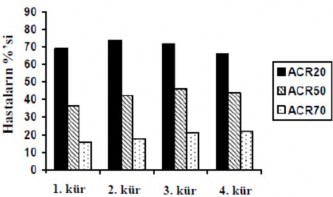
Çoklu tedavi kürleri boyunca metotreksat ile kombinasyon halinde rituximab tedavisi, çalışılan tüm hasta popülasyonlarında belirgin olan ACR, DAS28-ESR ve EULAR yanıtları ile gösterildiği gibi RA belirti ve semptomlarında uzun süreli iyileşmeler sağlamıştır (Şekil 2). Ayrıca HAQ-DI skoru ve HAQ-DI için MCID'ye ulaşan hasta oranı ile gösterildiği gibi fiziksel fonksiyonda uzun süreli iyileşme gözlenmiştir.
Şekil 2: TNF inhibitörlerine yeterli yanıt vermeyen hastalarda (n=146) 4 tedavi kürü için ACR yanıtları (her bir kürden 24 hafta sonra (hasta içi, vizit içi))
Klinik laboratuvar bulguları
Romatoid artritli toplam 3.095 hastadan 392'si (%12,7), klinik çalışmalarda rituximab tedavisinden sonra ADA açısından pozitif bulunmuştur. ADA'nın ortaya çıkışı, hastaların çoğunda klinik olarak kötüleşme ya da izleyen infüzyonlara gösterilen reaksiyon riskinde artış ile ilişkili bulunmamıştır. ADA varlığı, devam kürlerinin ikinci infüzyonundan sonraki alerjik reaksiyonlar veya infüzyona bağlı reaksiyonlar ile ilişkili olabilir.
Pediyatrik popülasyon
Avrupa İlaç Ajansı, otoimmün artritli pediyatrik popülasyonun tüm alt gruplarında rituximab ile yapılmış çalışmaların sonuçlarını sunma yükümlülüğünden feragat etmiştir. Pediyatrik kullanım bilgisi için Bkz. Bölüm 4.2.
Granülamatoz polianjitis (Wegener) (GPA) ve mikroskobik polianjitis (MPA)'de klinik deneyim
Yetişkin remisyon indüksiyonu
GPA/MPA klinik çalışmasına (Çalışma 1), ciddi aktif GPA (%75) ve MPA'i (%24) olan 15 yaş ve üzeri toplam 197 hasta dahil edilerek aktif-karşılaştırmalı, randomize, çift-kör, çok merkezli, non-inferior bir çalışmada tedavi edilmiştir.
Hastalar 3-6 ay boyunca her gün oral siklofosfamid (2 mg/kg/gün) veya 4 hafta boyunca haftada bir rituximab (375 mg/m) almak üzere 1:1 oranında randomize edilmişlerdi. Siklofosfamid kolundaki tüm hastalar takip süresince azatioprin idame tedavisi almıştı. Her iki koldaki hastalar 1 ila 3 gün boyunca günde 1.000 mg pulse intravenöz (i.v.) metilprednizolon (veya eşdeğer-dozda başka bir glukokortikoid) ve ardından oral prednizon (1 mg/kg/gün, en fazla 80 mg/gün) almıştı. Prednizon azaltımı çalışma tedavisinin başlamasından itibaren 6 ayda tamamlanmalıydı.
Primer sonuç ölçütü 6. ayda tam remisyon sağlanmasıydı ve bu da Wegener granülomatozu için Birmingham Vaskülit Aktivite Skoru'nun (BVAS/WG) “0†olması ve glukokortikoid kullanımının bırakılması olarak tanımlanmaktaydı. Tedavi farkı için önceden belirlenen non- inferiorite marjini % 20'ydi. Bu çalışma, 6. ayda tam remisyon (CR) açısından siklofosfamide karşı rituximabın non-interferiotesini göstermişti (Tablo 19).
Etkililik hem hastalık teşhisi yeni konan hem de nüksetmiş hastalığı olan hastalarda gözlenmiştir (Tablo 20).
Tablo 19: 6. ayda tam remisyona erişen hastaların yüzdesi (tedavi meyilli popülasyon*)
| Rituximab (n=99) | Siklofosfamid (n=98) | Tedavi farkı (Rituximab – Siklofosfamid) |
Oran |
%63,6 |
%53,1 | %10,6 %95,1 GA (%-3,2, % 24,3) |
GA = güven aralığı.
* En kötü durum modeli
%95,1 güven seviyesi ara etkililikanaliziniaçıklamakiçinekbir 0,001 alfayı yansıtmaktadır.
Tablo 20: Hastalık durumuna göre 6 aydaki tam remisyon
| Rituximab | Siklofosfamid | Fark (%95 GA) |
Tüm hastalar | n=99 | n=98 |
|
Yeni teşhis konulmuş hastalar |
n=48 |
n=48 |
|
Relaps görülen hastalar |
n=51 |
n=50 |
|
Tam remisyon | |||
Tüm hastalar | %63,6 | %53,1 | %10,6 (-3,2, 24,3) |
Yeni teşhis | %60,4 | %64,6 | %-4,2 |
konulmuş |
|
|
|
hastalar |
|
| (-23,6, 15,3) |
Relaps görülen | %66,7 | %42,0 | %24,7 |
hastalar |
|
| (5,8, 43,6) |
Verileri eksik olan hastalar için en kötü durum modeli geçerlidir.
12. ve 18. aylarda tam remisyon (CR)
Rituximab grubunda hastaların %48'i 12 ayda ve %39'u 18 ayda CR'a ulaşmıştır. Siklofosfamid (ve ardından tam remisyonun idamesi için azatioprin) ile tedavi edilen hastalarda, hastaların %39'u 12 ayda ve %33'ü 18 ayda CR'a ulaşmıştır. 12. aydan 18. aya kadar rituximab grubunda 8 relaps görülürken siklofosfamid grubunda dört relaps görülmüştür.
Laboratuvar değerlendirmeleri
Remisyon indüksiyonu çalışmasında rituximab ile tedavi edilen toplam 99 hastanın 23'ü (%23) 18 aya kadar ADA açısından pozitif bulunmuştur. Rituximab ile tedavi edilen 99 hastanın hiçbiri çalışma başlangıcındaki taramada ADA açısından pozitif değildir. Remisyon indüksiyonu çalışmasında ADA varlığının güvenlilik veya etkililik üzerinde belirgin bir eğilimi veya olumsuz bir etkisi olmamıştır.
Yetişkin idame tedavisi
Prospektif, çok-merkezli, kontrollü, açık-etiketli bi çalışmada hastalık remisyonu olan toplam 117 hasta (GPA'li 88, MPA'li 24 ve böbrek-tutulumlu ANCA ile ilişkili vaskülitli 5 hasta), azatioprin (59 hasta) ya da rituximab (58 hasta) almak üzere randomize edilmiştir. Dahil edilen hastalar 21 ila 75 yaş arasındadır ve yeni tanı konmuş veya glukokortikoidler ve pulse siklofosfamid ile kombine tedavi ardından tam remisyonda hastalığı nüksetmiş hastalardır. Hastaların çoğunluğu teşhis aşamasında ya da hastalıklarının seyri esnasında ANCA pozitiftir; GPA/MPA'in klinik bir fenotipi ile birlikte nekrotizan küçük damar vasküliti veya böbrek tutulumlu ANCA ile ilişkili vaskülit geçirdikleri veya her ikisini birden geçirdikleri histolojik olarak doğrulanmıştır.
Remisyon indüksiyon tedavisi araştırmacının kararına göre verilen i.v. prednizon içermiştir, bazı hastalarda daha öncesinde pulse metilprednizolon verilmiştir ve 4 ila 6 ay sonra remisyon elde edilene kadar pulse siklofosfamid içermiştir. Bu durumda, son pulse siklofosfamidden
sonra en fazla 1 ay içerisinde, hastalar randomize olarak rituximab (iki 500 mg i.v. infüzyonu
arasında iki hafta (1. gün ve 15. gün) ardından 18 ay boyunca her 6 ayda bir 500 mg i.v.) ya da azatioprin (12 ay boyunca 2 mg/kg/gün dozunda ardından 6 ay boyunca 1,5 mg/kg/gün dozunda ve son olarak 4 ay boyunca 1 mg/kg/gün dozunda (bu 22 ay sonrasında tedavi sonlandırılmıştır) oral yoldan uygulanmıştır) gruplarından birine dahil edilmiştir. Randomizasyondan sonra prednizon tedavisi kademeli olarak azaltılmıştır ve en az 18 ay boyunca düşük bir dozda (günde yaklaşık 5 mg) devam etmiştir. Prednizon dozunun kademeli olarak azaltımı ve 18 ay sonra prednizon tedavisinin sonlandırılması kararı araştırmacıya bırakılmıştır.
Tüm hastalar 28. aya kadar (son rituximab infüzyon veya azatioprin dozunun ardından sırasıyla 10 veya 6 ay) takip edilmiştir. CD4+ T-lemfosit titreleri 250 /mm'den az olan tüm hastalar için Pneumocystis jirovecii pnömoni profilaksisi gerekmiştir.
Primer sonuç ölçütü 28. aydaki majör relaps oranıdır. Sonuçlar
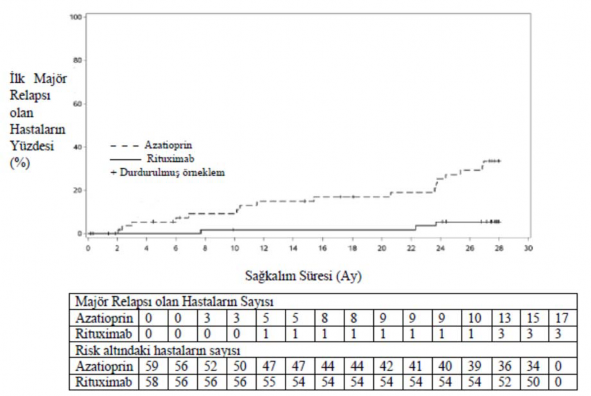
28. ayda, majör relaps (organ yetmezliğine ya da organ hasarına varabilecek ya da yaşamı tehdit edebilecek vaskülit aktivitesinin ([BVAS] > 0) klinik ve/veya laboratuvar belirtilerinin yeniden görülmesi ile tanımlanır) rituximab grubunda 3 hastada (%5) ve azatioprin grubunda 17 hastada (%29) (p=0,0007) görülmüştür. Minör relapslar (yaşamı tehdit etmeyen ve majör organ hasarında rol oynamayan) rituximab grubunda 7 hastada (%12) ve azatioprin grubunda 8 hastada (%14) meydana gelmiştir.
Kümülatif insidans oranı eğrileri, ilk majör relapsa kadar geçen sürenin rituximab alan hastalarda daha uzun olduğunu, 2. aydan başlayarak 28. aya kadar idame edildiğini göstermiştir (Şekil 3).
Şekil 3: İlk majör relapsın zaman içindeki kümülatif insidansı
Not: Hiçbir olay yaşamayan hastalar 28. ayda sansürlenmiştir.
Laboratuvar değerlendirmeleri
İdame tedavisi klinik çalışmasında rituximab ile tedavi edilen toplam 34 hastanın 6'sında (%18) ADA gelişmiştir. İdame tedavisi klinik çalışmasında ADA varlığının güvenlilik ya da etkililik üzerine belirgin bir eğilimi veya olumsuz bir etkisi olmamıştır.
Pediatrik popülasyon
Çalışma WA25615 (PePRS), şiddetli, aktif GPA veya MPA'i olan 25 pediyatrik hastada (≥ 2 ila < 18 yaş) çok merkezli, açık-etiketli, tek-kollu, kontrolsüz bir çalışmadır. Çalışmadaki hastaların medyan yaşı: 14 yıl (6 - 17 yıl aralığında) ve hastaların çoğu (20/25 [%80]) kadındı. Başlangıçta toplam 19 hastada (%76) GPA ve 6 hastada (%24) MPA vardı. Çalışmaya girişte on sekiz hasta (%72) yeni teşhis edilmiş hastalığa sahipti (13 hasta GPA'li ve 5 hasta MPA'li) ve 7 hastada nüksetmiş hastalık vardı (6 hasta GPA'li ve 1 hasta MPA'li).
Çalışma tasarımı, toplamda en fazla 54 aya (4,5 yıl) kadar en az 18 aylık bir takip ile ilk 6 aylık bir remisyon indüksiyonu aşamasından oluşmaktaydı. Hastalar, ilk rituximab i.v. infüzyonundan önce en az 3 doz i.v. metilprednizolon (30 mg/kg/gün, 1 g/gün'ü geçmeyecek şekilde) almıştır. Klinik olarak gerekliyse, i.v. metilprednizolonun ek günlük dozları (üçe kadar) verilebilir. Remisyon indüksiyonu rejimi, 1 mg/kg/gün (maksimum 60 mg/gün) dozunda [6. ayda minimum 0,2 mg/kg/gün'e (maksimum 10 mg/gün) azaltılabilir] oral prednizolon veya prednizon ile kombinasyon halinde, haftada bir defa olacak şekilde, çalışmanın 1, 8, 15 ve 22. günlerinde 375 mg/m BSA dozunda i.v. olarak uygulanan dört rituximab infüzyonundan oluşuyordu. Remisyon indüksiyonu aşamasından sonra, hastalar, araştırmacının kararına bağlı olarak, PVAS remisyonunu sürdürmek ve hastalık aktivitesini kontrol etmek (ilerleyici hastalık veya alevlenme dahil) veya ilk remisyona ulaşmak için 6. ayda veya sonrasında sonraki rituximab infüzyonlarını alabilirler.
25 hastanın tümü, 6 aylık remisyon indüksiyon fazı için haftada bir kez uygulanan dört i.v. infüzyonunu tamamlamıştır. 25 hastadan toplam 24'ü en az 18 aylık takibi tamamlamıştır.
Bu çalışmanın amaçları, pediyatrik GPA ve MPA hastalarında (≥ 2 ila < 18 yaş) rituximabın güvenliliğini, FK parametrelerini ve etkililiğini değerlendirmekti. Çalışmanın etkililik hedefleri keşif amaçlıdır ve temel olarak Pediyatrik Vaskülit Aktivite Skoru (PVAS) kullanılarak değerlendirilmiştir (Tablo 21).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
Hodgkin-dışı lenfoma
Tekli ajan olarak ya da CHOP tedavisi ile kombinasyon halinde tek veya çok sayıda rituximab infüzyonu alan (uygulanan rituximab dozları 100 ile 500 mg/m arasında değişmiştir) 298
Hodgkin-dışı lenfoma hastasında yürütülen bir popülasyon farmakokinetiği analizi temelinde,
spesifik olmayan klerens (CL), B hücreleri veya tümör yükünün katkıda bulunması olası spesifik klerens (CL) ve santral kompartıman dağılım hacmi (V) için tipik popülasyon tahminleri sırasıyla 0,14 L/gün, 0,59 L/gün ve 2,7 L'dir. Rituximabın hesaplanan medyan terminal eliminasyon yarılanma ömrü 22 gündür (6,1 ila 52 gün aralığında). 4 haftalık doz boyunca intravenöz infüzyon olarak 375 mg/m verilen 161 hastadan elde edilen verilerde başlangıç CD19-pozitif hücre sayımları ve ölçülebilir tümör lezyonlarının boyutu, rituximabın CL'sindeki değişkenliğin bir kısmına katkıda bulunmuştur. Daha yüksek CD19-pozitif hücre sayımlarına veya tümör lezyonlarına sahip hastalar daha yüksek CL'ye sahiptir. Bununla birlikte, CD19-pozitif hücre sayımları ve tümör lezyon boyutu için düzeltme sonrası CLiçin bireyler arası değişkenliğin büyük kısmı devam etmiştir. Vvücut yüzey alanı (BSA) ve CHOP tedavisine göre değişmiştir. Sırasıyla BSA'daki aralık (1,52 ila 2,32 m) ve eşzamanlı CHOP tedavisinin katkıda bulunduğu V'deki bu değişkenlik (%27,1 ve %19,0) nispeten küçüktür. Yaş, cinsiyet ve Dünya Sağlık Örgütü performans durumu rituximabın farmakokinetiği üzerinde bir etkiye sahip değildir. Bu analiz test edilen kovaryatlardan herhangi biri ile rituximab dozunun ayarlanmasının farmakokinetik değişkenliğinde anlamlı bir azalma ile sonuçlanmasının beklenmediğini düşündürmektedir.
Daha önce rituximab kullanmamış Hodgkin-dışı lenfomalı 203 hastaya 4 doz boyunca haftada bir aralıklarla 375 mg/m dozda intravenöz infüzyon olarak uygulanan rituximab, dördüncü infüzyonu takiben 486 mikrogram/mL'lik (77,5 ila 996,6 mikrogram/mL aralığında) ortalama bir Cvermiştir. Rituximab son tedavinin tamamlanmasından 3-6 ay sonra hastaların serumunda tespit edilebilmiştir.
Rituximabın Hodgkin-dışı lenfomalı 37 hastaya 8 doz boyunca haftada bir aralarla intravenöz infüzyon olarak 375 mg/m'lik bir dozda uygulanmasından sonra ortalama Cher bir ardışık infüzyon ile artmış olup, ilk infüzyondan sonra ortalama 243 mikrogram/mL (16-582 mikrogram/mL aralığında) ve sekizinci infüzyondan sonra 550 mikrogram/mL (171-1.177 mikrogram/mL aralığında) arasında değişmiştir.
6 siklus CHOP kemoterapisi ile kombinasyon halinde 375 mg/m'lik 6 infüzyon olarak uygulandığında rituximabın farmakokinetik profili, tek başına rituximab ile görülene benzerdir.
Pediyatrik DBBHL/BL/BAL/BLL Emilim
Pediyatrik DBBHL/BL/BAL/BLL'nin çalışıldığı klinik çalışmada, farmakokinetik, 3 yaşından büyük 35 hastadan oluşan bir alt grupta çalışılmıştır. İki yaş grubu (≥ 3 ila < 12 yaş ve ≥ 12 yaş ila < 18 yaş) arasında farmakokinetik karşılaştırılabilir olmuştur. Her iki indüksiyon siklusunda (siklus 1 ve 2) 375 mg/m dozunda uygulanan iki rituximab infüzyonunu takip eden konsolidayon sikluslarının (siklus 3 ve 4) herbirinde 375 mg/m dozunda uygulanan bir rituximab infüzyonu sonrasında maksimum konsantrasyon dördüncü infüzyondan (siklus 2) sonra en yüksek olmuştur; geometrik ortalama 347 mikrogram/mL olmuştur, bunu maksimum konsantrasyonun daha düşük geometrik ortalamaları takip etmiştir (siklus 4: 247 mikrogram/mL). Bu doz rejimi ile, vadi düzeyleri sürdürülmüştür (geometrik ortalama 41,8 mikrogram/mL (predoz Siklus 2; 1 siklusun ardından), 67,7 mikrogram/mL (predoz Siklus 3, 2 siklusun ardından) ve 58,5 mikrogram/mL (predoz Siklus 4, 3 siklusun ardından).
Rituximabın DBBHL/BL/BAL/BLL'li pediyatrik hastalardaki farmakokinetik özellikleriyetişkin Hodgkin-dışı lenfoma hastalarında gözlenene benzerdir.
≥ 6 ay'dan < 3 yaşına kadar olan grup için farmakokinetik verisi mevcut değildir ancak,
popülasyon PK tahminleri ≥ 3 yaş grubu ile kıyaslandığında bu yaş grubunda karşılaştırılabilir sistemik maruziyeti (EAA, Cvadi) destekler (Tablo 24). Başlangıçtaki daha küçük tümör büyüklüğü, daha düşük zamana bağımlı klerens sebebiyle daha yüksek maruziyet ile ilişkilidir ancak farklı tümör büyüklüklerinden etkilenen sistemik maruziyet, etkili olan ve güvenlilik profili açısından kabul edilebilir maruziyet aralığı içerisinde kalmıştır.
Yaş Grubu | ≥ 6 ay ila < 3 yaş | ≥ 3 yaş ila < 12 yaş | ≥ 12 yaş ila < 18 yaş |
C(mikrogram/mL) | 47,5 (0,01 – 179) | 51,4 (0,00 – 182) | 44,1 (0,00 – 149) |
EAA (mikrogram*gün/mL) | 13.501 (278 – 31.070) | 1.609 (135 – 31.157) | 11.467 (110 – 27.066) |
Tablo 24: Pediyatrik DBBHL/BL/BAL/BLL'de rituximab doz rejiminin ardından tahmini farmakokinetik parametreleri
Sonuçlar medyan olarak sunulmuştur (min – maks); Cpredoz Siklus 4'tür. Kronik lenfositik lösemi
Rituximab KLL hastalarında, fludarabin ve siklofosfamid ile kombinasyon halinde, i.v. infüzyon olarak ilk siklusta 375 mg/m, sonraki 5 siklusun her birinde 500 mg/m'ye artırılarak uygulanmıştır. Beşinci 500 mg/m'lik infüzyondan sonra ortalama C(n=15) 408 mikrogram/mL (97-764 mikrogram/mL aralığında), ortalama terminal yarılanma ömrü de 32 gündür (14 ila 62 gün aralığında).
Romatoid artrit
İki hafta arayla uygulanan 1.000 mg dozundaki iki intravenöz rituximab infüzyonunu takiben, ortalama terminal yarılanma ömrü 20,8 gün (8,58 ila 35,9 gün aralığında), ortalama sistemik klerens 0,23 L/gün (0,091 ile 0,67 L/gün aralığında) ve ortalama kararlı hal dağılım hacmi 4,6 L (1,7 ile 7,51 L aralığında) olmuştur. Aynı verilere ait popülasyon farmakokinetik analizi, sistemik klerens ve yarılanma ömrü için 0,26 L/gün ve 20,4 gün olmak üzere benzer ortalama değerleri göstermiştir. Popülasyon farmakokinetik analizleri vücut yüzey alanı ve cinsiyet farklılıklarının, farmakokinetik parametreler arasındaki bireyler arası farkı açıklayan en anlamlı ortak değişken olduğunu göstermiştir. Vücut yüzey alanı ayarlanmasından sonra, erkeklerde kadınlara göre daha büyük dağılım hacmi ve daha hızlı klerens görülmüştür. Cinsiyet kaynaklı farmakokinetik farklılıklar klinik olarak ilişkili bulunmamakta ve doz ayarlanmasını gerektirmemektedir. Karaciğer veya böbrek yetmezliği olan hastalarla ilgili farmakokinetik veri bulunmamaktadır.
Dört çalışmada, iki hafta aralıklarla 1. gün ve 15. günde uygulanan 500 mg ve 1.000 mg dozlardaki iki intravenöz rituximab infüzyonunu takiben, rituximab farmakokinetiği araştırılmıştır. Bu çalışmaların hepsinde, rituximab farmakokinetiği, araştırılan limitli doz aralığı için doz ile orantılı olmuştur. İlk infüzyonu takiben serum rituximabın ortalama Cdeğerleri, 2 x 500 mg'lık doz için 157 ila 171 mikrogram/mL aralığında ve 2 x 1.000 mg'lık doz için 298 ila 341 mikrogram/mL aralığında olmuştur. İkinci infüzyonu takiben ortalama Cdeğerleri 2 x 500 mg'lık doz için 183 ila 198 mikrogram/mL aralığında ve 2 x 1.000 mg'lık doz için 355 ila 404 mikrogram/mL aralığında olmuştur. Ortalama terminal eliminasyon yarı ömrü 2 x 500 mg doz için 15 ila 16 gün ve 2 x 1.000 mg doz için 17 ila 21 gün olmuştur. Her iki doz için, birinci infüzyona kıyasla, ikinci infüzyon sonrası ortalama C%16 ila %19 daha fazla olmuştur.
Rituximabın farmakokinetiği ikinci doz küründe yeniden tedavi sonrasında 500 mg ve 1.000 mg'lık iki i.v. dozu takiben değerlendirilmiştir. İlk infüzyonu takiben serum rituximabı için ortalama C2 x 500 mg dozu için 170 ila 175 mikrogram/mL ve 2 x 1.000 mg dozu için 317 ila 370 mikrogram/mL'dir. İkinci infüzyonu takiben C, 2 x 500 mg dozu için 207 mikrogram/mL'dir ve 2 x 100 mg dozu için 377 ila 386 mikrogram/mL arasında değişmiştir. İkinci kürü takiben ikinci infüzyondan sonra ortalama terminal eliminasyon yarılanma ömrü 2 x 500 mg dozu için 19 gündür ve 2 x 1.000 mg dozu için 21 ile 22 gün arasında değişmiştir. Rituximabın farmakokinetik parametreleri iki tedavi kürü için karşılaştırılabilir olmuştur.
Anti-TNF tedavisine yeterli yanıt vermeyen popülasyonundaki farmakokinetik parametreleri, aynı dozaj rejimini (2 hafta ara ile 2 x 1.000 mg i.v.) takiben, 369 mg/mL ortalama maksimum serum konsantrasyonu ve 19,2 gün ortalama terminal yarılanma ömrü değerleri ile benzer bulunmuştur.
Granülomatoz polianjitis (Wegener) (GPA) ve mikroskobik polianjitis (MPA) Yetişkin popülasyonu
Dört doz boyunca haftada bir kez 375 mg/m rituximab almış granülomatoz polianjitis ve mikroskobik polianjitis görülen 97 hastada popülasyon farmakokinetiği analizi temelinde hesaplanmış ortalama terminal eliminasyon yarılanma ömrü 23 gündür (9 ila 49 gün aralığında). Rituximab ortalama klerensi ve dağılım hacmi sırasıyla 0,313 L/gün (0,116 ila 0,726 L/gün aralığında) ve 4,50 L'dir (2,25 ila 7,39 L aralığında). İlk 180 gün boyunca maksimum konsantrasyon (C), 180. günde minimum konsantrasyon (C180) ve 180 gün boyunca eğrinin altındaki kümülatif alan (EAA180) (medyan [aralık]) sırasıyla 372,6 (252,3-533,5) mikrogram/mL, 2,1 (0-29,3) mikrogram/mL ve 10.302 (3.653-21.874) mikrogram/mL/gün'dür. Bu hastalarda rituximabın farmakokinetik parametreleri romatoid artrit hastalarında gözlenene benzer görünmektedir.
Pediyatrik Popülasyon
Dört doz için haftada bir kez 375 mg/m rituximab alan GPA ve MPA'li 25 çocuğun (6-17 yaş) popülasyon farmakokinetik analizine göre, tahmini medyan terminal eliminasyon yarı ömrü 22 gündür (aralık, 11 ila 42 gün). Rituximab ortalama klerensi ve dağılım hacmi sırasıyla 0,221 L/gün (aralık, 0, 0996 ila 0,381 L/gün) ve 2,27 L'dir (1,43 ila 3,17 L aralığında). İlk 180 gün boyunca maksimum konsantrasyon (C), 180. günde minimum konsantrasyon (C180) ve 180 gün boyunca eğrinin altındaki kümülatif alan (EAA180) (medyan [aralık]) sırasıyla 382,8 (270,6-513,6) mikrogram/mL, 0,9 (0-17,7) mikrogram/mL ve 9.787 (4.838-20.446) μg/mL*gündür. GPA veya MPA'li pediyatrik hastalarda rituximabın PK parametreleri, bir zamanlar klirens ve dağılım parametrelerinin hacmi üzerindeki BSA etkisi hesaba katıldığında, GPA veya MPA'li yetişkinlerdekine benzerdir.
Pemfigus vulgaris
1. gün, 15. gün, 168. gün ve 182. günde 1.000 mg dozda rituximab alan yetişkin PV hastalarındaki farmakokinetik parametreleri Tablo 25'te özetlenmiştir.
Tablo 25: PV Çalışması 2'den elde edilen, yetişkin PV hastalarındaki popülasyon farmakokinetiği
Parametre | İnfüzyon Siklusu | |
| 1.000 mg'lık 1. siklus 1. gün ve 15. gün N=67 | 1.000 mg'lık 2. siklus 168. gün ve 182. gün N=67 |
Terminal yarılanma ömrü (gün) Medyan (Aralık) |
21 (9,3-36,2) |
26,5 (16,4-42,8) |
Klerens (L/gün) Ortalama (Range) |
391 (159-1.510) |
247 (128-454) |
Dağılımın Santral Hacmi (L) Ortalama (Aralık) |
3,52 (2,48-5,22) |
3,52 (2,48-5,22) |
İlk iki rituximab uygulamasını takiben (1. siklusa denk gelen 1. günde ve 15. günde) PV'li hastalarda rituximabın farmakokinetik parametreleri GPA/MPA ve romatoid artritli hastalarda görülenlere benzer olmuştur. Son iki uygulamanın ardından (2. siklusa denk gelen 168. günde ve 182. günde), rituximab klerensi azalırken, dağılımın santral hacmi değişmeden kalmıştır.
Biyotransformasyon Hodgkin-dışı lenfoma Veri bulunmamaktadır.
Kronik lenfositik lösemi Veri bulunmamaktadır. Romatoid artrit
Veri bulunmamaktadır.
Granülomatoz polianjitis (Wegener) (GPA) ve mikroskobik polianjitis (MPA) Veri bulunmamaktadır.
Pemfigus vulgaris
Veri bulunmamaktadır.
Dağılım
Hodgkin-dışı lenfoma
Tek ajan olarak ya da CHOP tedavisi ile kombinasyon halinde tek veya çok sayıda rituximab infüzyonu alan (uygulanan rituximab dozları 100 ila 500 mg/m arasında değişmiştir) 298 Hodgkin-dışı lenfoma hastasındayürütülenbir popülasyonfarmakokineği analizine dayanarak,
spesifik olmayan klerens (CL), muhtemelen B hücreleri veya tümör yükünün katkıda bulunduğu spesifik klerens (CL) ve santral kompartman dağılım hacmi (V) için tipik popülasyon tahminleri sırasıyla 0,14 L/gün, 0,59 L/ gün ve 2,7 L'dir.
Kronik lenfositik lösemi Veri bulunmamaktadır. Romatoid artrit
Popülasyon farmakokinetiği analizleri, vücut yüzey alanı ve cinsiyet farklılıklarının, farmakokinetik parametreler arasındaki bireyler arası farkı açıklayan en anlamlı ortak değişken olduğunu göstermiştir. Vücut yüzey alanı ayarlamasından sonra, erkeklerde kadınlara göre dağılım hacmi daha yüksek ve klerens daha hızlıdır. Cinsiyet kaynaklı farmakokinetik farklılıklar klinik olarak ilişkili bulunmamakta ve doz ayarlamasını gerektirmemektedir.
Granülomatoz polianjitis (Wegener) (GPA) ve mikroskobik polianjitis (MPA)
Rituximab ortalama klerensi ve dağılım hacmi sırasıyla 0,313 L/gün (aralık, 0,116 ila 0,726 L/gün) ve 4,50 L'dir (aralık, 2,25 ila 7,39 L). GPA ve MPA hastalarında rituximabın farmakokinetik parametreleri romatoid artrit hastalarında gözlemlenene benzer görünmektedir (bakınız yukarıdaki bölüm).
Pemfigus vulgaris
Dağılımın santral hacmi ortalama 3,52 L (2,48-5,22)'dir. İlk iki rituximab uygulamasını takiben (1. siklusa denk gelen 1. günde ve 15. günde) ve son iki uygulamanın ardından (2. siklusa denk gelen 168. günde ve 182. günde), rituximab dağılımının santral hacmi değişmeden kalmıştır.
Eliminasyon Hodgkin-dışı lenfoma
Rituximabın tahmin edilen medyan terminal eliminasyon yarılanma ömrü 22 gündür (6,1 ila 52 gün aralığında). Rituximabın, 4 haftalık dozlar halinde 375 mg/m i.v. infüzyon olarak verildiği 161 hastadan elde edilen verilerde CL'sindeki değişkenliğin bir kısmına başlangıç CD19- pozitif hücre sayısı ve ölçülebilir tümör lezyonlarının boyutu katkıda bulunmuştur. Daha yüksek CD19-pozitif hücre sayısı ya da tümör lezyonları olan hastaların daha yüksek CL'si olmuştur. Bununla birlikte, CD19-pozitif hücre sayısı ve tümör lezyonu boyutu için düzeltme yapıldıktan sonra, CLiçin bireyler arası değişkenliğin büyük kısmı aynen kalmıştır. V1, vücut yüzey alanı (BSA) ve CHOP tedavisi ile değişmiştir. Sırasıyla, BSA'daki aralık (1,53 ila 2,32 m) ve eşzamanlı CHOP tedavisinin katkıda bulunduğu V1'deki (%27,1 ve %19) bu değişkenlik, göreceli olarak küçüktür.
Pediyatrik DBBHL/BL/BAL/BLL
3 yaşından büyük pediyatrik hastalarda medyan eliminasyon yarılanma ömrü 26 gün olmuştur. Kronik lenfositik lösemi
Rituximab KLL hastalarında, fludarabin ve siklofosfamid ile kombinasyon halinde, i.v.
infüzyon olarak ilk kürde 375 mg/m, sonraki 5 kürün her birinde 500 mg/m'ye arttırılarak uygulanmıştır. Beşinci 500 mg/m'lik i.v. infüzyondan sonra ortalama terminal yarılanma ömrü 32 gündür (14 ila 62 gün aralığında).
Romatoid artrit
İki hafta aralıkla uygulanan iki 1.000 mg intravenöz rituximab infüzyonunu takiben, ortalama terminal yarılanma ömrü 20,8 gün (8,58 ila 35,9 gün aralığında), ortalama sistemik klerens 0,23 L/gün (0,091 ila 0,67 L/gün aralığında) olmuştur. Aynı verilerin popülasyon farmakokinetiği analizinde, sistemik klerens ve yarılanma ömrü, benzer ortalama değerler elde edilerek, sırasıyla 0,26 L/gün ve 20,4 gün bulunmuştur (bakınız yukarıdaki bölüm).
Popülasyon farmakokinetik analizlerinde, vücut yüzey alanı ayarlamasından sonra, erkeklerde kadınlara göre daha hızlı klerens görülmüştür. Bu durum doz ayarlamasını gerektirmemektedir.
Granülomatoz polianjitis (Wegener) (GPA) ve mikroskobik polianjitis (MPA)
Dört doz boyunca haftada bir kere 375 mg/m rituximab alan 97 GPA ve MPA hastasındaki verilerin popülasyon farmakokinetik analizine dayanılarak, tahmini medyan terminal eliminasyon yarı ömrü 23 gündür (9 ila 49 gün aralığında). Rituximab ortalama klerensi 0,313 L/gün (0,116 ila 0,726 L/gün aralığında) olarak bulunmuştur. GPA ve MPA hastalarında rituximabın farmakokinetik parametreleri romatoid artrit hastalarında gözlemlenene benzer görünmektedir (bakınız yukarıdaki bölüm).
Pemfigus vulgaris
İlk iki rituximab uygulamasını takiben (1. siklusa denk gelen 1. günde ve 15. günde) medyan terminal yarılanma ömrü 21 (9,3-36,2) gündür. Son iki uygulamanın ardından (2. siklusa denk gelen 168. günde ve 182. günde) medyan terminal yarılanma ömrü 26,5 (16,4-42,8) gündür. 1. siklusun ardından ortalama klerens 391 L/gün (159-1.510) olurken, 2. siklus ardından ortalama klerens azalarak 247 L/gün (128-454) olmuştur.
Doğrusallık/doğrusal olmayan durum
Dört çalışmada, iki hafta aralıklarla 1. gün ve 15. günde uygulanan 500 mg ve 1.000 mg dozlardaki iki intravenöz rituximab infüzyonunu takiben, rituximab farmakokinetiği araştırılmıştır. Bu çalışmaların hepsinde, rituximab farmakokinetiği araştırılan limitli doz aralığı için doz ile orantılı olmuştur.
Hastalardaki karakteristik özellikler
Böbrek veya karaciğer yetmezliği olan hastalara ait farmakokinetik veri bulunmamaktadır.
Rituximabın farmakokinetiği üzerine yaş, cinsiyet, ırk ve Dünya Sağlık Örgütü performans statüsünün herhangi bir etkisi olmamıştır. Bu analiz, test edilen eşdeğişken faktörlerin herhangi biriyle rituximabın doz ayarlamasının, farmakokinetik değişkenlikte anlamlı bir azalmayla sonuçlanmasının beklenmediğini belirtmektedir.
5.3. Klinik öncesi güvenlilik verileri
Rituximabın B hücrelerindeki CD20 antijenine yüksek düzeyde spesifik olduğu gösterilmiştir. Sinomolgus maymunlarında yapılan toksisite çalışmaları, periferik kanda ve lenfoid dokuda B hücrelerinin beklenen farmakolojik tüketiminden başka bir etki göstermemiştir.
100 mg/kg'a kadarki dozlarda (gestasyonun 20-50. günleri arasında tedavi) sinomolgus maymunları üzerinde gelişimsel toksisite çalışmaları yapılmış ve fetüs için rituximabdan kaynaklanan herhangi bir toksisite kanıtının olmadığı gösterilmiştir. Ancak fetüsün lenfoid organlarında B hücrelerinin doza bağlı farmakolojik tüketimi gözlenmiş olup bu doğumdan sonra da devam etmiş ve bunaetkilenenyenidoğanhayvanlarda IgG düzeylerinde bir azalma
da eşlik etmiştir. B hücre sayısı, bu hayvanlarda doğumu takip eden 6 ay içerisinde normale dönmüş ve immünizasyon reaksiyonunu riske atmamıştır.
Mutajeniteyi araştıran standart testler bu molekül için uygun olmadığından yapılmamıştır. Rituximabın karsinojenik potansiyelini belirlemek için uzun dönem hayvan çalışmaları yapılmamıştır.
Rituximabın fertilite üzerine etkilerini tespit etmek için spesifik çalışmalar yapılmamıştır. Sinomolgus maymunlarındaki genel toksisite çalışmalarında, erkek ya da dişilerin üreme organları üzerine zararlı hiçbir etki gözlenmemiştir.
Tri-sodyum sitrat dihidrat
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ GENEL BİLGİLERİ
CELLTRION Healthcare İlaç San. ve Tic. Ltd.Şti
| Satış Fiyatı | 21764.26 TL [ 5 Sep 2025 ] |
| Önceki Satış Fiyatı | 21764.26 TL [ 27 Aug 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680614140129 |
| Etkin Madde | Rituksimab |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |