TURKTIPSAN METAMIZOL SODYUM 1000 mg/2 ml IM/IV 10 ampül Farmakolojik Özellikler
{ Metamizol Sodyum }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Pirazolonlar ATC Kodu: N02BB02
Metamizol'ün analjezik, antipiretik ve antispazmodik özellikleri olan bir pirazolon türevidir. Metamizol büyük olasılıkla kombine bir santral ve periferik etki Ä¢ekline sahiptir. Afferent lifler, omur ilik ve periakuaduktal gri madde düzeyindeki santral etki mekanizmaları metamizolün analjezik etkisine katkıda bulunabilir.
Etki mekanizması tam olarak açık değildir. Bazı araÄ¢tırmaların sonuçları metamizol ve ana metabolitinin (4-N-metilaminoantipirin) kombine bir santral ve periferik etki modeline sahip olabileceğini göstermektedir.
5.2. Farmakokinetik özellikler
Metamizol ve metabolitlerinin farmakokinetiği tam olarak açık değildir. Fakat aÄ¢ağıdaki bilgiler verilebilir:
Emilim:
Oral uygulamadan sonra metamizol tamamen aktif metaboliti olan 4-N-metilaminoantipirine (MAA) hidrolize olur. MAA'nın mutlak biyoyararlanımı yaklaÄ¢ık olarak %90'dır ve oral uygulama sonrası intravenöz uygulamaya oranla biraz daha yüksektir. Metamizol besinlerle birlikte alındığında MAA'nın farmakokinetiği fark edilir bir değiÄ¢ikliğe uğramaz.
Biyotransformasyon:
Klinik etkiyi temel olarak MAA ve bir dereceye kadar da 4-aminoantipirin (AA) sağlar. AA'nın EAA değerleri MAA'nın EAA değerinin yaklaÄ¢ık %25'ini oluÄ¢turur. 4-N- asetilaminoantipirin (AAA) ve 4-N-formilaminoantipirin (FAA) gibi metabolitlerin klinik etkileri yok gibi görünmektedir. Tüm metabolitler için lineer olmayan bir farmakokinetik gözlenir. Bu bulgunun klinik önemi hakkında bir yargıya varılabilmesi için daha fazla çalıÄ¢maya ihtiyaç vardır. Kısa dönemli tedavide metabolitlerin birikiminin fazla bir klinik anlamı yoktur.
Metamizol plasenta bariyerini geçer.
Dağılım:
Proteine bağlanma düzeyleri MAA için %58, AA için %48, FAA için %18 ve AAA için
%14'dür. Bir intravenöz doz sonrası metamizolün plazma yarılanma ömrü yaklaÄ¢ık 14 dakikadır.
Eliminasyon:
Radyoaktif iÄ¢aretli intravenöz dozun yaklaÄ¢ık %96'sı idrar, yaklaÄ¢ık %6'sı ise feçes yoluyla atılır. Tek bir oral dozdan sonra metabolitlerin %85'i idrarla atılmıÄ¢ ve bunun %3 ± %1'i MAA, %6 ± %3'ü AA, %26 ± %8'i AAA ve %23 ± %4'ü FAA'dan oluÄ¢muÄ¢tur, 1 g'lık tek bir oral metamizol dozundan sonra renal klirens MAA için 5 mL ± 2 mL/dk., AA için 38 mL ± 13 mL/dk., AAA için 61 mL ± 8mL/dk., ve FAA için 49 mL ± 5 mL/dk. olmuÄ¢tur. Aynı dozdan sonraki plazma yarılanma ömürleri de MAA için 2.7 ± 0.5 saat, AA için 3.7 ± 1.3 saat, AAA için 9.5 ± 1.5 saat ve FAA için 11.2 ± 1.5 saat olmuÄ¢tur.
Metamizol metabolitleri anne sütüne geçerler.
Doğrusallık / doğrusal olmayan durum:
Tüm metabolitler için lineer olmayan bir farmakokinetik gözlenir. Bu bulgunun klinik önemi hakkında bir yargıya varılabilmesi için daha fazla çalıÄ¢maya ihtiyaç vardır.
Hastalardaki karakteristik özellikler
Geriatrik popülasyon:
YaÄ¢lılarda ilaca maruz kalma EAA2-3 kat artar. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Karaciğer yetmezliği:
Karaciğer sirozu olan hastalarda, tek dozluk oral uygulama sonrasında, MAA ve FAA'nın yarılanma ömrü 3 kat artmıÄ¢tır (10 saat), ancak AA ve AAA'daki artıÄ¢ bu kadar belirgin olmamıÄ¢tır. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Böbrek yetmezliği:
Böbrek fonksiyonu bozulmuÄ¢ olan hastalara ait mevcut veriler bazı metabolitler için (AAA ve FAA) eliminasyonun azaldığını göstermektedir. Bu hastalarda yüksek dozlardan kaçınılmalıdır.
Biyoyararlanım:
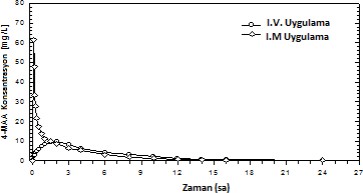
1987'de 12 gönüllü ile gerçekleÄ¢tirilen, film kaplı tabletlerin referans ürünle (2 dakikalık IV
uygulama) karÄ¢ılaÄ¢tırıldığı bir biyoyararlanım araÄ¢tırmasında, 4-MAA için aÄ¢ağıdaki sonuçlar gösterilmiÄ¢tir:
| i.m. uygulama (1 g) | i.v. uygulama (1 g) |
Doruk plazma konsantrasyonu (C) [mg/l] | 11.4 ± 3.12 | 62.1 ± 15.9 |
Doruk plazma konsantrasyonu (t) [s] | 1.67 ± 0.69 | 0.09 ± 0.02 |
Konsantrasyon-zaman eğri altı alan (EAA) [mg s/l] | 64.1 ± 14.8 | 67.8 ± 16.1 |
I.M. solüsyonunun 4-MAA plazma konsantrasyonu için EAA ile ölçülen mutlak biyoyararlanımı %87 olmuÄ¢tur.
Ä¡ekil 3: Konsantrasyon-zaman grafiğinde ortalama plazma eğrilerinin referans ürünle karÄ¢ılaÄ¢tırılması
5.3. Klinik öncesi güvenlilik verileri
Akut toksisite
Metamizol'ün fare ve sıçanlardaki en düÄ¢ük letal dozları: oral yolla yaklaÄ¢ık 4000 mg/kg vücut ağırlığı; intravenöz olarak yaklaÄ¢ık 2300 mg metamizol/kg vücut ağırlığı veya 400 mg MAA/kg vücut ağırlığıdır.
Ä ntoksikasyon belirtileri ise taÄ¢ipne, sedasyon ve premortal konvülziyonlar olmuÄ¢tur.
Kronik toksisite
Metamizolün, sıçanlarda günlük 150 mg/kg vücut ağırlığı dozlarda, köpeklerde ise günlük 50 mg/kg vücut ağırlığı dozlarda 4 hafta boyunca uygulanması tolere edilmiÄ¢tir.
Farklı hayvan türlerinde subkronik ve kronik toksisite çalıÄ¢maları gerçekleÄ¢tirilmiÄ¢tir.
Sıçanlarda 6 ay süreyle günlük 100-900 mg/kg vücut ağırlığı dozunda metamizol uygulanmıÄ¢tır. En yüksek dozda (900 mg/kg), 13. haftadan sonra retikülositlerde ve Heinz cisimciklerinde artıÄ¢ saptanmıÄ¢tır.
Köpeklerde 6 ay süreyle günlük 30-600 mg/kg vücut ağırlığı dozlarında metamizol uygulanmıÄ¢tır. Günde 300 mg/kg dozlarından itibaren, doza bağlı hemolitik anemi ve böbrek ve karaciğer iÄ¢levlerinde bozulma gözlenmiÄ¢tir.
Daha yüksek dozlar her iki cinste de serum kimyasında değiÄ¢ikliğe ve karaciğer ve dalakta hemosiderozise sebep olmuÄ¢; ayrıca kemik iliği toksisitesi ve anemi belirtileri saptanmıÄ¢tır.
In vitro ve in vivo deneyler, aynı test sistemlerinde metamizol için çeliÄ¢kili sonuçlar vermiÄ¢tir. Karsinojenite
Sıçanlarda yapılan uzun süreli çalıÄ¢malarda karsinojenik potansiyeli gösteren bir bulguya rastlanmamıÄ¢tır. Uzun süreli üç çalıÄ¢madan ikisinde, yüksek dozlarda karaciğer hücreli adenomlarda artıÄ¢ bildirilmiÄ¢tir.
Mutajenite
Literatürde hem pozitif hem de negatif sonuçlar tanımlanmıÄ¢tır. Ancak belirtilen Hoechst dereceli materyal ile yapılan in vitro ve in vivo çalıÄ¢malar mutajenik potansiyele iliÄ¢kin bir bulgu göstermemiÄ¢tir.
Üreme Toksisitesi
Sıçan ve tavÄ¢anlarda yapılan embriyotoksisite çalıÄ¢malarında teratojenik potansiyel gösterilmemiÄ¢tir.
TavÄ¢anlarda, maternal toksisite göstermeyen 100 mg/kg/gün dozunda letal etkiler bildirilmiÄ¢tir. Sıçanlarda fatal embriyotoksik etkiler, maternal toksisite gözlenen doz aralığında ortaya çıkmıÄ¢tır. Sıçanlarda 100 mg/kg/gün'ün üzerindeki dozlar, gestasyon süresinde uzama ve doğum sürecinde bozulmayla beraber, yavrularda mortalite artıÄ¢ına neden olmuÄ¢tur.
Fertilite testlerinde, 250 mg/kg/gün'ün üzerindeki dozlarda döl veren jenerasyonun gebelik oranında hafif bir azalma gösterilmiÄ¢tir. F1 jenerasyonun fertilitesi etkilenmemiÄ¢tir.
Metamizol metabolitleri anne sütüne geçmektedir. Emzirenlerdeki etkilerine dair bir bilgi mevcut değildir.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
İLAÇ GENEL BİLGİLERİ
Turktıpsan Sağlık Turizm Eğitim Ve Ticaret A.Ş
| Geri Ödeme Kodu | A16992 |
| Satış Fiyatı | 95.54 TL [ 5 Sep 2025 ] |
| Önceki Satış Fiyatı | 95.54 TL [ 27 Aug 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8697637750051 |
| Etkin Madde | Metamizol Sodyum |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında “artrit” tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |