UPTRAVI 200 mcg 140 film kaplı tablet Farmakolojik Özellikler
{ Selexsipag }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antitrombotik ajanlar, Heparin hariç trombosit agregasyon inhibitörleri ATC kodu: B01AC27
Etki mekanizması
Seleksipag prostasiklinden ve analoglarından farklı bir selektif IP reseptör agonistidir. Seleksipag, kendisinden yaklaşık 37 kat daha potent olan aktif metabolitinin elde edilmesi için karboksilesterazlar tarafından hidrolize edilir. Seleksipag ve aktif metaboliti, diğer prostanoid reseptörlerine (EP-EP, DP, FP ve TP) kıyasla IP reseptörüne yüksek seçicilik gösteren yüksek afiniteli IP reseptör agonistleridir . EP, EP, FP ve TP'ye karşı seçicilik önemlidir çünkü bunlar gastrointestinal kanalda ve kan damarlarında iyi tanımlanmış kontraktil reseptörlerdir. EP, EPve DP'e karşı seçicilik önemlidir çünkü bu reseptörler immün depresif etkilere aracılık etmektedir.
IP reseptörünün seleksipag ve aktif metaboliti ile stimülasyonu vazodilatör ve aynı zamanda anti-proliferatif ve anti-fibrotik etkilere yol açar. Seleksipag PAH'lı sıçanlarda kardiyak ve pulmoner yeniden şekillenmeyi engeller ve pulmoner ve periferik basınçlarda orantılı azalmalara neden olarak periferik vazodilatasyonun pulmoner farmakodinamik etkililiği yansıttığını gösterir. Seleksipag sıçan modelinde in vitro IP reseptör desensitizasyonuna ya da taşiflaksiye neden olmaz.
Farmakodinamik etkiler
Kardiyak elektrofizyolojisi
Sağlıklı gönüllülerle gerçekleştirilen kapsamlı bir QT çalışmasında günde iki defa 800 ve 1.600 mikrogram seleksipag tekrarlı dozları kardiyak repolarizasyon (QTaralığı) veya iletimi (PR ve QRS aralıkları) üzerinde etki göstermemiştir ve kalp atışında hafif bir hızlandırma etkisi göstermiştir (plaseboya göre düzeltilmiş, başlangıca göre uyarlanmış artış 800 mikrogram seleksipag dozlamasından sonra 1,5 - 3 saatte 6â7 vuru/dk'ya ve 1600 mikrogram seleksipag dozlamasından sonra aynı zaman noktalarında 9â10 vuru/dk'ya erişmiştir).
Koagülasyon faktörleri
Faz 1 ve 2 çalışmalarda von Willebrand faktörünün (vWF) plazma seviyesinde hafif bir azalma gözlenmiştir; vWF değerleri normal aralığın alt sınırının üstünde kalmıştır.
Pulmoner hemodinamikler
Faz 2 çift-kör, plasebo-kontrollü klinik çalışma, eş zamanlı olarak ERA ve / veya PDE-5 inhibitörleri alan PAH WHO FS IIâIII hastalarında 17 haftalık tedaviden sonra hemodinamik değişkenleri değerlendirmiştir. Seleksipagın bireysel olarak tolere edilebilen bir doza (günde iki defa 200 mikrogramlık artımlarla günde iki kere 800 mikrograma kadar; N = 33) titre edildiği hastalarda, plasebo ile karşılaştırıldığında (N = 10) pulmoner vasküler dirençte ortalama %30,3'lük istatistiksel olarak anlamlı bir azalma (%95 güven aralığı [CI]: -%44,7, -
%12,2; p = 0,0045) ve kardiyak indekste (ortalama tedavi etkisi) 0,48 L/dk./m2'lik bir artış (%95 CI: 0,13, 0,83) elde edilmiştir.
Klinik etkililik ve güvenlilik
PAH hastalarında etkililik
PAH'ın progresyonunda seleksipagın etkisi, 1156 semptomatik (WHO FS IâIV) PAH hastasıyla gerçekleştirilen çok merkezli, uzun süreli (maksimum maruz kalma süresi yaklaşık 4,2 yıl), çift-kör, plasebo-kontrollü, paralel grup, olay yönelimli Faz 3 çalışmasıyla (GRIPHON) gösterilmiştir Hastalar, günde iki defa plasebo (N = 582) ve seleksipag (n = 574) tedavisi için randomize edilmiştir. Doz, kişiselleştirilmiş idame dozunun belirlenmesi için (günde iki defa 200 - 1600 mikrogram) günde iki defa verilen 200 mikrogramlık artımlarla artırılmıştır.
Çalışmanın primer sonlanım noktası, tedavi sonuna kadar ilk mortalite veya morbidite olayına kadar geçen zamandır. Primer sonlanım noktası bileşik bir sonlanım olup, ölüm (tüm nedenlere bağlı); PAH için hastaneye yatış; akciğer transplantasyonu veya balon atriyal septostomi gerektiren PAH'ta progresyon; parenteral prostanoid tedavisi veya kronik oksijen tedavisine başlanması; veya diğer hastalık progresyonu (başlangıçta WHO FS II-III olan hastalarda 6 dakika yürüme mesafesinde (6DYM) başlangıca göre azalma (≥ %15) ve WHO FS'ta kötüleşme; başlangıçta WHO FS III-IV hastalarda 6DYM'de başlangıca göre azalma (≥ %15) ve ilave PAH-spesifik tedavi ihtiyacı) olarak tanımlanmıştır.
Tüm olaylar, tedavi randomizasyonuna körleştirilen, bağımsız bir komite tarafından doğrulanmıştır.
Ortalama yaş 48,1 olup (aralık: 18â80 yaş) gönüllülerin büyük kısmı beyaz ırk (%65) ve kadındır (%79,8). Hastaların %17,9'u ≥ 65 ve %1,1'i ≥75 yaşındadır. Hastaların yaklaşık %1,
%46, %53 ve %1'i sırasıyla başlangıçta WHO FS I, II, III ve IV'tedir.
Çalışma popülasyonundaki en yaygın etiyoloji idiyopatik veya kalıtsal PAH olup (%58), takip eden etiyolojiler bağ doku hastalıklarına bağlı PAH (%29), düzeltilmiş basit konjenital kalp hastalığı ile ilişkili PAH (%10) ve diğer etiyolojilerle ilişkili PAH'tır (ilaç ve toksinler [%2] ve HIV [%1]).
Başlangıçta, dahil edilen hastaların büyük kısmı (%80), ya ERA (%15) ya da PDE-5 inhibitörü (%32) ile monoterapi olarak veya hem ERA hem de PDE-5 inhibitörü (%33) ile kombinasyon halinde stabil dozda PAH spesifik tedavi almaktaydı.
Toplam medyan çift-kör tedavi süresi plasebo grubunda 63,7 hafta, seleksipag grubunda 70,7 haftadır. Seleksipag kullanan hastaların %23'ünde 200â400 mikrogram aralığında, %31'inde 600â1000 mikrogram aralığında ve %43'ünde 1.200â1.600 mikrogram aralığında idame dozu elde edilmiştir.
Günde iki kez 200â1600 mikrogram seleksipag ile tedavi plasebo ile karşılaştırıldığında, son dozun uygulanmasından sonraki 7 güne kadar morbidite veya mortalite olaylarında %40 oranında (nispi risk [HR] 0,60; %99 CI: 0,46, 0,78; log-sıra p değeri < 0,0001) azalma sağlamıştır (Şekil 1). Seleksipagın faydalı etkisi temelde PAH'a bağlı hastaneye yatış ve diğer nedenlere bağlı hastalık progresyonu olaylarında azalmaya atfedilebilir (Tablo 1).
Şekil 1 İlk morbidite-mortalite olayı Kaplan-Meier değerlendirmesi
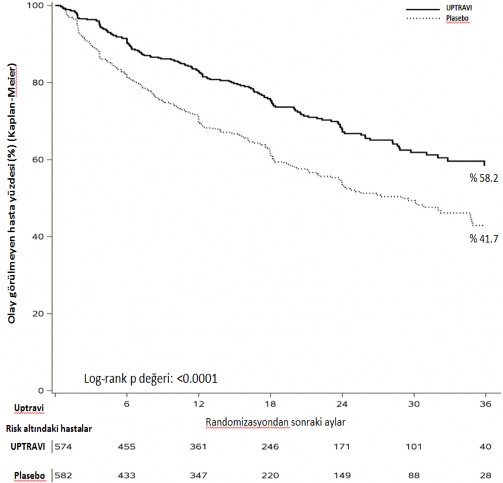
Tablo 1 Sonlanım noktası olaylarının özeti
Sonlanım noktası ve İstatistikler | Olay görülen hastalar | Tedavi karşılaştırması: seleksipag - plasebo | ||||
Plasebo (N=582) |
Seleksipag (N=574) | Mutlak risk azalması | Risk azalması (%99 GA) | HR (%99 GA) |
p değeri | |
Morbidite- mortalite olayı |
%58,3 |
%41,8 |
%16,5 | %40 (%22; %54) | 0,60 (0,46; 0,78) |
<0,0001 |
PAH'a bağlı hastaneye yatış n (%) | 109 (%18,7) | 78 (%13,6) |
%5,1 | %33 (%2; %54) | 0,67 (0,46; 0,98) |
0,04 |
Hastalık progresyonu n (%) | 100 (%17,2) | 38 (%6,6) |
%10.6 | %64 (%41; %78) | 0,36 (0,22; 0,59) |
< 0,0001 |
i.v./s.k. Prostanoid başlanması ya da oksijen tedavisi n (%) |
15 (%2,6) |
11 (%1,9) |
% 0,7 |
%32 (-%90; %76) |
0,68 (0,24; 1,90) |
0,53 |
Tedavi Sonu (TS) + 7 güne kadar ölüm n (%) |
37 (%6,4) |
46 (%8) |
-%1,7 | -%17 (- %107;%34) | 1,17 (0,66, 2,07) |
0,77 |
Çalışmanın kapanmasına kadar ölüm n (%) |
105 (%18) |
100 (%17,4) |
%0,6 | %3 (-%39; %32) | 0,97 (0,68; 1,39) |
0,42 |
GA = güven aralığı; TS = tedavi sonu; HR = nispi risk oranı; i.v. = intravenöz; PAH = pulmoner arteriyel hipertansiyon; s.k. = subkutan.
36 ayda olay yaşayan hasta %'si = 100 Ã (1 â Kaplan-Meier tahmini); tehlike oranı Cox orantılı tehlike modeli kullanılarak tahmin edilmiştir; tabakalandırılmamış tek taraflı log-sıra p değeri
5.2. Farmakokinetik özellikler
Genel özelliklerSeleksipag ve aktif metabolitinin farmakokinetiği ağırlıklı olarak sağlıklı gönüllülerde çalışılmıştır. Seleksipag ve aktif metabolitinin farmakokinetiği her ikisinde de tek ve çoklu doz uygulamasından sonra, 800 mikrogram tek doz ve günde iki kere 1.800 mikrogram çoklu doza kadar doz orantılıdır. Çoklu doz uygulamasından sonra seleksipag ve aktif metaboliti kararlı durum koşullarına 3 gün içinde ulaşmışlardır. Çoklu doz uygulamasından sonra ne ana bileşik ne de aktif metabolit plazmada birikmemiştir.
Sağlıklı gönüllülerde, kararlı durumdaki maruziyette (bir doz aralığında eğrinin altında kalan alan) denekler arası değişkenlik seleksipag ve aktif metabolit için sırasıyla %43 ve %39'dur. Maruziyette denekler arası değişkenlik seleksipag ve aktif metabolit için sırasıyla %24 ve
%19'dur.
PAH hastalarında ve sağlıklı deneklerde kararlı durumda seleksipag ve aktif metabolitine maruziyet benzerdir. Seleksipag ve aktif metabolitin PAH hastalarındaki farmakokinetik özellikleri hastalığın şiddetinden etkilenmemiştir ve zamanla değişmemiştir.
Emilim:
Seleksipag hızla absorbe edilir ve karboksilesterazlar tarafından aktif metabolitine hidrolize edilir.
Oral uygulamadan sonra seleksipag ve aktif metabolitinin maksimum gözlenen plazma konsantrasyonlarına sırasıyla 1â3 saat ve 3â4 saat içinde ulaşılır.
İnsanlarda seleksipagın mutlak biyoyararlanımı yaklaşık %49'dur. Bunun sebebi büyük ihtimalle seleksipagın ilk geçiş etkisidir. Çünkü aktif metabolitin plazma konsantrasyonları
oral ve intravenöz doz uygulamasından sonra benzerdir. Gıda varlığında, tek bir 400 mikrogram dozundan sonra seleksipaga maruziyet beyaz ırk deneklerinde %10 artarken, Japon deneklerde %15 azalmıştır; bu sırada aktif metabolite maruziyet beyaz ırkta %27 ve Japon deneklerde %12 azalmıştır. Tok uygulamaya göre aç uygulamadan sonra daha fazla gönüllü advers olay bildirmiştir.
Dağılım:
Seleksipag ve aktif metaboliti yüksek oranda plazma proteinlerine bağlanır (toplamda yaklaşık
%99 ve belli bir oranda albümine ve alfa1-asit glikoproteine). Kararlı halde seleksipag dağılım hacmi 11,7 L'dir.
Biyotransformasyon:
Seleksipag, karboksilesterazlar tarafından karaciğerde ve bağırsakta aktif metabolitine hidroliz edilir. Ağırlıklı olarak CYP2C8 ve daha az oranda CTP3A4 tarafından katalize edilen oksidatif metabolizma hidroksilatlanmış ve dealkile ürünlerin oluşumuna yol açar. UGT1A3 ve UGT2B7 aktif metabolitin glukuronidasyonuna katılır. Aktif metabolit haricinde insan plazmasında dolaşan metabolitlerden hiçbiri toplam ilaçla ilgili materyalin %3'ünü geçmez. Hem sağlıklı deneklerde hem de PAH hastalarında, oral uygulamadan sonra, kararlı durumda aktif metabolite maruziyet ana bileşikten yaklaşık 3 - 4 kat daha yüksektir.
Eliminasyon:
Seleksipagın eliminasyonu esas olarak metabolizma yoluyladır ve 0,8â2,5 saatlik bir ortalama terminal yarı ömre sahiptir. Aktif metabolitin yarılanma ömrü 6,2â13,5 saattir. Seleksipagın toplam vücut klirensi 17,9 L/saat'tir. Sağlıklı deneklerde atılım uygulamadan 5 gün sonra tamamlanmıştır ve esas olarak dışkıyla (uygulanan dozun %93'üne karşılık gelir) atılırken idrarla atılan miktar %12'sidir.
Özel popülasyonlar:
Sağlıklı gönüllülerde veya PAH hastalarında seleksipag ve aktif metabolitinin farmakokinetik özellikleri üzerinde cinsiyet, ırk, yaş veya vücut ağırlığının klinik olarak anlamlı etkisi gözlenmemiştir.
Böbrek yetmezliği
Ciddi böbrek yetmezliği olan deneklerde (eGFR < 30 mL/dk./1,73 m2) seleksipag ve aktif metabolitine maruziyette 1,4-1,7 kat artış (maksimum plazma konsantrasyonu ve plazma konsantrasyonu-zaman eğrisi altındaki alan) gözlenmiştir.
Karaciğer yetmezliği
Hafif (Child-Pugh A Sınıfı) veya orta derecede (Child-Pugh B Sınıfı) karaciğer yetmezliği olan gönüllülerde seleksipaga maruziyet, sağlıklı deneklerle karşılaştırıldığında sırasıyla 2 ve 4 kat yüksektir. Aktif metabolite maruziyet hafif karaciğer yetmezliği olan deneklerde neredeyse değişmeden kalmış ve orta derecede karaciğer yetmezliği olan deneklerde iki katına çıkmıştır. Şiddetli karaciğer yetmezliği olan sadece iki deneğe (Child-Pugh C Sınıfı) seleksipag verilmiştir. Bu iki denekte seleksipag ve aktif metabolitine maruziyet orta şiddette karaciğer
yetmezliği olan deneklerle (Child-Pugh B Sınıfı) benzerdir.
Karaciğer yetmezliği olan deneklerle yapılan bir çalışmadan elde edilen simülasyon verilerine ve modellemeye dayanarak, orta derecede karaciğer yetmezliği olan deneklerde (Child-Pugh B Sınıfı) kararlı halde günde tek doz uygulamasından sonra seleksipaga maruziyetin, günde iki doz uygulaması sırasında sağlıklı deneklerde gözlenene göre yaklaşık 2 kat yüksek olacağı öngörülmüştür. Bu hastalarda günde bir doz uygulaması sırasında kararlı halde maruziyetin, günde iki doz uygulaması sırasında sağlıklı deneklerde gözlenene benzer olacağı öngörülmüştür. Şiddetli karaciğer yetmezliği olan gönüllüler (Child-Pugh C Sınıfı), günde bir doz uygulaması sırasında orta derecede karaciğer yetmezliği olan denekler gibi kararlı halde benzer öngörülen maruziyet göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Kemirgenlerde tekrarlı doz toksisitesi çalışmalarında aşırı farmakolojinin bir sonucu olarak geçici güçlü kan basıncı düşüşü klinik belirtileri ve azalan yiyecek tüketimini ve kilo artışını indüklemiştir. Yetişkin ve yavru köpeklerde, bağırsak ve kemik /kemik iliği seleksipag ile tedaviden sonra ana hedef organları olarak tanımlanmıştır. Femoral ve / veya tibial epifiz büyüme plağının kapanmasında bir gecikme yavru köpeklerde gözlenmiştir. Gözlenmeyen advers etki düzeyi belirlenmemiştir. Yavru köpeklerde intestinal motilite üzerinde prostasikline bağlı etkiler nedeniyle intususepsiyon düzensiz bir şekilde gözlenmiştir. Aktif metabolitin IP reseptör potensine uygulanan güvenlilik sınırı insan terapötik maruziyeti karşısında 2 kattır (toplam maruziyete dayanarak). Bu bulgu fare veya sıçan toksisite çalışmalarında meydana gelmemiştir. Köpeklerin intususepsiyon geliştirmesinde türe özgü hassasiyeti nedeniyle, bu bulgu erişkin insanlarla ilişkili kabul edilmemektedir.
Köpeklerle yapılan çalışmalarda artan kemik osifikasyonu ve kemik iliğinde ilgili değişikliklerin köpeklerde EPreseptörlerinin aktivasyonu nedeniyle olduğu kabul edilmiştir. İnsan EPreseptörlerini seleksipag veya aktif metaboliti aktive etmez, bu etki türe özeldir ve dolayısıyla insanlarla ilişkili değildir.
Seleksipag ve aktif metaboliti, yürütülen genotoksisite çalışmalarından elde edilen tüm kanıtlara dayanarak genotoksik değildir.
2 yıllık karsinojenisite çalışmalarında, seleksipag farelerde tiroid adenomuna ve sıçanlarda Leydig hücre adenomun artan insidansına neden olmuştur. Mekanizma kemirgenlere özeldir. Retinal arteriyollerin kıvrımlanması (tortözite) sadece sıçanlarda 2 yıllık tedaviden sonra bildirilmiştir. Mekanistik olarak etkinin ve oküler hemodinamikte takip eden değişikliklerin yaşam boyu vazodilatasyonla indüklendiği kabul edilmektedir. Seleksipagın ek histopatolojik bulguları, yalnızca maksimum insan maruziyet düzeyinin aşılması bakımından yeterli olarak kabul edilen maruziyet durumlarında gözlenmiştir ve insanlarla az ilişkili olduğunu göstermektedir.
Sıçanlarda yapılan bir fertilite çalışmasında kopülasyona kadar geçen gün sayısında artışla sonuçlanan östrüs döngüsünün uzaması, terapötik maruziyetin (toplam maruziyete dayanarak) 173 kat üstündeki maruziyetlerde gözlenmiştir, gözlenmeyen advers etki düzeyi terapötik maruziyetin 30 kat üstündedir. Aksi takdirde, fertilite parametreleri etkilenmemiştir. Seleksipag sıçan ve tavşanlarda teratojenik değildir (toplam maruziyete dayanarak, seleksipag için terapötik maruziyetin 13 kat üstünde ve aktif metabolit için 43 kat üstünde maruziyet payları). Üreme üzerine potansiyel IP reseptör ilişkili etkiler için güvenlilik sınırı, reseptör
potenslerindeki farklılıklar uyarlandığı zaman, doğurganlık için 20, embriyo-fetal gelişim için sıçanlarda ve tavşanlarda sırasıyla 5 ve 1 idi. Sıçan doğum öncesi/sonrası geliştirme çalışmasında seleksipag annelik ve yavru üreme fonksiyonu üzerinde hiçbir etki indüklememiştir.
 Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir.
Rahim Boyu ( Serviks ) Kanseri
Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden
sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Satış Fiyatı | 167565.16 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 167565.16 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699593095573 |
| Etkin Madde | Selexsipag |
| ATC Kodu | B01AC27 |
| Birim Miktar | 200 |
| Birim Cinsi | MCG |
| Ambalaj Miktarı | 140 |
| Kan ve Kan Yapıcı Organlar > Antitrombotik İlaçlar |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |