VALAMOR 200 mg film kaplı tablet (63 tablet) Kısa Ürün Bilgisi
{ Ribosiklib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
VALAMOR 200 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Ribosiklib süksinat 254,4 mg
(200 mg ribosiklibe karşılık gelmektedir)
Yardımcı maddeler
Soya lesitin 0,344 mg
Yardımcı maddelerin tam listesi için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet
Açık grimsi mor, çentiksiz, yuvarlak, eğimli kenarlı, bir tarafında âRICâ ve diğer tarafında âNVRâ işlemeli.
Eğer QTcF ≥481 milisaniye tekrar görülürse, QTcF <481 milisaniyeye düzelene kadar ara verilir ve sonra VALAMOR'a bir sonraki düşük doz düzeyinden devam edilir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
VALAMOR, letrozol ile kombine tedavilerde, en az %10 östrojen reseptörü pozitif ve insan epidermal büyüme faktörü reseptörü 2 (HER2) negatif postmenopozal metastatik meme kanseri olan, adjuvan tedavinin tamamlanmasından 12 ay sonra relaps yapmış ya da ileri evre meme kanseri için daha önce hiçbir endokrin tedavi almamış hastalarda endikedir.
VALAMOR, fulvestrant ile kombine tedavilerde, en az %10 östrojen reseptörü pozitif ve insan epidermal büyüme faktörü reseptörü 2 (HER) negatif postmenopozal metastatik meme kanseri olan, daha önce fulvestrant ile tedavi edilmemiş hastalarda endikedir,
Metastatik hastalığın tedavisi için en az 6 ay boyunca ve en az bir basamak aromataz inhibitörü aldıktan sonra klinik ve/veya radyolojik hastalık progresyonu varlığında fulvestrant ile kombinasyon halinde;
4.2. Pozoloji ve uygulama şekli
VALAMOR ile tedavi, anti-kanser tedavilerin kullanımında deneyimli bir hekim tarafından başlatılmalıdır.
Pozoloji:
VALAMOR'un önerilen dozu, 28 günlük bir siklusu tamamlayacak şekilde arka arkaya 21 gün süreyle günde bir kez oral yoldan alınan 600 mg (üç adet 200 mg film kaplı tablet) ve bunu izleyen tedavisiz 7 gün şeklindedir. Tedavi, hasta tedaviden klinik fayda gördüğü sürece veya kabul edilemez toksisite meydana gelene kadar sürdürülmelidir.
VALAMOR, 2,5 mg letrozol ya da 500 mg fulvestrant ile birlikte kullanılmalıdır. VALAMOR letrozol ile birlikte kullanıldığında letrozol, 28 günlük siklus boyunca günde bir
kez alınmalıdır. Lütfen ilave bilgiler için letrozolün Kısa Ürün Bilgisine başvurunuz.
VALAMOR fulvestrant ile birlikte kullanıldığında fulvestrant, intramüsküler olarak 1., 15. ve
29. günlerde ve daha sonra ayda bir kere uygulanır. Lütfen ilave bilgiler için fulvestrantın Kısa Ürün Bilgisine başvurunuz.
VALAMOR aç veya tok karnına alınabilir (bkz. bölüm 4.5). Hastalar dozlarını her gün yaklaşık olarak aynı saatte, tercihen sabah saatlerinde almaya teşvik edilmelidir. Hasta dozu aldıktan sonra kusarsa veya bir dozu atlarsa, o gün ilave bir doz alınmamalıdır. Bir sonraki reçete edilmiş doz normal zamanında alınmalıdır.
Doz modifikasyonları
Ağır veya tolere edilemeyen advers ilaç reaksiyonlarının kontrol edilebilmesi için dozlara geçici olarak ara vermek, dozu azaltmak veya VALAMOR tedavisini kesmek gerekebilir. Dozda azaltma gerekiyorsa önerilen doz azaltımı kılavuzları Tablo 1'de verilmektedir.
Tablo 1 Önerilen doz modifikasyonu kılavuzları
| VALAMOR |
|
Doz | 200 mg'lık tablet sayısı | |
Başlangıç dozu İlk doz azaltımı İkinci doz azaltımı | 600 mg/gün 400 mg/gün 200 mg*/gün | 3 2 1 |
* Eğer 200 mg/günün de altında doz azaltımı gerekiyorsa tedavi bir daha başlanmamak üzere kesilmelidir. | ||
Tablo 2, 3, 4 ve 5'te belirli advers ilaç reaksiyonlarının kontrolü için dozlara ara verme, doz
azaltma ve tedavinin kesilmesi ile ilgili öneriler özetlenmektedir. Her hastanın tedavi planına, hasta bazında yapılan fayda/risk değerlendirmesine dayalı olarak tedaviden sorumlu hekimin klinik değerlendirmesi yön vermelidir (bkz. bölüm 4.4).
VALAMOR ile tedaviye başlanmadan önce tam kan sayımı yapılmalıdır. VALAMOR ile tedaviye başlandıktan sonra tam kan sayımı izlemi ilk 2 siklus süresince iki haftada bir, sonraki her 4 siklusun başında ve sonrasında klinik durum gerektirdikçe yapılmalıdır.
Tablo 2 Doz modifikasyonu ve yönetimi â Nötropeni
| Derece 1 veya 2* (MNS 1000/mm - ≤NAS) | Derece 3* (MNS 500 - <1000/mm) | Derece 3* febril nötropeni ** | Derece 4* (MNS <500/mm) |
Nötropeni | Herhangi bir doz ayarlaması gerekmez | Derece ≤2'ye düzelme olana kadar dozlara ara verilir.
VALAMOR'a aynı doz düzeyinden devam edilir.
Eğer toksisite 3. derecede tekrar görülürse: Derece ≤2'ye düzelme olana kadar dozlara ara verilir, ardından VALAMOR'a devam edilir ve doz 1 seviye düşürülür. | Derece ≤2'ye düzelme olana kadar dozlara ara verilir.
VALAMOR'a devam edilir ve doz 1 seviye düşürülür. | Derece ≤2'ye düzelme olana kadar dozlara ara verilir.
VALAMOR'a devam edilir ve doz 1 seviye düşürülür. |
* Derecelendirme AOOTK Versiyon 4.03'e göredir (AOOTK= Advers Olaylar için Ortak Terminoloji Kriteri). ** >38,3°C'lik tek bir ateşle derece 3 nötropeni (ya da bir saatten fazla >38°C ve/veya eş zamanlı enfeksiyon) MNS: Mutlak nötrofil sayısı, NAS: Normalin alt sınırı | ||||
VALAMOR ile tedaviye başlanmadan karaciğer fonksiyon testleri yapılmalıdır. VALAMOR ile tedaviye başlandıktan sonra karaciğer fonksiyon testleri izlemi ilk 2 döngü süresince iki haftada bir, sonraki her 4 siklusun başında ve sonrasında klinik durum gerektirdikçe yapılmalıdır. Eğer derece ≥2 anomaliler görülürse daha sık izlem yapılması önerilir.
Tablo 3 Doz modifikasyonu ve yönetimi â Hepatobiliyer toksisite
| Derece 1* (>NÜS â 3 x NÜS) | Derece 2* (>3 ila 5 x NÜS) | Derece 3* (>5 ila 20 x NÜS) | Derece 4* (>20 x NÜS) |
2 x NÜS | Herhangi | Başlangıç derece < 2: | Başlangıçtaki | VALAMOR |
üzerinde total bilirubin artışının eşlik etmediği başlangıca göre AST ve/veya ALT yükselmeleri**, | bir doz ayarlaması gerekmez | başlangıçtaki dereceye eşit veya bu derece altına düşüş olana kadar dozlara ara verilir, ardından VALAMOR'a aynı doz düzeyinden devam edilir. Eğer derecede 2 tekrar görülürse, VALAMOR'a bir sonraki düşük doz düzeyinden devam edilir. | dereceye eşit veya bu derece altına düşüş olana kadar VALAMOR dozuna ara verilir, ardından bir sonraki düşük doz düzeyinden devam edilir. Eğer derecede 3 tekrar görülürse, VALAMOR tedavisi kesilir. | tedavisi kesilir. |
Başlangıç derece 2: Dozlara herhangi bir ara verilmez. | ||||
Kolestaz yokluğunda AST ve/veya ALT'ta total bilirubin artışının eşlik ettiği kombine yükselmeler | Eğer hastalar başlangıçtaki derece fark etmeksizin total bilirubin >2x NÜS ile birlikte ALT ve/veya AST > 3x NÜS geliştirirse, VALAMOR tedavisi kesilir. | |||
* Derecelendirme AOOTK Versiyon 4.03'e göredir (AOOTK= Advers Olaylar için Ortak Terminoloji Kriteri) ** Başlangıç = tedavi başlangıcı öncesinde NÜS=Normalin üst sınırı | ||||
Tedaviye başlanmadan önce EKG değerlendirmesi yapılmalıdır. VALAMOR ile tedaviye başlandıktan sonra EKG, ilk siklusun yaklaşık 14. gününde ve ikinci siklusun başında, sonrasında klinik durum gerektirdikçe tekrarlanmalıdır. Tedavi sırasında QTcF uzaması olursa daha sık EKG izlemi önerilir.
Tablo 4 Doz modifikasyonu ve yönetimi â QT uzaması
QTcF >480 milisaniye gösteren EKG'ler | |
QTcF >500 milisaniye gösteren EKG'ler | Eğer QTcF değeri EKG'de >500 milisaniye ise, QTcF <481 milisaniye olana kadar VALAMOR'a ara verilir, ardından VALAMOR'a bir sonraki düşük doz düzeyinden devam edilir. |
Doz kesilmelidir.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Kritik visseral hastalık
Ribosiklibin etkililiği ve güvenliliği kritik visseral hastalığı olan hastalarda araştırılmamıştır. Nötropeni
Nötropeninin şiddetine bağlı olarak Tablo 2'de tarif edildiği gibi VALAMOR ile tedaviye ara
verilmesi, dozun azaltılması veya tedavinin kesilmesi gerekebilir (bkz. Bölüm 4.2 ve 4.8). Hepatobiliyer toksisite
VALAMOR ile tedaviye başlanmadan karaciğer fonksiyon testleri yapılmalıdır. VALAMOR ile tedaviye başlandıktan sonra karaciğer fonksiyon testleri izlenmelidir (bkz. Bölüm 4.2 ve 4.8).
Transaminaz yükselmelerinin şiddetine bağlı olarak Tablo 3'te tarif edildiği gibi VALAMOR ile tedaviye ara verilmesi, dozun azaltılması veya tedavinin kesilmesi gerekebilir (bkz. Bölüm 4.2 ve 4.8). Başlangıçta AST/ALT derece ≥ 3 yükselmeleri olan hastalar için öneriler belirlenmemiştir.
QT aralığında uzama
Çalışma E2301'de (MONALEESA-7) ribosiklib artı tamoksifen alan hastaların 14/87'sinde (%16,1) ve ribosiklib artı bir nonsteroidal aromataz inhibitörü (NSAI) alan hastaların 18/245'inde (%7,3), çalışma başlangıcına kıyasla > 60 milisaniyelik bir QTcF aralığı artışı gözlenmiştir. VALAMOR'un tamoksifen ile kombinasyon halinde kullanımı önerilmemektedir (bkz. bölüm 4.8 ve 5.1).
Tedaviye başlanmadan önce EKG değerlendirmesi yapılmalıdır. VALAMOR ile tedavi sadece QTcF değerleri <450 milisaniye olan hastalarda başlatılmalıdır. EKG, ilk siklusun yaklaşık 14. gününde ve ikinci siklusun başında, sonrasında klinik durum gerektirdikçe tekrarlanmalıdır (bkz. Bölüm 4.2 ve 4.8).
Tedaviye başlanmadan önce, ilk altı siklusun başında ve sonrasında klinik durum gerektirdikçe serum elektrolitlerinin (potasyum, kalsiyum, fosfor ve magnezyum dahil) izlemi yapılmalıdır. Anormallik varsa VALAMOR ile tedaviye başlanmadan önce ve VALAMOR ile tedavi sırasında düzeltilmelidir.
Halihazırda QTc uzaması olan ya da QTc uzaması açısından önemli riske sahip hastalarda VALAMOR kullanımından kaçınılmalıdır. Bu hastalar:
Uzun QT sendromu olan hastalar.
Yakın zamanda geçirilmiş miyokard enfarktüsü, konjestif kalp yetmezliği, stabil olmayan anjina ve bradiaritmiler dahil kontrol edilmemiş veya önemli kalp hastalığı olan hastalar.
Elektrolit anormallikleri olan hastalardır.
QTcF aralığında klinik olarak anlamlı uzamaya yol açabileceğinden VALAMOR'un QTc aralığını uzattığı bilinen ilaçlar ve/veya güçlü CYP3A4 inhibitörleri ile birlikte kullanımından kaçınılmalıdır (bkz. Bölüm 4.2, 4.5 ve 5.1). Güçlü bir CYP3A4 inhibitörü ile tedavinden kaçınılamazsa, doz günde bir kez 400 mg'a düşürülmelidir (bkz. Bölüm 4.2 ve 4.5).
Tedavi sırasında gözlenen QT uzamasına bağlı olarak Tablo 4'te tarif edildiği gibi VALAMOR ile tedaviye ara verilmesi, dozun azaltılması veya tedavinin kesilmesi gerekebilir (bkz. Bölüm 4.2, 4.8 ve 5.2).
Şiddetli kutanöz reaksiyonlar
VALAMOR tedavisi ile toksik epidermal nekroliz (TEN) bildirilmiştir. Şiddetli kutanöz reaksiyonları düşündüren işaret ve semptomlar (örn., sıklıkla kabarcıklar veya mukozal
lezyonlar ile birlikte progresif geniş çaplı deri döküntüsü) ortaya çıkarsa, VALAMOR acilen bırakılmalıdır.
İnterstisyel Akciğer Hastalığı/Pnömonit
VALAMOR ve diğer siklin-bağımlı kinaz 4/6 (CDK4/6) inhibitörleriyle tedavi edilen hastalarda şiddetli, yaşamı tehdit eden veya ölümcül interstisiyel akciğer hastalığı (İAH) ve/veya pnömonit oluşabilir.
Üç Faz-III klinik çalışmada (MONALEESA-2, MONALEESA-3, MONALEESA-7) ribosiklib tedavisi alan hastaların %1,1'inde herhangi bir dereceden İAH/pnömonit, %0,3'ünde Derece 3 ya da Derece 4, %0,1'inde ölüm rapor edilmiştir.
Ruhsatlandırma sonrasında ek İAH/Pnömonit olgularına rastlanmış olup, ölümlü vakalar bildirilmiştir. (bkz. Bölüm 4.8)
Hastalar, İAH/Pnömonit düşündüren akciğer semptomları (örn., hipoksi, öksürük, dispne) açısından takip edilmelidir. İAH/Pnömonit kuşkusu yaratacak yeni veya kötüleşen solunum semptomları olan hastalarda hemen VALAMOR kullanımı durdurularak hasta değerlendirmeye tabi tutulmalıdır. Tekrarlayan semptomatik veya şiddetli İAH veya pnömonit gözlenen hastalarda VALAMOR kullanımı kalıcı olarak bırakılmalıdır. (bkz. Bölüm 4.2)
Kan kreatinin yükselmesi
Ribosiklib, proksimal tübüllerden kreatinin aktif salgılanmasında rol oynayan renal taşıyıcılar organik katyon taşıyıcı 2 (OCT2) ve çoklu ilaç ve toksin ekstrüzyon proteini 1'in (MATE1) bir inhibitörü olarak kan kreatinin artışına neden olabilir (bkz. Böküm 4.5). Tedavi sırasında kan kreatinin artışı durumunda, böbrek yetmezliğini dışlamak için böbrek fonksiyonunun daha fazla değerlendirilmesi önerilir.
CYP3A4 substratları
Ribosiklib 600 mg dozda güçlü bir CYP3A4 inhibitörü ve 400 mg dozda orta güçte bir CYP3A4 inhibitörüdür. Bu nedenle, ribosiklib CYP3A4 ile metabolize edilen tıbbi ürünlerle etkileşime girebilir ki bu da CYP3A4 substratlarının serum konsantrasyonlarında artışa yol açabilir (bkz. bölüm 4.5). Dar terapötik indekse sahip duyarlı CYP3A4 substratları ile eş zamanlı kullanım durumunda dikkat önerilmektedir ve CYP3A4 inhibitörleri ile birlikte uygulamaya ilişkin öneriler için diğer ürünün KÜB'üne danışılmalıdır.
Böbrek yetmezliği
Şiddetli böbrek yetmezliği olan hastalar için önerilen 200 mg'lık başlangıç dozunun, normal böbrek fonksiyonu olan hastalardaki standart başlangıç dozuna kıyasla yaklaşık %45 daha düşük maruziyet ile sonuçlandığı tahmin edilmektedir. Bu başlangıç dozundaki etkinlik araştırılmamıştır. Şiddetli böbrek yetmezliği olan hastalarda, toksisite belirtileri açısından yakından izlenen hastalarda dikkatli olunmalıdır (bkz. Bölüm 4.2 ve 5.2).
Çocuk doğurma potansiyeli olan kadınlar
Çocuk doğurma potansiyeli olan kadınların, VALAMOR'u kullanırken ve son dozdan en az 21 gün sonrasına kadar etkili bir doğum kontrol yöntemi kullanmaları önerilmelidir (bkz. Bölüm 4.6).
Soya lesitini
VALAMOR soya lesitini içerir. Yer fıstığına veya soyaya aşırı duyarlılığı olan hastalar VALAMOR almamalıdır (bkz. bölüm 4.3).
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Ribosiklibin plazma konsantrasyonlarını yükseltebilen maddeler
Ribosiklib başlıca CYP3A4 ile metabolize olur. Dolayısıyla, CYP3A4 enzimi aktivitesini etkileyebilen tıbbi ürünler, ribosiklibin farmakokinetiğini etkileyebilir. Güçlü CYP3A4 inhibitörü ritonavirin (14 gün boyunca günde iki kez 100 mg) 400 mg'lık tekli ribosiklib dozu ile birlikte uygulanması sağlıklı gönüllülerde ribosiklib maruziyetini (EAA) ve pik konsantrasyonunu (C) tek başına verildiğinde 400 mg'lık tekli ribosiklib dozuna kıyasla sırasıyla 3,2 ve 1,7 kat artırmıştır. LEQ803 (ana maruziyetin %10'undan azını oluşturan baskın ribosiklib metaboliti) için Cve EAAsırasıyla %96 ve %98 azalmıştır.
Bunlarla sınırlı olmamak üzere klaritromisin, indinavir, itrakonazol, ketokonazol, lopinavir, ritonavir, nefazodon, nelfinavir, posakonazol, sakuinavir, telaprevir, telitromisin verapamil ve vorikonazol dahil güçlü CYP3A4 inhibitörlerinin eş zamanlı kullanımından kaçınılmalıdır (bkz. Bölüm 4.4). CYP3A4'yı inhibe etme potansiyeli daha düşük alternatif eş zamanlı tıbbi ürünler göz önünde bulundurulmalı ve hastalar ribosiklib ile ilişkili advers olaylar açısından izlenmelidir (bkz. Bölüm 4.2, 4.4 ve 5.2).
Eğer VALAMOR'un güçlü bir CYP3A4 inhibitörü ile bir arada kullanımından kaçınılamıyorsa, VALAMOR'un dozu bölüm 4.2'de tanımlandığı şekilde azaltılmalıdır. Öte yandan, bu doz ayarlaması ile ilgili klinik veri bulunmamaktadır. Hastalar arasındaki değişkenlik nedeniyle önerilen doz ayarlamaları tüm hastalarda optimal olmayabilir ve bu nedenle ribosiklib ile ilişkili advers olaylar için yakın izlem önerilir. VALAMOR ile ilişkili toksisite görülmesi durumunda doz modifiye edilmeli veya toksisite düzelene kadar tedaviye ara verilmelidir (bkz. Bölüm 4.2 ve 5.2). Güçlü CYP3A4 inhibitörü bırakılırsa CYP3A4 inhibitörünün en az 5 yarılanma ömründen sonra (söz konusu CYP3A4 inhibitörünün KÜB'ünü inceleyiniz), VALAMOR, güçlü CYP3A4 inhibitörünün başlatılmasından önce kullanılanla aynı dozda yeniden başlatılmalıdır.
Fizyoloji temelli farmakokinetik simülasyonları, 600 mg'lık ribosiklib dozunda orta güçte bir CYP3A4 inhibitörünün (eritromisin) ribosiklib kararlı durum Cve EAA değerini sırasıyla 1,2 kat ve 1,3 kat artırabileceğini düşündürmüştür. Ribosiklib dozları günde bir kez 400 mg'a azaltılmış hastalar için kararlı durum Cve EAA değerindeki artışın sırasıyla tahminen 1,4 ve 2,1 kat olduğu hesaplanmıştır. 200 mg'lık günlük dozdaki etkinin sırasıyla 1,7 ve 2,8 kat olacağı öngörülmüştür. Hafif veya orta şiddette CYP3A4 inhibitörleri ile tedavinin başlatılmasında ribosiklib dozunda ayarlama gerekli değildir. Bununla birlikte, ribosiklib ile ilişkili advers olayların izlenmesi önerilmektedir.
Hastalara greyfurt veya greyfurt suyundan uzak durmaları söylenmelidir. Bunların sitokrom CYP3A4 enzimlerini inhibe ettiği bilinmektedir ve ribosiklibe maruziyeti artırabilirler.
Ribosiklibin plazma konsantrasyonlarını düşürebilen maddeler
Güçlü CYP3A4 indükleyici rifampisinin (14 gün boyunca günde 600 mg) 600 mg'lık tekli ribosiklib dozu ile birlikte uygulanması ribosiklib EAAve Cdeğerlerini sağlıklı gönüllülerde tek başına verilen tekli 600 mg ribosiklib dozuna kıyasla sırasıyla %89 ve %81 azaltmıştır. LEQ803 Cdeğeri 1,7 kat artarken EAAdeğeri %27 azalmıştır. Böylece güçlü CYP3A4 indükleyicilerinin eş zamanlı kullanımı azalmış maruziyete ve sonuçta etkisizlik riskine yol açabilir. Güçlü CYP3A4 indükleyicilerinin eş zamanlı kullanımından kaçınılmalıdır; bunlar fenitoin, rifampisin, karbamazepin ve sarı kantaronu (Hypericum perforatum) içermekle beraber bunlarla sınırlı değildir. CYP3A4'ü indükleme potansiyeli olmayan ya da minimum potansiyele sahip alternatif bir eş zamanlı tıbbi ürün düşünülmelidir.
Orta güçte CYP3A4 indükleyicisinin ribosiklib maruziyeti üzerindeki etkisi araştırılmamıştır. Fizyoloji bazlı farmakokinetik simülasyonları orta güçte CYP3A4 indükleyicisinin (efavirenz) kararlı durum ribosiklib Cve EAA değerini sırasıyla %51 ve %70 azaltabileceğini düşündürmüştür. Böylece orta güçte CYP3A4 indükleyicilerinin eş zamanlı kullanımı azalmış maruziyete ve sonuç olarak özellikle günde bir kez 400 mg veya 200 mg'da ribosiklib ile tedavi edilen hastalarda yetersiz etkililik riskine yol açabilir.
Plazma konsantrasyonları VALAMOR ile değişebilen maddeler
Ribosiklib orta güç ila güçlü bir CYP3A4 inhibitörü olup, CYP3A4 ile metabolize edilen tıbbi substratlarla etkileşime girebilir ki bu da eş zamanlı kullanılan tıbbi ürünün serum konsantrasyonlarında artışa yol açabilir.
Sağlıklı gönüllülerde tek başına midazolam (CYP3A4 substratı) uygulaması ile karşılaştırıldığında midazolamın çoklu ribosiklib (400 mg) dozları ile birlikte uygulanması midazolam maruziyetini %280 yükseltmiştir (3,8 kat). Fizyolojik esaslı farmakokinetiğin (FEFK) kullanıldığı simülasyonlar, klinik olarak anlamlı 600 mg dozunda verilen VALAMOR'un midazolam EAA değerini 5,2 kat artırmasının beklendiğini göstermiştir. Bu nedenle, genel olarak, VALAMOR başka bir tıbbi ürün ile birlikte uygulandığında, CYP3A4 inhibitörleri ile birlikte kullanıma ilişkin öneriler için diğer ürünün KÜB'üne başvurulmalıdır. VALAMOR, dar terapötik endekse sahip CYP3A4 substratları ile birlikte uygulanırken dikkatli olunması önerilir (bkz. bölüm 4.4). Bunlarla sınırlı olmamak üzere alfentanil, siklosporin, everolimus, fentanil, sirolimus ve takrolimus dahil dar terapötik endekse sahip duyarlı CYP3A4 substratlarının dozunun azaltılması gerekebilir çünkü ribosiklib bunların maruziyetini artırabilir.
600 mg dozundaki ribosiklibin şu CYP3A4 substratları ile eş zamanlı uygulanmasından kaçınılmalıdır: alfuzosin, amiodaron, sisaprid, pimozid, kinidin, ergotamin, dihiroergotamin, ketiapin, lovastatin, simvastatin, sildenafil, midazolam, triazolam.
Sağlıklı gönüllülerde tek başına kafein (CYP1A2 substratı) alınması ile karşılaştırıldığında kafeinin çoklu ribosiklib (400 mg) dozları ile birlikte alınması kafein maruziyetini %20 (1,20 kat) artırmıştır. Klinik olarak anlamlı 600 mg dozunda FEFK'nin kullanıldığı simülasyonlar, ribosiklibin CYP1A2 substratları üzerinde sadece çok zayıf inhibitör etkisini öngörmüştür (EAA değerinde <2 kat artış).
Taşıyıcıların substratları olan maddeler
İn vitro değerlendirmeler, ribosiklibin ilaç taşıyıcıları P-gp, BCRP, OATP1B1/B3, OCT1, OCT2, MATE1 ve BSEP'in aktivitelerini inhibe etme yönünde potansiyele sahip olduğuna işaret etmiştir. Digoksin, pitavastatin, pravastatin, rosuvastatin ve metformini içeren ancak bunlarla sınırlı olmayan dar terapötik indeks sergileyen bu taşıyıcıların duyarlı substratları ile eş zamanlı tedavisi sırasında toksisite açısından dikkat ve takip tavsiye edilir.
İlaç-besin etkileşimleri
VALAMOR aç veya tok karnına uygulanabilir (bkz. Bölüm 4.2 ve 5.2). Gastrik pH değerini yükselten tıbbi ürünler
Ribosiklib 4,5 pH değerinde veya bu değerin altında ve biyo-uyumlu ortamlarda (pH 5 ve 6,5) yüksek çözünürlük sergiler. Ribosiklibin gastrik pH'i yükselten tıbbi ürünler ile birlikte uygulanması klinik bir çalışmada değerlendirilmemiştir; ancak popülasyon farmakokinetiği ve kompartımanlı olmayan farmakokinetik analizlerinde değişmiş ribosiklib emilimi gözlenmemiştir.
Ribosiklib ve letrozol arasındaki ilaç-ilaç etkileşimi
Meme kanseri olan hastalarda yürütülen klinik çalışmadan ve popülasyon farmakokinetiği analizinden veriler bu tıbbi ürünlerin birlikte uygulanmasından sonra ribosiklib ve letrozol arasında ilaç etkileşimi olmadığını göstermiştir.
Ribosiklib ile anastrozol arasındaki ilaç-ilaç etkileşimi
Meme kanseri olan hastalardaki bir klinik çalışmaya ait veriler, ribosiklib ile anastrozolün bir arada uygulanmasından sonra bu tıbbi ürünler arasında klinik olarak anlamlı bir ilaç etkileşimine işaret etmemiştir.
Ribosiklib ve fulvestrant arasındaki ilaç-ilaç etkileşimi
Meme kanserli hastalarda yürütülen klinik çalışmadan elde edilen veri, bu iki tıbbi ürünün birlikte uygulanmasını takiben fulvestrantın ribosiklib maruziyeti üzerinde klinik olarak ilişkili etkisinin olmadığını göstermiştir.
Ribosiklib ile tamoksifen arasındaki ilaç-ilaç etkileşimi
Meme kanseri olan hastalardaki bir klinik çalışmaya ait veriler, ribosiklib ile tamoksifenin bir arada uygulanmasından sonra tamoksifen maruziyetinin yaklaşık 2 kat arttığını göstermiştir.
Ribosiklib ile oral kontraseptifler arasındaki ilaç-ilaç etkileşimi
Ribosiklib ile oral kontraseptifler arasında ilaç-ilaç etkileşimi çalışmaları gerçekleştirilmemiştir
(bkz. Bölüm 4.6). Beklenen etkileşimler
QT aralığını uzatabilen anti-aritmik tıbbi ürünler ve diğer tıbbi ürünler:
VALAMOR'un anti-aritmik tıbbi ürünler gibi QT aralığını uzatma potansiyeli olduğu bilinen tıbbi ürünler (bunlarla sınırlı olmamak üzere amiodaron, disopiramid, prokainamid, kinidin ve sotalol) ve QT aralığını uzattığı bilinen diğer tıbbi ürünler (bunlarla sınırlı olmamak üzere klorokuin, halofantrin, klaritromisin, siprofloksazin, levofloksasin, azitromisin, haloperidol, metadon, moksifloksasin, bepridil, pimozid ve intravenöz ondansetron) ile birlikte uygulanmasından kaçınılmalıdır (bkz. Bölüm 4.4). Ayrıca, VALAMOR'un tamoksifen ile kombinasyon halinde kullanılması önerilmemektedir (bkz. Bölüm 4.1, 4.4 ve 5.1).
Özel popülasyonlara ilişkin ek bilgiler:
Etkileşim açısından özel popülasyonlara ilişkin veri bulunmamaktadır.
Pediyatrik popülasyon:
Etkileşim açısından özel popülasyonlara ilişkin veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
VALAMOR ile tedaviye başlanmadan önce gebelik durumu teyit edilmelidir.
VALAMOR kullanmakta olan çocuk doğurma potansiyeline sahip kadınların tedavi sırasında ve VALAMOR ile tedaviyi bıraktıktan sonra en az 21 gün süreyle etkili doğum kontrolü (örn. çift bariyer kontrasepsiyon) uygulamaları gerekmektedir.
Gebelik dönemi
Gebe kadınlarda yeterli ve gerekli kontrol gruplarına yer veren çalışmalar bulunmamaktadır. Hayvanlar üzerinde yapılan araştırmaların sonuçlarına göre, ribosiklib hamile kadınlara uygulandığında fetal zarara neden olabilir (bkz. Bölüm 5.3). VALAMOR'un hamilelik esnasında ve çocuk doğurma potansiyeli olup kontrasepsiyon yöntemi uygulamayan kadınlarda uygulanması önerilmemektedir.
Ribosiklibin gebe kadınlarda kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
VALAMOR, yarar-risk değerlendirmesine göre gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Ribosiklibin insan sütüyle atılıp atılmadığı bilinmemektedir. Ribosiklibin emen bebek ve süt üretimi üzerine etkisini gösteren veri bulunmamaktadır. Ribosiklib ve metabolitleri sıçan sütüne kolaylıkla geçmiştir. Hayvanlar üzerinde yapılan çalışmalar, ribosiklibin sütle atıldığını göstermektedir. Emzirmenin durdurulup durdurulmayacağına ya da VALAMOR tedavisinin durdurulup durdurulmayacağına/ tedaviden kaçınılıp kaçınılmayacağına ilişkin karar verilirken, emzirmenin çocuk açısından faydası ve VALAMOR tedavisinin emziren anne açısından faydası dikkate alınmalıdır. VALAMOR kullanan kadınların son VALAMOR dozundan en az 21 gün sonrasına kadar emzirmemeleri önerilir.
Üreme yeteneği/Fertilite
Ribosiklibin fertilite üzerine etkilerini gösteren klinik veri bulunmamaktadır. Hayvanlarda yapılan çalışmalara göre, ribosiklib üreme potansiyeli bulunan erkeklerde fertiliteyi zayıflatabilir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
VALAMOR, araç ve makine kullanma becerisi üzerinde minör etkiye sahip olabilir. Hastalara, VALAMOR ile tedavileri sırasında yorgunluk, baş dönmesi veya vertigo deneyimlemeleri halinde araç ve makine kullanırken dikkatli olmaları söylenmelidir (bkz. Bölüm 4.8).
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Birleştirilmiş veri kümesinde ribosiklib artı herhangi bir kombinasyon için sıklığın plasebo artı herhangi bir kombinasyon için sıklıktan fazla olduğu en yaygın advers reaksiyonlar (≥ %20 sıklıkla bildirilen) nötropeni, enfeksiyonlar, bulantı, yorgunluk, diyare, lökopeni, kusma, baş ağrısı, konstipasyon, alopesi, öksürük, döküntü, sırt ağrısı, anemi ve anormal karaciğer fonksiyonu testleridir.
Birleştirilmiş veri kümesinde ribosiklib artı herhangi bir kombinasyon için sıklığın plasebo artı herhangi bir kombinasyon için sıklıktan fazla olduğu en yaygın derece 3/4 advers reaksiyonlar (≥2 sıklıkla bildirilen) nötropeni, lökopeni, anormal karaciğer fonksiyonu testleri, lenfopeni, enfeksiyonlar, sırt ağrısı, anemi, yorgunluk, hipofosfatemi ve kusmadır.
Nedensel ilişkiye bakılmaksızın, faz III çalışmalarında kombinasyona bakmaksızın ribosiklib alan hastalarda advers olaylara bağlı doz azaltımı hastaların % 39,5'inde; faz III çalışmalarında herhangi bir kombinasyon ve ribosiklib alan hastalarda tedavinin kalıcı olarak durdurulması hastaların % 8,7'sinde bildirilmiştir.
Advers reaksiyonların tablo halinde özeti
Ribosiklibin genel güvenlilik profili, ribosiklibi endokrin tedavisi (N=582, bir aromataz inhibitörü ile kombinasyon halinde ve N=483, fulvestrant ile kombinasyon halinde) ile kombinasyon halinde alan ve HR-pozitif, HER2-negatif ileri veya metastatik meme kanseri üzerine randomize, çift kör, plasebo kontrollü faz III klinik çalışmalara (MONALEESA-2, MONALEESA-7 NSAI alt grubu ve MONALEESA-3) katılan 1065 hastanın birleştirilmiş veri kümesine dayanmaktadır. Pazarlama sonrasında, ilave advers reaksiyonlar görülmüştür.
Birleştirilmiş faz III çalışmaların veri kümesi genelinde ribosiklib tedavisine medyan maruziyet süresi 19,2 ay olup hastaların %61,7'sinde maruziyet ≥12 aydır.
Faz III çalışmalardan bildirilen advers reaksiyonlar (Tablo 6) MedDRA sistem organ sınıfına göre listelenmektedir. Her bir sistem organ sınıfı içinde advers reaksiyonlar sıklığa göre, en sık reaksiyonlar ilk belirtilerek sıralanmaktadır. Her bir sıklık gruplandırması içinde advers reaksiyonlar azalan ciddilik derecelerine göre sunulmaktadır. Ayrıca, her advers reaksiyon için karşılık gelen sıklık kategorisi şu sisteme dayanmaktadır (CIOMS III):
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 7 Üç Faz III klinik çalışmada ve pazarlama sonrası deneyim sırasında gözlenen advers reaksiyonlar
Advers reaksiyon | Sıklık |
Enfeksiyonlar ve enfestasyonlar | |
Enfeksiyonlar | Çok yaygın |
Kan ve lenf sistemi hastalıkları | |
Nötropeni, lökopeni, anemi, lenfopeni Trombositopeni, febril nötropeni | Çok yaygın Yaygın |
Metabolizma ve beslenme hastalıkları | |
İştah azalması Hipokalsemi, hipokalemi, hipofosfatemi | Çok yaygın Yaygın |
Sinir sistemi hastalıkları | |
Baş ağrısı, baş dönmesi Vertigo | Çok yaygın Yaygın |
Göz hastalıkları | |
Gözyaşı salgısında artış, göz kuruluğu | Yaygın |
Kardiyak hastalıkları | |
Senkop | Yaygın |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | |
Dispne, öksürük | Çok yaygın |
İnterstisyel akciğer hastalığı (İAH)/pnömonit | Yaygın |
Gastrointestinal hastalıklar | |
Bulantı, diyare, kusma, konstipasyon, karın ağrısı , stomatit, dispepsi Disguzi | Çok yaygın Yaygın |
Hepatobiliyer hastalıklar | |
Hepatotoksisite | Yaygın |
Deri ve deri altı doku hastalıkları | |
Alopesi, döküntü , prurit Eritem, cilt kuruluğu, vitiligo Toksik epidermal nekroliz (TEN)* | Çok yaygın Yaygın Bilinmiyor |
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları | |
Sırt ağrısı | Çok yaygın |
Genel bozukluklar ve uygulama bölgesine ilişkin durumlar | |
Yorgunluk, periferik ödem, pireksi, asteni Orofarengeal ağrı, ağız kuruluğu | Çok yaygın Yaygın |
Araştırmalar | |
Anormal karaciğer fonksiyonu testleri Kan kreatinin düzeyinde artış, elektrokardiyogramda QT uzaması | Çok yaygın Yaygın |
Seçilen advers reaksiyonların tanımı
Nötropeni
Nötropeni en sık bildirilen advers reaksiyon (%75,4) olup, faz III çalışmalarında ribosiklib ve herhangi bir kombinasyon kullanan hastaların %62'sinde nötrofil sayımlarında derece 3 veya 4 azalma (laboratuvar bulguları temelinde) bildirilmiştir.
Derece 2, 3 veya 4 nötropeni görülen hastalar arasında, bir olay yaşamış hastalar için başlangıca kadar geçen medyan süre 17 gündür. Derece ≥3 düzelmeye (normalizasyona veya derece <3'e) kadar geçen medyan süre ribosiklib artı herhangi bir kombinasyon tedavisi kollarında tedavide ara vermeyi ve/veya azaltmayı ve/veya tedavinin bırakılmasını takiben 12 gündür. Febril nötropeni faz III çalışmalarında ribosiklibe maruz kalmış hastaların yaklaşık %1,7'sinde bildirilmiştir. Hastalara herhangi bir ateş olayını derhal bildirmeleri söylenmelidir.
Nötropeni, şiddet derecesine dayalı olarak laboratuvar izlemi, dozlara ara verme ve/veya doz modifikasyonu ile kontrol edilmiştir. Nötropeniye bağlı tedavinin bırakılması düşük oranda gerçekleşmiştir (%0,8) (bkz. Bölüm 4.2 ve 4.4).
Hepatobiliyer toksisite
Faz III klinik çalışmalarda, hepatobiliyer toksisite olayları ribosiklib artı herhangi bir kombinasyon kollarındaki hastalarda, plasebo artı herhangi bir kombinasyon kollarındaki hastalara kıyasla daha yüksek bir oranda görülmüş (sırasıyla %27,3'e karşılık %19,6), ribosiklib artı herhangi bir kombinasyon ile tedavi edilen hastalar arasında daha fazla derece 3/4 advers olay bildirilmiştir (sırasıyla %13,2'ye kıyasla %6,1). Transaminazlarda yükselme gözlemlenmiştir. Ribosiklib ve plasebo kollarında sırasıyla ALT (%11,2'ye karşılık %1,7) ve AST'de (%7,8'e karşılık %2,1) derece 3 veya 4 artışlar bildirilmiştir. Kolestaz yokluğunda alkalen fosfataz normal iken ALT veya AST değerlerinde normalin üst sınırının üç katından büyük ve toplam bilirubin değerinde normalin üst sınırının iki katından büyük eş zamanlı yükselmeler, 6 hastada görülmüştür (Çalışma A2301'de [MONALEESA-2] 4 hasta; ribosiklib tedavisi bırakıldıktan sonra düzeyleri 154 gün içinde normale dönmüştür ve Çalışma F2301'de [MONALEESA-3] 2 hasta; ribosiklib tedavisi bırakıldıktan sonra düzeyleri sırasıyla 121 ve 532 gün içinde normale dönmüştür). Çalışma E2301'de (MONALEESA-7) bu gibi vakalar raporlanmamıştır.
Hepatobiliyer toksisite olayları nedeniyle dozlara ara verme ve/veya doz ayarlamaları, ribosiklib artı herhangi bir kombinasyon ile tedavi edilen hastaların %12,3'ünde, ağırlıklı olarak ALT düzeyinde yükselme (%7,9) ve/veya AST düzeyinde yükselme (%7,3) nedeniyle bildirilmiştir. Ribosiklib artı herhangi bir kombinasyon tedavisinin anormal karaciğer fonksiyonu testleri veya hepatotoksisite nedeniyle kesilmesi hastaların sırasıyla %2,4 ve
%0,3'ünde söz konusu olmuştur (bkz. Bölüm 4.2 ve 4.4).
Faz III çalışmalarda, derece 3 veya 4 ALT veya AST artışı olaylarının %70,9'u (90/127) tedavinin ilk 6 ayı içinde meydana gelmiştir. Derece 3 veya 4 ALT/AST artışı görülen hastalar arasında başlangıca kadar geçen medyan süre ribosiklib artı herhangi bir kombinasyon kolları için 92 gündür. Ribosiklib artı herhangi bir kombinasyon kollarında düzelmeye (normalizasyona veya derece ≤2'ye) kadar geçen medyan süre 21 gündür.
QT uzaması
Çalışma E2301'de (MONALEESA-7) çalışma başlangıcına göre gözlenen ortalama QTcF artışı, NSAI artı plasebo alt grubu ile karşılaştırıldığında tamoksifen artı plasebo alt grubunda yaklaşık 10 milisaniye daha yüksek olarak tek başına tamoksifenin, ribosiklib artı tamoksifen grubunda gözlenen QTcF değerlerine katkıda bulunmuş olabilecek bir QTcF uzatma etkisinin olduğunu düşündürmüştür. Plasebo kolunda, çalışma başlangıcına göre >60 milisaniyelik QTcF aralığı artışı tamoksifen alan 6/90 (%6,7) hastada görülürken, NSAI alan hiçbir hastada görülmemiştir (bkz. bölüm 5.2).Ribosiklib artı tamoksifen alan hastaların 14/87'sinde (%16,1) ve ribosiklib artı bir NSAI alan hastaların 18/245'inde (%7,3), çalışma başlangıcına kıyasla > 60 milisaniyelik bir QTcF aralığı artışı gözlenmiştir. Ribosiklibin tamoksifen ile kombinasyon halinde kullanımı önerilmemektedir (bkz. Bölüm 5.1).
Faz III klinik çalışmalarda, ribosiklib artı letrozol veya fulvestrant kollarında hastaların %9,3'ü ve plasebo artı letrozol veya fulvestrant kollarında hastaların %3,5'i en az bir QT aralığı uzaması olayı yaşamıştır (EKG'de QT uzaması ve senkop dahil). EKG verilerinde inceleme 15 hastanın (%1,4) >500 milisaniye başlangıç sonrası QTcF değerine sahip olduğunu ve 61 hastanın (%5,8) QTcF aralıklarında başlangıca göre >60 milisaniye artış yaşadığını göstermiştir. Torsade de pointes vakaları bildirilmemiştir. Elektrokardiyogramda QT uzaması ve senkop nedeniyle dozlara ara verme/doz ayarlamaları, ribosiklib artı letrozol veya fulvestrant ile tedavi edilen hastaların %2,9'unda bildirilmiştir.
EKG verilerinin analizi, ribosiklib artı letrozol veya fulvestrant kollarında ve plasebo artı letrozol veya fulvestrant kollarında sırasıyla 55 hasta (%5,2) ve 12 hastada (%1,5) en az bir
>480 milisaniye başlangıç sonrası QTcF sonucu göstermiştir. >480 milisaniye QTcF uzaması olan hastalar arasında olayın başlangıcına kadar geçen medyan süre kombinasyona bakılmaksızın 15 gün olmuş ve dozlara ara verildiğinde ve/veya doz azaltıldığında bu değişikliklerin geri dönüşlü olduğu görülmüştür (bkz. Bölüm 4.2, 4.4 ve 5.2).
Böbrek yetmezliği olan hastalar
Üç önemli çalışmada, hafif böbrek yetmezliği olan 341 hasta ve orta derecede böbrek yetmezliği olan 97 hasta ribosiklib ile tedavi edilmiştir. Şiddetli böbrek yetmezliği olan hastalar çalışmaya dahil edilmemiştir (bkz. Bölüm 5.1). Tedavi sırasında başlangıçtaki böbrek yetmezliğinin derecesi ile kan kreatinin değerleri arasında bir korelasyon bulunmaktadır. Hafif veya orta derecede böbrek yetmezliği olan hastalarda QT uzaması ve trombositopeni oranlarında hafif artış gözlenmiştir. Bu toksisiteler durumunda izleme ve doz ayarlama önerileri için bölüm 4.2 ve 4.4 bakınız.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Raporlanmış VALAMOR ile doz aşımı vakalarına ait sınırlı deneyim bulunmaktadır. Bir doz aşımı olayında, bulantı ve kusma gibi semptomlar meydana gelebilir. Buna ilaveten, hematolojik (örn., nötropeni, trombositopeni) toksisite ve olası QTc uzaması meydana gelebilir. Tüm doz aşımı durumlarında gerekli genel semptomatik ve destekleyici önlemler başlatılmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Antineoplastik ajanlar, protein kinaz inhibitörleri, sikline bağımlı kinaz (CDK) inhibitörleri
ATC kodu: L01EF02
Etki mekanizması:
Ribosiklib seçici sikline bağımlı kinaz (CDK) 4 ve 6 inhibitörü olup, biyokimyasal analizlerde sırasıyla 0,01 (4,3 ng/ml) ve 0,039 µM'lik (16,9 ng/ml) %50 inhibisyon (IC) değerleri ile sonuçlanır. Bu kinazlar D-sikline bağlanma ile birlikte aktive olurlar ve hücre döngüsü progresyonu ve hücresel proliferasyona yol alan sinyal yolaklarında önemli bir rol oynarlar.
Siklin D-CDK4/6 kompleksi hücre döngüsü progresyonunu, retinoblastoma proteininin (pRb) fosforilasyonu yoluyla regüle eder.
İn vitro ortamda ribosiklib pRb fosforilasyonunu azaltarak hücre döngüsünün G1 fazında durmaya ve meme kanseri hücre dizilerinde hücre proliferasyonunda azalmaya yol açmıştır. İn vivo ortamda tek ajan ribosiklib ile tedavi, iyi tolere edilen dozlarda pRb fosforilasyonunun inhibisyonu ile korelasyon gösteren tümör regresyonuna yol açmıştır.
Hastadan elde edilmiş östrojen reseptör-pozitif meme kanseri ksenogreft modelinin kullanıldığı in vivo çalışmalarda, ribosiklib ve antiöstrojen ajanları (örn. letrozol) kombinasyonu, ajanların tek başına uygulandığı durumla karşılaştırıldığında, kalıcı tümör regresyonu ve doz uygulaması bırakıldıktan sonra yeni tümör büyümesinde gecikme ile birlikte daha iyi bir tümör büyümesi inhibisyonu sağlamıştır. Ek olarak, ZR751 ER+ insan meme kanseri ksenogreftlerini taşıyan ve bağışıklık yetmezliği bulunan farelerde fulvestrant ile kombinasyon halindeki ribosiklibin in vivo anti-tümör aktivitesi değerlendirilmiştir ve fulvestrant ile kombinasyon, tam tümör büyümesi inhibisyonu ile sonuçlanmıştır.
Bilinen ER durumuna sahip meme kanseri hücre hatları paneli test edildiğinde, ribosiklibin ER- olanlara kıyasla ER+ meme kanseri hücre hatlarında daha etkili olduğu gösterilmiştir. Şimdiye kadar test edilen klinik öncesi modellerde, ribosiklib aktivitesi için intakt pRb gerekmiştir.
Kardiyak elektrofizyoloji:
İleri evre kanseri olan hastalarda ribosiklibin QTc aralığı üzerindeki etkisini değerlendirmek için tek dozdan sonra ve kararlı durumda seri, üçlü EKG'ler kaydedilmiştir. Bir farmakokinetik- farmakodinamik analiz, 50-1200 mg aralığında dozlarla ribosiklib ile tedavi edilen 997 hastayı içermiştir. Bu analiz, ribosiklibin QTc aralığında konsantrasyona bağımlı artışlara neden olduğunu düşündürmüştür. NSAI veya fulvestrant ile kombinasyon halindeki 600 mg ribosiklib için başlangıça göre tahmini ortalama QTcF değişimi, tamoksifen ile kombinasyon halinde 34,7 milisaniye (%90 GA: 31,64, 37,78) ile karşılaştırıldığında, sırasıyla kararlı durumdaki geometrik ortalamada C'ta sırasıyla 22 milisaniye (%90 GA: 20,56, 23,44) ve 23,7
milisaniye (%90 GA: 22,31, 25,08) olmuştur (bkz. Bölüm 4.4). Klinik etkililik ve güvenlilik:
Çalışma CLEE011A2301 (MONALEESA-2)
Hormon reseptörü pozitif, HER2 negatif ileri evre meme kanseri olan, ileri evre hastalık için daha önce bir tedavi almamış postmenopozal kadınlarda tek başına letrozole kıyasla ribosiklibin letrozol ile kombine tedavisi randomize, çift kör, plasebo kontrollü, çok merkezli bir faz III klinik çalışmada değerlendirilmiştir.
Toplam 668 hasta, karaciğer ve/veya akciğer metastazlarının varlığına (Var [n=292 (44%)]) kıyasla Yok [n=376 (56%)]) göre stratifiye edilerek 1:1 oranında ribosiklib 600 mg ve letrozol (n=334) veya plasebo ve letrozol (n=334) almak üzere randomize edilmiştir. Demografik özellikler ve başlangıç hastalık karakteristikleri çalışma kolları arasında dengeli ve karşılaştırılabilir nitelikte olmuştur. Ribosiklib, 28 gün süreyle günde bir kez 2,5 mg letrozol ile kombinasyon halinde oral yolla günde bir kez 600 mg dozunda arka arkaya 21 gün verilmiş, ardından 7 gün tedavisiz ara bırakılmıştır. Çalışma süresince veya hastalık progresyonundan sonra hastaların plasebodan ribosiklibe geçiş yapmalarına izin verilmemiştir.
Bu çalışmaya alınan hastaların medyan yaşı 62'dir (aralık 23 - 91). Hastaların %44,2'si 65 yaşın üzerindedir ve bu hastalarında 69'u 75 yaşın üzerindedir. Dahil edilen hastalar beyaz (%82,2), Asyalı (%7,6) ve siyahtır (%2,5). Tüm hastaların ECOG performans durumu 0 veya 1'dir. Ribosiklib kolunda, hastaların %46,6'sı çalışmaya girmeden önce neoadjuvan veya adjuvan
koşullarda kemoterapi görmüştür ve %51,3'ü neoadjuvan veya adjuvan koşullarda anti- hormonal tedavi almıştır. Hastaların %34,1'i de novo hastadır. Hastaların %22'sinde sadece kemiği tutan hastalık ve %58,8'inde visseral hastalık vardır. Daha önce anastrozol veya letrozol ile (neo)adjuvan tedavi görmüş hastalar çalışma randomizasyonundan en az 12 ay önce bu tedaviyi tamamlamış olmalıdır.
Birincil analiz
Çalışma için birincil sonlanım noktası tüm popülasyonda (tüm randomize hastalar) araştırıcı değerlendirmesi temelinde Solid Tümörlerde Yanıt Değerlendirme Kriterleri (RECIST v1.1) kullanılarak hedeflenen progresyonsuz sağkalım (PFS) olaylarının %80'i gözlendikten sonra yürütülmüş planlanan ara analizde karşılanmış ve körlenmiş bağımsız merkezi radyolojik değerlendirme ile doğrulanmıştır.
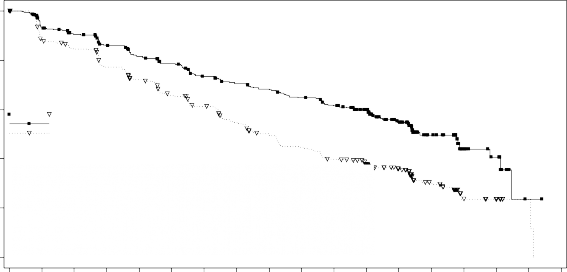
Tam analiz setinde etkililik sonuçları, plasebo artı letrozol alan hastalara kıyasla, ribosiklib artı letrozol kombinasyonu ile tedavi edilen hastalar için klinik olarak anlamlı tedavi etkisi ile PFS'de istatistiksel olarak anlamlı düzelme göstermiştir (tehlike oranı [HR] = 0,556, %95 GA: 0,429, 0,720, tek yönlü stratifiye edilmiş log sıra testi p değeri 0,00000329).
Global sağlık durumu/QoL verileri ribosiklib artı letrozol kolu ve plasebo artı letrozol kolu arasında ilgili bir fark olmadığını göstermiştir.
Tablo 8 ve 9'da etkililik verilerine ilişkin daha olgun bir güncelleme (02 Ocak 2017 veri kesme) sunulmaktadır.
Medyan PFS ribosiklib artı letrozol ile tedavi edilen hastalar için 25,3 ay (%95 GA: 23, 30,3) iken, plasebo artı letrozol alan hastalar için 16 (%95 GA: 13,4, 18,2) aydır. Ribosiklib artı letrozol alan hastaların %54,7'sinin, plasebo artı letrozol alan hastaların ise %35,9'unun 24. ayda progresyonsuz olduğu öngörüldü.
Tablo 8 MONALEESA-2 - Araştırmacının radyolojik değerlendirmesine dayalı etkililik sonuçları (PFS) (02 Ocak 2017 veri kesme)
| Güncellenen analiz | |
| Ribosiklib artı letrozol N=334 | Plasebo artı letrozol N=334 |
Progresyonsuz sağkalım | ||
Medyan PFS [ay] (%95 GA) | 25,3 (23 â 30,3) | 16 (13,4 â 18,2) |
Tehlike oranı (%95 GA) | 0,568 (0,457 - 0,704) | |
p değeri | 9,63x10 | |
GA=güven aralığı; N=hasta sayısı; PFS = Progresyonsuz sağkalım | ||
Şekil 1 MONALEESA-2 - Araştırmacının değerlendirmesine dayalı PFS'nin Kaplan- Meier grafiği (02 Ocak 2017 veri kesme)
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
Önceden belirlenmiş alt grup PFS analizleri serisi prognostik faktörler ve başlangıç özellikleri temelinde tedavi etkisinin tutarlılığını araştırmak üzere yürütülmüştür. Yaş, ırk, önceki adjuvan veya neo adjuvan kemoterapi veya hormonal tedaviler, karaciğer ve/veya akciğer tutulumu ve sadece kemiğe metastaz yapan hastalığı içeren tüm bireysel hasta alt gruplarında hastalık progresyonu veya ölüm riskinde ribosiklib artı letrozol kolu lehine bir azalma gözlenmiştir. Bu, karaciğer ve/veya akciğer metastazları olan hastalar için (HR 0,561 [%95 GA: 0,424, 0,743], medyan progresyonsuz sağkalım [mPFS] ribosiklib artı letrozol için 24,8 ay ve tek başına letrozol için 13,4 ay) ya da karaciğer ve/veya akciğer metastazları olmayan hastalar için (HR 0,597 [%95 GA: 0,426, 0,837], mPFS 27,6 aya karşılık 18,2 ay) belirgindir.
Genel yanıt ve klinik fayda oranları için güncellenmiş bulgular Tablo 9'da gösterilmektedir.
Tablo 9 MONALEESA-2 - Araştırmacı değerlendirmesine dayalı etkililik sonuçları (ORR, CBR) (02 Ocak 2017 veri kesme)
Analiz | Ribosiklib artı letrozol (%, %95 GA) | Plasebo artı letrozol (%, %95 GA) | p değeri |
Tam analiz seti | N=334 | N=334 |
|
Genel yanıt oranı | 42,5 (37,2; 47,8) | 28,7 (23,9; 33,6) | 9,18 Ã 10 |
Klinik fayda oranı | 79,9 (75,6; 84,2) | 73,1 (68,3; 77,8) | 0,018 |
Ölçülebilir hastalığı olan hastalar | N=257 | N=245 |
|
Genel yanıt oranı | 54,5 (48,4; 60,6) | 38,8 (32,7;44,9) | 2,54 Ã 10 |
Klinik fayda oranı | 80,2 (75,3; 85) | 71,8 (66,2; 77,5) | 0,018 |
Nihai genel sağkalım analizi
Genel çalışma popülasyonunda bu nihai genel sağkalım analizinden bulgular Tablo 10 ve Şekil 2'de sunulmaktadır.
Tablo 10 MONALEESA-2- Etkililik bulguları (OS) (10 Haziran 2021 veri kesme)
Genel sağkalım, genel çalışma popülasyonu | Ribosiklib artı letrozol N=334 | Plasebo artı letrozol N=334 |
Olay sayısı â n [%] | 181 (54,2) | 219 (65,6) |
Medyan OS [ay] (%95 GA) | 63,9 (52,4; 71) | 51,4 (47,2; 59,7) |
Tehlike oranı (%95 GA) | 0,765 (0,628; 0,932) | |
p-değeri | 0,004 | |
OS olaysız oran, (%) (%95 GA) |
| |
24 ay | 86,6 (82,3; 89,9) | 85 (80,5; 88,4) |
60 ay | 52,3 (46,5; 57,7) | 43,9 (38,3; 49,4) |
72 ay | 44,2 (38,5; 49,8) | 32 (26,8; 37,3) |
GA = güven aralığı IRT'ye göre akciğer ve/veya karaciğer metastazları durumuna göre yürütülen sınıflandırma | ||
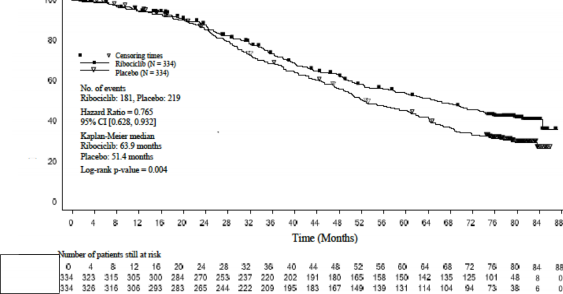
Şekil 2 MONALEESA-2- Genel popülasyonda OS'nin Kaplan-Meier grafiği (10 Haziran 2021 veri kesme)
Log-sıra testi ve Cox PH modeli IRT'ye göre karaciğer ve/veya akciğer metastazları durumuna göre sınıflandırılır.
Tek taraflı P-değeri sınıflandırılmış log-sıra testinden elde edilir.
Çalışma CLEE011E2301 (MONALEESA-7)
Ribosiklib, randomize çift kör, plasebo kontrollü, çok merkezli bir faz III klinik çalışmada, hormon reseptörü pozitif, HER2-negatif ilerlemiş meme kanseri olan premenopozal ve perimenopozal kadınların tedavisinde, NSAI veya tamoksifen artı goserelin ile kombinasyon halinde, bir NSAI veya tamoksifen artı goserelin ile kombinasyon halinde plasebo karşısında değerlendirilmiştir. MONALEESA-7'deki hastalar ilerlemiş meme kanseri için önceden endokrin tedavisi görmemişlerdir.
Toplam 672 hasta, karaciğer ve/veya akciğer metastazlarının varlığına (Var [n=344 (%51,2)] karşısında Yok [n=328 (%48,8)]), ilerlemiş hastalık için önceki kemoterapi (Var [n=120 (%17,9)] karşısında Yok [n=552 (%82,1)]) ve endokrin kombinasyon partneri (NSAI ve goserelin [n=493 (%73,4)] karşısında tamoksifen ve goserelin [n=179 (%26,6)]) göre katmanlandırılarak 1:1 oranında ya ribosiklib 600 mg artı NSAI/tamoksifen artı goserelin (n=335) ya da plasebo artı NSAI/tamoksifen artı goserelin (n=337) almak üzere randomize edilmiştir. Demografik özellikler ve çalışma başlangıcı hastalık karakteristikleri çalışma kolları arasında dengeli ve birbirine yakın olmuştur. Ribosiklib, 28 gün süreyle günde bir kez oral yolla NSAI (letrozol 2,5 mg veya anastrozol 1 mg) veya tamoksifen (20 mg) ve 28 günde bir subkutan yolla goserelin (3,6 mg) ile kombinasyon halinde, hastalık progresyonuna veya kabul edilemez toksisiteye kadar oral yolla günde bir kez 600 mg dozunda arka arkaya 21 gün verilmiş, ardından 7 gün tedavisiz ara bırakılmıştır. Çalışma sırasında veya hastalık progresyonundan sonra hastaların plasebodan ribosiklibe geçiş yapmalarına izin verilmemiştir. Endokrin kombinasyon partnerlerinin değiştirilmesine de izin verilmemiştir.
Bu çalışmaya kaydedilen hastaların medyan yaşı 44 yıldır (aralık: 25 ila 58) ve hastaların
%27,7'si 40 yaşın altındadır. Dahil edilen hastaların çoğu Beyaz (%57,7), Asyalı (%29,5) veya Siyahtır (%2,8) ve neredeyse tüm hastaların (%99) başlangıç ECOG performans durumu 0 veya 1'dir. Çalışmaya giriş öncesinde bu 672 hastanın %14'ü önceden metastatik hastalık için
kemoterapi görmüş, %32,6'sı adjuvan ve %18'i neoadjuvan koşullarda kemoterapi almış, ve
%39,6'sı adjuvan ve %0,7'si neoadjuvan koşullarda endokrin tedavisi almıştır. Çalışma E2301'de hastaların %40,2'sinde de novo metastatik hastalık, %23,7'sinde sadece kemiği tutan hastalık ve %56,7'sinde visseral hastalık söz konusudur.
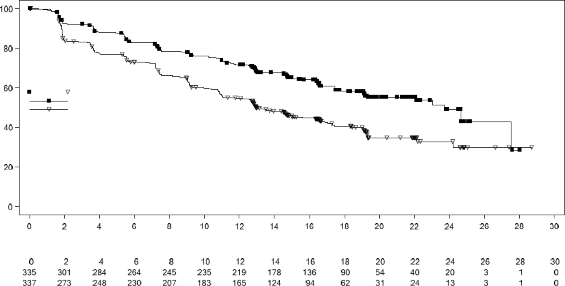
Çalışma, tam analiz setinde (randomize edilen tüm hastalar) araştırmacı değerlendirmesine dayanan ve RECIST v1.1 kriterleri kullanılarak 318 progresyonsuz sağkalım (PFS) olayından sonra gerçekleştirilen birincil analizde birincil sonlanım noktasına ulaşmıştır. Birincil etkililik sonuçları, körlenmiş bağımsız merkezi radyolojik değerlendirmeye dayalı PFS sonuçlarıyla desteklenmiştir. Birincil PFS analizi tarihinde medyan takip süresi 19,2 ay olmuştur.
Genel çalışma popülasyonunda etkililik sonuçları, plasebo artı NSAI/tamoksifen artı goserelin kullanan hastalar ile karşılaştırıldığında ribosiklib artı NSAI/tamoksifen artı goserelin kullanan hastalarda, klinik olarak anlamlı bir tedavi etkisiyle birlikte PFS'de istatistiksel olarak anlamlı bir düzelme göstermiştir (Tehlike Oranı: 0,553, %95 GA: 0,441, 0,694, tek yanlı katmanlandırılmış log sıra testi p değeri 9,83x10). Medyan PFS, ribosiklib artı NSAI/tamoksifen artı goserelin ile tedavi edilen hastalarda 23,8 ay (%95 GA: 19,2, NE) ve plasebo artı NSAI/tamoksifen artı goserelin verilen hastalarda 13 ay (%95 GA: 11, 16,4) olmuştur.
PFS için dağılımı, Şekil 3'te, PFS için Kaplan-Meier eğrisinde özetlenmektedir.
Şekil 3 MONALEESA-7 â Genel popülasyonda PFS'nin araştırmacı değerlendirmesine dayalı Kaplan-Meier grafiği
Randomize edilen hastaların yaklaşık %40'ından rastgele seçilmiş bir alt grubun körlenmiş bağımsız merkezi radyolojik değerlendirmesine dayalı PFS sonuçları, araştırmacı değerlendirmesine dayalı birincil etkililik sonuçlarını destekler nitelikte olmuştur (Tehlike Oranı: 0,427; %95 GA: 0,288, 0,633).
Birincil PFS analizi tarihinde genel sağkalım verileri hazır olmayıp 89 (%13) ölüm (Tehlike Oranı: 0,916 [%95 GA: 0,601, 1,396]) söz konusu olmuştur.
RECIST v1.1'e göre araştırmacı değerlendirmesine dayalı genel yanıt oranı (ORR) ribosiklib kolunda (%40,9; %95 GA: 35,6, 46,2), plasebo kolundan daha yüksek bulunmuştur (%29,7;
%95 GA: 24,8, 34,6, p=0,00098). Gözlenen klinik fayda oranı (CBR), plasebo kolu (%69,7;
%95 GA: 64,8:74,6, p=0,002) ile karşılaştırıldığında ribosiklib kolunda (%79,1; %95 GA:
74,8:83,5) daha yüksektir.
NSAI artı goserelin ile kombinasyon halinde ribosiklib veya plasebo alan 495 hastanın önceden tanımlanmış alt grup analizinde, medyan PFS ribosiklib artı NSAI alt grubunda 27,5 ay (%95 GA: 19,1, NE) ve plasebo artı NSAI alt grubunda 13,8 ay (%95 GA: 12,6, 17,4) bulunmuştur
[Tehlike Oranı: 0,569; %95 GA: 0,436, 0,743]. Etkililik sonuçları Tablo 11'de özetlenmekte ve PFS için Kaplan-Meier eğrileri Şekil 4'te verilmektedir.
Tablo 11 MONALEESA-7 â NSAI alan hastalarda etkililik sonuçları (PFS)
| Ribosiklib + NSAI + goserelin N=248 | Plasebo + NSAI + goserelin N=247 |
Progresyonsuz sağkalım |
|
|
Medyan PFS [ay] (%95 GA) | 27,5 (19,1; NE) | 13,8 (12,6 â 17,4) |
Tehlike oranı (%95 GA) | 0,569 (0,436; 0,743) | |
GA=güven aralığı; N=hasta sayısı; NE = Hesaplanabilir değil. | ||
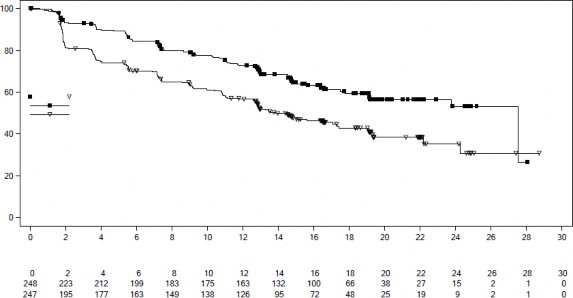
Şekil 4 MONALEESA-7 â NSAI alan hastalarda PFS'nin araştırmacı değerlendirmesine dayalı Kaplan-Meier grafiği
Genel yanıt oranı (ORR) etkililik sonuçları ve RECIST v1.1'e dayalı araştırmacı değerlendirmesine göre klinik fayda oranı (CBR) Tablo 12'de verilmektedir.
Tablo 12 MONALEESA-7 â NSAI alan hastalarda araştırmacı değerlendirmesine dayalı etkililik sonuçları (ORR, CBR)
Analiz | Ribosiklib artı NSAI artı goserelin (%, %95 GA) | Plasebo artı NSAI artı goserelin (%, %95 GA) |
Tam analiz seti | N=248 | N=247 |
Genel yanıt oranı (ORR) | 39,1 (33; 45,2) | 29,1 (23,5; 34,8) |
Klinik fayda oranı (CBR) | 80,2 (75,3; 85,2) | 67,2 (61,4; 73,1) |
Ölçülebilir hastalığı olan hastalar | N=192 | N=199 |
Genel yanıt oranı | 50,5 (43,4; 57,6) | 36,2 (29,5; 42,9) |
Klinik fayda oranı | 81,8 (76,3; 87,2) | 63,8 (57,1; 70,5) |
Ribosiklib artı NSAI alt grubundaki sonuçlar yaş, ırk, önceki adjuvan/ neoadjuvan kemoterapi veya hormonal tedaviler, karaciğer ve/veya akciğer tutulumu ve sadece kemiği tutan metastatik hastalığı içeren farklı alt gruplar genelinde tutarlı olmuştur.
Genel sağkalım verilerinin daha olgun bir güncellemesi (veri kesme tarihi 30 Kasım 2018) Tablo 13 ve Şekil 5 ve 6'da verilmektedir.
İkinci OS analizinde çalışma, OS'de istatistiksel olarak anlamlı bir iyileşme göstererek anahtar ikincil sonlanım noktasını karşılamıştır.
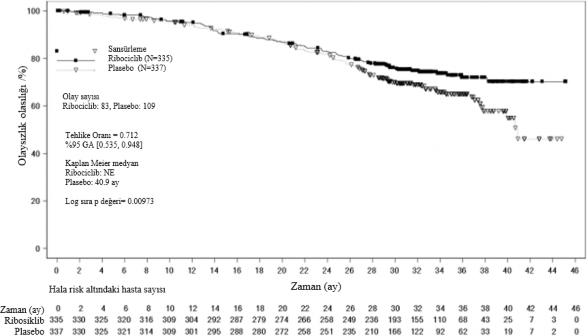
Tablo 13 MONALEESA-7 â Etkililik sonuçları (OS) (veri kesme tarihi 30 Kasım 2018)
| Güncellenmiş analiz | |
Genel sağkalım, genel çalışma popülasyonu | Ribosiklib 600 mg N= 335 | Plasebo N=337 |
Olay sayısı â n [%] | 83 (24,8) | 109 (32,3) |
Medyan OS [ay] (%95 GA) | NE (NE;NE) | 40,9 (37,8; NE) |
Tehlike oranı ( %95 GA) | 0,712 (0,535;0,948) | |
p-değeri | 0,00973 | |
Genel sağkalım, NSAI alt grubu | Ribosiklib 600 mg N=248 | Plasebo N=247 |
Olay sayısı - n [%] | 61 (24,6) | 80 (32,4) |
Medyan OS [ay] (%95 GA) | NE (NE; NE) | 40,7 (37,4; NE) |
Tehlike oranı (%95 GA) | 0,699 (0,501;0,976) | |
GA= güven aralığı, NE = tahmin edilemez, N = hasta sayısı; | ||
Şekil 5 MONALEESA-7: Son OS analizinin Kaplan Meier grafiği (veri kesme tarihi 30 Kasım 2018)
Log-sıra testi ve Cox modeli akciğer ve/veya karaciğer metastazı, ileri evre hastalık için önceki kemoterapi ve IRT başına endokrin kombinasyon partneri ile stratifiye edilmiştir.
Şekil 6 MONALEESA-7: NSAI alan hastalarda son OS analizinin Kaplan Meier grafiği
(veri kesme tarihi 30 Kasım 2018)
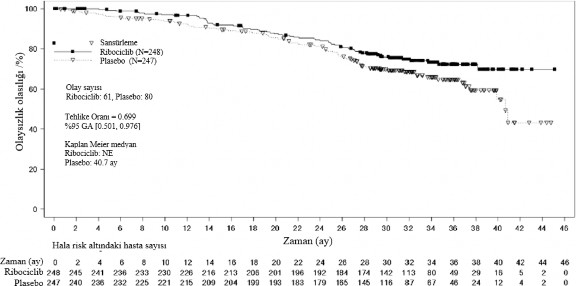
Tehlike oranı stratifiye edilmemiş Cox modeline dayanmaktadır.
Ek olarak, genel çalışma popülasyonundaki 0,692 HR değeri (%95 GA: 0,548, 0,875) ile bu çalışmada daha önce ribosiklib alan hastalarda sonraki basamak tedavide progresyon veya ölüm (PFS2) olasılığı, plasebo kolundaki hastalara göre daha düşük olmuştur. Medyan PFS2, plasebo kolunda 32,3 ay bulunmuştur (%95 GA: 27,6, 38,3) ve ribosiklib kolunda ulaşılmamıştır (%95 GA: 39,4, NE). NSAI alt grubu için benzer sonuçlar gözlenmiş, HR değeri 0,660 (%95 GA: 0,503, 0,868) ile medyan PFS2 plasebo kolunda 32,3 ay olurken (%95 GA: 26,9, 38,3), ribosiklib kolunda ulaşılmamıştır (%95 GA: 39,4, NE).
Çalışma CLEE011F2301 (MONALEESA-3)
Ribosiklib, 2:1 randomize çift kör, plasebo kontrollü, çok merkezli bir faz III klinik çalışmada, önceden endokrin tedavi almamış ya da sadece bir basamak endokrin tedavi almış hormon reseptörü pozitif, HER2-negatif ileri evre meme kanseri olan 726 postmenopozal kadının tedavisinde, tek başına fulvestrant karşısında fulvestrant ile kombinasyon halinde değerlendirilmiştir.
Bu çalışmaya kaydedilen hastaların medyan yaşı 63'tür (aralık 31 - 89). Hastaların %46,7'si 65 yaş ve üzeri olup bunlar arasında 75 yaş ve üzeri hasta oranı %13,8'dir. Dahil edilen hastalar beyaz (%85,3), Asyalı (%8,7) veya siyahtır (%0,7) ve neredeyse tüm hastaların (%99,7) ECOG performans durumu 0 veya 1'dir. Bu çalışmaya birinci ve ikinci basamak hastalar kaydedilmiştir (hastaların %19,1'inde de novo metastatik hastalık söz konusudur). Çalışmaya giriş öncesinde hastaların %42,7'si adjuvan ve %13,1'i neoadjuvan koşullarda kemoterapi almış, %58,5'i adjuvan ve %1,4'ü neoadjuvan koşullarda endokrin tedavisi almış, %21'i ise ilerlemiş meme kanseri koşullarında önceden endokrin tedavisi görmüştür. Çalışma F2301'de %21,2'sinde sadece kemiği tutan hastalık ve %60,5'inde visseral hastalık söz konusudur.
Birincil analiz
Çalışma, tam analiz setinde (randomize edilen tüm hastalar, veri kesme tarihi: 3 Kasım 2017) araştırmacı değerlendirmesine dayanan ve RECIST v1.1 kriterleri kullanılarak 361 progresyonsuz sağkalım (PFS) olayından sonra gerçekleştirilen birincil analizde birincil sonlanım noktasına ulaşmıştır. Birincil PFS analizi tarihinde medyan takip süresi 20,4 ay olmuştur.
Birincil etkililik sonuçları, tam analiz setinde plasebo artı fulvestrant alan hastalar ile karşılaştırıldığında ribosiklib artı fulvestrant alan hastalarda, progresyon veya ölüm bağıl riskinde ribosiklib artı fulvestrant kolu lehine tahmini %41'lik azalmayla, PFS'de istatistiksel olarak anlamlı bir düzelme göstermiştir (tehlike oranı: 0,593, %95 GA: 0,480, 0,732, tek yanlı stratifiye edilmiş log sıra testi p değeri 4,1x10).
Birincil etkililik bulguları körlenmiş bir bağımsız merkezi radyolojik değerlendirme ile %40 görüntüleme alt setinin rastgele merkezi denetimi ile desteklenmiştir (tehlike oranı 0,492; %95 GA: 0,345, 0,703).
İkinci OS ara analizi zamanında PFS için tanımlayıcı bir güncelleme yürütülmüş olup, genel popülasyon ve önceki endokrin tedaviye göre alt gruplarda güncellenmiş PFS bulguları Tablo 14'te özetlenmektedir ve Kaplan-Meier eğrisi Şekil 7'de sunulmaktadır.
Tablo 14 MONALEESA-3(F2301) â Araştırmacı değerlendirmesine dayalı güncellenmiş etkililik PFS sonuçları (veri kesme tarihi 3 Haziran 2019)
| Ribosiklib + fulvestrant N=484 | Plasebo + fulvestrant N=242 |
Progresyonsuz sağkalım genel çalışma popülasyonu | ||
Olay sayısı â n [%] | 283 (58,5) | 193 (79,8) |
Medyan PFS [ay] (%95 GA) | 20,6 (18,6; 24) | 12,8 (10,9 â 16,3) |
Tehlike oranı (%95 GA) | 0,587 (0,488; 0,705) | |
Birinci basamak alt grubu | Ribosiklib + fulvestrant N=237 | Plasebo + fulvestrant N=128 |
Olay sayısı â n [%] | 112 (47,3) | 95 (74,2) |
Medyan PFS [ay] (%95 GA) | 33,6 (27,1; 41,3) | 19,2 (14,9; 23,6) |
Tehlike oranı (%95 GA) | 0,546 (0,415; 0,718) | |
İkinci basamak veya erken relaps alt grubu | Ribosiklib + fulvestrant N=237 | Plasebo + fulvestrant N=109 |
Olay sayısı â n [%] | 167 (70,5) | 95 (87,2) |
Medyan PFS [ay] (%95 GA) | 14,6 (12,5; 18,6) | 9,1 (5,8;11) |
Tehlike oranı (%95 GA) | 0,571 (0,443;0,737) | |
GA=güven aralığı; daha önce endokrin tedavi almamış de novo ileri evre meme kanserli hastalar ve (neo)adjuvan endokrin tedavisinin tamamlanmasından 12 ay sonra relaps olmuş hastalar hastalığı adjuvan tedavi sırasında veya (neo)adjuvan endokrin tedavisinin tamamlanmasından sonraki 12 ay içinde relaps olmuş hastalar ve ileri hastalık için bir basamak endokrin tedaviden sonra progresyon göstermiş hastalar | ||
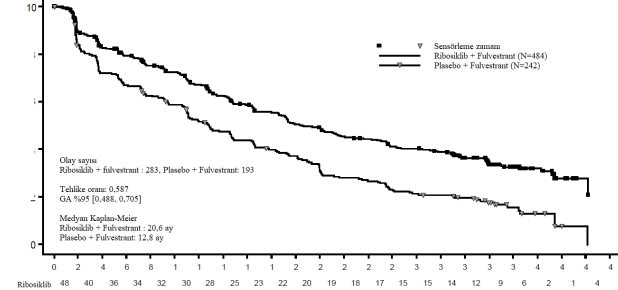
Olaysızlık oranı (%)
Şekil 7 MONALEESA-3 (F2301)â PFS için Araştırmacı değerlendirmesine dayalı Kaplan-Meier grafiği (Veri kesme tarihi: 3 Haziran 2019)
Genel yanıt oranı (ORR) ve RECIST v1.1'e dayalı araştırmacı değerlendirmesine göre klinik fayda oranı (CBR) için etkililik sonuçları Tablo 15'te verilmektedir.
Tablo 15 MONALEESA-3 â Araştırmacı değerlendirmesine dayalı etkililik sonuçları (ORR, CBR) (3 Kasım 2017 veri kesme)
Analiz | Ribosiklib + fulvestrant (%, %95 GA) | Plasebo + fulvestrant (%, %95 GA) |
Tam analiz seti | N=484 | N=242 |
Genel yanıt oranı (ORR) | 32,4 (28,3; 36,6) | 21,5 (16,3;26,7) |
Klinik fayda oranı (CBR) | 70,2 (66,2; 74,3) | 62,8 (56,7;68,9) |
Ölçülebilir hastalığı olan hastalar | N=379 | N=181 |
Genel yanıt oranı | 40,9 (35,9; 45,8) | 28,7 (22,1; 35,3) |
Klinik fayda oranı | 69,4 (64,8;74) | 59,7 (52,5; 66,8) |
Ribosiklib artı fulvestrant ile tedavi edilen hastaların önceden tanımlanmış alt grup analizine dayalı tehlike oranları yaş, önceki tedavi (erken veya ilerlemiş), önceki adjuvan/neoadjuvan kemoterapi veya hormonal tedaviler, karaciğer ve/veya akciğer tutulumu ve sadece kemiği tutan metastatik hastalığı içeren farklı alt gruplar genelinde tutarlı fayda göstermiştir.
Genel Sağkalım Analizi
İkinci genel sağkalım analizinde, çalışma ikincil sonlanım noktasını sağlayarak, genel sağkalımda istatistiksel olarak anlamlı bir iyileşme göstermiştir.
Genel çalışma popülasyonunda ve alt gruplar analizinde bu nihai genel sağkalım analizinden elde edilen bulgular Tablo 16 ve Şekil 8'de sunulmaktadır.
Tablo 16 MONALEESA-3 (F2301) etkililik bulguları (OS) (Veri kesme tarihi: 03- Haz-2019)
| Ribosiklib + fulvestrant | Plasebo + fulvestrant |
Genel çalışma popülasyonu | N=484 | N=242 |
Olay sayısı â n [%] | 167 (34,5) | 108 (44,6) |
Medyan OS [ay] (%95 GA) | NE, (NE;NE) | 40 (37;NE) |
HR (%95 GA) | 0,724 (0,568; 0,924) | |
p-değeri | 0,00455 | |
Birinci basamak alt grubu | n=237 | n=128 |
Olay sayısı â n [%] | 63 (26,6) | 47 (36,7) |
HR (%95 GA) | 0,700 (0,479;1,021) | |
İkinci basamak veya erken relaps alt grubu | n=237 | n=109 |
Olay sayısı â n [%] | 102 (43) | 60 (55) |
HR (%95 GA) | 0,730 (0,530; 1,004) | |
NE = Hesaplanamaz | ||
ve 0,025'lik bir genel anlam düzeyi için Lan-DeMets (O'Brien-Fleming) alfa-harcama fonksiyonu ile tayin edildiği üzere 0,01129'luk bir eşiğe karşı kıyaslanır.
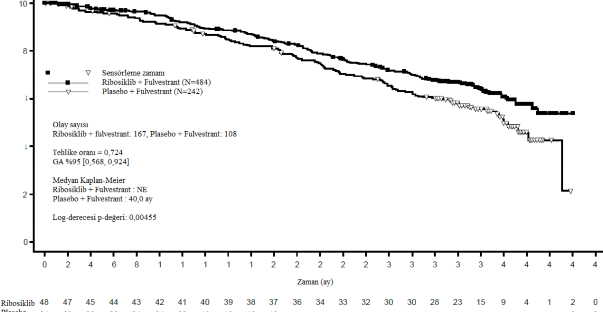
Şekil 8 MONALEESA-3 (F2301) OS Kaplan-Meier grafiği (tam analiz seti [FAS]) (Veri kesme tarihi: 3 Haziran 2019)
Log-sıra testi ve Cox modeli akciğer ve/veya karaciğer metastazları, ileri hastalık için önceki kemoterapi ve IRT'ye göre endokrin kombinasyonu partnerine göre tabakalandırılır.
Ribosiklib kolundaki hastalarda bir sonraki basamak tedavide progresyona veya ölüme (PFS2) kadar geçen süre, genel çalışma popülasyonunda plasebo kolundaki hastalara kıyasla daha uzundur (HR: 0,670 [%95 GA: 0,542, 0,830]). Medyan PFS2, ribosiklib kolu için 39,8 ay (%95
GA: 32,5, NE), plasebo kolunda 29,4 aydır (%95 GA: 24,1, 33,1).
Yaşlı hastalar
MONALEESA-2 ve MONALEESA-3 çalışmalarında ribosiklib alan tüm hastaların temsili oranları ≥65 yaş ve ≥75 yaş arasındadır (bkz. Bölüm 5.1). Bu hastalar ile daha genç hastalar arasında ribosiklibin güvenliliği ve etkililiği bakımından genel farklılıklar gözlenmemiştir (bkz. Bölüm 4.2).
Böbrek yetmezliği olan hastalar
Üç pivot çalışmada (MONALEESA-2, MONALEESA-3 ve MONALEESA-7), normal böbrek fonksiyonu olan 510 (% 53,8) hasta, hafif böbrek yetmezliği olan 341 (%36) hasta ve orta derecede böbrek yetmezliği olan 97 (% 10,2) hasta ribosiklib ile tedavi edilmiştir. Şiddetli böbrek yetmezliği olan hastalar, çalışmalara dahil edilmemiştir. Normal böbrek fonksiyonu olanlara kıyasla, 600 mg başlangıç dozunda ribosiklib alan hafif ve orta derecede böbrek yetmezliği olan hastalarda progresyonsuz sağkalım sonuçları tutarlıdır. Güvenlilik profili, renal kohortlar arasında genel olarak tutarlıdır (bkz. Bölüm 4.8).
5.2. Farmakokinetik özellikler
Genel özelliklerRibosiklibin farmakokinetiği, ilerlemiş meme kanseri olan hastalarda 50 mg ila 1200 mg'lık günlük oral dozlarından sonra incelenmiştir. Sağlıklı gönüllülere 400 mg ile 600 mg arasında tek oral dozlar veya tekrarlı 400 mg dozları (8 gün) verilmiştir.
Emilim:
Ribosiklibin mutlak biyoyararlanımı bilinmemektedir.
Ribosiklib oral kullanımın ardından C'a ulaşma zamanı (T) 1-4 saat arasında olmuştur. Ribosiklib, test edilen doz aralığında (50 - 1200 mg) maruziyette (Cve EAA) oransal değerin biraz üzerinde artışlar sergilemiştir. Tekrarlanan günlük tek doz uygulamaları sonrasında kararlı durumuma genellikle 8 gün sonra ulaşılmıştır ve ribosiklib, 2,51 geometrik ortalama birikme oranı (aralık: 0,97-6,4) ile birikme göstermiştir.
Besin etkisi
Açlık durumu ile karşılaştırıldığında, ribosiklib film kaplı tabletin tek bir 600 mg dozunun yüksek oranda yağ içeren yüksek kalorili bir öğün ile birlikte oral yolla uygulanmasının, ribosiklibin emilim hızı ve ölçüsü üzerinde herhangi bir etkisi olmamıştır.
Dağılım:
Ribosiklibin insan plazma proteinlerine bağlanması in vitro ortamda yaklaşık %70 bulunmuştur ve konsantrasyondan bağımsız olmuştur (10 - 10000 ng/ml). Ribosiklib kırmızı kan hücreleri ile plazma arasında eşit dağılmış, in vivo ortamda kan-plazma oranı 1,04 bulunmuştur. Popülasyon farmakokinetik analizine dayanılarak kararlı durumda görünür dağılım hacmi (Vss/F) 1090 litredir.
Biyotransformasyon:
In vitro ve in vivo çalışmalar ribosiklibin insanda ağırlıklı olarak CYP3A4 aracılığıyla olmak üzere geniş ölçüde hepatik metabolizma ile eliminasyona uğradığını göstermiştir. [C] ribosiklibin 600 mg'lık tek dozunun insanlara oral uygulanmasından sonra ribosiklib için ana metabolik yolaklar, oksidasyonu (dealkilasyon, C ve/veya N-oksijenasyon, oksidasyon (-2H)) ve bunların kombinasyonlarını içermiştir. Ribosiklib faz 1 metabolitlerinin faz II konjügatları N-asetilasyon, sülfasyon, sistein konjügasyonu, glikozilasyon ve glukuronidasyonu içermiştir. Ribosiklib, plazmadaki başlıca dolaşan ilaç kaynaklı entite olmuştur. Dolaşımdaki başlıca metabolitler metabolit M13 (CCI284, N-hidroksilasyon), M4 (LEQ803, N-demetilasyon) ve M1'i (ikincil glukuronid) içermiştir. Ribosiklibin klinik aktivitesi (farmakolojik ve güvenlilik) başta ana ilaç kaynaklı olmuş, dolaşımdaki metabolitlerin göz ardı edilebilir katkısı olduğu görülmüştür.
Ribosiklib geniş ölçüde metabolize olmuş olup, değişmemiş ilaç feçes ve idrarda sırasıyla
%17,3 ve %12,1'e karşılık gelmiştir. Metabolit LEQ803 dışkıda önemli bir metabolit olmuş ve feçes ve idrarda sırasıyla uygulanan dozun yaklaşık %13,9 ve %3,74'ünü temsil etmiştir. Gerek feçes gerekse idrarda sayısız başka metabolit de minör miktarlarda tespit edilmiştir (uygulanan dozun ≤ %2,78'i).
Eliminasyon:
İlerlemiş kanseri olan hastalarda 600 mg'da kararlı durumda geometrik ortalama plazma efektif yarılanma ömrü (birikme oranına dayalı) 32 saat (%63 CV) ve geometrik ortalama görünür oral klirens (CL/F) 25,5 l/saat (%66 CV) bulunmuştur. Sağlıklı gönüllülerdeki çalışmalarda 600 mg
dozunda ribosiklibin geometrik ortalama görünür plazma terminal yarılanma ömrü (T) 29,7 ile 54,7 saat, ribosiklibin geometrik ortalama CL/F değeri ise 39,9 ila 77,5 l/saat aralığında olmuştur.
Ribosiklib ve metabolitleri renal yolağın küçük bir katkısı ile ağırlıklı olarak feçes ile elimine olur. 6 sağlıklı erkek gönüllüde, tek bir oral [C] ribosiklib dozunun uygulanmasından sonra uygulanan toplam radyoaktivitenin %91,7'si 22 gün içinde tespit edilmiştir; feçes ana atılma yolu olup (%69,1) dozun %22,6'sı idrarda tespit edilmiştir.
Doğrusallık/doğrusal olmayan durum:
Ribosiklib, test edilen 50 ila 1200 mg doz aralığında hem tek hem de tekrarlı dozlardan sonra maruziyette (Cve EAA) oransal değerin biraz üzerinde artışlar sergilemiştir. Bu analiz doz gruplarının çoğu için küçük örneklem büyüklükleri ile sınırlıdır ve verilerin çoğu 600 mg doz grubundan gelmektedir.
Hastalardaki karakteristik özellikler
Özel popülasyonlar Böbrek bozukluğu
Böbrek fonksiyonunun ribosiklib farmakokinetiği üzerindeki etkisi 400 mg'lık tek bir ribosiklib dozunda, normal böbrek fonksiyonuna sahip (mutlak GFR [aGFR] ≥90 ml/dakika)14 sağlıklı gönüllü ile hafif böbrek yetmezliği (aGFR 60 ila <90 ml/dakika) olan 8, orta derece böbrek yetmezliği olan (aGFR 30 ile <60 ml/dakika) 6, şiddetli böbrek yetmezliği olan (aGFR 15 ila
<30 ml/dakika) 7 gönüllünün ve son dönem böbrek hastalığı (aGFR <15 ml/dakika) olan (SDBY) 3 hastanın dahil edildiği bir böbrek yetmezliği çalışmasında değerlendirilmiştir.
Normal böbrek fonksiyonu olan gönüllülerde maruz kalmaya göre hafif, orta ve şiddetli böbrek yetmezliği olan hastalarda EAA1,6 kat, 1,9 kat ve 2,7 kat ve C1,8 kat, 1,8 kat ve 2,3 kat artmıştır. Ribosiklibin etkililik ve güvenlilik çalışmaları, hafif böbrek yetmezliği olan hastaların büyük bir kısmını kapsadığından (bkz. Bölüm 5.1), böbrek yetmezliği çalışmasında orta veya şiddetli böbrek yetmezliği olan gönüllülerden elde edilen veriler, normal böbrek fonksiyonu olan ve hafif renal yetmezliği olan gönüllülere ait birleştirilmiş verilerle karşılaştırılmıştır. Normal böbrek fonksiyonu ve hafif böbrek yetmezliği olan gönüllülere ait birleştirilmiş verilerle karşılaştırıldığında, orta ve şiddetli böbrek yetmezliği olan hastalarda EAAsırasıyla 1,6 kat ve 2,2 kat ve Cise 1,5 kat ve 1,9 kat artmıştır. Az sayıda denek nedeniyle SDBY'li denekler için bir kat farkı hesaplanmamıştır, ancak sonuçlar şiddetli böbrek yetmezliği olan deneklere kıyasla ribosiklib maruziyetinde benzer veya biraz daha büyük bir artışa işaret etmektedir.
Böbrek fonksiyonunun ribosiklib farmakokinetiği üzerindeki etkisi, hastalara 600 mg başlangıç dozunun verildiği etkinlik ve güvenlik çalışmalarına dahil edilen kanser hastalarında da değerlendirilmiştir (bkz. Bölüm 5.1). 600 mg ribosiklibin tek doz veya tekrarlı dozlar halinde oral uygulamasını takiben kanser hastalarında yapılan çalışmalardan elde edilen farmakokinetik verilerin bir alt grup analizinde, hafif (n=57) veya orta (n=14) böbrek yetmezliği olan hastalarda ribosiklibin EAAve Cdeğerleri, normal böbrek fonksiyonu olan hastalardaki (n=86) EAAve Cile karşılaştırılabilir olup, hafif veya orta derecede böbrek yetmezliğinin ribosiklib maruziyeti üzerinde klinik olarak anlamlı bir etkisi olmadığını düşündürmektedir.
Karaciğer bozukluğu
Karaciğer bozukluğu olan kansersiz gönüllülerde yürütülen bir farmakokinetik çalışmaya dayanılarak, hafif karaciğer bozukluğunun ribosiklib maruziyetine herhangi bir etkisi olmamıştır (bkz. bölüm 4.2). Ribosiklib için ortalama maruziyet, orta şiddetli (geometrik ortalama oran [GMR]: Ciçin 1,44; EAAiçin 1,28) ve şiddetli (GMR: Ciçin 1,32; EAAiçin 1,29) karaciğer bozukluğu olan hastalarda iki kattan az artış göstermiştir (bkz. Bölüm 4.2).
Normal karaciğer fonksiyonuna sahip 160 meme kanserli hasta ve hafif karaciğer bozukluğuna sahip 47 hastayı içeren bir popülasyon farmakokinetiği analizine dayanılarak, hafif karaciğer bozukluğunun ribosiklib maruziyetine herhangi bir etkisi olmayarak spesifik karaciğer bozukluğu çalışmasının bulgularını desteklemiştir. Ribosiklib orta şiddette veya şiddetli hepatik bozukluğu olan meme kanseri hastalarında araştırılmamıştır.
Yaş, ağırlık, cinsiyet ve ırkın etkisi
Popülasyon farmakokinetik analizi yaş, beden ağırlığı veya cinsiyetin ribosiklibin sistemik maruziyetinde doz ayarlaması gerektirebilecek bir etkisinin olmadığını göstermiştir. Farmakokinetikte ırka bağlı değişikliklerin verileri sonuca varabilmek için çok sınırlıdır.
In vitro etkileşimler
Ribosiklibin sitokrom P450 enzimleri üzerindeki etkisi
İn vitro, ribosiklib klinik açıdan ilgili konsantrasyonlarda CYP1A2, CYP2E1 ve CYP3A4/5'in geri dönüşümlü inhibitörü ve CYP3A4/5'in zamana bağımlı inhibitörüdür. İn vitro değerlendirmeler ribosiklibin klinik açıdan ilgili konsantrasyonlarda CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 ve CYP2D6'nın aktivitelerini inhibe etme potansiyeline sahip olmadığını göstermiştir. Ribosiklib CYP1A2, CYP2C9 ve CYP2D6'nın zamana bağımlı inhibisyonu için potansiyele sahip değildir.
İn vitro veriler ribosiklibin UGT enzimlerini veya CYP enzimleri CYP2C9, CYP2C19 ve CYP3A4'ü PXR ile indükleme potansiyeline sahip olmadığını göstermektedir. Bu nedenle, VALAMOR'un bu enzimlerin substratlarını etkilemesi olası değildir. İn vitro veriler CAR aracılığıyla CYP2B6'yı indükleme potansiyelini dışlamak için yeterli değildir.
Transporterlerin ribosiklib üzerindeki etkisi
Ribosiklib, in vitroda P-gp için bir substrattır; fakat kütle denge verilerine dayalı olarak, P-gp veya BCRP inhibisyonunun terapötik dozlarda ribosiklib maruziyetini etkileme olasılığı yoktur. Ribosiklib in vitroda, karaciğer alım transporterleri OATP1B1, OATP1B3 veya OCT-1'nin bir substratı değildir.
Ribosiklibin transporterler üzerindeki etkisi:
İn vitro değerlendirmeler, ribosiklibin, ilaç transporterleri P-gp, BCRP, OATP1B1/1B3, OCT1, OCT2, MATE1 ve BSEP'nin aktivitelerini inhibe etme potansiyeline sahip olduğuna işaret etmiştir. Ribosiklib in vitroda klinik açıdan önemli konsantrasyonlarda OAT1, OAT3 veya MRP2'yi inhibe etmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi
Köpeklerdeki in vivo kardiyak güvenlilik çalışmalarında, önerilen 600 mg dozundan sonra hastalarda elde edilmesi beklenecek maruziyette doz ve konsantrasyon ile ilişkili QTc aralığı
uzaması gösterilmiştir. Artmış maruziyetlerde (beklenen klinik C'ın yaklaşık 5 katı) prematür ventriküler kontraksiyon (PVC'ler) olaylarını tetikleme potansiyeli de mevcuttur.
Tekrarlı doz toksisitesi
Sıçanlarda 27 haftaya ve köpeklerde 39 haftaya varan tekrarlı doz toksisitesi çalışmaları (3 haftalık tedavi/1 haftalık tedavisiz tedavi planı), ribosiklib toksisitesinin ana hedef organı olarak hepatobiliyer sistemi göstermiştir (proliferatif değişiklikler, kolestaz, kum benzeri safra taşı ve koyu safra). Tekrarlı doz çalışmalarında ribosiklibin farmakolojik etkisi ile ilişkili hedef organlar kemik iliğini (hiposellülerite), lenfoid sistem (lenfoid deplesyonu), intestinal mukoza (atrofi), deri (atrofi), kemik (azalmış kemik formasyonu), böbrek (tübüler epitel hücrelerde eş zamanlı dejenerasyon ve rejenerasyon) ve testisi (atrofi) içermiştir. Testiste görülen geri dönüşlülük eğilimi göstermiş atrofik değişikliklerin yanı sıra diğer tüm değişiklikler 4 haftalık tedavisiz periyottan sonra tamamen geri dönüşlü olmuştur. Bu etkiler, testiküler germ hücreler üzerinde, seminiferöz tübüllerde atrofi ile sonuçlanan doğrudan anti-proliferatif etki ile bağlantılı olabilir. Toksisite çalışmalarında hayvanlarda ribosiklibe maruziyet genellikle 600 mg/gün (EAA bazında) çoklu dozları alan hastalarda gözlenenden küçük veya eşit olmuştur.
Üreme toksisitesi/Fertilite
Ribosiklib, sıçanda veya tavşanda maternal toksisite göstermeyen dozlarda fetotoksisite ve teratojenisite göstermiştir. Prenatal maruziyetten sonra EAA bazında en yüksek önerilen doz olan 600 mg/gün dozunda, sırasıyla insandaki maruziyetten daha düşük düzeylerde veya insandaki maruziyetin 1,5 katında ribosiklib ile sıçanlarda daha yüksek implantasyon sonrası kayıp ve azalmış fetal ağırlık insidansları gözlenmiştir ve ribosiklib tavşanlarda teratojeniktir.
Sıçanlarda, geçici olarak değerlendirilmiş ve/veya düşük fetal ağırlıkla ilişkilendirilmiş iskelet değişikliklerinin eşlik ettiği azalmış fetal ağırlık tespit edilmiştir. Tavşanlarda, embriyofetal gelişim üzerine, fetal anomaliler (malformasyonlar ve dış, iç organ ve iskelet varyantları) ve fetal büyüme (daha düşük fetal ağırlıklar) insidansında artış ile kanıtlanmış olan advers etkiler olmuştur. Bu bulgular azalmış/küçük akciğer loblarını ve aort arkında ek damarı ve diyafram fıtığını, aksesuar lobun olmamasını veya (kısmen) kaynaşmış akciğer loblarını ve azalmış/küçük aksesuar akciğer lobunu (30 ve 60 mg/kg), ekstra/ rudimenter onüçüncü kaburgayı ve şekilsiz hiyoid kemiğini ve polekste azalmış parmak kemiği sayısını içermiştir. Herhangi bir embriyofetal mortalite göstergesi söz konusu olmamıştır.
Dişi sıçanlardaki bir fertilite çalışmasında ribosiklib, 300 mg/kg/güne kadarki dozlarda (olasılıkla, EAA bazında en yüksek önerilen doz olan 600 mg/gün dozunda hastalardaki klinik maruziyetten daha düşük veya eşit bir maruziyette) üreme fonksiyonunu, fertiliteyi ya da erken dönem embriyonik gelişimi etkilememiştir.
Ribosiklib erkek fertilitesi çalışmalarında değerlendirilmemiştir. Bununla birlikte, sıçan ve köpek toksisite çalışmalarında, EAA bazında en yüksek önerilen doz olan 600 mg/gün dozundaki maruziyetin altında veya bu maruziyete eşit düzeylerde, testislerde atrofik değişiklikler bildirilmiştir.
Bu etkiler, testiküler germ hücreler üzerinde, seminiferöz tübüllerde atrofi ile sonuçlanan doğrudan anti-proliferatif etki ile bağlantılı olabilir.
Ribosiklib ve metabolitleri sıçan sütüne kolaylıkla geçmiştir. Ribosiklibe maruziyet sütte plazmadıkinden daha yüksektir.
Genotoksisite
Bakteriyel in vitro sistemlerde ve memeli in vivo ve in vitro sistemlerde metabolik aktivasyon içeren veya içermeyen genotoksisite çalışmaları, ribosiklibin genotoksik potansiyeline ilişkin herhangi bir kanıt ortaya koymamıştır.
Karsinojenez
Ribosiklib, sıçanlarda yapılan 2 yıllık bir çalışmada karsinojenite açısından değerlendirilmiştir.
Ribosiklibin 2 yıl boyunca oral yoldan ≥300 mg/kg/gün dozlarda verilmesi, dişi sıçanların uterusunda/serviksinde endometriyal epitelyal tümörler ve glandüler ve skuamöz hiperplazi insidansında artışa ve 50 mg/kg/gün dozunda verilmesi ise erkek sıçanların tiroid bezinde foliküler tümörlerde insidansta artışa neden olmuştur. Neoplastik değişikliklerin görüldüğü dişi ve erkek sıçanlarda kararlı durumda (EAA) ortalama maruziyet, hastalarda önerilen 600 mg/gün dozunda elde edilenin sırasıyla 1,2 ve 1,4 katıdır. Neoplastik değişikliklerin görüldüğü dişi ve erkek sıçanlarda kararlı durumda ortalama maruziyet (EAA), hastalarda 400 mg/gün dozunda elde edilenin sırasıyla 2,2 ve 2,5 katı olmuştur.
Ek neoplastik olmayan proliferatif değişiklikler, artan karaciğer değiştirilmiş odakları (bazofilik ve berrak hücreli) ve erkek sıçanlarda testiküler interstisyel (Leydig) hücre hiperplazisini, sırasıyla ≥5 mg/kg/gün ve 50 mg/kg/gün dozlarında içermiştir.
Rahim/serviks ve testiküler interstisyel (Leydig) hücreler üzerindeki etkiler, hipofiz bezinde laktotrofik hücre fonksiyonunun CDK4 inhibisyonuna bağlı olarak hipotalamus-hipofiz- gonadal ekseni değiştiren uzun süreli hipoprolaktinemi ile ilişkili olabilir.
Erkeklerde tiroid bulguları için potansiyel mekanizmalar, karaciğerde kemirgenlere özgü bir mikrozomal enzim indüksiyonunu ve/veya persistan hedefli (on-target) bir hipoprolaktinemiye ikincil olarak hipotalamus-hipofiz-testis-tiroid ekseninin disregülasyonunu içerir.
Bu mekanizma ile insanlarda östrojen/progesteron oranındaki herhangi bir potansiyel artış, ribosiklibin insanlarda östrojen seviyesini azaltan tedavilerle kombinasyon halinde kullanım endikasyonu olduğu gibi, östrojen sentezi üzerindeki eş zamanlı anti-östrojen tedavisinin bir inhibitör etkisi ile telafi edilecektir.
Prolaktin sentezi ve rolü açısından kemirgenler ve insanlar arasındaki önemli farklılıklar göz önüne alındığında, bu etki biçiminin insanlarda sonuçları olması beklenmemektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tablet bileşenleri:
Mikrokristalin selüloz Krospovidon (Tip A)
Düşük sübstitüe hidroksipropilselüloz Magnezyum stearat
Kolloidal silikon dioksit
Film kaplama bileşenleri:
Siyah demir oksit (E172) Kırmızı demir oksit (E172) Soya lesitin
Polivinil alkol (kısmen hidrolize)
Talk
Titanyum dioksit (E171) Ksantan sakızı
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
30C'nin altında oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
21 film kaplı tablet içeren PCTFE/PVC blisterler
Ambalaj büyüklüğü: 63 film kaplı tablet
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor.
Gıda Alerjisi
Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
En Yaygın Alerji Türleri Bağışıklık sistemi, polen, arı zehiri veya evcil hayvan gibi yabancı bir maddeye veya çoğu insanda reaksiyona neden olmayan bir yiyeceğe tepki gösterdiğinde alerjiler meydana gelir. |
 |
Artrit Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
İLAÇ GENEL BİLGİLERİ
Farmanova Sağlık Hizmetleri Ltd. Şti
| Satış Fiyatı | 19712.74 TL [ 10 Jul 2023 ] |
| Önceki Satış Fiyatı | 19354.33 TL [ 3 Jul 2023 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699074090721 |
| Etkin Madde | Ribosiklib |
| ATC Kodu | L01EF02 |
| Birim Miktar | 200 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 63 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |