VALCYTE 50 mg/ml oral çözelti için toz 100 ml Kısa Ürün Bilgisi
{ Valgansiklovir }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
VALCYTE 50 mg/mL oral çözelti için toz
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir şişe, 12 g oral çözelti için toz içinde 5,5 g valgansiklovir hidroklorür içerir.
Sulandırılmasının ardından, 1 mL çözelti, 50 mg valgansiklovir'e eşdeğer (serbest baz), 55 mg valgansiklovir hidroklorür içerir.
Yardımcı maddeler
Sodyum Benzoat: 0,10 g (15 mg sodyum ihtiva eder) Sodyum Sakarin: 0,03 g (2 mg sodyum ihtiva eder) Propilen Glikol: 0,017 g
Mannitol: 5,78 g
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Oral çözelti için toz.
Toz, beyaz - açık sarı renkte granüldür.
Toz sulandırıldığında temiz, renksiz – kahverengi bir çözelti oluşturur.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
VALCYTE,
Edinilmiş immün yetmezlik sendromu (AIDS) olan erişkin hastalardaki sitomegalovirüs (CMV) retiniti tedavisinde,
4.2. Pozoloji ve uygulama şekli
Pozoloji/ uygulama sıklığı ve süresi:Dikkat: Doz aşımından kaçınmak için, önerilen dozlara kesinlikle uyulması gereklidir (bkz. Bölüm 4.4 ve 4.9).
Valgansiklovir, oral dozlama sonrasında hızlı ve yoğun bir şekilde gansiklovir'e
metabolize olur. Günde iki kere 900 mg oral olarak alınan valgansiklovir, günde iki
kere 5 mg/kg dozlamasıyla intravenöz alınan gansiklovir'e terapötik olarak eşdeğerdir. 900 mg valgansiklovir oral çözeltisinin uygulamasını takiben gansiklovir'in sistemik maruziyeti, 900 mg valgansiklovir tabletlerine eşdeğerdir.
Uygulama sıklığı ve süresi:
Sitomegalovirüs (CMV) retiniti tedavisinde:
Erişkinler:
CMV retinitinin indüksiyon tedavisinde:
Aktif CMV retiniti olan erişkin hastalarda önerilen doz, 21 gün süreyle günde iki defa olmak üzere 900 mg'dır. Uzun süreli indüksiyon tedavisi, kemik iliği toksisitesi riskini artırabilir (bkz. Bölüm 4.4).
CMV retinitinin idame tedavisi:
İndüksiyon tedavisinin devamında ya da inaktif CMV retiniti olan yetişkin hastalarda önerilen doz günde bir kez alınan 900 mg'dır. Retiniti kötüleşen hastalar indüksiyon tedavisini tekrar edebilir, ancak viral ilaç direnci olasılığına dikkat edilmelidir (bkz. CMV retinitinin indüksiyon tedavisi).
İdame tedavisinin süresi bireysel olarak belirlenmelidir. Çocuklar:
CMV retiniti tedavisi alan pediyatrik hastalarda VALCYTE'in güvenliliği ve etkililiği, yeterli ve iyi kontrollü klinik çalışmalar ile kanıtlanmamıştır.
Solid organ transplantasyonunda CMV hastalığının önlenmesinde:
Erişkinler:
Böbrek nakli hastalarında önerilen doz, transplantasyondan sonraki 10 gün içinde başlayarak ve transplantasyondan sonraki 100. güne kadar devam eden günde bir kez alınan 900 mg'dır. Transplantasyondan sonraki 200. güne kadar profilaksiye devam edilebilir (bkz. Bölüm 4.4, 4.8 ve 5.1).
Böbrek nakli haricinde solid organ nakli almış erişkin hastalarda önerilen doz, transplantasyondan sonraki 10 gün içinde başlayarak ve transplantasyondan sonraki
100. güne kadar devam eden, günde bir kez alınan 900 mg'dır.
Çocuklar:
Doğumdan itibaren, CMV hastalığı geliştirme riski olan pediyatrik solid organ nakli hastalarında önerilen günlük VALCYTE dozu, vücut yüzeyi alanına (VYA) ve Schwartz formülünden elde edilen kreatinin klerensine (KrKlS) dayanmakta ve aşağıdaki denklem kullanılarak hesaplanmaktadır:
Pediyatrik doz (mg) = 7 x VYA x KrKlS
(Lütfen aşağıda yer alan Mosteller VYA formülü ve Schwartz Kreatinin Klerensi
formüllerine bakınız).
Eğer hesaplanan Schwartz kreatinin klerensi 150 mL/dak/1,73 m'yi geçerse, denklemde maksimum değer olarak 150 mL/dak/1,73 m kullanılmalıdır.
Mosteller VYA (m) = 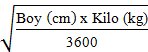
Schwartz Kreatinin Klerensi (mL/dk/1,73 m) = ![]() Burada k değeri;
Burada k değeri;
2 yaşından küçük hastalar için 0,45 2-13 yaş erkek çocuklar için 0,55
2-16 yaş kız çocuklar için 0,55
13-16 yaş erkek çocuklar için 0,7 olarak alınır.
Lütfen 16 yaşından büyük hastalar için erişkin dozunu dikkate alınız.
Verilen k değerleri, serum kreatin ölçümü için kullanılan Jaffe yöntemine dayanmaktadır ve enzimatik yöntemler kullanılması halinde düzeltme gerektirebilir.
* Belirli alt popülasyonlarda k değerinin düşürülmesi gerekebilir (örn. düşük doğum ağırlığına sahip olan pediyatrik hastalarda).
Pediyatrik böbrek nakli hastalarında, önerilen günlük mg dozuna (7 x VYA x KrKlS) nakil işleminden sonraki 10 gün içinde başlanmalıdır ve nakilden sonraki 200. güne kadar devam edilmelidir.
Böbrek nakli haricinde herhangi bir solid organ nakli alan pediyatrik hastalarda, önerilen günlük mg dozuna (7 x VYA x KrKlS) nakil işleminden sonraki 10 gün içinde başlanmalıdır ve nakilden sonraki 100. güne kadar devam edilmelidir.
Gerçek verilebilir doz için, hesaplanan doz 25 mg'ın katlarına artırılarak yuvarlanmalıdır. Oral dispenser mL olarak derecelendirilir. 50 mg'lık doz 1 mL'ye eşdeğerdir:
Valgansiklovir dozu | VALCYTE oral çözelti için uygulanacak doz |
50 mg | 1 mL |
75 mg | 1,5 mL |
100 mg | 2 mL |
500 mg | 10 mL |
Eğer hesaplanan doz 900 mg (2x9 mL)'ı geçerse, maksimum doz olan 900 mg (2x9
mL) uygulanmalıdır.
VALCYTE oral çözelti, tedaviyi yukarıdaki formülde hesaplanan doza göre uygulama şansı vermesi açısından tercih edilen formülasyondur, fakat eğer hesaplanan doz ile mevcut doz arasındaki sapma %10'dan az ise ve hasta tablet yutabilir durumda ise VALCYTE film kaplı tabletler de tercih edilebilir. Örneğin alınacak dozun, 405 mg ile
495 mg arasında bir değer olarak hesaplandığı durumda 1 adet 450 mg tablet kullanılabilir.
Profilaksi dönemi boyunca, hastanın serum kreatinin seviyelerinin, boy ve vücut ağırlığındaki değişikliklerin düzenli olarak takip edilmesi ve buna göre uygun dozun tekrar düzenlenmesi önerilmektedir.
Uygulama şekli:
VALCYTE oral yoldan uygulanır ve mümkünse yiyeceklerle birlikte alınmalıdır (bkz. Bölüm 5.2).
Bu tıbbi ürünü kullanmadanya da uygulamadan önce alınması gereken önlemler:
VALCYTE oral çözelti için tozu, oral uygulama öncesinde sulandırmak gerekmektedir. İki oral dozlama dispenseri 0,5 mL derecelendirme ile 10 mL'ye (500 mg) kadar hacim sağlamaktadır. Hastaların kutuda bulunan dispenseri kullanması önerilmektedir. VALCYTE oral çözelti için oral uygulamadan önce tozun sulandırılması ile ilgili talimatlar için Bölüm 4.4 ve Bölüm 6.6'ya bakınız.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Serum kreatinin ya da kreatinin klerens düzeyleri dikkatle izlenmelidir. Kreatinin klerensi doğrultusunda, aşağıdaki tabloda gösterildiği şekilde doz ayarlaması gereklidir (bkz. Bölüm 4.4 ve 5.2).
Tablo 1. Böbrek yetmezliği olan hastalarda VALCYTE oral çözelti için toz dozu
KrKl (mL/dk) İndüksiyon dozu İdame/önleme dozu
 60
40 – 59
25 – 39
10 –24
< 10
Günde iki kez 900 mg Günde iki kez 450 mg Günde bir kez 450 mg Günde bir kez 225 mg
200 mg (diyaliz sonrası haftada üç defa)
Günde bir kez 900 mg Günde bir kez 450 mg Günde bir kez 225 mg Günde bir kez 125 mg 100 mg (diyaliz sonrası haftada üç defa)
Kreatinin klerensi, serum kreatinine bağlı olarak aşağıdaki formül yardımıyla
hesaplanır:
Erkekler için = | (140 – yaş [yıl]) x (vücut ağırlığı [kg]) |
(72) x (0,011 x serum kreatinin [mikromol/L]) |
Kadınlar için= 0,85 x erkeklerdeki değer Böbrek yetmezliği olan hastalar için dozaj:
Valgansiklovir dozu | VALCYTE oral çözelti için uygulanacak doz |
125 mg | 2,5 mL |
225 mg | 4,5 mL |
450 mg | 9 mL |
Hemodiyalize giren hastalar:
Hemodiyaliz alan hastalarda (KrKl < 10 mL/dk) doz ayarlaması gereklidir (bkz. Bölüm 4.4 ve 5.2) ve doz tavsiyesi yukarıdaki Tablo 1'de verilmiştir.
Karaciğer yetmezliği:
VALCYTE'ın etkililiği ve güvenliliğine ilişkin çalışma yoktur (bkz. Bölüm 5.2).
Pediyatrik popülasyon:
Pediyatrik solid organ nakli hastalarının dozlanması, hastanın böbrek fonksiyonu ve vücut yüzey alanına bağlı olarak bireyselleştirilir.
Geriyatrik popülasyon:
Bu hasta popülasyonundaki güvenlilik ve etkililik henüz belirlenmemiştir. 65 yaş üstü yetişkinlerde herhangi bir çalışma yapılmamıştır. Böbrek klerens düzeyleri yaş ile birlikte azaldığından, VALCYTE geriyatrik hastalarda böbrek durumları göz önünde bulundurularak uygulanmalıdır (bkz. Tablo 1).
Ağır lökopeni, nötropeni, anemi, trombositopeni ve pansitopeni olan hastalar:
Tedaviye başlamadan önce Özel kullanım uyarıları ve önlemleri bölümüne bakınız.
VALCYTE ile tedavi sırasında kan hücreleri sayımında ciddi bir bozulma varsa, hematopoetik büyüme faktörleriyle tedavi ve/veya doz azaltımlarının gündeme getirilmesi önerilir (bkz. Bölüm 4.4).
4.3. Kontrendikasyonlar
VALCYTE, valgansiklovir, gansiklovir, ya da ilacın bileşenlerinden herhangi birine karşı aşırı duyarlı olduğu bilinen hastalarda kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Çapraz aşırı duyarlılık
Gansiklovir ile asiklovir ve pensiklovirin kimyasal yapısının benzerliği nedeniyle, bu ilaçlar arasında bir çapraz aşırı duyarlılık reaksiyonu oluşması mümkündür. Bu
nedenle, asiklovir ve pensiklovire (veya ön ilaçları, sırasıyla valasiklovir veya famsiklovir) karşı aşırı duyarlılığı olduğu bilinen hastalarda VALCYTE reçete edilirken dikkatli olunmalıdır.
Kullanmadan önce alınacak önlemler
Teratojenik karakteri nedeni ile, VALCYTE tozu ve sulandırılmış solüsyonu dikkatle ele alınmalıdır. İnhalasyondan kaçınılmalıdır. Eğer toz veya solüsyon direkt ciltle temas ederse, bu bölge su ve sabun ile iyice yıkanmalıdır. Eğer solüsyon gözünüze bulaşırsa, göz derhal su ile iyice yıkanmalıdır (bkz. Bölüm 6.6).
Mutajenite, teratojenisite, karsinojenisite, doğurganlık ve kontrasepsiyon
Valgansiklovir tedavisine başlamadan önce, hastalar fetusa yönelik potonsiyel riskler konusunda uyarılmalıdır. Hayvan deneylerinde gansiklovirin mutajenik, teratojenik ve karsinojenik olduğu ve üreme yeteneğini baskıladığı görülmüştür. Bu sebeple VALCYTE insanlarda potansiyel bir teratojen ve karsinojen olarak kabul edilebilir ve doğum kusurlarına ve kansere yol açma potansiyeli vardır (bkz. Bölüm 5.3). Klinik ve klinik dışı çalışmalara bağlı olarak VALCYTE'ın ayrıca spermatogenezin geçici veya kalıcı olarak inhibisyonuna neden olduğu düşünülmektedir. Çocuk doğurma potansiyeline sahip kadınlara, tedavi sırasında ve tedaviden sonra en az 30 gün boyunca etkili bir kontrasepsiyon yöntemi kullanmaları önerilmelidir. Erkek hastalara, kadın partnerin kesinlikle gebe kalma riski bulunmadığı durumlar dışında, tedavi sırasında ve tedaviden sonra en az 90 gün boyunca, bariyer yöntemiyle kontrasepsiyon uygulamaları tavsiye edilmelidir (bkz. Bölüm 4.6, 4.8 ve 5.3).
Valgansiklovir uzun vadede karsinojenisite ve üreme toksisitesi yaratma potansiyeline sahiptir.
Miyelosupresyon
VALCYTE (ve gansiklovir) ile tedavi edilen hastalarda, ağır lökopeni, nötropeni, anemi, trombositopeni, pansitopeni, kemik iliği depresyonu ve aplastik anemi gözlenmiştir. Mutlak nötrofil sayımı 500 hücre/mcL'den, ya da trombosit sayımı 25.000/mcL'den, veya hemoglobin 8 g/dL'den düşük ise, tedavi başlatılmamalıdır (bkz. Bölüm 4.2 ve 4.8).
Profilaksi için kullanımın 100 günü aşması halinde lökopeni ve nötropeni gelişme riski dikkate alınmalıdır (bkz. Bölüm 4.2, 4.8 ve 5.1).
VALCYTE, önceden var olan hematolojik sitopeni veya ilaçla ilgili hematolojik sitopeni hikayesi olan hastalarda ve radyoterapi alan hastalarda dikkatle kullanılmalıdır.
Tedavi süresince tam kan ve trombosit sayımları düzenli olarak izlenmelidir. Böbrek yetmezliği olan ve pediyatrik hastalarda, hastanın nakil kliniğine her gitmesinde hematolojik izlemin arttırılması gerekebilir. Ağır lökopeni, nötropeni, anemi ve/veya trombositopeni olan hastalarda, hematopoetik büyüme faktörleriyle tedavi ve/veya doz azaltımlarının gündeme getirilmesi önerilir (bkz. Bölüm 4.2 ve 4.8).
Böbrek yetmezliği
Böbrek fonksiyonları bozuk olan hastalarda, kreatinin klerensine bağlı olarak doz ayarlamaları gereklidir (bkz. Bölüm 4.2 ve 5.2).
Diğer ilaçlarla kullanımı
İmipenem-silastatin ve gansiklovir almakta olan hastalarda konvülsiyonlar bildirilmiştir. VALCYTE, olası yararları potansiyel risklerine ağır basmadığı sürece, imipenem-silastatin ile eş zamanlı olarak kullanılmamalıdır (bkz. Bölüm 4.5).
Didanozin, miyelosupresif ajanlar (örn. zidovudin) ya da böbrek fonskiyonlarını etkileyen ajanlar ve VALCYTE ile aynı anda tedavi gören hastalar eklenmiş toksisite için yakından dikkatle izlenmelidir (bkz. Bölüm 4.5).
Transplantasyonda CMV hastalığının profilaktik tedavisi için VALCYTE kullanımıyla ilgili yapılan kontrollü klinik çalışmalar (bkz. Bölüm 5.1) akciğer ve bağırsak nakli hastalarını içermemiştir. Bu yüzden, bu nakil hastalarındaki deneyim sınırlıdır.
VALCYTE oral çözelti için toz, sodyum benzoat içerir. Benzoatlar ciltte, gözlerde ve mukoz membranlarda hafif tahrişe yol açar.
VALCYTE her dozunda 10 g'dan az mannitol ihtiva eder. Hafif derecede laksatif etkisi olabilir.
Kontrollü diyet
Bu tıbbi ürün her dozunda 0,188 mg/mL sodyum ihtiva eder. Bu durum sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
Bu tıbbi ürün 12g şişede 100 mg ve sulandırıldıktan sonra 1mg/ml konsantrasyonda sodyum benzoat ihtiva eder. Benzoat tuzu yenidoğanda (4 haftalık olana kadar) sarılık riskini artırabilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Valgansiklovir ile görülen ilaç etkileşmeleri:
VALCYTE ile in-vivo ilaç etkileşim çalışması yapılmamıştır.
VALCYTE, gansiklovire metabolize olduğundan; gansiklovir ile ilişkili sistemik ilaç etkileşmeleri, VALCYTE için de beklenebilir.
Gansiklovir ile görülen ilaç etkileşmeleri: Farmakokinetik etkileşimler
Probenesid
Oral gansiklovir ile verilen probenesid, gansiklovirin renal klerensinde istatistiksel olarak anlamlı (%20) bir azalma ile sonuçlanmış; bu ise gansiklovirin vücutta kalış süresinde istatistiksel olarak anlamlı (%40) bir artışa yol açmıştır. Bu değişiklikler,
böbrek tübüllerinden sekresyonda yarışmalı bir etkileşim mekanizması ile uyumludur. Bu nedenle probenesid ve VALCYTE almakta olan hastalar, gansiklovir toksisitesi yönünden yakından izlenmelidirler.
Didanozin
Gansiklovir (hem intravenöz hem oral) ile birlikte verildiğinde, didanozin plazma konsantrasyonları sürekli olarak yüksek bulunmuştur. 5 ve 10 mg/kg/gün intravenöz dozlarda didanozin EAA değerlerinde %38 ile %67 aralığında değişen artışlar gözlenmiştir, dolayısıyla bu ilaçların aynı anda kullanılmasının farmakokinetik etkileşimi konfirme edilmiştir. Gansiklovir konsantrasyonları üzerinde klinik olarak belirgin bir etki bulunmamaktadır. Hastalar didanozin toksisitesi (örn. pankreatit) için yakından izlenmelidir (bkz. Bölüm 4.4).
Diğer antiretroviraller
Sitokrom P450 izoenzimleri gansiklovir farmakokinetiğinde herhangi bir rol oynamamaktadır. Bunun sonucu olarak, proteaz inhibitörleri ve non nükleozid ters (revers) transkriptaz inhibitörleri (NNRTI) ile farmakokinetik etkileşim mümkün gözükmemektedir.
Farmakodinamik etkileşimler
İmipenem-silastatin
Gansiklovir ile eş-zamanlı olarak imipenem-silastatin alan hastalarda konvülsiyonlar bildirilmiştir. Beklenen yararlar olası risklere karşı ağır basmadığı sürece bu ilaçlar eş zamanlı olarak kullanılmamalıdır (bkz. Bölüm 4.4).
Zidovudin
Hem zidovudinin hem de gansiklovirin nötropeni ve anemiye neden olma potansiyeli bulunmaktadır. Bu iki ilaç birlikte verdiğinde farmakodinamik etkileşim oluşabilmektedir. Bazı hastalar tam dozda eş zamanlı tedaviyi tolere edemeyebilirler (bkz. Bölüm 4.4).
Potansiyel ilaç etkileşimleri
Gansiklovir/valgansiklovir, miyelosupresif veya böbrek yetmezliği ile ilişkili olan diğer ilaçlar ile birlikte verildiğinde toksisite artabilir. Buna nükleozidler (örn. zidovudin, didanozin, stavudin) ve nükleotid analogları (örn. tenofovir, adefovir), immunosüpresanlar (örn. siklosporin, takrolimus, mikofenolat mofetil), antineoplastik ajanlar (örn. doksorubisin, vinblastin, vinkristin, hidroksiüre) ve anti-enfektiv ajanlar (trimetoprim/sülfonamidler, dapson, amfoterisin B, flusitosin, pentamidin) dahildir.
Bu nedenle bu ilaçların valgansiklovir ile birlikte uygulanmaları yalnızca, beklenen yararlar olası risklere karşı ağır bastığında gündeme getirilmelidir (bkz. Bölüm 4.4).
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/ Doğum kontrolü (Kontrasepsiyon)
Üreme toksisitesi ve teratojenite potansiyeli nedeniyle, çocuk doğurma potansiyeli olan kadınların tedavi süresince ve tedaviden sonra en az 30 gün boyunca etkili doğum kontrol yöntemi kullanmaları önerilmelidir. Eğer partnerlerinin hamilelik riski bulunmadığı kesin değilse, erkek hastalara, VALCYTE tedavisi sırasında ve tedaviden sonra en az 90 gün boyunca, bariyer yöntemiyle kontrasepsiyon uygulamaları tavsiye edilmelidir (bkz. Bölüm 4.4 ve 5.3).
Gebelik dönemi
Hayvanlar üzerinde yapılan çalışmalar, gebelik ve/veya embriyonal/fetal gelişim ve/veya doğum ve/veya doğum sonrası gelişim üzerindeki etkiler bakımından yetersizdir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Hamile kadınlarda VALCYTE kullanımı ile ilgili yeterli bilgi yoktur. VALCYTE'ın aktif metaboliti olan gansiklovir plasentaya kolaylıkla geçmektedir. Farmakolojik etki mekanizması ve hayvan üreme toksisite çalışmaları esas alınarak insanlarda teorik olarak teratojenik riski vardır. Annede beklenen yarar fetus üzerindeki potansiyel risklere karşı ağır basmadığı sürece, gebe kadınlarda VALCYTE kullanılmasından kaçınılmalıdır.
Laktasyon dönemi
Gansiklovirin anne sütüne geçip geçmediği bilinmemektedir, fakat gansiklovirin anne sütüne geçmesi ve bebekte ciddi advers reaksiyonlara yol açması olasılığı ihmal edilemez. Hayvan verileri, gansiklovirin emziren sıçanların sütüne geçtiğini göstermektedir. Bu nedenle, VALCYTE kullanımı sırasında emzirme bırakılmalıdır.
Üreme yeteneği/ Fertilite
CMV profilaksisi için 200 güne kadar VALCYTE tedavisi gören renal transplant hastaları ile yapılan küçük bir klinik çalışma, valgansiklovirin spermatogenez üzerindeki etkisini, tedavi tamamlandıktan sonra ölçülen sperm yoğunluğunda ve motilitesinde azalma olarak göstermiştir. Bu etkinin VALCYTE tedavisinin kesilmesinden yaklaşık altı ay sonra geri dönüşlü olduğu ve tedavi edilmeyen kontrollerde gözlenenlerle karşılaştırılabilir seviyelerde ortalama sperm yoğunluğu ve motilitesinin geri kazanıldığı görülmektedir.
Hayvan çalışmalarında, gansiklovir erkek ve dişi farelerde doğurganlığı bozmuştur ve farelerde, sıçanlarda ve köpeklerde klinik olarak ilgili olduğu düşünülen dozlarda spermatogenezi inhibe ettiği ve testiküler atrofiye yol açtığı gösterilmiştir.
Klinik ve klinik dışı çalışmalara dayanarak, gansiklovir (ve valgansiklovirin) insan spermatogenezinin geçici veya kalıcı inhibisyonuna neden olabileceği düşünülmektedir (bkz. Bölüm 4.4 ve 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanma yeteneğine etkileri üzerine herhangi bir çalışma yapılmamıştır.
VALCYTE ve/veya gansiklovir kullanımında konvülsiyonlar, sedasyon, sersemlik, ataksi ve/veya konfüzyon bildirilmiştir. Ortaya çıkabilecek bu tür etkiler, hastanın araç ve makine kullanma becerileri de dahil olmak üzere, uyanık ve tetikte olmayı gerektiren işleri etkileyebilir, hastalar bu yönden uyarılmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti:
Valgansiklovir, gansiklovirin bir ön-ilacıdır ve oral uygulama sonrasında hızla gansiklovire metabolize olur. Dolayısıyla, gansiklovir kullanımıyla ilişkili olduğu bilinen istenmeyen etkilerin, VALCYTE ile de ortaya çıkabileceği beklenebilir. VALCYTE ile yapılan klinik çalışmalarda gözlenen istenmeyen etkilerin hepsi de, önceden gansiklovir ile gözlenmiştir. Bu nedenle, IV veya oral gansiklovir (farmasötik form artık mevcut değildir) veya valgansiklovir ile bildirilen advers ilaç reaksiyonları, aşağıda verilen advers ilaç reaksiyonları tablosuna dahil edilmiştir.
Valgansiklovir/gansiklovir ile tedavi edilen hastalarda, en ciddi ve sık görülen advers ilaç reaksiyonları hematolojik reaksiyonlardır ve bunlara nötropeni, anemi ve trombositopeni dahildir (bkz. Bölüm 4.4).
Advers etkiler tablosunda verilen görülme sıklıkları, gansiklovir veya valgansiklovir ile idame tedavisi alan hasta popülasyonu havuzundan (n=1.704) elde edilmiştir. İstisna olarak, anafilaktik reaksiyon, agranülositoz ve granülositopeni için görülme sıklıkları ise pazarlama sonrası deneyimden elde edilmiştir. Advers reaksiyonlar MedDRA sistem organ sınıfına göre listelenmiştir. Görülme sıklığı kategorileri aşağıdaki sisteme göre belirlenmiştir: Çok yaygın (≥ 1/10); yaygın (≥ 1/100 ile < 1/10); yaygın olmayan (≥ 1/1.000 ile < 1/100); seyrek (≥ 1/10.000 ile < 1/1.000); çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Gansiklovir/valgansiklovirin genel güvenlilik profili HIV ve transplant popülasyonları arasında tutarlıdır, ancak retina ayrılması yalnızca CMV retiniti hastalarında bildirilmiştir. Bununla birlikte, bazı reaksiyonların sıklığında farklılıklar vardır. Valgansiklovir, intravenöz gansiklovir'e kıyasla, daha yüksek diyare riski ile ilişkilendirilmiştir. Yüksek ateş, kandida enfeksiyonları, depresyon, ciddi nötropeni (ANC <500/mcL) ve deri reaksiyonları HIV hastalarında daha sık bildirilmiştir. Organ nakli alan hastalarda böbrek ve karaciğer fonksiyon bozukluğu daha sık bildirilmiştir.
Tablo 1 Sıklık ve sistem organ sınıfına göre advers ilaç reaksiyonları
Sistem organ sınıfı | Çok yaygın | Yaygın | Yaygın olmayan | Seyrek |
Enfeksiyonlar | Oral | Sepsis |
|
|
ve | kandiyazis | (bakteriyemi, | ||
enfestasyonlar | dahil kandida | viremi), | ||
| enfeksiyonları, | influenza, selülit, | ||
| üst solunum | idrar yolları |
| yolları enfeksiyonu | enfeksiyonu |
|
|
Kan ve lenfatik sistemi hastalıkları | Nötropeni, anemi | Trombositopeni, lökopeni, pansitopeni | Kemik iliği depresyonu | Aplastik anemi, agranülositoz*, granülositopeni* |
Bağışıklık sistemi hastalıkları |
| Aşırı duyarlılık |
| Anafilaktik reaksiyonlar* |
Metabolizma ve beslenme hastalıkları | İştah azalması | Kilo kaybı |
|
|
Psikiyatrik hastalıklar |
| Depresyon, anksiyete, zihin karışıklığı durumu, | Ajitasyon, psikotik bozukluklar, halüsinasyon, anormal düşünceler |
|
Sinir sistemi hastalıkları | Baş ağrısı | Uykusuzluk, disguzi (tat alma bozuklukları), hipoastezi, parestezi, nöbet, periferik nöropati, baş dönmesi (sersemlik hali), | Tremor |
|
Göz hastalıkları |
| Görme bozuklukları, makular ödem, retina dekolmanı**, gözde uçuşan cisimler, göz ağrısı, konjonktivit |
|
|
Kulak ve iç kulak hastalıkları |
| Kulak ağrısı | Sağırlık |
|
Kardiyak hastalıkları |
|
| Aritmiler, |
|
Vasküler hastalıkları |
| Hipotansiyon |
|
|
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | Dispne, öksürük |
|
|
|
Gastrointestinal hastalıkları | İshal, bulantı, kusma, karın | Üst karın ağrısı, dispepsi, |
|
|
| ağrısı | kabızlık, gaz, disfaji, ağız ülseri, karında şişkinlik, pankreatit |
|
|
Hepato-bilier hastalıkları |
| Karaciğer fonksiyonlarında anormallik, kan alkalin fosfataz yükselmesi, aspartat aminotransferaz yükselmesi, alanin aminotransferaz yükselmesi |
|
|
Deri ve derialtı doku hastalıkları | Dermatit | Gece terlemesi, kaşıntı, döküntü, alopesi | Ürtiker, cilt kuruluğu |
|
Kas-iskelet bozuklukları, bağ dokusu ve kemik hastalıkları |
| Sırt ağrısı, miyalji, altralji, kas krampları |
|
|
Böbrek ve idrar yolu hastalıkları |
| Azalmış renal kreatinin klerensi, böbrek fonksiyon bozukluğu, artmış kan kreatinin düzeyi | Hematuri, böbrek yetmezliği |
|
Üreme sistemi ve meme hastalıkları |
|
| Erkeklerde infertilite |
|
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Yüksek ateş, yorgunluk | Ürperme- titreme, ağrı, halsizlik, asteni | Göğüs ağrısı |
|
*Bu advers reaksiyonların sıklıkları pazarlama sonrası deneyimden türetilmiştir.
**Retina dekolmanı, yalnızca CMV retiniti için tedavi edilen HIV hastalarında
bildirilmiştir.
Seçilen advers reaksiyonların tanımı Nötropeni
Nötropeni riski, tedavi öncesi nötrofil sayısına dayanarak tahmin edilemez. Nötropeni genellikle indüksiyon tedavisinin birinci veya ikinci haftasında oluşur. Hücre sayısı
genellikle ilacın kesilmesinden veya dozun azaltılmasından sonra 2-5 gün içinde normale döner (bkz. Bölüm 4.4).
Trombositopeni
Başlangıçta trombosit sayısı düşük (<100.000/mcL) olan hastalarda trombositopeni geliştirme riski artar. İmmunsupresif ilaçlarla tedaviye bağlı iyatrojenik immumsupresyona sahip hastalar, trombositopeni açısından AIDS hastalarına göre daha yüksek risk altındadır (bkz. Bölüm 4.4). Şiddetli trombositopeni, hayatı tehdit edici kanama ile ilişkilendirilebilir.
Tedavi süresinin veya endikasyonun advers reaksiyonlara etkileri
Ağır nötropeni (<500 ANC/mcL), valgansiklovir, intravenöz veya oral gansiklovir ile tedavi gören CMV retiniti hastalarında (%14), valgansiklovir veya oral gansiklovir alan solid organ transplantasyonu hastalarına göre daha sık görülmüştür. Nakilden 100 gün sonrasına kadar valgansiklovir veya oral gansiklovir alan hastalarda ağır nötropeni insidansı sırasıyla %5 ve %3 iken nakilden 200 gün sonrasına kadar valgansiklovir alan hastalardaki ağır nötropeni insidansı %10'dur.
CMV retinitis hastalarına kıyasla, nakil sonrası 100 gün veya 200 güne kadar hem valgansiklovir hem de oral gansiklovir ile tedavi edilen solid organ nakli alan hastalarda, serum kreatininde görülen artış daha fazladır. Bununla birlikte, böbrek fonksiyon bozukluğu solid organ nakli hastalarında sık görülen bir durumdur.
VALCYTE'ın genel güvenlilik profili, yüksek riskli böbrek hastalarında, profilaksinin 200 güne kadar uzatılmasıyla değişmemiştir. Lökopeni 200 gün kolunda bir miktar daha fazla insidansta görülürken, nötropeni, anemi ve trombositopeni insidansı her iki kolda da benzer olmuştur.
Pediyatrik hastalar
VALCYTE, gansiklovire maruziyet süresi 2-200 gün arasında olmak üzere, CMV hastalığı geliştirme riski olan 179 pediyatrik solid organ nakli hastasında (3 hafta ila 16 yaş arası) ve semptomatik konjenital CMV hastalığı olan 133 yenidoğanda (2 gün ile 31 gün arası) araştırılmıştır.
Pediyatrik klinik çalışmalarda en yaygın bildirilen advers olaylar ishal, bulantı, nötropeni, lökopeni ve anemidir.
Solid organ nakli hastalarında, pediyatrik hastalardaki genel güvenlilik profili erişkinler ile karşılaştırıldığında benzerdir. Pediyatrik solid organ nakli hastalarında yürütülen iki klinik çalışmada da nötropeni sıklığının, erişkin hastalara kıyasla, hafifçe daha yüksek olduğu bildirilmiştir, fakat pediyatrik popülasyon için nötropeni ile enfeksiyöz advers olaylar arasında herhangi bir korelasyon saptanmamıştır.
Yenidoğanlarda ve bebeklerde sitopeni riskinin daha yüksek olması, bu yaş gruplarında kan sayımlarının dikkatlice izlenmesini gerektirir (bkz. Böküm 4.4).
Pediyatrik böbrek nakli hastalarında valgansiklovir maruziyetinin 200 güne kadar uzaması advers olay görülme sıklığında genel bir artış ile ilişkilendirilmemiştir. 100. güne kadar tedavi edilen pediyatrik hastalar ve 100. güne veya 200. güne kadar tedavi edilen erişkin böbrek nakli hastaları ile karşılaştrıldığında, ciddi nötropeni (ANC <
500/ mcL) görülme sıklığı 200. güne kadar tedavi edilen pediyatrik hastalarda daha yüksektir (bkz. Bölüm 4.4).
VALCYTE ile tedavi edilen semptomatik konjenital CMV enfeksiyonu olan yenidoğan veya bebeklerde sınırlı veri olmasına rağmen, güvenliliğin valgansiklovir/ gansiklovir'in bilinen güvenlilik profili ile tutarlı olduğu görünmektedir.
Şüpheli advers reaksiyonların raporlanması:
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0800 314 00 08;
faks: 0312 218 35 99)
4.9. Doz aşımı ve tedavisi
Valgansiklovir ve intravenöz gansiklovir ile edinilen doz aşımı deneyimleri
Valgansiklovir doz aşımının aynı zamanda, renal toksisitede artış ile de sonuçlanabileceği beklenmektedir (bkz. Bölüm 4.2 ve 4.4).
Klinik araştırmalardan ve pazarlama sonrası kullanım deneyimlerinden bazıları ölümcül sonuçlara yol açan, intravenöz gansiklovir için yapılan doz aşım bildirimleri gelmiştir. Bu olguların bazılarında herhangi bir istenmeyen olay bildirilmemiştir. Hastaların büyük çoğunluğunda, aşağıdaki istenmeyen olayların bir ya da daha fazlası ortaya çıkmıştır:
Hematolojik toksisite: pansitopeni, kemik iliği yetmezliği, lökopeni, nötropeni, granülositopeni dahil miyelosupresyon
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Sistemik kullanım için antiviraller, nükleositler ve
nükleotidler (ters transkriptaz inhibitörleri hariç) ATC kodu: J05A B14
Etki mekanizması:
Valgansiklovir, gansiklovirin bir L-valin esteridir (ön-ilaç); oral uygulamadan sonra bağırsaklar ve karaciğerde bulunan esterazlar tarafından hızla gansiklovir'e metabolize edilir. Gansiklovir, in vitro ve in vivo ortamlarda Herpes virüslerin replikasyonunu inhibe eden 2'-deoksiguanozin'in sentetik bir analoğudur. Duyarlı insan virüsleri arasında insan sitomegalovirüsü (HCMV), Herpes simpleks virüs-1 ve -2 (HSV-1 ve HSV-2), insan Herpes virüsü -6, -7 ve -8 (HHV-6, HHV-7, HHV-8), Epstein-Barr virüsü (EBV), Varisella-zoster virüsü (VZV) ve hepatit B virüsü (HBV) bulunmaktadır.
Sitomegalovirüs (CMV) ile enfekte hücrelerde gansiklovir, ilk olarak, bir viral protein kinaz olan pUL97 tarafından gansiklovir monofosfata fosforile edilir. Hücrelerdeki kinazlar tarafından yapılan ileri fosforilasyon ile gansiklovir trifosfat oluşur ve bu madde de daha sonra hücre içinde yavaş metabolize olur. Yarı ömürleri sırasıyla 18 saat ve 6 ila 24 saat olan HSV ve HCMV ile enfekte hücrelerde, ekstraselüler gansiklovirin uzaklaştırılmasından sonra bu olayların oluştuğu gösterilmiştir. Fosforilasyonun geniş ölçüde viral kinaza bağlı olması nedeniyle, gansiklovir fosforilasyonu tercihen, virüs ile enfekte hücrelerde oluşmaktadır.
Gansiklovir'in virüstatik aktivitesi, viral DNA sentezinin aşağıdaki yollarla inhibe edilmesine bağlıdır; (a) deoksiguanozin trifosfatın viral DNA polimeraz tarafından DNA ile bütünleştirilmesinin yarışmalı inhibisyonu ve (b) gansiklovir trifosfatın viral DNA ile bütünleşmesi ve böylelikle DNA uzamasının sonlanmasına ya da son derecede kısıtlanmasına neden olması.
Antiviral Aktivite
Gansiklovirin in vitro ortamda CMV'ye karşı tipik antiviral ICdeğeri, 0,08 mcM (0,02 mcg/mL) ile 14 mcgM (3,5 mcg/mL) arasındadır.
VALCYTE'ın klinik antiviral etki çalışmaları yeni teşhis edilmiş CMV retinitli AIDS hastalarında yapılmıştır. CMV dökülmesi çalışmaya giriş döneminde %46 iken (32/69), dört haftalık VALCYTE tedavisinden sonra %7'ye (4/55) kadar azalmıştır.
Klinik etklililik ve güvenlilik
Erişkin hastalar:
CMV retinitinin tedavisi:
Günde 2 kez 900 mg VALCYTE veya günde iki kez 5 mg/kg intravenöz gansiklovir ile indüksiyon tedavisi için yapılan bir çalışma için yeni teşhis edilmiş CMV retiniti olan hastalar randomize edilmiştir. 4. haftada CMV retinitinde ilerleme olan hastaların oranı her iki grupta da aynıdır; hastaların 7/70'i intravenöz gansiklovir kolunda, 7/71'i valgansiklovir kolunda ilerleme kaydetmiştir.
İndüksiyon tedavi dozlamasının ardından bu çalışmadaki hastalar günde 900 mg'lık VALCYTE idame tedavisi almışlardır. Randomizasyondan CMV retinitinin ilerlemesine kadar olan ortalama (medyan) süre VALCYTE ile indüksiyon ve idame tedavisi alan grupta 226 (160) gün, intravenöz gansiklovir ile indüksiyon tedavisi ve VALCYTE idame tedavisi alan grupta 219 (125) gündür.
Transplantasyonda CMV hastalığının önlenmesi:
CMV hastalığı (D+/R-) için yüksek risk taşıyan kalp, karaciğer ve böbrek transplant hastalarında, transplantasyonun 10. gününden başlayıp 100. güne kadar VALCYTE (günde bir defa 900 mg) veya oral gansiklovirin (günde üç defa 1.000 mg) alındığı çift kör, çift plasebo klinik olarak aktif karşılaştırmalı bir çalışma yapılmıştır. Bağımsız bir sonlanım komitesi tarafından karara bağlandığı üzere CMV hastalığının insidansı (CMV sendromu + invaziv doku hastalığı), transplant sonrası 6 ay süresince oral gansiklovir kolundaki (n= 125) % 15,2 ile karşılaştırıldığında VALCYTE kolunda (n= 239) % 12,1'dir. Profilaksinin (100. gün sonrası) kesilmesi sonrasında meydana gelen vakaların çoğunluğu, valgansiklovir kolunda, oral gansiklovir kolunda gerçekleşen ortalama zamandan daha geç ortaya çıkmıştır. İlk 6 aydaki akut red insidansı, oral gansiklovir kolundaki % 36 ile karşılaştırıldığında valgansiklovire randomize edilen hastalarda % 29,7'dir. Eşdeğer insidansı olan greft kaybı ise her iki kolda da hastaların
%0,8'inde görülmüştür.
VALCYTE CMV profilaksisi süresinin nakil sonrası 100 günden nakil sonrası 200 güne çıkarılmasının etkililik ve güvenliliğini değerlendirmek üzere yüksek CMV hastalığı riski taşıyan 326 böbrek nakli hastasında çift-kör, plasebo-kontrollü bir çalışma gerçekleştirilmiştir. Hastalar nakilden sonraki 10 gün içinde nakil sonrası 200. güne veya 100. güne kadar VALCYTE tablet (günde bir defa 900 mg) ve ardından 100 gün boyunca plasebo almak üzere randomize (1:1) edilmiştir. Nakil sonrası ilk 12 ayda CMV hastalığı gelişen hastaların oranı aşağıdaki tabloda belirtilmiştir.
CMV hastalığı olan böbrek nakli olan hastaların yüzdesi, 12 aylık ITT
popülasyon
| Valgansiklovir
900 mg günde bir defa 100 gün N=163 | Valgansiklovir
900 mg günde bir defa 200 gün N=155 | Tedavi Grupları Arasındaki Fark |
CMV hastalığı teyit edilen veya varsayılan hastalar | 71 (%43,6) [%35,8; %51,5] | 36 (%23,2) [%16,8; %30,7] | %20,3 [%9,9; %30,8] |
CMV hastalığı teyit edilen hastalar | 60 (%36,8) [%29,4; %44,7] | 25 (%16,1) [%10,7; %22,9] | %20,7 [%10,9; %30,4] |
Nakil sonrası 100. güne kadar VALCYTE ile CMV profilaksisi uygulanan hastalara kıyasla nakil sonrası 200. güne kadar VALCYTE ile CMV profilaksisi uygulanan anlamlı derecede daha az sayıda yüksek riskli böbrek nakli hastasında CMV hastalığı gelişmiştir.
Greft sağkalım oranı ve ayrıca biyopsiyle tespit edilen akut ret insidansının her iki tedavi grubunda benzer olduğu görülmüştür. Nakil sonrası 12. aydaki greft sağkalım oranı 100 günlük doz uygulama rejiminde %98,2 (160/163) ve 200 günlük doz rejiminde %98,1 (152/155) olarak belirlenmiştir. Nakil sonrası 24. aya kadar, tümü
100 günlük doz uygulama grubunda olmak üzere 4 greft kaybı vakası daha bildirilmiştir. Nakil sonrası 12. ayda biyopsiyle tespit edilen akut ret insidansı 100 günlük doz uygulama rejiminde %17,2 (28/163) ve 200 günlük doz rejiminde %11 (17/155) olarak belirlenmiştir. Nakil sonrası 24. aya kadar 200 gün doz uygulama grubunda bir vaka daha bildirilmiştir.
Viral direnç
Kronik valgansiklovir uygulamalarından sonra, gansiklovir monofosforilasyonundan sorumlu viral kinaz geninde (UL97) ve/veya viral polimeraz geninde (UL54) oluşan mutasyonların seleksiyonu yoluyla, gansiklovire karşı dirençli virüsler ortaya çıkabilmektedir. Klinik izolatlarda, yedi doğal UL97 sübstitüsyonu, M460V/I, H520Q, C592G, A594V, L595S, C603W'nin en yaygın bildirilen gansiklovir direnciyle ilişkili sübstitüsyonlardır. UL97 geninde mutasyonlar taşıyan virüsler sadece gansiklovire karşı dirençli iken, UL54 geninde mutasyonlar olan virüsler, viral polimerazı hedefleyen başka antivirallere karşı çapraz direnç gösterebilmektedirler.
CMV retinitinin tedavisi
CMV hastalığı olan 148 hastanın polimorfonükleer lökosit (PMNL) izolatlarındaki CMV genotipik analizinin dahil olduğu - klinik bir çalışmanın sonuçları, valgansiklovir tedavisinin 3, 6, 12 ve 18 ay sonrasında sırasıyla % 2,2, % 6,5, % 12,8 ve % 15,3 UL97 mutasyonlarını içermektedir
Transplantasyonda CMV hastalığının önlenmesi:
Aktif karşılaştırma çalışması
Toplanan PMNL numunelerinde CMV'nin genotipik analizi ile direnç çalışılmıştır i)
100. günde (çalışma ilacı profilaksisinin sonu), ve ii) transplantasyondan sonraki 6 aya kadar şüpheli CMV hastalığı vakalarında. Valgansiklovir almak üzere randomize edilen 245 hastadan, test için 198 adet 100. gün numunesi alınmıştır, gansiklovire direnç mutasyonları gözlenmemiştir. Bu, oral gansiklovir karşılaştırma kolundaki hastalardan test edilen 103 numunede tespit edilen (%1,9) 2 gansiklovire direnç mutasyonları ile karşılaştırılabilirdir.
Valgansiklovir almak üzere randomize edilen 245 hastadan, CMV hastalığı şüphesi olan 50 hastaya ait numune test edilmiş ve direnç mutasyonu gözlenmemiştir. Gansiklovir karşılaştırma kolundaki 125 hastadan CMV hastalığı şüphesi olan 29 hastaya ait numune test edilmiş, 2 direnç mutasyonu gözlenmiştir. Bu da % 6,9'luk bir direnç insidansı vermektedir.
Profilaksi çalışması süresinin nakil sonrası 100 günden 200 güne çıkarılması
Direnç analizi kriterlerini karşılayan 72 hastadan alınan virüsten elde edilen UL54 ve UL97 genleri üzerinde genotipik analiz gerçekleştirilmiştir: profilaksi sonunda pozitif viral yük (>600 kopya/mL) sergileyen hastalar ve/veya nakilden sonra 12. aya kadar (52 hafta) doğrulanmış CMV hastalığı olan hastalar. Her tedavi grubunda üç hastanın bilinen gansiklovir direnç mutasyonu olduğu görülmüştür.
Pediyatrik popülasyon
CMV retinitinin tedavisi:
Avrupa İlaç Ajansı, immün yetmezliği olan ve CMV nedeniyle enfeksiyon tedavisi gören tüm pediyatrik popülasyon alt gruplarında VALCYTE ile çalışma yapma zorunluluğuna muafiyet hakkı tanımıştır (pediyatrik kullanım hakkında bilgi için bkz. Bölüm 4.2).
Transplantasyonda CMV hastalığının önlenmesi:
Pediyatrik dozlam algoritması (bkz. Bölüm 4.2) uyarınca 100 güne kadar günde bir kez valgansiklovir alan pediyatrik solid organ nakli alıcılarında Faz II farmakokinetik ve güvenlilik çalışması (4 ay ila 16 yaş arası, n=63) erişkinlerdekine benzer maruziyetler meydana getirmiştir (bkz. Bölüm 4.2).
Tedavi sonrası takip 12 haftadır. Bazal durumda, CMV D/R seroloji durumu, vakaların
%40'ında D+/R-, %38inde D+/R+, %19'unda D-/R+ ve %3'ünde D-/R-‘dir. 7 hastada CMV virüsünün varlığı raporlanmıştır. Gözlemlenen advers ilaç reaksiyonları yetişkinlerdeki reaksiyonlara benzer niteliktedir (bkz. Bölüm 4.8).
Doz algoritmasına (bkz. Bölüm 4.2) göre 200 güne kadar günde bir defa valgansiklovir alan pediyatrik böbrek nakli alıcılarına (1-16 yaş, n=57) yönelik bir Faz IV tolerabilite çalışması düşük CMV insidansı ortaya koymuştur. Tedavi sonrası takip 24 hafta sürmüştür. Başlangıçtaki CMV D/R serolojik durumu vakaların %45'inde D+/R+, %39'unda D+/R-, %7'sinde D-/R+, %7'sinde D-/R- ve %2'sinde ND/R+ olarak belirlenmiştir. 3 hastada CMV viremisi bildirilmiş ve bir hastada CMV sendromu vakasından şüphelenilmiş ancak merkezi laboratuar tarafından CMV PCR ile doğrulanmamıştır. Gözlemlenen advers ilaç reaksiyonlarının yetişkinlerde gözlemlenen reaksiyonlarla benzer nitelikte olduğu görülmüştür (bkz. Bölüm 4.8).
Bu veriler erişkinlerden çocuklara etkililik verilerinin ekstrapolasyonunu desteklemekte ve pediyatrik hastalar için pozoloji önerileri sağlamaktadır.
Pediyatrik doz algoritması (bkz. Bölüm 4.2) uyarınca 2 gün üst üste günde bir doz valgansiklovir alan kalp nakli hastaları ile gerçekleştirilen Faz I farmakokinetik ve güvenlilik çalışmasında (3 hafta ila 125 gün, n= 14) erişkinlere benzer maruziyetler elde edilmiştir (bkz. Bölüm 5.2). Tedavi sonrası izleme süresi 7 gündür. Her ne kadar bu çalışmada hasta sayısı ve vagansiklovir maruziyeti sınırlı olsa da, güvenlilik profili diğer pediyatrik ve erişkin çalışmaları ile tutarlıdır.
Konjenital CMV:
Konjenital semptomatik CMV hastası yenidoğan ve bebeklerde gansiklovir ve/veya
valgansiklovirin etkililiği ve güvenliliği iki çalışmada araştırılmıştır.
İlk çalışmada, valgansiklovir'in tek doz kullanımının (doz aralığı 14-16-20 mg/kg/doz) farmakokinetiği ve güvenliliği, semptomatik konjenital CMV hastalığı olan 24 yenidoğanda (yaş 8-34 gün) araştırılmıştır (bkz. Bölüm 5.2). Yenidoğanlar 6 hafta antiviral tedavisi alırken 24 hastanın 19'u 4 haftaya kadar oral valgansiklovir alıp kalan 2 haftada i.v. gansiklovir almışlardır. Kalan 5 hasta çalışma süresi boyunca daha çok i.v. gansiklovir tedavisi almıştır.
İkinci çalışmada semptomatik konjenital CMV hastalığı olan 2 ila 30 günlük 109 bebekte altı haftaya karşı altı ay valgansiklovir tedavisinin etkililiği ve güvenliliği araştırılmıştır. Tüm bebekler 6 hafta süresince günde iki kez 16 mg/kg dozda oral valgansiklovir almıştır. 6 hafta tedaviden sonra, bebeklerin tedavisi 6 aylık tedavi tamamlanana kadar valgansiklovir ile aynı dozda tedaviye devam etmek veya plasebo almak şeklinde, 1:1 olarak randomize edilmiştir.
Bu tedavi endikasyonu valgansiklovir için halen önerilmemektedir. Çalışmaların tasarımı ve elde edilen sonuçlar valgansiklovir hakkında uygun etkililik ve güvenlilik çıkarımlarında bulunmak için çok sınırlıdır.
5.2. Farmakokinetik özellikler
Genel özelliklerValgansiklovirin farmakokinetik özellikleri HIV (Human immuno deficiency virus - İnsan immün yetmezlik virüsü) ve CMV seropozitif hastalarda, CMV retiniti olan AIDS hastalarında ve solid organ transplantasyonu hastalarında değerlendirilmiştir.
Sadece tokluk koşullarında 450-2.625 mg doz aralığında valgansiklovir uygulamasının ardından gansiklovir EAA bakımından doz oransallığı kanıtlanmıştır.
Emilim:
Valgansiklovir, gansiklovirin bir ön-ilacıdır; gastrointestinal kanaldan hızla emilir ve barsak duvarı ve karaciğerde hızlı bir şekilde gansiklovire metabolize edilir. Valgansiklovir ile sistemik temas kısa süreli ve düşüktür. Valgansiklovirden oluşan gansiklovirin mutlak biyoyararlanımı çalışılan tüm hasta popülasyonlarında %60 civarında olup, intravenöz gansiklovir uygulaması sonrasında elde edilen maruziyete benzerdir (aşağıya bakınız)
HIV pozitif, CMV pozitif hastalarda valgansiklovir:
HIV pozitif, CMV pozitif hastalarda bir hafta boyunca günde iki defa gansiklovir ve valgansiklovir uygulamasının ardından sistemik maruziyet:
Parametre | Gansiklovir (5 mg/kg, IV) n=18 | Valgansiklovir (900 mg, p.o.) n=25 | |
Gansiklovir | Valgansiklovir | ||
EAA (mcg.saat/mL)
C(mcg/mL) | 28,6 ± 9
10,4 ± 4,9 | 32,8 ± 10,1
6,7 ± 2,1 | 0,37 ± 0,22
0,18 ± 0,06 |
Gansiklovirin CMV retiniti progresyonuna kadar geçen süreyi artırma bakımından etkililiğinin sistemik maruziyetle (EAA) korelasyon gösterdiği kanıtlanmıştır.
Solid organ nakli hastalarında valgansiklovir:
Oral yoldan günlük gansiklovir ve valgansiklovir uygulamasının ardından solid organ nakli hastalarında kararlı durumda sistemik gansiklovir maruziyeti:
Parametre | Gansiklovir (1.000 mg, günde 3 kez) n=82 | Valgansiklovir (900 mg, günde 1 kez) n=161 |
Gansiklovir | ||
EAA(mcg.saat/mL)
C(mcg/mL) | 28 ± 10,9
1,4 ± 0,5 | 46,3 ± 15,2
5,3 ± 1,5
|
Kalp, böbrek ve karaciğer nakli alıcılarında sistemik gansiklovir maruziyetinin böbrek fonksiyonu doz algoritmasına göre oral valgansiklovir uygulamasının ardından benzer olduğu görülmüştür.
Valgansiklovirin oral çözelti olarak uygulanmasının ardından tablet formülasyonuyla eşdeğer sistemik gansiklovir maruziyetleri elde edilmiştir.
Yiyecek etkisi:
Valgansiklovir 900 mg'lık önerilen dozda yemekle birlikte uygulandığında, açlık durumuna kıyasla hem ortalama gansiklovir EAA (yaklaşık %30) hem de ortalama gansiklovir C(yaklaşık %14) için daha yüksek değerler gözlenmiştir. Ayrıca, VALCYTE yemekle birlikte alındığında gansiklovir maruziyeti bakımından bireyler arasında görülen değişkenlik azalmaktadır. VALCYTE sadece klinik çalışmalarda yemekle birlikte uygulanmıştır. Dolayısıyla, VALCYTE'ın yemekle birlikte uygulanması önerilmektedir (bkz. Bölüm 4.2).
Dağılım:
Valgansiklovirin hızlı bir şekilde gansiklovire metabolize olması nedeniyle, valgansiklovirin proteinlere bağlanması belirlenememiştir. Gansiklovirin intravenöz uygulamadan sonraki stabil halinde dağılım hacmi (V) 0.680  0.161 L/kg (n=114) olarak ölçülmüştür. Intravenöz gansiklovirin dağılım hacmi vücut ağırlığı ile doğru orantılıdır ve stabil halinde bu hacim 0.54-0.87 L/kg arasında değişmektedir. Gansiklovir beyin omurilik sıvısına geçmektedir. Gansiklovirin 0.5 ve 51 µg/mL'den daha yüksek konsantrasyonlarında plazma proteinlerine bağlanma oranı %1-2 olmuştur.
Biyotransformasyon:
Valgansiklovir hızla ve yoğun bir şekilde gansiklovire metabolize olmaktadır; gansiklovir dışında başka hiçbir metabolit saptanmamıştır. Gansiklovirin kendisi ise önemli ölçüde metabolize olmamaktadır.
Eliminasyon:
Oral valgansiklovir doz uygulamasının ardından, ilaç hızlı bir şekilde metabolize olarak gansiklovire dönüşür. Gansiklovir sistemik dolaşımdan glomerüler filtrasyon ve aktif tübüler sekresyon yoluyla elimine edilir. Normal böbrek fonksiyonuna sahip hastalarda IV yoldan uygulanan gansiklovirin >%90'ı 24 saat içinde metabolize olmamış bir şekilde idrarda geri kazanılmıştır. Normal böbrek fonksiyonuna sahip hastalarda, valgansiklovir uygulamasının ardından gansiklovirin pik sonrası plazma konsantrasyonları 0,4 saat ile 2,0 saat arasında değişen bir yarı-ömür süresi içinde azalmaktadır.
Doğrusallık/doğrusal olmayan durum:
450 ila 2.625 mg doz aralığındaki valgansikolvir uygulamalarında, gansiklovir EAA
bakımından doz orantısallığı sadece tokluk koşulları altında gösterilmiştir.
Hastalardaki karakteristik özellikler
Pediyatrik popülasyon
Pediyatrik solid organ nakli alıcılarına (4 ay–16 yaş, n=63) yönelik bir Faz II farmakokinetik ve güvenlilik çalışmasında valgansiklovir 100 güne kadar günde bir defa uygulanmıştır. Farmakokinetik parametrelerinin organ tipi ve yaş aralığında ve yetişkinlerle benzer olduğu görülmüştür. Popülasyon farmakokinetiği modellemesi biyoyararlanımın yaklaşık %60 düzeyinde olduğunu göstermiştir. Hem vücut yüzey alanı hem de böbrek fonksiyonu klerensi olumlu etkilemiştir.
Pediyatrik kalp nakli alıcılarına (3 haftalık–125 günlük, n=14) yönelik bir Faz I farmakokinetik ve güvenlilik çalışmasında valgansiklovir iki çalışma günü boyunca günde bir defa uygulanmıştır. Popülasyon farmakokinetiği ortalama biyoyararlanımı
%64 olarak hesaplamıştır.
Bu iki çalışmaya ait bulgular ve yetişkin popülasyondan elde edilen farmakokinetik bulgular arasında yapılan karşılaştırma EAAaralıklarının yetişkinler dahil olmak üzere bütün yaş gruplarında oldukça benzer olduğunu göstermektedir. EAAve Cortalama değerleri bütün pediyatrik yaş aralığında azalma eğilimi göstermesine karşın, <12 yaşındaki pediyatrik yaş gruplarında da benzer olup, bu durumun artan yaşla korelasyon gösterdiği görülmüştür. Bu eğilimin ortalama klerens ve yarı-ömür (t) değerleri bakımından daha belirgin olduğu görülmüştür; ancak popülasyon farmakokinetiği modellemesinde görüldüğü üzere, hastanın büyümesiyle ilişkili olarak kilo, boy ve böbrek fonksiyonunda meydana gelen değişiklikler klerensi etkilediği için, beklenen bir durumdur.
Aşağıdaki tabloda bu iki çalışmada modele dayalı hesaplanan EAAaralıkları ve ayrıca yetişkin verilerine kıyasla ilgili pediyatrik yaş gruplarında EAA, C, Klerens ve t 'ye ait ortalama ve standart sapma değerleri özetlenmiştir:
PK Parametresi | Erişkinler* | Pediyatrik hastalar | |||
| ≥18 yaş (n=160) | < 4 ay (n=14) | 4 ay - ≤2 yaş (n=17) | >2 - < 12 yaş (n=21) | ≥12 yaş – 16 yaş (n=25) |
EAA | 46,3 ± 15,2 | 68,1 ± | 64,3 ± 29,2 | 59,2 ± 15,1 | 50,3 ± 15 |
(mcg.saat/mL) |
| 19,8 |
|
|
|
EAA | 15,4 – | 34-124 | 34-152 | 36-108 | 22-93 |
aralığı | 116,1 |
|
|
|
|
C | 5,3 ± 1,5 | 10,5 ± | 10,3 ± 3,3 | 9,4 ± 2,7 | 8 ± 2,4 |
(mcg/mL) |
| 3,36 |
|
|
|
Klerens | 12,7 ± 4,5 | 1,25 ± | 2,5 ± 2,4 | 4,5 ± 2,9 | 6,4 ± 2,9 |
(L/saat) |
| 0,473 |
|
|
|
t (saat) | 6,5 ± 1,4 | 1,97 ± 0,185 | 3,1 ± 1,4 | 4,1 ± 1,3 | 5,5 ± 1,1 |
*PV 16000 çalışma raporundan alınmıştır
Yukarıda açıklanan her iki çalışmada günde bir defa VALCYTE dozunun modifiye edilmiş bir Schwartz formülünden elde edilen vücut yüzey alanı (VYA) ve kreatinin klerensine (KrKlS) dayalı olduğu görülmüş ve bu doz Bölüm 4.2'de sunulan doz algoritması kullanılarak hesaplanmıştır.
Valgansiklovir uygulamasının ardından gansiklovirin farmakokinetiği de semptomatik konjenital CMV hastalığı olan yenidoğan ve bebeklerde yapılan iki çalışmada değerlendirilmiştir. Birinci çalışmada 8-34 günlük 24 yenidoğana günde iki defa intravenöz yoldan gansiklovir uygulanmıştır. Hastalara daha sonra oral valgansiklovir tedavisi uygulanmıştır; valgansiklovir oral çözelti tozu dozunun günde iki defa 14 mg/kg ile 20 mg/kg arasında değiştiği ve toplam tedavi süresinin 6 hafta olduğu görülmüştür. Günde iki defa 16 mg/kg dozunda valgansiklovir oral çözelti tozu yenidoğanlara günde iki defa intravenöz yoldan uygulanan 6 mg/kg'lık gansiklovir dozuyla benzer bir gansiklovir maruziyeti sağlamış ve ayrıca yetişkinlere intravenöz yoldan uygulanan 5 mg/kg'lık etkili dozla benzer bir gansiklovir maruziyetine ulaşılmasını sağlamıştır.
İkinci çalışmada, 2-30 günlük 109 yenidoğana 6 hafta boyunca günde iki defa 16 mg/kg valgansiklovir oral çözelti tozu uygulanmış ve ardından çalışmaya alınan 109 hastanın 96'sı 6 ay boyunca valgansiklovir veya plasebo almak üzere randomize edilmiştir. Bununla birlikte, ortalama EAAin ilk çalışmadaki ortalama EAAdeğerlerine kıyasla daha düşük olduğu görülmüştür. Aşağıdaki tabloda yetişkin verilerine kıyasla standart sapmalar dahil ortalama EAA, Cve tdeğerleri belirtilmiştir:
PK | Erişkinler | Pediyatrik hastalar (neonatal ve infant) |
Parametresi |
|
| ||
| 5 mg/kg GAN | 6 mg/kg GAN | 16 mg/kg | 16 mg/kg |
Tek doz | Günde 2 kez | VAL | VAL | |
(n=8) | (n=19) | Günde 2 kez | Günde 2 kez | |
|
| (n=19) | (n=100) | |
EAA (mcg.saat/mL) | 25,4 ± 4,32 | - | - | - |
EAA(mcg.saat/mL) | - | 38,2 ± 42,7 | 30,1 ± 15,1 | 20,85 ± 5,4 |
C(mcg/mL) | 9,03 ± 1,26 | 12,9 ± 21,5 | 5,44 ± 4,04 | - |
t (h) | 3,32 ± 0,47 | 2,52 ± 0,55 | 2,98 ± 1,26 | 2,98 ± 1,12 |
GAN=IV Gansiklovir. VAL=Oral Valgansiklovir
Bu veriler, konjenital CMV enfeksiyonu olan pediyatrik hastalarda etkililik veya pozoloji önerileri konusunda bir sonuca varmak için yeterli değildir.
Yaşlılar
65 yaş üstü yetişkinlerde valgansiklovir veya gansiklovirin farmakokinetiğine ilişkin herhangi bir inceleme gerçekleştirilmemiştir (bkz. Bölüm 4.2).
Böbrek yetmezliği olan hastalar
900 mg'lık tek bir oral valgansiklovir dozunun ardından gansiklovirin farmakokinetiği böbrek yetmezliği dışında başka bir sağlık sorunu olmayan 24 sağlıklı bireyde değerlendirilmiştir.
Çeşitli derecelerde böbrek yetmezliği olan hastalarda oral yoldan 900 mg'lık tek bir VALCYTE tablet dozunda gansiklovirin farmakokinetik parametreleri:
Tahmini kreatinin klerensi (mL/dak) | N | Görünen klerens (mL/dak) ortalama ± SD | EAA(mcg.saat/mL) ortalama ± SD | Yarı-ömür (saat) ortalama ± SD |
51-70 | 6 | 249 ± 99 | 49,5 ± 22,4 | 4,85 ± 1,4 |
21-50 | 6 | 136 ± 64 | 91,9 ± 43,9 | 10,2 ± 4,4 |
11-20 | 6 | 45 ± 11 | 223 ± 46 | 21,8 ± 5,2 |
<10 | 6 | 12,8 ± 8 | 366 ± 66 | 67,5 ± 34 |
Azalan böbrek fonksiyonu valgansiklovirden gansiklovir klerensinin azalmasına ve buna karşılık terminal yarı-ömrün artmasına neden olmuştur. Dolayısıyla, böbrek yetmezliği olan hastalar için doz ayarlaması gerekmektedir (bkz. Bölüm 4.2 ve 4.4).
Hemodiyaliz uygulanan hastalar
Hemodiyaliz uygulanan hastalar için, VALCYTE oral çözelti tozunun bireye göre ayarlanmış doz olarak verilmesi önerilmektedir (bkz. Bölüm 4.2 ve 4.4).
Stabil karaciğer nakli hastaları
Stabil karaciğer nakli alıcılarında valgansiklovirden gansiklovire dönüşüm farmakokinetiği açık etiketli ve 4 bölümlü bir çapraz geçiş çalışmasında incelenmiştir (N=28). Tokluk koşullarında 900 mg'lık tek bir valgansiklovir dozunun ardından valgansiklovirden gansiklovir biyoyararlanımı yaklaşık %60 olarak belirlenmiştir. Gansiklovirin EAAdeğeri karaciğer nakli hastalarında 5 mg/kg intravenöz gansiklovirle elde edilen ile benzer olduğu görülmüştür.
Karaciğer yetmezliği olan hastalar
VALCYTE'ın güvenlilik ve etkililiği karaciğer yetmezliği olan hastalarda incelenmemiştir. Gansiklovir böbrek yoluyla atıldığı için, karaciğer yetmezliği gansiklovirin farmakokinetiğini anlamlı bir şekilde etkilememektedir ve bu nedenle spesifik bir doz önerisinde bulunulmamıştır.
Kistik fibrozisli hastalar
Kistik fibrozisi (CF) olan veya olmayan akciğer nakli alıcılarına yönelik bir Faz I farmakokinetik çalışmada 31 hastaya (CF'si olan 16 ve CF'si olmayan 15 hasta) günlük 900 mg VALCYTE ile nakil sonrası profilaksi uygulanmıştır. Çalışma, kistik fibrozisin akciğer nakli alıcılarında toplam ortalama sistemik gansiklovir maruziyetini istatistiksel olarak anlamlı bir şekilde etkilemediğini göstermiştir. Akciğer nakli alıcılarında gansiklovir maruziyetinin diğer solid organ nakli alıcılarında CMV hastalığının önlenmesinde etkili olduğu kanıtlanmış olan maruziyet düzeyiyle benzer olduğu görülmüştür.
5.3. Klinik öncesi güvenlilik verileri
Valgansiklovir, gansiklovirin bir ön-ilacıdır ve bu yüzden gansiklovir ile görülen etkiler aynı şekilde valgansiklovir için de geçerlidir. Klinik öncesi güvenlilik çalışmalarında valgansiklovirin toksisitesi gansiklovir ile görülen ile aynıdır ve indüksyon dozu verilen insanlardakine benzer veya onlardan daha düşük gansiklrovir maruziyet seviyelerinde indüklenmiştir.
Bu bulgular şunlardır: geri dönüşümsüz olanlar; gonadotoksisite (testiküler hücre kaybı) ve nefrotoksisite (üremi ve hücre dejenerasyonu) ve geri dönüşümlü olanlar; miyelotoksisite (anemi, nötropeni, lenfositopeni) ve gastrointestinal toksisite (mukozal hücre nekrozu).
Gansiklovirin fare lenfoma hücrelerinde mutajenik ve memeli hücrelerinde klastojenik olduğu görülmüştür. Bu bulgular fareler üzerinde yapılan ve pozitif bulguların elde edildiği gansiklovire yönelik karsinojenisite çalışmasıyla tutarlıdır. Gansiklovir potansiyel bir karsinojendir.
Daha ileri çalışmalarda gansiklovir'in mutajenik, karsinojenik, teratojenik, embriyotoksik, aspermatojenik olduğunu (örn. erkek fertilitesine zarar veren) ve kadın fertilitesini baskıladığını göstermiştir.
Hayvanlardan elde edilen veriler gansiklovirin emziren sıçanların sütüne geçtiğini göstermektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Povidon K-30 Fumarik asit
Sodyum benzoat (E211) Sodyum sakarin Mannitol (E421)
Tutti-frutti aroması Maltodekstrinler (mısır) Propilen glikol
Arap zamkı (E414) ve özellikle muz, ananas ve şeftali aroması içeren doğal eşdeğer aromalar.
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
Oral çözelti için toz: 36 ay
Sulandırıldıktan sonra: 49 gün (buzdolabında 2°- 8°C'de)
6.4. Saklamaya yönelik özel tedbirler
tedbirler
Bu ilaç için özel muhafaza koşulları gerekli değildir.
Oral çözelti için toz: 30 °C'nin altındaki oda sıcaklığında saklanmalıdır. Hazırlanan çözeltinin muhafaza şartları için Bölüm 6.3'e bakınız.
Orijinal ambalajında saklanmalıdır. Şişe sıkıca kapalı tutulmalıdır.
6.5. Ambalajın niteliği ve içeriği
Kutuda, çocuk emniyetli, plastik, vidalı kapaklı amber renkli cam şişe, şişe adaptörü ve 2 adet şırınga içeren blister paketler.
Her bir şişe, 12 g oral çözelti için toz içerir. Sulandırılan çözeltinin hacmi, minimum
88 mL kullanılabilir hacim sağlayan 100 mL'dir.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
VALCYTE insanlar için potansiyel bir teratojen ve karsinojen olarak kabul edildiği için, tozun ve sulandırılmış çözeltinin taşınmasında dikkatli olunmalıdır (bkz. Bölüm 4.4).
Tozun veya sulandırılmış çözeltinin cilt ya da müköz membranlar ile doğrudan temas etmesinden kaçınılmalıdır. Böyle bir temas oluşursa, su ve sabunla iyice yıkamalıdır. Eğer toz veya çözelti gözlere bulaşırsa, gözler yalnızca su ile yıkanmalıdır.
VALCYTE oral çözelti için toz'un hastaya verilmeden önce eczacı tarafından sulandırılması önerilmektedir.
Çözeltinin hazırlanması:
91 mL su dereceli silindir (mezür) yardımıyla ölçülür.
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| CITOVIR | 8699738090340 | 14,391.68TL |
| VALCYTE | 8682340179053 | 14,391.39TL |
| VALGANIR | 8699502094628 | 14,391.68TL |
| Diğer Eşdeğer İlaçlar |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ GENEL BİLGİLERİ
Roche Müstahzarları Sanayi A.Ş.
| Satış Fiyatı | TL |
| Önceki Satış Fiyatı | |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699505593494 |
| Etkin Madde | Valgansiklovir |
| ATC Kodu | J05AB14 |
| Birim Miktar | 50 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 100 |
| Enfeksiyona Karşı Kullanılan (Antienfektif) İlaçlar > Virüslere Karşı Direkt Etkili İlaçlar > Valgansiklovir |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |