VENAPERTA 10000 ANTI-XA IU/1 ml enjeksiyonluk çözelti içeren kullanıma hazır enjektör (2 adet) Kısa Ürün Bilgisi
{ Enoksaparin Sodyum }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
VENAPERTA 10000 Anti-XA IU/1 mL enjeksiyonluk çözelti içeren kullanıma hazır enjektör Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Enoksaparin sodyum: 100 mg (10.000 anti-Xa IU'ya eşdeğer)
Enoksaparin sodyum, domuz intestinal mukozasından üretilen heparin benzil esterin alkalin depolimerizasyonuyla elde edilen biyobenzer bir maddedir.
Yardımcı maddeler
Yardımcı maddeler için 6.1 'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti içeren kullanıma hazır enjektör. Berrak, renksiz çözelti
Karnınızın sağ veya sol tarafında yanlarına doğru ve göbeğinizden en az 5 cm uzakta bir bölge seçiniz.
UNUTMAYINIZ:
Enjeksiyonu göbeğinizden ve mevcut morluklar veya yara izlerinden en az 5 cm. uzak olacak bir noktaya yapmalısınız. Enjeksiyon noktasını karnınızın sağ ve sol yanında dönüşümlü olarak değiştirmelisiniz.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
VENAPERTA yetişkinlerde aşağıdaki durumların tedavisinde endikedir:
Özellikle ortopedik cerrahi veya kanser cerrahisi dahil genel cerrahi geçirenler olmak üzere, orta ve yüksek riskli cerrahi uygulanan hastalarda venöz tromboemboli profilaksisinde (venlerde pıhtı oluşumunun önlenmesi)
Venöz tromboemboli riski yüksek akut kalp yetmezliği, solunum yetmezliği, ciddi enfeksiyonlar ve romatizmal hastalıkları içeren akut medikal hastalıkları olan ve mobilitesi azalmış hastalarda venöz tromboemboli profilaksisinde
Hemodiyaliz sırasında ekstrakorporeal dolaşımda tromboz oluşumunun önlenmesinde
Derin ven trombozu ve trombolitik tedavi veya cerrahi gerektirme ihtimali olan pulmoner emboli hariç, pulmoner emboli tedavisinde
Akut koroner sendrom:
Oral asetilsalisilik asit ile kombinasyon halinde, kararsız angina ve non ST-segment yükselmeli miyokard infarktüsü (NSTEMI) tedavisinde.
Medikal olarak tedavi edilen ya da daha sonra Perkütan Koroner Girişim uygulanan hastalar da dahil olmak üzere, akut ST-segment yükselmeli miyokard infarktüsünün (STEMI) tedavisi.
4.2. Pozoloji ve uygulama şekli
Orta ve yüksek riskli cerrahi hastalarında venöz tromboemboli hastalığının profilaksisi:
Orta derecede tromboemboli riski olan hastalarda, önerilen enoksaparin sodyum dozu subkütan enjeksiyon yoluyla günde bir kez 2.000 IU'dur. (20 mg). Enoksaparin sodyumun
2.000 IU'luk (20 mg) preoperatif başlangıç dozunun (cerrahiden 2 saat önce), orta derecede riskli cerrahide etkili ve güvenli olduğu kanıtlanmıştır.
Orta düzeyde riskli hastalarda, iyileşme durumu (örn. mobilite) ne olursa olsun, enoksaparin sodyum tedavisine en az 7-10 gün devam edilmelidir. Hastanın önemli derecede azalmış olan mobilitesinde düzelme görülünceye kadar profilaksiye devam edilmelidir.
Yüksek derecede tromboemboli riski olan hastalarda önerilen enoksaparin sodyum dozu, tercihen cerrahiden 12 saat önce başlatılan ve subkütan enjeksiyon ile günde bir kez verilen 4.000 IU 'dur (40 mg). Enoksaparin sodyum ile preoperatif profilaksiye 12 saatten daha önce başlanması gerekiyorsa (örn. ertelenmiş bir ortopedik cerrahiyi beklemekte olan yüksek riskli hastalar), son enjeksiyon cerrahiden en geç 12 saat önce yapılmış olmalı ve cerrahiden 12 saat sonra tekrar başlanmalıdır.
Majör ortopedik cerrahi uygulanan hastalar için, 5 haftaya varan genişletilmiş tromboprofilaksi önerilir.
Kanser nedeniyle abdominal ya da pelvik cerrahi geçiren venöz tromboembolizm (VTE) riski yüksek hastalar için 4 haftaya varan genişletilmiş tromboprofilaksi önerilir.
4.3. Kontrendikasyonlar
Enoksaparin sodyum aşağıdaki durumlarda kontrendikedir:
Enoksaparin sodyum, heparin ya da diğer düşük molekül ağırlıklı heparinler (DMAH) dahil olmak üzere heparin türevlerine ya da Bölüm 6.1'de belirtilen yardımcı maddelerden herhangi birine karşı aşırı duyarlılık,
Son 100 gün içinde immün sistem aracılı heparin ilişkili trombositopeni (HIT) öyküsü veya dolaşımda antikor varlığı (ayrıca Bkz. Bölüm 4.4)
Klinik açıdan anlamlı aktif kanama ya da yakın zamanda geçirilmiş hemorajik inme, gastrointestinal ülser, yüksek kanama riski olan malign neoplazm varlığı, yakın zamanda geçirilmiş beyin, spinal veya oftalmik cerrahi, bilinen ya da şüphelenilen özofageal varisler, arteriyovenöz malformasyonlar, vasküler anevrizmalar ya da majör intraspinal veya intraserebral vasküler anormallikler dahil yüksek hemoraji riski olan durumlar
Önceki 24 saat içinde tedavi için enoksaparin sodyum kullanıldığında spinal ya da epidural anestezi veya lokal-bölgesel anestezi (Bkz. Bölüm 4.4)
4.4. Özel kullanım uyarıları ve önlemleri
Genel:
Enoksaparin sodyum, diğer DMAH'lerle dönüşümlü olarak (bir birime bir birim) kullanılamaz. Bu tıbbi ürünler üretim prosesi, moleküler ağırlık, spesifik anti-Xa ve anti-IIa aktiviteleri, birim, dozaj ve klinik etkinlik ile güvenlilik açısından farklıdırlar. Bu da farmakokinetik ve ilişkili biyolojik aktivitelerinin (örn. antitrombin aktivitesi ve trombosit etkileşimleri) farklı olmasına yol açar. Bu yüzden her ürünün spesifik kullanım şekline özellikle dikkat edilmesi ve talimatlara uyulması gerekmektedir.
HIT öyküsü (>100 gün):
Son 100 gün içinde immün sistem aracılı HIT öyküsü veya dolaşımda antikor varlığı söz konusu olan hastalarda enoksaparin sodyum kullanımı kontrendikedir. (Bkz. Bölüm 4.3). Antikorlar birkaç yıl dolaşımda kalabilir.
Enoksaparin sodyum, dolaşımda antikor izlenmeyen heparin ilişkili trombositopeni öyküsü (>100 gün) olan hastalarda çok dikkatli kullanılmalıdır. Bu tip durumlarda enoksaparin sodyum kullanma kararı yalnızca dikkatli bir fayda-risk değerlendirmesinden sonra ve heparin dışı alternatif tedavilerin (örn. danaparoid sodyum veya lepirudin) düşünülmesinin ardından verilmelidir.
Trombosit sayılarının izlenmesi:
Antikor aracılı HIT riski DMAH'lerde de söz konusudur. Trombositopeni ortaya çıkarsa, genellikle enoksaparin sodyum tedavisinin başlangıcını takip eden 5. ve 21. günler arasında görülür.
Postoperatif hastalarda HIT riski daha yüksektir ve genelde kardiyak cerrahi sonrası ile kanser hastalarında meydana gelir.
Bu yüzden enoksaparin sodyum ile tedaviye başlamadan önce ve daha sonra tedavi sırasında düzenli olarak trombosit sayılarının ölçülmesi tavsiye edilir.
HIT düşündüren klinik semptomlar söz konusuysa (herhangi bir yeni arteriyel ve/veya venöz tromboembolizm olayı, enjeksiyon yerinde herhangi bir ağrılı cilt lezyonu, tedavi sırasında herhangi bir alerjik ya da anafilaktoid reaksiyon), trombosit sayısı ölçülmelidir. Hastalar bu semptomların meydana gelebileceğini bilmeli ve eğer olursa birinci basamak hekimlerine bilgi vermelidir.
Pratikte trombosit sayısında doğrulanmış anlamlı bir azalma gözlenirse (başlangıç değerinin
%30-50'si) enoksaparin sodyum tedavisi hemen kesilmeli ve hasta heparin dışında alternatif başka bir antikoagülan tedavisine geçirilmelidir.
Hemoraji:
Diğer antikoagülanlarla olduğu gibi herhangi bir yerde kanama meydana gelebilir. Eğer kanama meydana gelirse hemorajinin kökeni araştırılmalı ve uygun tedavi tayin edilmelidir.
Tüm diğer antikoagülan tedavilerinde olduğu gibi enoksaparin sodyum da, kanama potansiyelinin arttığı aşağıdaki durumlarda dikkatle kullanılmalıdır:
Bozulmuş hemostaz,
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Eşzamanlı kullanım önerilmez:
Hemostazı etkileyen ilaçlar (Bkz. Bölüm 4.4)
Eğer kesin olarak endike değilse hemostazı etkileyen ajanların enoksaparin sodyum tedavisinden önce kesilmesi önerilmektedir. Kombinasyon endikasyonu varsa, enoksaparin sodyum uygun durumlarda dikkatli klinik ve laboratuvar takip eşliğinde kullanılmalıdır. Bu ajanlar arasında aşağıdaki gibi tıbbi ürünler bulunmaktadır:
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Deneysel araştırmalar bir fetotoksisite veya teratojenite bulgusu ortaya koymamıştır.
Gebelik dönemi
İnsanlarda, enoksaparin sodyumun gebeliğin ikinci ve üçüncü trimesteri sırasında plasenta bariyerini geçtiğine ilişkin herhangi bir bulgu yoktur. Birinci trimesterle ilgili herhangi bir bilgi bulunmamaktadır.
Hayvanlardaki çalışmalarda herhangi bir fetotoksisite ya da teratojenite bulgusu ile karşılaşılmamıştır (Bkz. Bölüm 5.3). Hayvanlardaki verilere göre enoksaparin sodyumun plasentadan geçişi minimaldir. İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebe kadınlara verilirken tedbirli olunmalıdır.
Enoksaparin sodyum gebelikte yalnızca hekimin açıkça gerekli gördüğü durumlarda kullanılmalıdır.
Enoksaparin sodyum kullanan gebe kadınlar kanama ya da aşırı antikoagülasyon açısından yakından takip edilmeli ve hemorajik risk konusunda uyarılmalıdır. Gebe kadınlarda gebe olmayan kadınlara göre hemoraji, trombositopeni ya da osteoporoz riskinde artış olduğuna ilişkin genel bir bulgu yoktur ve bu riskler prostetik kalp kapağı olan kadınlarla sınırlıdır (Bkz. Bölüm 4.4).
Epidural anestezi planlanan kadınlarda işlem öncesinde enoksaparin sodyum tedavisinin kesilmesi önerilir (Bkz. Bölüm 4.4).
Laktasyon dönemi
Enoksaparin sodyumun insan sütüne değişmeden geçip geçmediği bilinmemektedir. Emziren sıçanlarda, Enoksaparin sodyum ya da metabolitlerinin süte geçişi çok azdır. Enoksaparin sodyumun oral emilim olasılığı düşüktür. VENAPERTA emzirme sırasında kullanılabilir.
Üreme yeteneği/Fertilite
Enoksaparin sodyumun fertilite üzerindeki etkilerine ilişkin klinik veri mevcut değildir. Hayvanlardaki çalışmalarda fertilite üzerinde herhangi bir etki görülmemiştir (Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanımı üzerine bilinen herhangi bir etkisi bulunmamaktadır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Enoksaparin, klinik çalışmalarda enoksaparin alan 15.000'den fazla hastada değerlendirilmiştir. Bunlar, tromboembolik komplikasyonlar açısından risk altındaki hastalarda ortopedik veya abdominal cerrahiyi takiben derin ven trombozunun profilaksisi için 1.776, hareket yeteneği şiddetli ölçüde kısıtlanmış akut medikal hastalarda derin ven trombozunun profilaksisi için 1.169, pulmoner embolizmin eşlik ettiği veya etmediği derin ven trombozunun tedavisi için
559, kararsız angina ve Q-dalgasız miyokard infarktüsünün tedavisi için 1.578 ve akut ST- yükselmeli miyokard infarktüsünün tedavisi için 10.176 hastayı içermiştir.
Bu klinik çalışmalarda uygulanan enoksaparin sodyum rejimi endikasyonlara bağlı olarak farklılık göstermektedir. Cerrahi geçiren ya da mobilitesi ciddi şekilde kısıtlanmış akut hastalığı bulunan olgularda derin ven trombozu profilaksisi için kullanılan enoksaparin sodyum dozu günde bir kez olmak üzere S.C. yolla 4.000 IU (40 mg)'dır. Pulmoner embolizmin (PE) eşlik ettiği veya etmediği derin ven trombozunun (DVT) tedavisinde, enoksaparin alan hastalar 12 saatte bir 100 IU/kg (1 mg/kg) subkütan dozu ya da günde bir kez 150 IU/kg (1,5 mg/kg) subkütan dozu ile tedavi edilmiştir. Kararsız angina ve Q-dalgasız miyokard infarktüsünün tedavisi için klinik çalışmalarda, dozlar 12 saatte bir 100 IU/kg (1 mg/kg) subkütan olmuş ve akut ST-yükselmeli miyokard infarktüsünün tedavisi için klinik çalışmada enoksaparin sodyum rejimi 3.000 IU'luk (30 mg) IV bolusu takiben 12 saatte bir 100 IU/kg (1 mg/kg) subkütan olmuştur.
Enoksaparin tedavisi ile ilişkili olarak akut generalize ekzantematöz püstüloz (AGEP) bildirilmiştir (Bkz. Bölüm 4.4).
Klinik çalışmalarda en sık bildirilen reaksiyonlar hemoraji, trombositopeni ve trombositozdur (Bkz. Bölüm 4.4 ve aşağıda âSeçilmiş advers reaksiyonların tanımıâ).
Bu klinik çalışmalarda gözlenen ve pazarlama sonrası deneyimde bildirilen advers etkiler aşağıda ayrıntılı olarak verilmektedir.
İstenmeyen etkiler aşağıdaki sıklık derecelerine göre sınıflandırılır:
Çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1.000 ila < 1/100); seyrek (≥ 1/10.000 ila <1/1.000); ve çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları
Yaygın: Hemoraji, hemorajik anemi *, trombositopeni, trombositoz
Seyrek: Eozinofili*, tromboz ile birlikte immüno-alerjik trombositopeni gelişen vakalar; bunların bazılarında tromboz ile birlikte organ enfarktüsü ya da ekstremite iskemisi görülmüştür (Bkz. Bölüm 4.4).
Bağışıklık sistemi hastalıkları
Yaygın: Alerjik reaksiyon
Seyrek: Anafilaktik/anafilaktoid reaksiyonlar (şok dahil)*
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı *
Vasküler hastalıkları
Seyrek: Spinal hematom * (ya da nöraksiyal hematom). Bu reaksiyonlar uzun süreli ya da kalıcı paraliz dahil değişik derecelerde nörolojik hasara yol açmıştır (Bkz. Bölüm 4.4).
Hepato-bilier hastalıkları
Çok yaygın: Karaciğer enzimlerinde artış (başlıca: transaminaz düzeyi > 3 x normal üst sınır) Yaygın olmayan: Hepatoselüler karaciğer hasarı *
Seyrek: Kolestatik karaciğer hasarı *
Deri ve deri altı doku hastalıkları Yaygın: Ürtiker, kaşıntı, eritem Yaygın olmayan: Büllöz dermatit
Seyrek: Alopesi *, Kutanöz vaskülit*, genellikle enjeksiyon bölgesinde cilt nekrozu* (bu fenomenlerden önce genellikle ağrılı ve infiltratif purpura ya da eritematöz plaklar görülmüştür) Enjeksiyon bölgesinde nodüller* (kistik enoksaparin içeriği olmayan enflamatuvar nodüller). Birkaç gün içinde iyileşmekte ve tedavinin bırakılmasına yol açmamaktadırlar.
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Seyrek: Uzun süreli tedavinin ardından osteporoz * (tedavi süresi > 3 ay)
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Yaygın: Enjeksiyon bölgesinde hematom, enjeksiyon bölgesinde ağrı, enjeksiyon bölgesinde diğer reaksiyonlar (örn. ödem, hemoraji, hipersensitivite, enflamasyon, kitle, ağrı ya da reaksiyon)
Yaygın olmayan: Enjeksiyonbölgesinde cilt nekrozu, lokal irritasyon
Araştırmalar
Seyrek: Hiperkalemi * (Bkz. Bölüm 4.4 ve 4.5)
Seçilmiş advers reaksiyonların tanımı Hemorajiler
Bunlar arasında hastaların en fazla % 4,2' sinde (cerrahi hastalar) bildirilen majör hemorajiler bulunmaktadır. Bu olguların bazıları ölümle sonuçlanmıştır. Cerrahi hastalarda hemorajik komplikasyonlar aşağıdaki durumlarda majör kabul edilmiştir: (1) hemoraji önemli bir klinik olaya yol açtığında ya da (2) hemoglobinde ≥ 2 g/dL düşüşle birlikte gerçekleştiğinde veya ≥ 2 ünite kan ürünü transfüzyonu gerektirdiğinde. Retroperitoneal ve intrakraniyal hemorajiler her durumda majör kabul edilmiştir.
Diğer antikoagülanlarda olduğu gibi, hemoraji aşağıdaki gibi ilişkili risk faktörlerinin varlığında ortaya çıkabilir: Kanamaya yatkın organik lezyonlar, invazif işlemler ya da hemostazı etkileyen ilaçların eş zamanlı kullanımı (Bkz. Bölüm 4.4 ve 4.5).
Sistem organ sınıfı | Cerrahi hastalarında profilaksi | Medikal hastalarda profilaksi | DVT (PE varlığında ve yokluğunda) | Kararsız angina ve Q- dalgasız MI olan hastalarda tedavi | Akut STEMI olan hastalarda tedavi |
Kan ve lenf sistemi hastalıklar ı | Çok yaygın: Hemoraji*
Seyrek: Retroperitonea l hemoraji | Yaygın: Hemoraji * | Çok yaygın: Hemoraji*
Yaygın olmayan: İntrakraniyal hemoraji, Retroperitonea l hemoraji | Yaygın: Hemoraji*
Seyrek: Retroperitonea l hemoraji | Yaygın: Hemoraji*
Yaygın olmayan: İntrakraniyal hemoraji, Retroperitonea l hemoraji |
*: örn. hematom, enjeksiyon bölgesi dışındaki ekimoz, yarada hematom, hematüri, epistaksis ve gastrointestinal kanama.
Trombositopeni ve trombositoz
Sistem organ sınıfı | Cerrahi hastalarında profilaksi | Medikal hastalarda profilaksi | DVT (PE varlığında ve yokluğunda) | Kararsız angina ve Q- dalgasız MI olan hastalarda tedavi | Akut STEMI olan hastalarda tedavi |
Kan ve lenf sistemi hastalıklar | Çok yaygın: Trombositoz*
Yaygın: Trombositope ni | Yaygın olmayan: Trombosit openi | Çok yaygın: Trombositoz *
Yaygın: Trombositop eni | Yaygın olmayan: Trombositop eni | Yaygın: Trombositoz* Trombositopeni
Çok seyrek: İmmuno-alerjik trombositopeni |
*: Trombosit artışı > 400 g/L
Pediyatrik popülasyon
Çocuklarda enoksaparin sodyumun etkililik ve güvenliliği belirlenmemiştir (Bkz. Bölüm 4.2).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)' ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0312 218 35 99)
4.9. Doz aşımı ve tedavisi
Belirti ve semptomlar:
İntravenöz, ekstrakorporeal veya subkütan enoksaparin sodyumun kazara doz aşımı hemorajik komplikasyonlara yol açabilir. Büyük dozlarda olsa dahi oral uygulamayı takiben enoksaparin sodyumun absorbe olması mümkün değildir.
Antidotu ve tedavisi:
Antikoagülan etkiler protaminin yavaş intravenöz enjeksiyonu ile büyük ölçüde nötralize edilebilmektedir. Protamin dozu enjekte edilen enoksaparin sodyum dozuna bağlı olup, enoksaparin sodyum son 8 saat içinde uygulanmış ise 1 mg protamin 100 IU (1 mg) enoksaparin sodyumun antikoagülan etkisini nötralize etmektedir. Enoksaparin sodyum uygulanmasının üstünden 8 saatten daha uzun zaman geçmiş ise veya ikinci bir protamin dozunun gerekli olduğu belirlenmiş ise, 100 IU (1 mg) enoksaparin sodyum başına 0.5 mg protamin infüzyonu uygulanabilir. Enoksaparin sodyum enjeksiyonundan 12 saat sonra, protamin uygulanmasına gerek duyulmayabilir. Bununla birlikte, yüksek protamin dozlarıyla dahi, enoksaparin sodyumun anti-Xa aktivitesi hiçbir zaman tam olarak nötralize edilmez (maksimum yaklaşık
%60) (Bkz. protamin tuzlarının reçete bilgileri).
İğne kapağını dikkatlice VENAPERTA enjektöründen çıkarınız. Kapağı atabilirsiniz. İğne dolu ve kullanıma hazırdır.
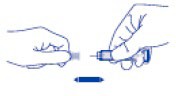
Hava kabarcıklarını uzaklaştırmak amacıyla kendinize enjeksiyon yapmadan önce enjektör pistonuna BASTIRMAYINIZ. Bu ilacın miktarının azalmasına neden olabilir. Kapağı
çıkardıktan sonra, iğnenin temiz kalmasını (steril) sağlamak için iğneyi herhangi bir yere temas ettirmeyiniz.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Heparinler, Antitrombotik ajan ATC kodu: B01AB05
Farmakodinamik etkiler
Enoksaparin ortalama moleküler ağırlığı yaklaşık 4.500 dalton olan ve standart heparinin antitrombotik ve antikoagulan aktivitelerini ayrıştıran bir DMAH'dir. Etkin madde sodyum tuzudur.
VENAPERTA biyobenzer bir ilaçtır.
In vitro saflaştırılmış sistemde enoksaparin sodyum yüksek anti-Xa aktivite (yaklaşık 100 IU/mg) ve düşük anti-IIa ya da anti-trombin aktivitesi gösterir (yaklaşık 28 IU/mg); bunlar arasındaki oran 3,6'dır. Antikoagulan aktiviteye anti-trombin III (ATIII) etkisi aracılık eder ve insanlarda anti-trombotik aktivite sağlanır.
Sağlıklı kişilerde, hastalarda ve klinik dışı modellerde enoksaparinin anti-Xa/IIa aktivitesine ek
antitrombotik ve anti-inflamatuvar özelliklere sahip olduğu belirlenmiştir.
Bunlar arasında, faktör VIIa gibi diğer koagulasyon faktörlerinin ATIII'e bağımlı inhibisyonu, endojen Doku Faktörü Yolağı İnhibitör (TFPI) salıverilmesi ve vasküler endotelden kan dolaşımına vWF (von Willebrand faktörü) salınımındaki azalma bulunmaktadır. Bu faktörlerin enoksaparin sodyumun genel antitrombotik etkisine katkı sağladıkları bilinmektedir.
Profilaktik bir tedavi olarak kullanıldığında, enoksaparin sodyum aPTT'yi önemli ölçüde etkilemez. Küratif tedavi olarak kullanıldığında, doruk aktivite esnasında aPTT kontrole göre 1,5 - 2,2 kez uzayabilir.
Klinik etkililik ve güvenlilik
Cerrahiyle ilişkili venöz tromboembolik hastalığın önlenmesi
- Ortopedik cerrahi sonrası uzun süreli VTE profilaksisi
Kalça replasman cerrahisi uygulanan hastalarda uzun süreli profilaksiyi değerlendiren bir çift kör çalışmada, daha önce venöz tromboembolik hastalık öyküsü bulunmayan 179 hasta hastanede yatışları sırasında 4.000 IU (40 mg) enoksaparin sodyum ile tedavi edilmişler ve taburculuk sonrası 3 hafta süreyle günde bir kez S.C. yolla 4.000 IU enoksaparin sodyum (n=90) ya da plasebo kullanacak (n=89) şekilde randomize edilmişlerdir. Uzun süreli profilaksi sırasında DVT insidansı enoksaparin sodyum grubunda plaseboya göre anlamlı ölçüde daha düşük bulunmuş ve PE bildirilmemiştir. Majör kanama kaydedilmemiştir.
Etkililik verileri aşağıdaki tabloda sunulmuştur.
| Enoksaparin sodyum 4.000 IU (40 mg) günde bir kez S.C. n (%) | Plasebo günde bir kez S.C. n (%) |
Uzun Süreli Profilaksi Uygulanan Tüm Hastalar | 90 (100) | 89 (100) |
Total VTE | 6 (6,6) | 18 (20,2) |
Total DVT (%) | 6 (6,6) | 18 (20,2) |
Proksimal DVT (%) | 5 (5,6) | 7 (8,8) |
*p değeri plaseboya karşı =0,008 #p değeri plaseboya karşı =0,537 | ||
İkinci bir çift kör çalışmada, VTE'si olmayan ve kalça replasman cerrahisi uygulanan 262 hastaya başlangıçta hastanede yatış sırasında 4.000 IU (40 mg) S.C. enoksaparin sodyum uygulanmış ve bu hastalar taburcu edildikten sonra 3 hafta süreyle günde bir kez S.C. yolla
4.000 IU (40 mg) (n=131) enoksaparin sodyum ya da plasebo (n=131) kullanacak şekilde randomize edilmişlerdir. İlk çalışmaya benzer şekilde, uzun süreli profilaksi sırasında VTE insidansı enoksaparin grubunda hem total VTE (enoksaparin sodyum 21 (%16)'e karşı plasebo 45 (%34,4); p=0,001) hem de proksimal DVT (enoksaparin sodyum 8 (%6,1)'e karşı plasebo 28 (%21,4); p < 0,001) için daha düşük bulunmuştur. Enoksaparin sodyum ve plasebo grupları arasında majör kanama açısından anlamlı fark belirlenmemiştir.
Kanser cerrahisi sonrası uzun süreli DVT profilaksisi
Çift kör, çok merkezli bir çalışmada abdominal ya da pelvik kanser nedeniyle elektif cerrahi uygulanan 332 hastada dört hafta ya da bir hafta süreli enoksaparin sodyum profilaksisi etkililik ve güvenlilik açısından karşılaştırılmıştır. Hastalar 6-10 gün süreyle enoksaparin sodyum tedavisi almışlar (4.000 IU (40 mg) S.C.) ve ardından 21 gün süreyle enoksaparin sodyum ya da plasebo kullanacak şekilde randomize edilmişlerdir. Bilateral venografi 25-31. günler arasında gerçekleştirilmiştir (venöz tromboembolizm semptomları gelişirse daha erken). Hastalar üç ay süreyle izlenmiştir. Abdominal ya da pelvik kanser cerrahisi sonrasında dört hafta süreli enoksaparin sodyum profilaksisi, bir hafta süreli enoksaparin sodyum profilaksisi ile karşılaştırıldığında venografi ile gösterilmiş tromboz insidansını anlamlı ölçüde azaltmıştır. Çift kör faz sonunda venöz tromboembolizm oranları plasebo grubunda %12,0 (n=20) ve
enoksaparin sodyum grubunda %4,8 (n=8) olarak belirlenmiştir (p=0,02). Bu farklılık üçüncü ayda devam etmiştir (%13,8'e karşı %5,5 (n=23'e karşı 9), p=0,01). Çift kör fazda ya da izlem fazında kanama ya da diğer komplikasyonlar açısından farklılık belirlenmemiştir.
Hareket kısıtlılığına yol açması beklenen akut hastalığı olan kişilerde venöz tromboembolik hastalık profilaksisi
Akut hastalık sırasında hareketliliği önemli ölçüde kısıtlanmış (yürüme mesafesi ≤ 3 gün süreyle < 10 metre) hastalarda DVT profilaksisi için günde bir kez 2.000 IU (20 mg) S.C. enoksaparin sodyum, günde bir kez 4.000 IU (40 mg) S.C. enoksaparin sodyum ve plasebo karşılaştırmak amacıyla çift kör, çok merkezli, paralel gruplu bir çalışma gerçekleştirilmiştir. Çalışmaya kalp yetmezliği (NYHA Sınıfı III ya da IV); akut solunum yetmezliği ya da komplikasyonlu kronik solunum yetmezliği, akut infeksiyonu, akut romatizmal hastalığı ve en az bir VTE risk faktörü (yaş ≥ 75, kanser, geçirilmiş VTE, obezite, variköz venler, hormon terapisi, kronik kalp hastalığı ya da solunum yetmezliği) olan hastalar katılmıştır.
Çalışmaya toplam 1.102 hasta kaydedilmiş ve 1.073 hasta tedavi edilmiştir. Tedavi 6-14 gün sürdürülmüştür (medyan tedavi süresi 7 gün). Günde bir kez S.C. yolla uygulanan 4.000 IU (40 mg) enoksaparin sodyum, plasebo ile karşılaştırıldığında VTE insidansını anlamlı ölçüde düşürmüştür. Etkililikle ilgili veriler aşağıdaki tabloda sunulmaktadır.
| Enoksaparin sodyum 2.000 IU (20 mg) günde bir kez S.C. n (%) | Enoksaparin sodyum 4.000 IU (40 mg) günde bir kez S.C. n (%) | Plasebo n (%) |
Akut Hastalık Sırasında Tedavi Edilen Tüm Olgular |
287 (100) |
291(100) |
288 (100) |
Total VTE (%) | 43 (15,0) | 16 (5,5)* | 43 (14,9) |
Total DVT (%) | 43 (15,0) | 16 (5,5) | 40 (13,9) |
Proksimal DVT (%) | 13 (4,5) | 5 (1,7) | 14 (4,9) |
VTE = venöz tromboembolik olaylar; bunlar arasında DVT, PE, ve tromboembolik kökenli olduğu düşünülen ölüm bulunmaktadır * p değeri, plaseboya karşı =0,0002 | |||
Çalışma kayıt tarihinden yaklaşık 3 ay sonra enoksaparin sodyum 4.000 IU (40 mg) grubundaki VTE insidansı plasebo grubuna anlamlı ölçüde daha düşük kalmayı sürdürmüştür. Total ve majör kanama olaylarının sıklığı plasebo grubunda %8,6 ve %1,1, enoksaparin sodyum 2.000 IU (20 mg) grubunda %11,7 ve %0,3 ve enoksaparin sodyum 4.000 IU (40 mg) grubunda ise
%12,6 ve %1,7 olarak belirlenmiştir.
Pulmoner embolizmin eşlik ettiği ya da etmediği derin ven trombozunun tedavisi
PE'nin eşlik ettiği ya da etmediği akut alt ekstremite DVT'si olan 900 hastanın katıldığı çok merkezli, paralel gruplu bir çalışmada olgular hastanede aşağıdaki tedavi gruplarına randomize edilmiştir: (i) enoksaparin sodyum 150 IU/kg (1,5 mg/kg) günde bir kez S.C., (ii) enoksaparin sodyum 100 IU/kg (1 mg/kg) her 12 saatte bir S.C., ya da (iii) heparin IV bolus (5,000 IU) ve sonrasında sürekli infüzyon (aPTT 55-85 saniye olacak şekilde). Tüm hastalara aynı zamanda, enoksaparin sodyum ya da standart heparin tedavisini izleyen ilk 72 saat içerisinde varfarin sodyum tedavisi de başlanmış (protrombin zamanına göre INR 2,0-3,0 olacak şekilde) ve bu tedavi 90 gün süreyle devam ettirilmiştir. Enoksaparin sodyum ya da standart heparin tedavisi minimum 5 gün süreyle ve hedeflenen varfarin sodyum INR'sine ulaşılana kadar sürdürülmüştür. Her iki enoksaparin sodyum rejimi yineleyen venöz tromboembolizm riskini (DVT ve/veya PE) azaltmak açısından standart heparin tedavisine eşdeğer bulunmuştur. Aşağıdaki tabloda etkililik verileri sunulmaktadır.
| Enoksaparin sodyum 150 IU/kg (1,5 mg/kg) günde bir kez S.C. n (%) | Enoksaparin sodyum 100 IU/kg (1 mg/kg) günde iki kez S.C. n (%) | Heparin aPTT'ye göre ayarlı IV Terapi n (%) |
PE'li ya da PE'siz tedavi edilmiş tüm DVT hastaları |
298 (100) |
312 (100) |
290 (100) |
Total VTE (%) | 13 (4,4)* | 9 (2,9)* | 12 (4,1) |
Yalnızca DVT (%) | 11 (3,7) | 7 (2,2) | 8 (2,8) |
Yalnızca DVT (%) | 9 (3,0) | 6 (1,9) | 7 (2,4) |
PE (%) | 2 (0,7) | 2 (0,6) | 4 (1,4) |
VTE = venöz tromboembolik olay (DVT ve/veya PE) *Total VTE için tedavi farklarına ilişkin %95 güven aralığı: | |||
Heparine karşı günde bir kez enoksaparin sodyum (-3 ila 3,5)
5.2. Farmakokinetik özellikler
Genel Özellikler
Enoksaparin sodyumun farmakokinetik parametreleri, esas olarak; plazma anti-Xa aktivitesinin zaman süreci ve ayrıca anti-IIa aktivitesi açısından, önerilen dozaj aralıklarında; tekli ve tekrarlanan subkütan uygulamadan sonra ve tekli intravenöz uygulamadan sonra incelenmiştir.
Anti-Xa ve anti-IIa farmakokinetik aktivitelerin kantitatif tayini, validasyonu yapılmış amidolitik yöntemler kullanılarak gerçekleştirilmiştir.
Emilim:
Subkütan enjeksiyonun ardından anti-Xa aktivitesine dayanarak enoksaparin sodyumun mutlak biyoyararlanımı % 100'e yakındır.
Farklı dozlar ve doz rejimleri kullanılabilir.
Ortalama maksimum plazma anti-Xa aktivitesi subkütan enjeksiyondan 3-5 saat sonra gözlenmekte ve 2.000 IU, 4.000 IU, 100 IU/kg ve 150 IU/kg (20 mg, 40 mg, 1 mg/kg ve 1,5 mg/kg) dozlarının tek subkütan uygulanmasını takiben sırasıyla yaklaşık 0,2; 0,4; 1 ve 1,3 anti- Xa IU/mL'ye ulaşmaktadır.
3.000 IU (30 mg) dozda IV bolus ve hemen ardından subkütan yolla 12 saatte bir uygulanan 1 mg/kg, 1,16 IU/mL'lik başlangıç pik anti-Faktör Xa düzeyleri (n = 16) ve sabit durum düzeylerinin %88'ine karşılık gelen bir ortalama etkilenim sağlamıştır. Sabit duruma tedavinin ikinci gününde ulaşılmaktadır.
Sağlıklı gönüllülerde günde bir kez 4.000 IU (40 mg) ve günde bir kez 150 IU/kg (1,5 mg/kg) rejimlerinin tekrarlanan subkütan uygulanmasını takiben, tek doz sonrasına kıyasla yaklaşık
%15 daha yüksek bir ortalama maruz kalma oranı ile sabit duruma 2. gün ulaşılmaktadır. Günde iki kez 100 IU/kg'lık (1 mg/kg) rejiminin tekrarlanan subkütan uygulanmasını takiben sabit duruma 3. gün ile 4. gün arasında ulaşılmakta olup, tek doz sonrasına kıyasla yaklaşık %65 daha yüksek bir ortalama maruz kalma oranı ve sırasıyla yaklaşık 1,2 ve 0,52 IU/mL'lik ortalama pik ve taban düzeyleri saptanmaktadır.
Sağlıklı gönüllülerde 100-200 mg/mL'lik doz aralığında enjeksiyon hacmi ve doz konsantrasyonu farmakokinetik parametreleri etkilememektedir.
Enoksaparin sodyumun farmakokinetik profili önerilen doz aralığında lineer görünümlüdür. Hastalar arasında ve aynı hasta içinde değişkenlik düşüktür. Tekrarlanan S.C. uygulamalardan sonra birikim görülmez.
Subkütan uygulamadan sonra plazma anti-IIa aktivitesi anti-Xa aktivitesine kıyasla yaklaşık 10 kat daha düşüktür. Ortalama maksimum anti-IIa aktivitesi subkütan uygulamadan yaklaşık 3-4 saat sonra gözlenmekte ve günde iki kez 100 IU/kg (1 mg/kg) ve günde bir kez 150 IU/kg'ın
(1,5 mg/kg) tekrarlanan uygulanmasını takiben sırasıyla 0,13 IU/mL ve 0,19 IU/mL'ye ulaşmaktadır.
Dağılım:
Enoksaparin sodyum anti-Xa aktivitesinin dağılım hacmi yaklaşık 4,3 litredir ve kan hacmine yakındır.
Biyotransformasyon:
Enoksaparin sodyum esas olarak karaciğerde, depolimerizasyon ve/veya desülfasyon yoluyla son derece azalmış biyolojik potense sahip düşük molekül ağırlıklı türlere metabolize olmaktadır.
Eliminasyon:
Enoksaparin sodyum düşük klirensli bir ilaçtır ve 150 IU/kg'lık (1,5 mg/kg) 6-saatlik IV
infüzyondan sonra ortalama anti-Xa plazma klirensi 0,74 L/sa düzeyindedir.
Eliminasyon monofazik görünümlüdür ve yarılanma ömrü tek S.C. doz sonrasında 5 saat ve tekrarlanan dozlardan sonra 7 saat civarındadır.
Aktif metabolitlerin renal klirensi uygulanan dozun yaklaşık %10'unu ve aktif ve aktif olmayan metabolitlerin renal atılımı dozun %40'ını temsil etmektedir.
Doğrusallık/doğrusal olmayan durum:
Veri bulunmamaktadır.
Hastalardaki karakteristik özellikler Yaşlılar:
Bir popülasyon farmakokinetik analizinin sonuçlarına göre, enoksaparin sodyumun kinetik profili böbrek fonksiyonu normal olduğunda yaşlı bireylerde genç bireylere kıyasla farklılık göstermemektedir. Bununla birlikte, böbrek fonksiyonu yaşla birlikte düştüğünden, yaşlı hastalarda enoksaparin sodyum eliminasyonu azalma gösterebilir (Bkz. Bölüm 4.4, 4.2 ve 5.2).
Karaciğer yetmezliği:
İleri evreli sirozu olan ve günde bir kez 4.000 IU (40 mg) enoksaparin sodyum ile tedavi edilen hastalarda, maksimum anti-Xa aktivitesindeki azalma ile hepatik yetmezliğin şiddetindeki artış (Child-Pugh kategorisiyle değerlendirilmiştir) arasında ilişki saptanmıştır. Bu azalmanın ana sebebi, hepatik yetmezliği olan hastalarda ATIII sentezindeki azalmaya bağlı olarak ATIII düzeylerinin de azalmasıdır.
Böbrek Yetmezliği:
Sabit durumda anti-Xa plazma klirensi ile kreatinin klirensi arasında doğrusal bir ilişki gözlenmiştir ve bu, böbrek fonksiyonu bozulmuş hastalarda enoksaparin sodyum klirensinin azaldığını göstermektedir. Sabit durumda eğri altında kalan alan (EAA) ile ifade edilen anti-Xa maruz kalma, tekrarlanan günde bir kez subkütan 4.000 IU (40 mg) dozlarından sonra hafif böbrek yetmezliği (kreatinin klirensi 50-80 mL/dk) ve orta derecede böbrek yetmezliği
(kreatinin klirensi 30-50 mL/dk) olan hastalarda küçük bir artış göstermektedir. Ağır böbrek yetmezliği (kreatinin klirensi<30 mL/dk) olan hastalarda ise, sabit durumda EAA, tekrarlanan günde bir kez subkütan 4.000 IU (40 mg) dozlarından sonra ortalama %65 oranında anlamlı bir artış göstermektedir (Bkz. Bölüm 4.4 ve 4.2).
Kilo:
Tekrarlanan günde bir kez subkütan 150 IU/kg (1,5 mg/kg) doz uygulamasından sonra, anti-Xa aktivitesi için ortalama EAA sabit durumda obez sağlıklı gönüllülerde (BMI 30-48 kg/m) obez olmayan kontrollere kıyasla biraz daha yüksek olup, E(maksimum anti-Xa aktivitesi) artmamaktadır. Obez bireylerde subkütan doz uygulamasıyla daha düşük bir kiloya göre ayarlanmış klirens söz konusudur.
Kiloya göre ayarlanmamış doz uygulandığında, tek bir subkütan 4.000 IU (40 mg) dozu takiben anti-Xa maruz kalma düzeyinin, normal kilolu kontrollerle karşılaştırıldığında düşük kilolu kadınlarda (< 45 kg) %52 ve düşük kilolu erkeklerde (< 57 kg) %27 daha yüksek olduğu saptanmıştır (Bkz. Bölüm 4.4).
Hemodiyaliz:
25 IU, 50 IU ya da 100 IU/kg'lık tek IV dozlardan (0,25, 0,5 ya da 1 mg/kg) sonra enoksaparin sodyumun farmakokinetik profili kontrol popülasyonundakine benzer bulunmuş, ancak EAA değerinin kontrole göre 2 kez daha yüksek olduğu görülmüştür.
Farmakokinetik etkileşimler:
Eşzamanlı olarak birlikte uygulandığında, enoksaparin sodyum ile trombolitikler arasında herhangi bir farmakokinetik etkileşim gözlenmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Enoksaparinin, Ames testi, fare lenfoma hücresi ileriye dönük mutasyon testi dahil olmak üzere in vitro testlerde herhangi bir mutajenik aktivite göstermemiştir. Ayrıca in vitro insan lenfosit kromozomal düzensizlik testi ve in vivo sıçan kemik iliği kromozomal düzensizlik testinde klastojenik etki de gözlemlenmemiştir.
Enoksaparinin, erkek ve dişi sıçanlarda 20 mg/kg/gün subkütan doz düzeylerine kadar fertilite ve reprodüktif performans üzerinde hiçbir etkisinin olmadığı gözlemlenmiştir. Gebe sıçan ve tavşanlarda, 30 mg/kg/gün enoksaparin subkütan doz düzeylerine kadar herhangi bir teratojenik etki veya fetotoksisite bulgusuna rastlanmamıştır.
Enoksaparinin antikogülan etkilerinin yanı sıra, 15 mg/kg/gün doz uygulaması ile hem sıçan ve köpekler üzerinde yapılan 13 haftalık subkutan toksisite araştırmalarında hem de10 mg/kg/gün doz uygulaması ile sıçan ve maymunlar üzerinde yapılan 26 haftalık subkütan ve intravenöz toksisite araştırmalarında hiçbir yan etki bulgusuna rastlanmamıştır.
Enjektörü bir kalem tutuyormuş gibi elinize alınız. Diğer elinizle, karnınızda enjeksiyon için seçtiğiniz bölgenin derisini nazikçe yakalayınız ve baş ile işaret parmaklarınızın arasında hafifçe sıkarak bir deri kıvrımı oluşturunuz.
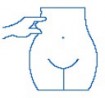
Bütün enjeksiyon boyunca deri kıvrımını tutmaya devam ediniz.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Enjeksiyonluk su
6.2. Geçimsizlikler
Subkütan Enjeksiyon:Diğer ürünler ile karıştırılmamalıdır.
IV (Bolus) Enjeksiyon (yalnızca akut STEMI endikasyonu için):
Enoksaparin sodyum, sudaki %5 dekstroz ya da normal serum fizyolojik çözeltisi (%0,9) ile güvenle uygulanabilir (Bkz. Bölüm 4.2).
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında ve ambalajında saklayınız. Buzdolabında saklamayınız ve dondurmayınız.
Önceden doldurulmuş enjektörler tek kullanımlıktır; kullanılmayan kısım atılmalıdır.
6.5. Ambalajın niteliği ve içeriği
1 mL çözelti içeren 2 adet kullanıma hazır enjektör
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj Atıklarının Kontrolü Yönetmeliğiâ ne uygun olarak imha edilmelidir.7. RUHSAT SAHİBİ
POLİFARMA İLAÇ SANAYİ VE TİC. A.Ş.
Vakıflar OSB Mahallesi, Sanayi Caddesi, No:22/1 Ergene/TEKİRDAĞ
Tel: 0 282 675 14 04
Faks: 0 282 675 14 05
e-mail: info@polifarma.com.tr
İğneyi dik olarak (90° lik açıyla) deri kıvrımına sonuna kadar batırınız
 Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur.
Artrit
Artrit, oldukça yaygın bir hastalıktır ancak iyi anlaşılamamıştır. Aslında artrit tek bir hastalığın adı değildir; eklem ağrısı veya eklem hastalıklarını adlandırmanın gayri resmi yoludur. |
 Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez.
Aşırı Alkol Kullanımı, Alkolizm
Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür.
Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması
gerekmez. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| CLEXANE | 8699809950344 | 302.68TL |
| CRUSIA | 8699769950415 | 778.61TL |
| ENOX | 8699717950061 | |
| OKSAPAR | 8699828950073 | |
| VENAPERTA | 8699606954743 | 88.07TL |
| Diğer Eşdeğer İlaçlar |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Tiroid Kanseri En sık görülen tiroid kanseri türü olan papiller tiroid kanseri, tüm tiroid kanserlerinin yaklaşık %70'ini oluşturur. |
İLAÇ GENEL BİLGİLERİ
Polifarma İlaç San.ve Tic. A.Ş.
| Satış Fiyatı | 359.95 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 359.95 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699606954774 |
| Etkin Madde | Enoksaparin Sodyum |
| Yerli ve Beşeri bir ilaçdır. |