VENAPERTA 6000 ANTI-XA IU/0.6 ml enjeksiyonluk çözelti içeren kullanıma hazır enjektör (2 adet) Klinik Özellikler
{ Enoksaparin Sodyum }
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
VENAPERTA yetişkinlerde aşağıdaki durumların tedavisinde endikedir:
Özellikle ortopedik cerrahi veya kanser cerrahisi dahil genel cerrahi geçirenler olmak üzere, orta ve yüksek riskli cerrahi uygulanan hastalarda venöz tromboemboli profilaksisinde (venlerde pıhtı oluşumunun önlenmesi)
Venöz tromboemboli riski yüksek akut kalp yetmezliği, solunum yetmezliği, ciddi enfeksiyonlar ve romatizmal hastalıkları içeren akut medikal hastalıkları olan ve mobilitesi azalmış hastalarda venöz tromboemboli profilaksisinde
Hemodiyaliz sırasında ekstrakorporeal dolaşımda tromboz oluşumunun önlenmesinde
Derin ven trombozu ve trombolitik tedavi veya cerrahi gerektirme ihtimali olan pulmoner emboli hariç, pulmoner emboli tedavisinde
Akut koroner sendrom:
Oral asetilsalisilik asit ile kombinasyon halinde, kararsız angina ve non ST-segment yükselmeli miyokard infarktüsü (NSTEMI) tedavisinde.
Medikal olarak tedavi edilen ya da daha sonra Perkütan Koroner Girişim uygulanan hastalar da dahil olmak üzere, akut ST-segment yükselmeli miyokard infarktüsünün (STEMI) tedavisi.
4.2. Pozoloji ve uygulama şekli
Orta ve yüksek riskli cerrahi hastalarında venöz tromboemboli hastalığının profilaksisi:
Orta derecede tromboemboli riski olan hastalarda, önerilen enoksaparin sodyum dozu subkütan enjeksiyon yoluyla günde bir kez 2.000 IU'dur. (20 mg). Enoksaparin sodyumun
2.000 IU'luk (20 mg) preoperatif başlangıç dozunun (cerrahiden 2 saat önce), orta derecede riskli cerrahide etkili ve güvenli olduğu kanıtlanmıştır.
Orta düzeyde riskli hastalarda, iyileşme durumu (örn. mobilite) ne olursa olsun, enoksaparin sodyum tedavisine en az 7-10 gün devam edilmelidir. Hastanın önemli derecede azalmış olan mobilitesinde düzelme görülünceye kadar profilaksiye devam edilmelidir.
Yüksek derecede tromboemboli riski olan hastalarda önerilen enoksaparin sodyum dozu, tercihen cerrahiden 12 saat önce başlatılan ve subkütan enjeksiyon ile günde bir kez verilen 4.000 IU 'dur (40 mg). Enoksaparin sodyum ile preoperatif profilaksiye 12 saatten daha önce başlanması gerekiyorsa (örn. ertelenmiş bir ortopedik cerrahiyi beklemekte olan yüksek riskli hastalar), son enjeksiyon cerrahiden en geç 12 saat önce yapılmış olmalı ve cerrahiden 12 saat sonra tekrar başlanmalıdır.
Majör ortopedik cerrahi uygulanan hastalar için, 5 haftaya varan genişletilmiş tromboprofilaksi önerilir.
Kanser nedeniyle abdominal ya da pelvik cerrahi geçiren venöz tromboembolizm (VTE) riski yüksek hastalar için 4 haftaya varan genişletilmiş tromboprofilaksi önerilir.
4.3. Kontrendikasyonlar
Enoksaparin sodyum aşağıdaki durumlarda kontrendikedir:
Enoksaparin sodyum, heparin ya da diğer düşük molekül ağırlıklı heparinler (DMAH) dahil olmak üzere heparin türevlerine ya da Bölüm 6.1'de belirtilen yardımcı maddelerden herhangi birine karşı aşırı duyarlılık,
Son 100 gün içinde immün sistem aracılı heparin ilişkili trombositopeni (HIT) öyküsü veya dolaşımda antikor varlığı (ayrıca Bkz. Bölüm 4.4)
Klinik açıdan anlamlı aktif kanama ya da yakın zamanda geçirilmiş hemorajik inme, gastrointestinal ülser, yüksek kanama riski olan malign neoplazm varlığı, yakın zamanda geçirilmiş beyin, spinal veya oftalmik cerrahi, bilinen ya da şüphelenilen özofageal varisler, arteriyovenöz malformasyonlar, vasküler anevrizmalar ya da majör intraspinal veya intraserebral vasküler anormallikler dahil yüksek hemoraji riski olan durumlar
Önceki 24 saat içinde tedavi için enoksaparin sodyum kullanıldığında spinal ya da epidural anestezi veya lokal-bölgesel anestezi (Bkz. Bölüm 4.4)
4.4. Özel kullanım uyarıları ve önlemleri
Genel:
Enoksaparin sodyum, diğer DMAH'lerle dönüşümlü olarak (bir birime bir birim) kullanılamaz. Bu tıbbi ürünler üretim prosesi, moleküler ağırlık, spesifik anti-Xa ve anti-IIa aktiviteleri, birim, dozaj ve klinik etkinlik ile güvenlilik açısından farklıdırlar. Bu da farmakokinetik ve ilişkili biyolojik aktivitelerinin (örn. antitrombin aktivitesi ve trombosit etkileşimleri) farklı olmasına yol açar. Bu yüzden her ürünün spesifik kullanım şekline özellikle dikkat edilmesi ve talimatlara uyulması gerekmektedir.
HIT öyküsü (>100 gün):
Son 100 gün içinde immün sistem aracılı HIT öyküsü veya dolaşımda antikor varlığı söz konusu olan hastalarda enoksaparin sodyum kullanımı kontrendikedir. (Bkz. Bölüm 4.3). Antikorlar birkaç yıl dolaşımda kalabilir.
Enoksaparin sodyum, dolaşımda antikor izlenmeyen heparin ilişkili trombositopeni öyküsü (>100 gün) olan hastalarda çok dikkatli kullanılmalıdır. Bu tip durumlarda enoksaparin sodyum kullanma kararı yalnızca dikkatli bir fayda-risk değerlendirmesinden sonra ve heparin dışı alternatif tedavilerin (örn. danaparoid sodyum veya lepirudin) düşünülmesinin ardından verilmelidir.
Trombosit sayılarının izlenmesi:
Antikor aracılı HIT riski DMAH'lerde de söz konusudur. Trombositopeni ortaya çıkarsa, genellikle enoksaparin sodyum tedavisinin başlangıcını takip eden 5. ve 21. günler arasında görülür.
Postoperatif hastalarda HIT riski daha yüksektir ve genelde kardiyak cerrahi sonrası ile kanser hastalarında meydana gelir.
Bu yüzden enoksaparin sodyum ile tedaviye başlamadan önce ve daha sonra tedavi sırasında düzenli olarak trombosit sayılarının ölçülmesi tavsiye edilir.
HIT düşündüren klinik semptomlar söz konusuysa (herhangi bir yeni arteriyel ve/veya venöz tromboembolizm olayı, enjeksiyon yerinde herhangi bir ağrılı cilt lezyonu, tedavi sırasında herhangi bir alerjik ya da anafilaktoid reaksiyon), trombosit sayısı ölçülmelidir. Hastalar bu semptomların meydana gelebileceğini bilmeli ve eğer olursa birinci basamak hekimlerine bilgi vermelidir.
Pratikte trombosit sayısında doğrulanmış anlamlı bir azalma gözlenirse (başlangıç değerinin
%30-50'si) enoksaparin sodyum tedavisi hemen kesilmeli ve hasta heparin dışında alternatif başka bir antikoagülan tedavisine geçirilmelidir.
Hemoraji:
Diğer antikoagülanlarla olduğu gibi herhangi bir yerde kanama meydana gelebilir. Eğer kanama meydana gelirse hemorajinin kökeni araştırılmalı ve uygun tedavi tayin edilmelidir.
Tüm diğer antikoagülan tedavilerinde olduğu gibi enoksaparin sodyum da, kanama potansiyelinin arttığı aşağıdaki durumlarda dikkatle kullanılmalıdır:
Bozulmuş hemostaz,
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Eşzamanlı kullanım önerilmez:
Hemostazı etkileyen ilaçlar (Bkz. Bölüm 4.4)
Eğer kesin olarak endike değilse hemostazı etkileyen ajanların enoksaparin sodyum tedavisinden önce kesilmesi önerilmektedir. Kombinasyon endikasyonu varsa, enoksaparin sodyum uygun durumlarda dikkatli klinik ve laboratuvar takip eşliğinde kullanılmalıdır. Bu ajanlar arasında aşağıdaki gibi tıbbi ürünler bulunmaktadır:
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Deneysel araştırmalar bir fetotoksisite veya teratojenite bulgusu ortaya koymamıştır.
Gebelik dönemi
İnsanlarda, enoksaparin sodyumun gebeliğin ikinci ve üçüncü trimesteri sırasında plasenta bariyerini geçtiğine ilişkin herhangi bir bulgu yoktur. Birinci trimesterle ilgili herhangi bir bilgi bulunmamaktadır.
Hayvanlardaki çalışmalarda herhangi bir fetotoksisite ya da teratojenite bulgusu ile karşılaşılmamıştır (Bkz. Bölüm 5.3). Hayvanlardaki verilere göre enoksaparin sodyumun plasentadan geçişi minimaldir. İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebe kadınlara verilirken tedbirli olunmalıdır.
Enoksaparin sodyum gebelikte yalnızca hekimin açıkça gerekli gördüğü durumlarda kullanılmalıdır.
Enoksaparin sodyum kullanan gebe kadınlar kanama ya da aşırı antikoagülasyon açısından yakından takip edilmeli ve hemorajik risk konusunda uyarılmalıdır. Gebe kadınlarda gebe olmayan kadınlara göre hemoraji, trombositopeni ya da osteoporoz riskinde artış olduğuna ilişkin genel bir bulgu yoktur ve bu riskler prostetik kalp kapağı olan kadınlarla sınırlıdır (Bkz. Bölüm 4.4).
Epidural anestezi planlanan kadınlarda işlem öncesinde enoksaparin sodyum tedavisinin kesilmesi önerilir (Bkz. Bölüm 4.4).
Laktasyon dönemi
Enoksaparin sodyumun insan sütüne değişmeden geçip geçmediği bilinmemektedir. Emziren sıçanlarda, Enoksaparin sodyum ya da metabolitlerinin süte geçişi çok azdır. Enoksaparin sodyumun oral emilim olasılığı düşüktür. VENAPERTA emzirme sırasında kullanılabilir.
Üreme yeteneği/Fertilite
Enoksaparin sodyumun fertilite üzerindeki etkilerine ilişkin klinik veri mevcut değildir. Hayvanlardaki çalışmalarda fertilite üzerinde herhangi bir etki görülmemiştir (Bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanımı üzerine bilinen herhangi bir etkisi bulunmamaktadır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Enoksaparin, klinik çalışmalarda enoksaparin alan 15.000'den fazla hastada değerlendirilmiştir. Bunlar, tromboembolik komplikasyonlar açısından risk altındaki hastalarda ortopedik veya abdominal cerrahiyi takiben derin ven trombozunun profilaksisi için 1.776, hareket yeteneği şiddetli ölçüde kısıtlanmış akut medikal hastalarda derin ven trombozunun profilaksisi için 1.169, pulmoner embolizmin eşlik ettiği veya etmediği derin ven trombozunun tedavisi için
559, kararsız angina ve Q-dalgasız miyokard infarktüsünün tedavisi için 1.578 ve akut ST- yükselmeli miyokard infarktüsünün tedavisi için 10.176 hastayı içermiştir.
Bu klinik çalışmalarda uygulanan enoksaparin sodyum rejimi endikasyonlara bağlı olarak farklılık göstermektedir. Cerrahi geçiren ya da mobilitesi ciddi şekilde kısıtlanmış akut hastalığı bulunan olgularda derin ven trombozu profilaksisi için kullanılan enoksaparin sodyum dozu günde bir kez olmak üzere S.C. yolla 4.000 IU (40 mg)'dır. Pulmoner embolizmin (PE) eşlik ettiği veya etmediği derin ven trombozunun (DVT) tedavisinde, enoksaparin alan hastalar 12 saatte bir 100 IU/kg (1 mg/kg) subkütan dozu ya da günde bir kez 150 IU/kg (1,5 mg/kg) subkütan dozu ile tedavi edilmiştir. Kararsız angina ve Q-dalgasız miyokard infarktüsünün tedavisi için klinik çalışmalarda, dozlar 12 saatte bir 100 IU/kg (1 mg/kg) subkütan olmuş ve akut ST-yükselmeli miyokard infarktüsünün tedavisi için klinik çalışmada enoksaparin sodyum rejimi 3.000 IU'luk (30 mg) IV bolusu takiben 12 saatte bir 100 IU/kg (1 mg/kg) subkütan olmuştur.
Enoksaparin tedavisi ile ilişkili olarak akut generalize ekzantematöz püstüloz (AGEP) bildirilmiştir (Bkz. Bölüm 4.4).
Klinik çalışmalarda en sık bildirilen reaksiyonlar hemoraji, trombositopeni ve trombositozdur (Bkz. Bölüm 4.4 ve aşağıda âSeçilmiş advers reaksiyonların tanımıâ).
Bu klinik çalışmalarda gözlenen ve pazarlama sonrası deneyimde bildirilen advers etkiler aşağıda ayrıntılı olarak verilmektedir.
İstenmeyen etkiler aşağıdaki sıklık derecelerine göre sınıflandırılır:
Çok yaygın (≥ 1/10); yaygın (≥ 1/100 ila < 1/10); yaygın olmayan (≥ 1/1.000 ila < 1/100); seyrek (≥ 1/10.000 ila <1/1.000); ve çok seyrek (< 1/10.000); bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları
Yaygın: Hemoraji, hemorajik anemi *, trombositopeni, trombositoz
Seyrek: Eozinofili*, tromboz ile birlikte immüno-alerjik trombositopeni gelişen vakalar; bunların bazılarında tromboz ile birlikte organ enfarktüsü ya da ekstremite iskemisi görülmüştür (Bkz. Bölüm 4.4).
Bağışıklık sistemi hastalıkları
Yaygın: Alerjik reaksiyon
Seyrek: Anafilaktik/anafilaktoid reaksiyonlar (şok dahil)*
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı *
Vasküler hastalıkları
Seyrek: Spinal hematom * (ya da nöraksiyal hematom). Bu reaksiyonlar uzun süreli ya da kalıcı paraliz dahil değişik derecelerde nörolojik hasara yol açmıştır (Bkz. Bölüm 4.4).
Hepato-bilier hastalıkları
Çok yaygın: Karaciğer enzimlerinde artış (başlıca: transaminaz düzeyi > 3 x normal üst sınır) Yaygın olmayan: Hepatoselüler karaciğer hasarı *
Seyrek: Kolestatik karaciğer hasarı *
Deri ve deri altı doku hastalıkları Yaygın: Ürtiker, kaşıntı, eritem Yaygın olmayan: Büllöz dermatit
Seyrek: Alopesi *, Kutanöz vaskülit*, genellikle enjeksiyon bölgesinde cilt nekrozu* (bu fenomenlerden önce genellikle ağrılı ve infiltratif purpura ya da eritematöz plaklar görülmüştür) Enjeksiyon bölgesinde nodüller* (kistik enoksaparin içeriği olmayan enflamatuvar nodüller). Birkaç gün içinde iyileşmekte ve tedavinin bırakılmasına yol açmamaktadırlar.
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Seyrek: Uzun süreli tedavinin ardından osteporoz * (tedavi süresi > 3 ay)
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Yaygın: Enjeksiyon bölgesinde hematom, enjeksiyon bölgesinde ağrı, enjeksiyon bölgesinde diğer reaksiyonlar (örn. ödem, hemoraji, hipersensitivite, enflamasyon, kitle, ağrı ya da reaksiyon)
Yaygın olmayan: Enjeksiyonbölgesinde cilt nekrozu, lokal irritasyon
Araştırmalar
Seyrek: Hiperkalemi * (Bkz. Bölüm 4.4 ve 4.5)
Seçilmiş advers reaksiyonların tanımı Hemorajiler
Bunlar arasında hastaların en fazla % 4,2' sinde (cerrahi hastalar) bildirilen majör hemorajiler bulunmaktadır. Bu olguların bazıları ölümle sonuçlanmıştır. Cerrahi hastalarda hemorajik komplikasyonlar aşağıdaki durumlarda majör kabul edilmiştir: (1) hemoraji önemli bir klinik olaya yol açtığında ya da (2) hemoglobinde ≥ 2 g/dL düşüşle birlikte gerçekleştiğinde veya ≥ 2 ünite kan ürünü transfüzyonu gerektirdiğinde. Retroperitoneal ve intrakraniyal hemorajiler her durumda majör kabul edilmiştir.
Diğer antikoagülanlarda olduğu gibi, hemoraji aşağıdaki gibi ilişkili risk faktörlerinin varlığında ortaya çıkabilir: Kanamaya yatkın organik lezyonlar, invazif işlemler ya da hemostazı etkileyen ilaçların eş zamanlı kullanımı (Bkz. Bölüm 4.4 ve 4.5).
Sistem organ sınıfı | Cerrahi hastalarında profilaksi | Medikal hastalarda profilaksi | DVT (PE varlığında ve yokluğunda) | Kararsız angina ve Q- dalgasız MI olan hastalarda tedavi | Akut STEMI olan hastalarda tedavi |
Kan ve lenf sistemi hastalıklar ı | Çok yaygın: Hemoraji*
Seyrek: Retroperitonea l hemoraji | Yaygın: Hemoraji * | Çok yaygın: Hemoraji*
Yaygın olmayan: İntrakraniyal hemoraji, Retroperitonea l hemoraji | Yaygın: Hemoraji*
Seyrek: Retroperitonea l hemoraji | Yaygın: Hemoraji*
Yaygın olmayan: İntrakraniyal hemoraji, Retroperitonea l hemoraji |
*: örn. hematom, enjeksiyon bölgesi dışındaki ekimoz, yarada hematom, hematüri, epistaksis ve gastrointestinal kanama.
Trombositopeni ve trombositoz
Sistem organ sınıfı | Cerrahi hastalarında profilaksi | Medikal hastalarda profilaksi | DVT (PE varlığında ve yokluğunda) | Kararsız angina ve Q- dalgasız MI olan hastalarda tedavi | Akut STEMI olan hastalarda tedavi |
Kan ve lenf sistemi hastalıklar | Çok yaygın: Trombositoz*
Yaygın: Trombositope ni | Yaygın olmayan: Trombosit openi | Çok yaygın: Trombositoz *
Yaygın: Trombositop eni | Yaygın olmayan: Trombositop eni | Yaygın: Trombositoz* Trombositopeni
Çok seyrek: İmmuno-alerjik trombositopeni |
*: Trombosit artışı > 400 g/L
Pediyatrik popülasyon
Çocuklarda enoksaparin sodyumun etkililik ve güvenliliği belirlenmemiştir (Bkz. Bölüm 4.2).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)' ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0312 218 35 99)
4.9. Doz aşımı ve tedavisi
Belirti ve semptomlar:
İntravenöz, ekstrakorporeal veya subkütan enoksaparin sodyumun kazara doz aşımı hemorajik komplikasyonlara yol açabilir. Büyük dozlarda olsa dahi oral uygulamayı takiben enoksaparin sodyumun absorbe olması mümkün değildir.
Antidotu ve tedavisi:
Antikoagülan etkiler protaminin yavaş intravenöz enjeksiyonu ile büyük ölçüde nötralize edilebilmektedir. Protamin dozu enjekte edilen enoksaparin sodyum dozuna bağlı olup, enoksaparin sodyum son 8 saat içinde uygulanmış ise 1 mg protamin 100 IU (1 mg) enoksaparin sodyumun antikoagülan etkisini nötralize etmektedir. Enoksaparin sodyum uygulanmasının üstünden 8 saatten daha uzun zaman geçmiş ise veya ikinci bir protamin dozunun gerekli olduğu belirlenmiş ise, 100 IU (1 mg) enoksaparin sodyum başına 0.5 mg protamin infüzyonu uygulanabilir. Enoksaparin sodyum enjeksiyonundan 12 saat sonra, protamin uygulanmasına gerek duyulmayabilir. Bununla birlikte, yüksek protamin dozlarıyla dahi, enoksaparin sodyumun anti-Xa aktivitesi hiçbir zaman tam olarak nötralize edilmez (maksimum yaklaşık
%60) (Bkz. protamin tuzlarının reçete bilgileri).
İğne kapağını dikkatlice VENAPERTA enjektöründen çıkarınız. Kapağı atabilirsiniz. İğne dolu ve kullanıma hazırdır.
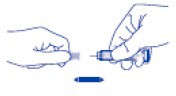
Hava kabarcıklarını uzaklaştırmak amacıyla kendinize enjeksiyon yapmadan önce enjektör pistonuna BASTIRMAYINIZ. Bu ilacın miktarının azalmasına neden olabilir. Kapağı
çıkardıktan sonra, iğnenin temiz kalmasını (steril) sağlamak için iğneyi herhangi bir yere temas ettirmeyiniz.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
İLAÇ GENEL BİLGİLERİ
Polifarma İlaç San.ve Tic. A.Ş.
| Satış Fiyatı | 236.45 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 210.19 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699606954767 |
| Etkin Madde | Enoksaparin Sodyum |
| ATC Kodu | B01AB05 |
| Birim Miktar | 60+0,6 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 2 |
| Kan ve Kan Yapıcı Organlar > Antitrombotik İlaçlar > Enoksaparin Sodyum |
| Yerli ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |