VENCLXTO 100 mg 14 film kaplı tablet Kısa Ürün Bilgisi
{ Venetoklaks }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
VENCLYXTO 100 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her bir film kaplı tablet 100 mg venetoklaks içerir.
Yardımcı maddeler
Yardımcı maddeler için Bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet
VENCLYXTO 100 mg film kaplı tablet açık sarı renkli, oblong bikonveks şeklinde olup, 17,2 mm uzunluğunda 9,5 mm genişliğindeki tabletlerin bir yüzünde V, diğer yüzünde ise 100 basılı bulunmaktadır.
gün – 50 mg
gün 50 mg
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
VENCLYXTO ve obinutuzumab kombinasyonu, daha önce tedavi edilmemiş, yetişkin kronik lenfositik lösemi (KLL) hastalarının tedavisinde endikedir (bkz. Bölüm 5.1).
VENCLYXTO ve rituksimab kombinasyonu, daha önce en az bir sıra tedavi almış yetişkin KLL/SLL hastalarının tedavisinde endikedir.
VENCLYXTO monoterapisi;
B-hücre reseptörü yolağı inhibitörü kullanmaya uygun olmayan veya B-hücre reseptörü yolağı inhibitörüne yanıt vermeyen 17p delesyonu ya da TP53 mutasyonu olan erişkin KLL/SLL hastalarının tedavisinde;
4.2. Pozoloji ve uygulama şekli
VENCLYXTO ile tedavi, kansere karşı tıbbi ürünlerin kullanımında uzman bir hekim tarafından başlatılmalı ve kontrol edilmelidir. Venetoklaks ile tedavi edilen hastalarda tümör lizis sendromu (TLS) gelişebilir. TLS riskini önlemek ve azaltmak için risk değerlendirmesi, profilaktik önlemler, doz
titrasyon çizelgesi, laboratuvar izleme ve ilaç etkileşimleri dahil olmak üzere bu bölümde açıklanan
bilgiler izlenmelidir.
Pozoloji/uygulama sıklığı ve süresi:
Kronik lenfositik lösemi (KLL) Doz-titrasyon takvimi
Başlangıç dozu 7 gün boyunca günde bir defa 20 mg venetoklakstır. Doz Tablo 1'de gösterildiği gibi günlük 400 mg'a ulaşana kadar 5 haftalık bir periyotta kademeli olarak artırılmalıdır.
Tablo 1: KLL hastalarında doz artış programı
Hafta | VENCLYXTO günlük dozu |
1 | 20 mg |
2 | 50 mg |
3 | 100 mg |
4 | 200 mg |
5 | 400 mg |
5 haftalık doz titrasyon takvimi aşamalı olarak tümör yükünün azaltılması ve tümör lizis sendromu (TLS) riskini düşürmek için tasarlanmıştır.
Venetoklaks ve obinutuzumab kombinasyonu
Venetoklaks her biri 28 günden oluşan toplam 12 kür olarak obinutuzumab ile kombine 6 kür, ardından tek bir ajan olarak 6 kür venetoklaks şeklinde verilir.
Obinutuzumab 1. kürün 1. gününde 100 mg olarak uygulanır, ardından 1. gün veya 2. gün 900 mg
uygulanır. Toplam 6 kür olmak üzere, 1. kürün 8. ve 15. günlerinde ve sonraki her 28 günlük kürün 1. gününde 1000 mg uygulanır.
1. Kürün 22. gününde 5 haftalık venetoklaks doz titrasyon takvimi (bkz. Tablo 1) başlatılmalıdır ve 2.
kürün 28. gününe kadar devam edilmelidir.
Doz titrasyon takvimi tamamlandıktan sonra önerilen venetoklaks dozu, obinutuzumabın 3. kürünün
1. gününden 12. kürün son gününe kadar günde bir kez 400 mg'dır. Venetoklaks'ın rituksimab ile kombine kullanımında titrasyon sonrası doz
Rituksimab ile kombine kullanımda venetoklaksın önerilen dozu günde bir kez 400 mg'dir (kombinasyon tedavisinin ayrıntıları için Bölüm 5.1'e bakınız).
Rituksimab, hasta venetoklaks doz-titrasyon takvimini tamamladıktan ve 7 gün boyunca önerilen günlük 400 mg venetoklaks dozunu aldıktan sonra uygulanır.
Venetoklaks, rituksimabın 1. kürünün 1. gününden itibaren 24 ay boyunca alınır (bkz. Bölüm 5.1).
Venetoklaks monoterapisinin titrasyon sonrası dozu
VENCLYXTO'nun önerilen dozu günde bir kez 400 mg'dir. Tedavi, hastalık progresyonuna kadar ya da hastanın tedaviyi daha fazla tolere edemediği zamana kadar devam ettirilir.
Akut miyeloid lösemi (AML)
Venetoklaks dozu kombinasyon ajanına bağlıdır.
Önerilen venetoklaks doz programı (doz titrasyonu dahil) Tablo 2'de gösterilmektedir.
Tablo 2: AML hastalarında doz artış programı
Gün | Venetoklaks günlük dozu | |
1. gün | 100 mg | |
2. gün | 200 mg | |
3. gün | 400 mg | |
4. gün ve sonrası | 400 mg hipometile edici bir ajanla kombine olarak verilirken | 600 mg düşük doz sitarabin ile kombine olarak verilirken |
1. siklusun 1. gününde bir hipometile edici ajan veya düşük doz sitarabin başlatılmalıdır.
Azasitidin, 1. siklusun 1. gününden başlayarak her 28 günlük siklusun 1-7 günleri arasında intravenöz
veya subkütan yoldan 75 mg/m dozunda uygulanmalıdır.
Desitabin, 1. siklusun 1. gününden başlayarak her 28 günlük siklusun 1-5 günleri arasında intravenöz
yoldan 20 mg/m dozunda uygulanmalıdır.
Sitarabin 1. siklusun 1. gününden başlayarak her 28 günlük siklusun 1-10 günleri arasında subkütan
yoldan 20 mg/m dozunda uygulanmalıdır.
Hematolojik toksisitelerin yönetilmesi ve kan sayımını iyileştirmek gerektiğinde, venetoklaks dozuna
ara verilebilir (bkz. Tablo 6).
Ek bilgi için azasitidin, desitabin veya düşük doz sitarabin reçete bilgisine bakınız.
Hastalık progresyonu veya kabul edilemez toksisite gözlenene kadar hipometile edici bir ajan veya düşük doz sitarabin ile kombine venetoklaksa devam edilmelidir.
Tümör lizis sendromunun (TLS) önlenmesi
Venetoklaks ile tedavi edilen hastalarda TLS gelişebilir. Hastalık endikasyonuna göre yönetimle ilgili spesifik ayrıntılar için aşağıdaki uygun bölüme bakılmalıdır.
Kronik lenfositik lösemi
VENCLYXTO tümörde hızlı bir küçülmeye neden olabilir ve böylece, tümör yükü ve diğer hasta özelliklerinden bağımsız olarak, tüm KLL hastalarında başlangıçtaki 5 haftalık doz-titrasyon fazında TLS için bir risk oluşabilir. Hızlı bir şekilde yönetim gerektiren TLS ile uyumlu elektrolitlerdeki değişiklikler VENCLYXTO'nun ilk dozunun uygulanmasından sonra en erken 6 ila 8 saat içerisinde
ve her doz artışından sonra ortaya çıkabilir. Hastaya özgü faktörleri TLS riski düzeyi açısından değerlendiriniz ve TLS riskini azaltmak için ilk venetoklaks dozundan önce hastalara hidrasyon ve hiperürisemiye yönelik profilaksi sağlayınız.
TLS riski komorbidite özellikle böbrek fonksiyonlarının azalması (kreatinin klirensi [CrCl] <80 mL/dk) ve tümör yükü dahil olmak üzere birden çok faktöre bağlı bir süreçtir. Splenomegali, genel TLS riskine katkıda bulunabilir. Risk VENCLYXTO tedavisi ile tümör yükü küçüleceği için azalabilir (bkz. Bölüm 4.4).
VENCLYXTO başlatılmadan önce tüm hastalar için radyografik değerlendirme dahil (örn. BT taraması) tümör yükü değerlendirmesi yapılmalıdır. Kan kimyası (potasyum, ürik asit, fosfor, kalsiyum ve kreatinin) değerlendirilmeli ve önceden var olan anormallikler düzeltilmelidir.
Tablo 3'te, klinik araştırma verilerinden elde edilen tümör yükü tayini baz alınarak venetoklaks tedavisi sırasında önerilen TLS profilaksisi ve izlemi açıklanmaktadır (bkz. Bölüm 4.4). Ayrıca ayakta tedavi gören veya hastaneye yatışı gerçekleştirilen tüm hastalarda riske göre profilaksi ve izlem için tüm komorbiditeler dikkate alınmalıdır.
Tablo 3: KLL hastalarında tümör yüküne göre önerilen TLS profilaksisi
Tümör yükü | Profilaksi | Kan kimyası izleme | ||
|
Hidrasyon | Anti- hiperürisemikler | Değerlendirme ortamı ve sıklığı | |
Düşük | Tüm LN <5 cm VE ALC <25 x10/L | Oral (1,5-2 L) | Allopurinol | Ayakta tedavi |
Orta | Herhangi LN 5 cm ila <10 cm VEYA ALC ≥25 x10/L | Oral (1,5-2 L) ve ek intravenöz düşünülebilir | Allopurinol | Ayakta tedavi |
|
|
|
| |
|
|
|
| ilk doz için: CrCl <80 mL/dk olan hastaların hastaneye yatışı düşünülmelidir; hastanede izleme için aşağıya bakınız |
20 mg'lık ve 50 mg'lık ilk doz için: Doz öncesi, 6 ila 8 saat, 24 saat
gün – 70 mg
gün 100 mg
4.3. Kontrendikasyonlar
Etkin madde
durumunda kontrendikedir.
KLL hastalarında, başlangıçta ve doz-titrasyon fazı süresince güçlü CYP3A inhibitörleri ile eş zamanlı kullanımı kontrendikedir (bkz. Bölüm 4.2 ve 4.5).
Tüm hastalarda, St. John's wort (sarı kantaron) içeren preparatlar ile eş zamanlı kullanımı
kontrendikedir (bkz. Bölüm 4.4 ve 4.5).
4.4. Özel kullanım uyarıları ve önlemleri
Tümör lizis sendromu
VENCLYXTO ile tedavi edilen hastalarda fatal olaylar ve diyaliz gerektiren böbrek yetmezliği de dahil olmak üzere tümör lizis sendromu görülmüştür (bkz. Bölüm 4.8).
VENCLYXTO tümörde hızlı küçülmeye ve böylece başlangıç ve doz titrasyonu süresince TLS için bir riskin ortaya çıkmasına neden olabilir. Hızlı bir şekilde yönetilmesi gereken TLS ile uyumlu elektrolit değişiklikleri VENCLYXTO'nun ilk dozunun uygulanmasından sonra ve her doz artışından sonra en erken 6 ila 8 saat içerisinde ortaya çıkabilir. Pazarlama sonrası izlemlerde, 20 mg'lık tek bir venetoklaks dozundan sonra fatal olaylar dahil TLS bildirilmiştir. TLS riskini önlemek ve azaltmak için risk değerlendirmesi, profilaktik önlemler, doz titrasyonu ve modifikasyon programı, laboratuvar izlemi ve ilaç etkileşimleri dahil olmak üzere Bölüm 4.2'de açıklanan bilgiler izlenmelidir.
KLL'de TLS riski komorbidite (özellikle böbrek fonksiyonlarının azalması), tümör yükü ve splenomegali dahil olmak üzere birden çok faktöre bağlı bir süreçtir.
Tüm hastalar risk açısından değerlendirilmeli ve hidrasyon ve anti-hiperürisemikler dahil olmak üzere TLS için uygun profilaksi almalıdır. Kan kimyaları izlenmeli ve anormallikler hemen iyileştirilmelidir. Genel risk arttıkça daha yoğun önlemler (intravenöz hidrasyon, sık izlem, hastaneye yatış) alınmalıdır. Gerektiği takdirde dozlama durdurulmalıdır; venetoklaks yeniden başlatılırken doz modifikasyon kılavuzu takip edilmelidir (bkz. Tablo 4 ve Tablo 5). “Tümör lizis sendromunun (TLS) önlenmesi†için talimatlar izlenmelidir (bkz. Bölüm 4.2).
VENCLYXTO'nun güçlü veya orta etkili CYP3A inhibitörleri ile eş zamanlı kullanımı venetoklaks maruziyetini artırabilir ve başlangıçta ve doz-titrasyon fazında TLS riskini artırabilir (bkz. Bölüm 4.2 ve 4.3). P-gp veya BCRP inhibitörleri de venetoklaks maruziyetini artırabilir (bkz. Bölüm 4.5).
Nötropeni ve enfeksiyonlar
KLL hastalarında rituksimab veya obinutuzumab ile kombinasyon çalışmasında ve monoterapi çalışmalarında, venetoklaks ile tedavi edilen hastalarda derece 3 veya 4 nötropeni bildirilmiştir (bkz. Bölüm 4.8).
AML hastalarında, derece 3 veya 4 nötropeni tedaviye başlamadan önce yaygındır. Nötrofil sayımları hipometile edici ajan veya düşük doz sitarabin ile kombine venetoklaks ile kötüye gidebilir. Devam eden tedavi sikluslarında nötropeni tekrar ortaya çıkabilir.
Tedavi periyodu süresince tam kan sayımı izlenmelidir. Şiddetli nötropeni görülen hastalarda doz azaltımı ya da dozun kesilmesi önerilmektedir (bkz. Bölüm 4.2).
Fatal sonuçlanan sepsis dahil olmak üzere ciddi enfeksiyonlar bildirilmiştir (bkz. Bölüm 4.8). Herhangi bir enfeksiyon belirtisinin ve semptomunun izlenmesi gerekmektedir. Şüpheli enfeksiyonlara, antimikrobiyaller ve uygun şekilde doz kesintileri ya da azaltımı ve büyüme faktörlerinin kullanımı (örn. G-CSF) dahil olmak üzere hızla tedavi uygulanması gerekmektedir (bkz. Bölüm 4.2).
İmmünizasyon
VENCLYXTO ile tedavi süresince veya sonrasında canlı atenüe aşılarla immünizasyonun etkililiği ve güvenliliği çalışılmamıştır. Canlı aşılar VENCLYXTO ile tedavi süresince ve B-hücresinde iyileşme sağlanana kadar uygulanmamalıdır.
CYP3A indükleyicileri
CYP3A4 indükleyicileri ile eş zamanlı kullanımı VENCLYXTO maruziyetinin azalmasına ve buna bağlı olarak etkisizliğe neden olabilir. Venetoklaks ile eş zamanlı olarak güçlü ya da orta derecede CYP3A4 indükleyicilerin kullanımından kaçınılmalıdır (bkz. Bölüm 4.3 ve 4.5).
Çocuk doğurma potansiyeli bulunan kadınlar
Çocuk doğurma potansiyeli bulunan kadınlar, VENCLYXTO ile tedavi süresince oldukça etkili bir kontrasepsiyon yöntemi kullanmalıdır (bkz. Bölüm 4.6).
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Venetoklaks ağırlıklı olarak CYP3A tarafından metabolize edilir. Venetoklaks plazma konsantrasyonlarını artırabilen ajanlarCYP3A inhibitörleri
11 hastada 7 gün süre ile günde bir kez güçlü bir CYP3A, P-gp ve BCRP inhibitörü olan ketokonazolün 400 mg'lık dozu ile birlikte uygulanması venetoklaks maksimum konsantrasyonu (C) ve eğri altında kalan alan (EAA) değerlerini sırasıyla 2,3 ve 6,4 kat yükseltmiştir. 6 sağlıklı hastada 14 gün süre ile günde bir kez güçlü bir CYP3A ve P-gp inhibitörü olan ritonovirin 50 mg'lık dozu ile birlikte uygulama venetoklaks Cve EAA değerlerini sırasıyla 2,4 ve 7,9 kat yükseltmiştir. Tek başına 400 mg uygulanan venetoklaks ile karşılaştırıldığında güçlü bir CYP3A ve P-gp inhibitörü olan posakonazolün 300 mg'lık dozunun, 50 mg ve 100 mg venetoklaks ile 7 gün boyunca 12 hastada birlikte kullanımı venetoklaks C'ını sırasıyla 1,6 kat ve 1,9 kat ve EAA değerlerini sırasıyla 1,9 kat ve 2,4 kat artırmıştır. Venetoklaks ile diğer güçlü CYP3A4 inhibitörlerinin eş zamanlı kullanımının venetoklaks EAA değerini ortalama 5,8 ila 7,8 kat artırdığı tahmin edilmektedir.
VENCLYXTO'nun güçlü CYP3A inhibitörleri (örn., itrakonazol, ketokonazol, posakonazol, vorikonazol, klaritromisin, ritonavir) ya da orta etkili CYP3A inhibitörleri (örn., siprofloksasin, diltiazem, eritromisin, flukonazol, verapamil) ile eşzamanlı kullanımı gereken hastalar için venetoklaks dozlaması Tablo 7'ye göre uygulanmalıdır. Hastalar toksisite belirtileri açısından daha yakından izlenmelidir ve ek doz ayarlanması gerekebilir. CYP3A inhibitörüne başlamadan önce kullanılan venetoklaks dozu, inhibitörün kesilmesinden 2-3 gün sonra yeniden başlatılabilir (bkz. Bölüm 4.2).
VENCLYXTO ile tedavi sırasında CYP3A inhibitörleri içeren greyfurt ürünleri, turunçgiller (Sevilya portakalı) ve yıldız meyvesi (karambola) kullanımından kaçınılmalıdır.
P-gp ve BCRP inhibitörleri
Venetoklaks P-gp ve BCRP için bir substrattır. Venetoklaks ile günde tek doz 600 mg rifampisinin (bir P-gp inhibitörü) eş zamanlı uygulanması, 11 sağlıklı hastada venetoklaks Cve EAA değerlerini sırasıyla %106 ve %78 yükseltmiştir. Venetoklaksın başlangıçta ve doz titrasyonu fazı sürecince P-gp ve BCRP inhibitörleri ile eş zamanlı kullanımından kaçınılmalıdır, eğer bir P-gp veya BCRP inhibitörü kullanılmalıysa, hastalar toksisite belirtileri açısından yakından izlenmelidir (bkz. Bölüm 4.4).
CYP3A indükleyicileri
Venetoklaks ile günde bir kez 600 mg rifampisinin (güçlü bir CYP3A indükleyicisi) 13 gün süreyle eş zamanlı uygulanmasının ardından, 10 sağlıklı hastada venetoklaks Cve EAA değerleri sırasıyla %42 ve %71 düşmüştür. VENCLYXTO'nun güçlü CYP3A indükleyicileri (örn. karbamazepin, fenitoin, rifampisin) veya orta etkili CYP3A indükleyicileri (örn. bosentan, efavirenz, etravirin, modafinil, nafsilin) ile eşzamanlı kullanımından kaçınılmalıdır. Daha düşük CYP3A indüksiyonu ile alternatif tedaviler düşünülmelidir. St. John's wort içeren preparatlar etkililiği azaltabileceğinden VENCLYXTO ile tedavi sırasında kontrendikedir (bkz. Bölüm 4.3).
Azitromisin
12 sağlıklı gönüllü ile gerçekleştirilen bir ilaç-ilaç etkileşim çalışmasında, ilk gün eş zamanlı olarak uygulanan 500 mg azitromisinin ardından 4 gün süreyle eş zamanlı olarak verilen 250 mg azitromisin, venetoklaksın Cdeğerini %25 ve EAA'yi ise %35 oranında azaltmıştır. Venetoklaks, kısa bir süre için azitromisin ile birlikte uygulandığında herhangi bir doz ayarlaması gerekmemektedir.
Gastrik asit azaltıcı ajanlar
Popülasyon farmakokinetiği analizlerine dayanarak, gastrik asit azaltıcı ajanlar (örn. proton pompası inhibitörleri, H2-reseptör antagonistleri, antiasitler) venetoklaks biyoyararlanımını etkilememektedir.
Safra asidi sekestranları
Venetoklaksın safra asidi sekestranları ile birlikte kullanılması, venetoklaks emilimini azaltabileceğinden tavsiye edilmemektedir. VENCLYXTO ile safra asidi sekestranı birlikte kullanılacaksa, etkileşim riskini azaltmak için safra asidi sekestranının Kısa Ürün Bilgileri takip edilmelidir ve venetoklaks sekestrandan en az 4-6 saat sonra uygulanmalıdır.
Plazma konsantrasyonları VENCLYXTO ile değişebilen ajanlar
Varfarin
5 mg varfarin ve 400 mg venetoklaks tek doz ilaç-ilaç etkileşim çalışması üç sağlıklı gönüllüde R- varfarin ve S-varfarinin Cve EAA değerlerinde %18 ve %28 yükselme ile sonuçlanmıştır. Kararlı durumdaki venetoklaks dozu verilmediğinden, uluslararası normalize edilmiş oranın (INR) varfarin alan hastalarda yakından izlenmesi tavsiye edilmektedir.
P-gp, BCRP ve OATP1B1 substratları
Venetoklaks in vitro bir P-gp, BCRP ve OATP1B1 inhibitörüdür. Bir ilaç-ilaç etkileşim çalışmasında, tek doz 100 mg venetoklaksın bir P-gp substratı olan 0,5 mg digoksin ile birlikte uygulanması, digoksin Cdeğerinde %35 ve EAA değerlerinde %9 oranında artışa neden olmuştur. Dar terapötik aralıklı P- gp veya BCRP substratları (ör. digoksin, dabigatran, everolimus, sirolimus) ile VENCLYXTO'nun birlikte kullanımından kaçınılmalıdır.
Eğer dar terapötik aralıklı P-gp veya BCRP substratı kullanılması gerekiyorsa, dikkatli bir şekilde kullanılmalıdır. Oral yolla kullanılan, gastrointestinal sistemde inhibisyona duyarlı bir P-gb veya BCRP substratının (örn. dabigatran eteksilat) uygulanması, potansiyel bir etkileşimi en aza indirgemek için mümkün olduğunca venetoklaks uygulamasından ayrılmalıdır.
Eğer bir statin (OATP substratı) venetoklaks ile birlikte kullanılacaksa, statin-ilişkili toksisite açısından yakından takibi önerilmektedir.
Özel popülasyonlara ilişkin ek bilgiler
Herhangi bir etkileşim çalışması yapılmamıştır.
Pediyatrik popülasyon:
Herhangi bir etkileşim çalışması yapılmamıştır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Kadınlar VENCLYXTO alırken ve tedaviden sonra en az 30 gün gebe kalmaktan kaçınmalıdır. Bu nedenle çocuk doğurma potansiyeli bulunan kadınlar VENCLYXTO ile tedavi süresince ve tedavi tamamlandıktan sonra 30 gün süreyle yüksek derecede etkili bir kontrasepsiyon yöntemi kullanmalıdır. Günümüzde venetoklaksın hormonal kontraseptiflerin etkililiğini düşürüp düşürmediği bilinmemektedir. Bu nedenle, hormonal kontraseptif yöntemi kullanan kadınlar ayrıca bir bariyer yöntemi kullanmalıdır.
Gebelik dönemi
Hayvanlarda yürütülen embriyo-fetal toksisite çalışmalarına göre, VENCLYXTO gebelere uygulandığında fetüse zarar verebilir (bkz. Bölüm 5.3).
VENCLYXTO'nun gebe kadınlarda kullanımına ilişkin yeterli ve iyi kontrol edilmiş veri mevcut değildir. Hayvanlar üzerinde yapılan araştırmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir. Gebelik süresince ve çocuk doğurma potansiyeli bulunup yüksek etkili doğum kontrol yöntemi kullanmayan kadınlarda VENCLYXTO kullanılmaması önerilmektedir.
Laktasyon dönemi
Venetoklaksın veya metabolitlerinin insan sütüne geçip geçmediği bilinmemektedir. Emzirilen çocuk açısından bir risk olduğu göz ardı edilemez.
VENCLYXTO ile tedavi sırasında emzirme durdurulmalıdır.
Üreme yeteneği/Fertilite
Venetoklaksın fertilite üzerindeki etkilerine ait insan verileri mevcut değildir. Klinik olarak ilgili maruziyetlerde köpeklerdeki testis toksisitesine dayanarak, VENCLYXTO ile tedavide erkek fertilitesi risk altında olabilir (bkz. Bölüm 5.3). Tedaviye başlamadan önce, bazı erkek hastaların sperm depolama konusunda danışmanlık alması düşünülebilir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
VENCLYXTO'nun araç ve makine kullanımı üzerinde etkisi yoktur veya ihmal edilebilir düzeydedir. VENCLYXTO alan bazı hastalarda yorgunluk ve baş dönmesi raporlanmıştır ve hastanın araç ve makine kullanma becerisi değerlendirilirken dikkate alınmalıdır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özeti
Kronik lenfositik lösemi
VENCLYXTO'nun genel güvenlilik profili klinik çalışmalarda obinutuzumab veya rituksimab ile kombine veya monoterapi halinde venetoklaks tedavi edilen 758 KLL hastasından elde edilen verilere dayanmaktadır. İki adet faz 3 (CLL14 ve MURANO), iki adet faz 2 (M13-982 ve M14-032) ve bir adet faz 1 (M12-175) çalışmada yer alan hastalar güvenlilik analizine dahil edilmiştir. CLL14, daha önce tedavi edilmemiş ve komorbiditeleri olan 212 KLL hastasının obinutuzumab ile kombinasyon halinde venetoklaks aldığı randomize, kontrollü bir çalışmadır. MURANO, daha önce KLL tedavisi alan 194 hastanın dahil edildiği ve venetoklaksın rituksimab ile kombine kullanıldığı randomize, kontrollü bir klinik çalışmadır. Faz 2 ve faz 1 çalışmalarında, önceden tedavi almış 352 KLL hastası venetoklaks monoterapisi ile tedavi edilmiş olup, bu hastaların 212'si 17p delesyonuna sahiptir ve 146 hasta ise B-hücreli reseptör yolağı inhibitörü ile tedavi altında başarısız olmuştur. (bkz. Bölüm 5.1)
Obinutuzumab veya rituksimab ile kombinasyon çalışmalarında VENCLYXTO alan hastalarda meydana gelen en yaygın advers reaksiyonlar (≥%20) herhangi bir derecede nötropeni, diyare ve üst solunum yolu enfeksiyonu idi. Monoterapi çalışmalarında, en yaygın advers reaksiyonlar ise nötropeni/nötrofil sayısında düşme, diyare, bulantı, anemi, yorgunluk ve üst solunum yolu enfeksiyonu idi.
Obinutuzumab veya rituksimab ile kombine venetoklaks alan hastalarda en yaygın bildirilen ciddi advers reaksiyonlar (≥ %2) pnömoni, sepsis, febril nötropeni ve TLS idi. Monoterapi çalışmalarında en yaygın bildirilen ciddi advers reaksiyonlar (≥ %2) pnömoni ve febril nötropeni idi.
Akut miyeloid lösemi
VENCLYXTO'nun genel güvenlilik profili, klinik çalışmalarda bir hipometile edici ajan (azasitidin veya desitabin) (VIALE-A Faz 3 randomize ve M14-358 Faz 1 randomize olmayan çalışmalar) veya düşük doz sitarabin (VIALE-C Faz 3 randomize çalışma) ile kombine venetoklaks kullanılarak yapılan klinik çalışmalarda tedavi edilen yeni tanı almış 456 akut miyeloid lösemi (AML) hastasından elde edilen verilere dayanmaktadır.
VIALE-A çalışmasında, azasitidin ile kombine venetoklaks alan hastalarda herhangi bir derecede en yaygın görülen advers reaksiyonlar (≥%20), trombositopeni, nötropeni, febril nötropeni, bulantı, diyare, kusma, anemi, halsizlik, pnömoni, hipokalemi ve iştah azalmasıdır.
Azasitidin ile kombine venetoklaks alan hastalarda en yaygın görülen ciddi advers reaksiyonlar (≥%5),
febril nötropeni, pnömoni, sepsis ve hemorajidir.
VIALE-C çalışmasında, düşük doz sitarabin ile kombinasyon halinde venetoklaks alan hastalarda herhangi bir derecedeki en yaygın advers reaksiyonlar (≥%20), nötropeni, trombositopeni, bulantı, febril nötropeni, anemi, kusma, diyare, hipokalemi, iştah azalması ve pnömonidir. En sık bildirilen ciddi advers reaksiyonlar (≥%5) febril nötropeni, pnömoni ve sepsistir.
M14-358 çalışmasında, desitabin ile kombine venetoklaks alan hastalarda herhangi bir derecede en yaygın görülen advers reaksiyonlar (≥ %20) trombositopeni, febril nötropeni, bulantı, hemoraji, pnömoni, diyare, halsizlik, baş dönmesi/senkop, kusma, nötropeni, hipotansiyon, hipokalemi, iştah
azalması, baş ağrısı, abdominal ağrı ve anemidir. En sık bildirilen ciddi advers reaksiyonlar (≥%5) febril
nötropeni, pnömoni, bakteremi ve sepsistir.
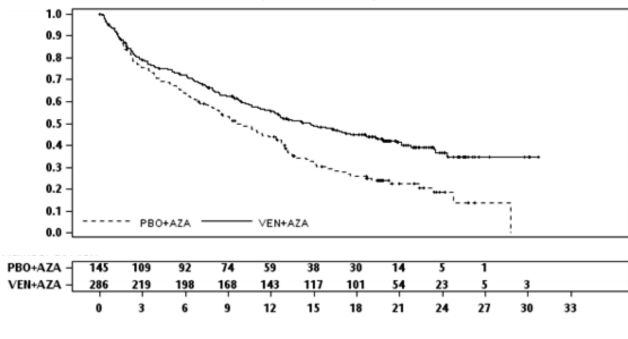
VIALE-A çalışmasındaki 30 günlük mortalite oranı, azasitidin ile kombine venetoklaks için %7,4
(21/283), azasitidin ile plasebo kolunda %6,3'tür (9/144).
VIALE-C çalışmasındaki 30 günlük mortalite oranı düşük doz sitarabin ile kombine venetoklaks için %12,7 (18/142), düşük doz sitarabin ile plasebo kolunda %16,2'dir (11/68).
M14-358 çalışmasındaki 30 günlük mortalite oranı desitabin ile kombine venetoklaks için %6,5'tir
(2/31).
Advers reaksiyonlar tablolaştırılmış listesi
Aşağıda listelenen advers reaksiyonlar MedDRA sistem organ sınıfı ve sıklığına göre belirtilmiştir. Sıklıklar çok yaygın (≥1/10), yaygın (≥1/100 ila <1/10), yaygın olmayan (≥1/1.000 ila <1/100), seyrek (≥1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki mevcut verilerden hareketle tahmin edilemiyor) olarak tanımlanmıştır. İstenmeyen etkiler, her bir sıklık grubunda, ciddiyetindeki azalma ile gösterilmiştir.
Kronik lenfositik lösemi
VENCLYXTO ile obinutuzumab, rituksimab ile kombinasyon halinde ya da monoterapi olarak KLL
hastalarında bildirilen advers ilaç reaksiyonlarının sıklıkları Tablo 8'de özetlenmiştir.
Tablo 8: VENCLYXTO ile tedavi edilen KLL hastalarında bildirilen advers ilaç reaksiyonları
Sistem Organ Sınıfı |
Sıklık |
Tüm dereceler | Derece ≥ 3 |
Enfeksiyonlar ve enfestasyonlar |
Çok yaygın | Pnömoni Üst solunum yolu enfeksiyonu |
|
Yaygın |
Sepsis Üriner sistem enfeksiyonu | Sepsis Pnömoni Üriner sistem enfeksiyonu Üst solunum yolu enfeksiyonu | |
Kan ve lenf sistemi hastalıkları |
Çok yaygın | Nötropeni Anemi Lenfopeni | Nötropeni Anemi |
Yaygın | Febril nötropeni | Febril nötropeni Lenfopeni | |
Metabolizma ve beslenme hastalıkları |
Çok yaygın | Hiperkalemi Hiperfosfatemi Hipokalsemi |
|
|
Yaygın |
Tümör lizis sendromu Hiperürisemi |
Tümör lizis sendromu Hiperkalemi Hiperfosfatemi Hipokalsemi Hiperürisemi |
Gastrointestinal hastalıklar |
Çok yaygın | Diyare Kusma Bulantı Konstipasyon |
|
Yaygın |
| Diyare Kusma Bulantı | |
Yaygın olmayan |
| Konstipasyon | |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar |
Çok yaygın |
Yorgunluk |
|
Yaygın |
| Yorgunluk | |
Araştırmalar | Yaygın | Kan kreatininde yükselme |
|
Yaygın olmayan |
| Kan kreatininde yükselme | |
Akut miyeloid lösemi
Hipometile edici ajanlar veya düşük doz sitarabin ile kombinasyon halinde AML hastalarında VENCLYXTO ile bildirilen advers ilaç reaksiyonlarının sıklıkları Tablo 9'da özetlenmiştir.
Tablo 9: VENCLYXTO ile tedavi edilen AML hastalarında bildirilen advers ilaç reaksiyonları
Sistem Organ Sınıfı |
Sıklık |
Tüm dereceler |
Derece ≥ 3 |
Enfeksiyonlar ve enfestasyonlar |
Çok yaygın | Pnömoni Sepsis Üriner sistem enfeksiyonu | Pnömoni Sepsis |
Yaygın |
| Üriner sistem enfeksiyonu | |
Kan ve lenf sistemi hastalıkları |
Çok yaygın | Nötropeni Febril nötropeni Anemi Trombositpeni | Nötropeni Febril nötropeni Anemi Trombositpeni |
Metabolizma ve beslenme hastalıkları |
Çok yaygın | Hipokalemi İştah azalması |
Hipokalemi |
Sistem Organ Sınıfı |
Sıklık |
Tüm dereceler |
Derece ≥ 3 |
| Yaygın | Tümör lizis sendromu | İştah kaybı Tümör lizis sendromu |
Sinir sistemi hastalıkları | Çok yaygın | Baş dönmesi/senkop Baş ağrısı |
|
Yaygın |
| Baş dönmesi/senkop | |
Yaygın olmayan |
| Baş ağrısı | |
Vasküler hastalıklar |
Çok yaygın | Hipotansiyon Hemoraji |
Hemoraji |
Yaygın |
| Hipotansiyon | |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | Çok yaygın | Dispne |
|
Yaygın |
| Dispne | |
Gastrointestinal hastalıklar |
Çok yaygın | Bulantı Diyare Kusma Stomatit Abdominal ağrı |
|
Yaygın |
| Bulantı Diyare Kusma | |
Yaygın olmayan |
| Stomatit | |
Hepato-bilier hastalıklar | Yaygın | Kolesistit/kolelitiazis | Kolesistit/kolelitiazis |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları |
Çok yaygın |
Artralji |
|
Yaygın olmayan |
| Artralji | |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar |
Çok yaygın | Yorgunluk Asteni |
|
Yaygın |
| Yorgunluk Asteni | |
Araştırmalar |
Çok yaygın |
Kilo kaybı Kan bilirubininde yükselme |
|
Sistem Organ Sınıfı |
Sıklık |
Tüm dereceler |
Derece ≥ 3 |
|
Yaygın |
| Kilo kaybı Kan bilirubininde yükselme |
Advers reaksiyonlar sebebiyle dozun azaltılması veya dozun kesilmesi
Kronik lenfositik lösemi
Advers reaksiyonlara bağlı doz kesilmeleri, CLL14 ve MURANO çalışmalarında sırasıyla obinutuzumab veya rituksimab ile kombinasyon halinde venetoklaks ile tedavi edilen hastaların
%16'sında görülmüştür. Venetoklaks ile monoterapi çalışmalarında hastaların %11'i advers reaksiyonlar nedeniyle çalışmayı bırakmıştır.
CLL14 çalışmasında venetoklaks ve obinutuzumab kombinasyonu ile tedavi edilen hastaların
%21'inde, MURANO çalışmasında venetoklaks ve rituksimab kombinasyonu ile tedavi edilen hastaların %15'inde ve monoterapi çalışmalarında venetoklaks ile tedavi edilen hastaların %14'ünde advers reaksiyonlara bağlı doz azaltılması görülmüştür.
CLL14 çalışmasında venetoklaks ve obinutuzumab kombinasyonu ile tedavi edilen hastaların
%74'ünde ve MURANO çalışmasında venetoklaks ve rituksimab kombinasyonu ile tedavi edilen hastaların %71'inde advers reaksiyonlara bağlı olarak doza ara verilmiştir. Venetoklaks dozuna ara verilmesine yol açan en yaygın advers reaksiyon nötropeni idi (CLL14 ve MURANO çalışmalarında sırasıyla %41 ve %43). Venetoklaks ile yapılan monoterapi çalışmalarında, hastaların %40'ında advers reaksiyonlardan kaynaklanan doza ara verilmeler meydana gelmiştir, doz ara verilmelerine en çok yol açan advers reaksiyon nötropeni idi (%5).
Akut miyeloid lösemi
Hipometile edici bir ajanla kombine venetoklaks
VIALE-A çalışmasında, venetoklaks ve azasitidin kombinasyonuyla tedavi edilen hastaların %24'ünde advers reaksiyonlar nedeniyle venetoklaks bırakılmıştır. Hastaların %2'sinde advers reaksiyonlar nedeniyle venetoklaks dozu azaltılmıştır. Hastaların %72'sinde advers reaksiyonlar nedeniyle venetoklaks dozuna ara verilmiştir. Kemik iliğinde tam remisyona ulaşan hastalardan %53'ünde ANC
<500/mikrolitre olduğu için doza ara verilmiştir. Venetoklaks dozuna ara verilmesine neden olan en yaygın advers reaksiyonlar (>%10) febril nötropeni, nötropeni, pnömoni ve trombositopenidir.
M14-358 çalışmasında, venetoklaks ve desitabin kombinasyonuyla tedavi edilen hastaların %26'sında advers reaksiyonlar nedeniyle venetoklaks bırakılmıştır. Hastaların %6'sında advers reaksiyonlar nedeniyle venetoklaks dozu azaltılmıştır. Hastaların %65'inde advers reaksiyonlar nedeniyle venetoklaks dozuna ara verilmiştir. Venetoklaks dozuna ara verilmesine neden olan en yaygın advers reaksiyonlar (≥%5) febril nötropeni, nötropeni/nötrofil sayısında azalma, pnömoni, platelet sayısında azalma ve beyaz kan hücresi sayısında azalmadır.
Randomize çalışmada düşük doz sitarabin ile kombine venetoklaks (VIALE-C)
VIALE-C çalışmasında, venetoklaks ve düşük doz sitarabin kombinasyonuyla tedavi edilen hastaların
%26'sında advers reaksiyonlar nedeniyle venetoklaks bırakılmıştır. Hastaların %10'unda advers reaksiyonlar nedeniyle venetoklaks dozu azaltılmıştır. Hastaların %63'ünde advers reaksiyonlar nedeniyle venetoklaks dozuna ara verilmiştir. Lösemik kemik iliği remisyonu elde edilen hastaların
%37'sine ANC < 500/mikroL olduğu için doz kesintileri uygulanmıştır. Venetoklaks dozuna ara verilmesine neden olan en yaygın advers reaksiyonlar (>%5) nötropeni, trombositopeni, pnömoni, febril nötropeni ve anemidir.
Seçilen advers reaksiyonların tanımı
Tümör lizis sendromu
Tümör lizis sendromu venetoklaks başlatılırken önemli bir tanımlanmış risktir.
Kronik lenfositik lösemi
Titrasyon fazının daha kısa (2 ila 3 hafta) ve başlangıç dozunun daha yüksek olduğu ilk Faz 1 doz bulma çalışmalarında 2 fatal olay ve 1'i diyalize ihtiyaç duyan 3 akut renal yetmezlik olayı dahil olmak üzere TLS insidansı %13 (10/77; 5 laboratuvar TLS; 5 klinik TLS)'dür.
TLS riski, doz rejiminin yeniden gözden geçirilmesi, profilakside modifikasyon ve önlemlerin izlenmesi ile azaltılmıştır. Venetoklaksın klinik çalışmalarında, herhangi bir ölçülebilir lenf nodu ≥ 10 cm veya hem ALC≥ 25 x 10/L ve hem de herhangi bir ölçülebilen lenf nodu ≥ 5 cm olan hastalar, daha yoğun hidrasyon alabilmeleri ve titrasyon fazı süresince 20 mg ve 50 mg'lık ilk gün dozlamasının izlenebilmesi için hastaneye yatırılmıştır (bkz. Bölüm 4.2).
M13-982 ve M14-032 çalışmalarında günde bir defa 20 mg'lık başlangıç dozuna başlayanlar ve 5 hafta sonra artırılarak günlük 400 mg alan 168 KLL hastasında TLS oranı %2 idi. Tüm olaylar laboratuvar TLS (aşağıdaki kriterlerin her biri 24 saat içerisinde ≥2'sini karşılayan laboratuvar anormallikleri: potasyum > 6 mmol/L, ürik asit > 476 mikromol/L, kalsiyum <1,75 mmol/L, veya fosfor> 1,5 mmol/L; ya da TLS olayları olarak raporlanmıştır) ve lenf nodu ≥ 5 cm veya ALC≥ 25 x 109/L olan hastalarda görülmüştür. Bu hastalarda akut böbrek yetmezliği, kardiyak aritmiler veya ani ölüm ve/veya nöbetler gibi klinik sonuçlar ile TLS gözlemlenmemiştir. Tüm hastalarda CrCl ≥ 50 mL/dk idi.
Açık etiketli, randomize faz 3 çalışmasında (MURANO), venetoklaks + rituksimab ile tedavi edilen hastalarda TLS insidansı %3'tür (6/194). 77/389 hastanın çalışmaya dahil edilmesinin ardından, protokol, Pozoloji bölümünde verilen mevcut TLS profilaksisi ve izleme önlemleri dâhil edilecek şekilde düzenlenmiştir (bkz. bölüm 4.2). Bütün TLS olguları venetoklaks doz-titrasyon fazı sırasında meydana gelmiş ve iki gün içinde kaybolmuştur. 6 hastanın tamamı doz titrasyonunu tamamlamış ve önerilen günlük 400 mg'lik venetoklaks dozuna ulaşmıştır. Mevcut 5 haftalık doz-titrasyon takvimini, TLS profilaksisi ve izlem önlemlerini takip eden hastalarda klinik TLS gözlenmemiştir (bkz. bölüm 4.2). TLS ile ilişkili derece ≥ 3 laboratuvar anormalliklerinin oranı hiperkalemi %1, hiperfosfatemi %1 ve hiperürisemi %1 idi.
Açık etiketli, randomize faz 3 çalışmada (CLL14), venetoklaks + obinutuzumab ile tedavi edilen hastalarda TLS insidansı %1,4 (3/212) olmuştur. Üç TLS olayı da düzelmiş ve çalışmadan çekilmeye yol açmamıştır. TLS olayları nedeniyle iki vakada obinutuzumab uygulaması gecikmiştir.
Pazarlama sonrası izlemlerde, 20 mg'lık tek bir venetoklaks dozundan sonra fatal olaylar dahil TLS bildirilmiştir. (bkz. Bölüm 4.2 ve 4.4).
Akut miyeloid lösemi
Azasitidin ile kombine venetoklaks ile yapılan randomize Faz 3 çalışmasında (VIALE-A), TLS insidansı %1,1'dir (3/283, 1 klinik TLS), düşük doz sitarabin ile kombine venetoklaks ile yapılan Faz 3 çalışmasında (VIALE-C) TLS insidansı %5,6'dır (8/142, 4 klinik TLS, 2'si ölümle sonuçlanmıştır). Çalışmalarda venetoklaks başlatılmadan önce akyuvar sayısının <25x10/L'ye düşmesi beklenmiştir ve standart profilaksi ve izleme ek olarak bir doz titrasyon takvimi uygulanması gerekmiştir (bkz. Bölüm 4.2). Tüm TLS olguları doz titrasyonu sırasında gerçekleşmiştir.
M14-358 çalışmasında, desitabin ile kombine venetoklaks ile hiçbir laboratuvar veya klinik TLS olgusu bildirilmemiştir.
Nötropeni ve enfeksiyonlar
Nötropeni, VENCLYXTO tedavisinde tanımlanmış bir risktir.
Kronik lenfositik lösemi
CLL14 çalışmasında, venetoklaks + obinutuzumab kolundaki hastaların %58'inde nötropeni (tüm derecelerde) bildirilmiştir; venetoklaks + obinutuzumab ile tedavi edilen hastaların %41'i doz kesintisi yaşamış ve hastaların %2'si nötropeni nedeniyle venetoklaksı bırakmıştır. Hastaların %25'inde 3. dereceden nötropeni ve %28'inde 4. dereceden nötropeni bildirilmiştir. 3. veya 4. dereceden nötropeninin medyan süresi 22 gündür (aralık: 2 ila 363 gün). Hastaların %6'sında febril nötropeni,
%19'unda ≥3. derece enfeksiyonlar ve %19'unda ciddi enfeksiyonlar bildirilmiştir. Hastaların
%1,9'unda tedavi sırasında ve %1,9'unda tedavi kesildikten sonra enfeksiyona bağlı ölüm meydana gelmiştir.
MURANO çalışmasında, nötropeni (bütün dereceler), venetoklaks + rituksimab kolunda hastaların
%61'inde bildirilmiştir. Nötropeni nedeniyle venetoklaks + rituksimab ile tedavi edilen hastaların
%43'ü doz kesintisi yaşamış ve hastaların %3'ü venetoklaksı bırakmıştır. Derece 3 nötropeni, hastaların
%32'sinde, derece 4 nötropeni ise hastaların %26'sında bildirilmiştir. Derece 3 veya 4 nötropeninin medyan süresi 8 gündür (aralık: 1- ila -712 gün). Venetoklaks + rituksimab ile tedavi edilen hastalarda, febril nötropeni hastaların %4'ünde, derece ≥3 enfeksiyonlar hastaların %18'inde ve ciddi enfeksiyonlar hastaların %21'inde raporlanmıştır.
Akut miyeloid lösemi
VIALE-A çalışmasında, hastaların %45'inde derece ≥3 nötropeni bildirilmiştir. Venetoklaks ile azasitidin kolunda, plasebo ile azasitidin koluyla karşılaştırıldığında sırasıyla şunlar bildirilmiştir: febril nötropeni %42'ye karşı %19, derece ≥3 enfeksiyonlar %64'e karşı %51, ciddi enfeksiyonlar %57'ye karşı %44.
M14-358 çalışmasında, venetoklaks ile desitabin kolundaki hastaların %35'i (tüm dereceler) ve
%35'inde (derece 3 ve 4) nötropeni bildirilmiştir.
VIALE-C çalışmasında, hastaların %53'ünde derece ≥3 nötropeni bildirilmiştir. Venetoklaks ile düşük doz sitarabin kolunda, plasebo ile düşük doz sitarabin koluyla karşılaştırıldığında sırasıyla şunlar bildirilmiştir: febril nötropeni %32'ye karşı %29, derece ≥3 enfeksiyonlar %43'e karşı %50, ciddi enfeksiyonlar %37'ye karşı %37.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:tufam@titck.gov.tr; tel 0 800 314
00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
VENCLYXTO için spesifik bir antidot yoktur. Aşırı doz alan hastalar yakından izlenmeli ve uygun destekleyici tedavi uygulanmalıdır. Doz titrasyon fazında, tedaviye ara verilmeli ve hastalar TLS belirtileri ve semptomları (ateş, titreme, bulantı, kusma, konfüzyon, nefes darlığı, nöbetler, düzensiz kalp ritmi, koyu renkli veya bulanık idrar, olağan dışı yorgunluk, kas veya eklem ağrısı, abdominal ağrı ve distansiyon) ve yanı sıra diğer toksisiteler açısından dikkatli şekilde takip edilmelidir (bkz. Bölüm 4.2). Venetoklaksın geniş dağılım hacmi ve büyük oranda proteinlere bağlanması nedeniyle diyalizin venetoklaksı anlamlı düzeyde temizlemesi muhtemelen mümkün olmayacaktır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer antineoplastik ajanlar
ATC kodu: L01XX52
Etki mekanizması
Venetoklaks, güçlü, seçici B-hücreli lenfoma (BCL)-2 inhibitörü olan bir anti-apoptotik proteindir. Tümör hücresi sağkalımında aracı olan KLL ve AML hücrelerinde BCL-2'nin aşırı ekspresyonu gösterilmiş ve kemoreapötik ajanlara karşı direnç ile ilişkilendirilmiştir. Venetoklaks mitokondriyal dış memran permeabilizasyonunu (MOMP), kaspaz aktivasyonu ve programlı hücre ölümünü başlatmak için doğrudan BCL-2'nin BH3 bağlama oluğuna bağlanarak, BIM gibi BH3 motifi içeren pro-apoptik proteinlerin yerini alır. Klinik dışı çalışmalarda, venetoklaks BCL-2'yi aşırı eksprese eden tümör hücrelerinde sitotoksik aktivite göstermiştir.
Farmakodinamik etkiler
Kardiyak elektrofizyoloji
Venetoklaksın günde 1 defa olmak üzere 1200 mg'a kadar olan çoklu dozlarının düzeltilmiş QT (QTc) aralığındaki etkisi 176 hastada yürütülen bir açık-etiketli, tek-kollu bir çalışmada değerlendirilmiştir. Bu çalışmada venetoklaksın QTc aralığı üzerine bir etkisi yoktur ve venetoklaks maruziyeti ile QTc aralığı değişikliği arasında bir ilişki mevcut değildir.
Klinik etkililik ve güvenlilik
Kronik lenfositik lösemi
Daha önce tedavi edilmemiş KLL hastalarının tedavisi için obinutuzumab ile kombinasyon halinde venetoklaks – çalışma BO25323 (CLL14)
Randomize (1:1), çok merkezli, açık etiketli bir faz 3 CLL 14 çalışması, daha önce tedavi edilmemiş ve komorbiditeleri olan hastalarda (toplam Kümülatif Hastalık Değerlendirme Ölçeği [CIRS] skoru >6
veya kreatinin klirensi [CrCl] <70 mL/dk) venetoklaks + obinutuzumabın obinutuzumab + klorambusile karşı etkililiğini ve güvenliliğini değerlendirmiştir. Çalışmadaki hastalar TLS riski açısından değerlendirilmiş ve obinutuzumab uygulamasından önce uygun şekilde profilaksi almıştır. Tüm hastalar toplam 6 kür olmak üzere, 1. kürün 1. gününde 100 mg obinutuzumab almış ve ardından 1. gün veya 2.
gün 900 mg, ardından 1. kürün 8. ve 15. günlerinde ve sonraki her kürün 1. gününde 1000 mg'lık dozlar almıştır. 1. kürün 22. gününde, venetoklaks + obinutuzumab kolundaki hastalar, 5 haftalık venetoklaks doz titrasyon takvimine başlamıştır ve 2. kürün 28. gününe kadar devam etmişlerdir. Doz titrasyon takvimi tamamlandıktan sonra hastalar 3. kürün 1. gününden 12. kürün son gününe kadar günde bir kez 400 mg venetoklaksa devam etmiştir. Her kür 28 gündür. Obinutuzumab + klorambusil koluna randomize edilen hastalar, 1. - 12. kürlerin 1. gününde ve 15. gününde 0,5 mg/kg oral klorambusil almıştır. Tedavi tamamlandıktan sonra hastalar, hastalık progresyonu ve genel sağkalım (OS) açısından izlenmeye devam edilmiştir.
Temel demografik özellikler ve hastalık özellikleri çalışma kolları arasında benzerdi. Medyan yaş 72'ydi (aralık: 41 ila 89 yaş), hastaların %89'u beyazdı, %67'si erkekti; sırasıyla %36'sı ve %43'ü Binet evre B ve C'ydi. Medyan CIRS skoru 8'di (aralık: 0 ila 28) ve hastaların %58'inde CrCl <70 mL/dk'ydı. Hastaların %8'inde 17p delesyonu, %10'unda TP53 mutasyonları, %19'unda 11q delesyonu ve
%57'sinde mutasyona uğramamış IgHV tespit edilmiştir. Birincil analiz sırasında medyan takip 28 aydır (aralık: 0 ila 36 ay).
Başlangıçta, medyan lenfosit sayımı her iki çalışma kolunda da 55 x 10 hücre/L düzeyindeydi. 1. kürün
15. gününde medyan sayım obinutuzumab + klorambusil kolunda 1,03 x 10 hücre/L'ye (aralık: 0,2 ila
43,4 x 10 hücre/L) ve venetoklaks + obinutuzumab kolunda 1,27 x 10 hücre/L'ye (aralık: 0,2 ila
83,7 x 10 hücre/L) düşmüştür.
Progresyonsuz sağkalım (PFS) araştırmacılar tarafından, Uluslararası Kronik Lenfositik Lösemi Çalışma Grubu (IWCLL) tarafından güncellenen Ulusal Kanser Enstitüsü sponsorluğundaki Çalışma Grubu (NCI-WG) kılavuzları (2008) kullanılarak değerlendirilmiştir.
Primer analiz zamanında (veri kesme tarihi 17 Ağustos 2018) araştırmacılar tarafından yapılan değerlendirmeye göre venetoklaks ve obinutuzumab kolundaki hastaların %14'üne (30/216) kıyasla, obinutuzumab ve klorambusil kolundaki hastaların %36'sında (77/216) hastalık progresyonu ya da ölüm gibi bir PFS olayı yaşanmıştır (tehlike oranı [HR]: 0,35 [%95 güven aralığı [GA]: 0,23, 0,53]; p<0,0001, gruplandırılmış log-rank testi). Her iki çalışma kolunda da medyan PFS'ye ulaşılmamıştır.
Progresyonsuz sağkalım ayrıca bir Bağımsız İnceleme Komitesi (IRC) tarafından değerlendirilmiştir ve araştırmacı tarafından değerlendirilen PFS ile tutarlıdır.
Araştırmacı tarafından değerlendirilen genel yanıt oranı (ORR) venetoklaks ve obinutuzumab ile obinutuzumab ve klorambusil kollarında sırasıyla %85 (%95 GA: 79,2, 89,2) ve %71 (%95 GA: 64,8, 77,2)'dir (p=0,0007, Cochran-Mantel-Haenszel testi). Araştırmacı tarafından değerlendirilen tam remisyon ve tam olmayan kemik iliği iyileşmesi olan tam remisyon (CR + CRi) oranı venetoklaks ve obinutuzumab ile obinutuzumab ve klorambusil kollarında sırasıyla %50 ve %23'dür (p<0,0001, Cochran-Mantel-Haenszel testi).
Tedavi sonunda minimal rezidüel hastalık (MRD) alele özgü oligonükleotid polimeraz zincir reaksiyonu (ASO-PCR) testi kullanılarak değerlendirilmiştir. MRD negatifliği 10 lökosit başına birden az KLL hücresi olarak tanımlanmıştır. Periferik kandaki MRD negatiflik oranları venetoklaks ve obinutuzumab kolunda %76 (%95 GA: 69,2, 81,1) iken, obinutuzumab ve klorambusil kolunda %35 (%95 GA: 28,8, 42,0)'dır (p<0,0001). Protokole göre, kemik iliğindeki MRD, sadece yanıt görülen hastalarda (CR / CRi ve kısmi remisyon [PR]) değerlendirilmiştir. Kemik iliğinde MRD negatiflik
oranları venetoklaks ve obinutuzumab kolunda %57 (%95 GA: 50,1, 63,6) ve obinutuzumab ve
klorambusil kolunda %17 (%95 GA: 12,4, 22,8)'dir (p<0,0001).
65 aylık takip
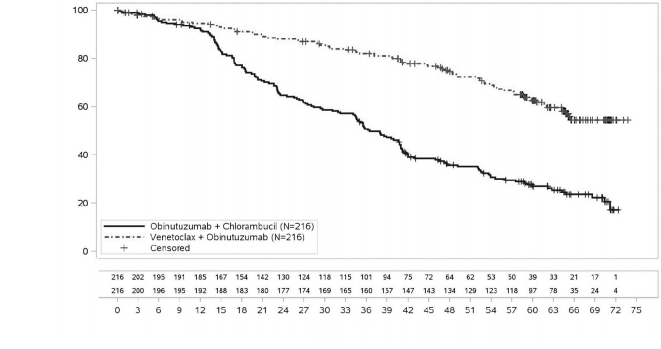
Etkililik, 65 aylık bir medyan takipten sonra değerlendirilmiştir (veri kesme tarihi 8 Kasım 2021). CLL14 için 65 aylık takipte etkililik sonuçları Tablo 10'da sunulmaktadır. Araştırmacı tarafından değerlendirilen PFS'nin Kaplan-Meier eğrisi Şekil 1'de gösterilmektedir.
Tablo 10: CLL14'te araştırmacı tarafından değerlendirilen etkililik sonuçları (65 aylık takip)
Sonlanım noktası | Venetoklaks + obinutuzumab N = 216 | Obinutuzumab + klorambusil N = 216 |
Progresyonsuz sağkalım | ||
Olay sayısı (%) | 80 (37) | 150 (69) |
Medyan, ay (%95 GA) | NR (64,8, NE) | 36,4 (34,1, 41) |
Tehlike oranı, tabakalı (%95 GA) | 0,35 (0,26, 0,46) | |
Genel sağkalım | ||
Olay sayısı (%) | 40 (19) | 57 (26) |
Tehlike oranı, gruplandırılmış (%95 GA) | 0,72 (0,48, 1,09) | |
GA = güven aralığı; NE = değerlendirilmedi; NR = ulaşılamadı | ||
Zaman (ay)
Progresyonsuz Sağkalım
Şekil 1: 65 aylık takip ile CLL14'te araştırmacı tarafından değerlendirilen progresyonsuz sağkalıma ilişkin Kaplan-Meier eğrisi (tedavi amaçlı popülasyon)
Venetoklaks + obinutuzumaba kıyasla obinutuzumab + klorambusil tedavisinin PFS açısından faydası delesyon 17p ve / veya TP53 mutasyonu ve / veya mutasyona uğramamış IgHV olan yüksek riskli hastalar da dahil olmak üzere değerlendirilen tüm hasta alt gruplarında gözlenmiştir.
Daha önce en az bir kez tedavi almış KLL hastalarının tedavisi için rituksimab ile kombine venetoklaks – çalışma GO28667 (MURANO)
Daha önce tedavi almış KLL hastalarında, rituksimab ile kombine bendamustine karşı rituksimab ile kombine venetoklaksın güvenlilik ve etkililiği bir randomize (1:1), çok merkezli, açık etiketli faz 3 çalışmada değerlendirilmiştir. Venetoklaks+rituksimab kolundaki hastalar, hastalık progresyonu ve kabul edilemez düzeyde toksisite olmaksızın, 5 haftalık doz-titrasyon takvimini tamamlamış ve rituksimabın 1. kürünün 1.gününden itibaren 24 ay boyunca 400 mg venetoklaks almıştır. Rituksimab, 5 haftalık doz titrasyon takviminin ardından 1. kür için 375 mg/m ile başlatılmış, 2-6 arası kürler için ise 500 mg/m olarak kullanılmıştır. Her bir kür 28 gündür. Bendamustin + rituksimab koluna randomize edilen hastalar 6 kür boyunca 1. ve 2.günlerde 70 mg/m bendamustin ve yukarıda yer alan doz ve takvimde rituksimab almıştır.
Medyan yaş 65 olup (aralık: 22 ila 85 yaş), bunların %74'ü erkek ve %97'si beyaz ırktandır. Tanıdan itibaren geçen medyan süre 6,7 yıldır (aralık: 0,3 ila 29,5 yıl). Önceki anti-KLL tedavilerinin medyan sayısı 1 olup (aralık: 1 ila 5 tedavi), alkilleyici ajanları (%94), anti-CD20 antikorlarını (%77), B-hücre reseptör yolağı inhibitörlerini (%2) ve pürin analoglarını (%81, %55'i fludarabin + siklofosfamid + rituksimab (FCR)) içermektedir. Başlangıçta hastaların %47'sinde ≥5 cm'lik bir veya birden fazla lenf nodu bulunmaktadır ve %68'inde ALC≥25 x 10/L'dir. Hastalardan %27'sinde 17p delesyonu,
%26'sında TP53 mutasyonu, %37'sinde 11q delesyonu bulunmakta, %68'i mutasyona uğramamış
IgHV geni taşımaktadır. Analiz sırasındaki medyan takip süresi 23,8 aydır (aralık: 0,0 ila 37,4 aydır).
Progresyonsuz sağkalım, araştırmacılar tarafından, IWCLL tarafından güncellenen NCI-WG kılavuzları (2008) kullanılarak değerlendirilmiştir.
Primer analiz zamanında (veri kesme tarihi 8 Mayıs 2017), bendamustin + rituksimab kolundaki hastaların %58'ine (114/195) kıyasla, venetoklaks + rituksimab kolundaki hastaların %16'sı (32/194) bir PFS olayı yaşamıştır (tehlike oranı: 0,17 [%95 GA: 0,11, 0,25]; p<0,0001, gruplandırılmış log-rank testi). PFS olayları venetoklaks + rituksimab kolunda 21 hastalık ilerlemesi ve 11 ölüm olayından, bendamustin + rituksimab kolunda 98 hastalık ilerlemesi ve 16 ölüm olayından meydana gelmiştir. Medyan PFS'ye venetoklaks + rituksimab kolunda ulaşılmazken bendamustin + rituksimab kolunda 17 ay (%95 GA: 15,5, 21,6) olarak izlenmiştir.
12 ve 24 aylık PFS tahminleri venetoklaks + rituksimab kolunda sırasıyla %93 (%95 GA: 89,1, 96,4)
ve %85 (%95 GA: 79,1, 90,6) bendamustin + rituksimab kolunda sırasıyla %73 (%95 GA: 65,9, 79,1)
ve %36 (%95 GA: 28,5, 44) olarak hesaplanmıştır.
Primer analize yönelik etkililik sonuçları da IRC tarafından değerlendirilmiş ve venetoklaks + rituksimab alan hastalar için ilerleme veya ölüm riskinde istatistiksel olarak anlamlı %81'lik bir azalmaya işaret etmiştir (tehlike oranı: 0,19 [%95 GA: 0,13, 0,28]; p<0,0001).
Venetoklaks + rituksimab alan hastalara yönelik araştırmacı değerlendirmeli genel yanıt oranı (ORR)
%93 olarak hesaplanırken (%95 GA: 88,8, 96,4), %27'lik bir tam remisyon (CR) + tamamlanmamış kemik iliği iyileşmesi ile tam remisyon (Cri) oranı, %3'lük bir nodüler kısmi remisyon (nPR) oranı ve
%63'lük bir kısmi remisyon (PR) oranı hesaplanmıştır. Bendamustin + rituksimab alan hastalar için ORR, %68 olarak hesaplanırken (%95 GA: 60,6, 74,2), %8'lik bir CR + CRi oranı, %6'lık bir nPR oranı ve %53'lük bir PR oranı hesaplanmıştır. Yaklaşık 23,8 aylık medyan izlemeyle birlikte medyan cevap süresi (DOR)'ye ulaşılmamıştır. Venetoklaks + rituksimab alan hastalara yönelik IRC değerlendirmeli ORR %92 olarak hesaplanırken (%95 GA: 87,6, 95,6), %8'lik bir CR + CRi oranı,
%2'lik bir nPR oranı ve %82'lik bir PR oranı hesaplanmıştır. Bendamustin + rituksimab alan hastalar için IRC değerlendirmeli ORR, %72 olarak hesaplanırken [%95 GA: 65,5, 78,5], %4'lük bir CR + CRi
oranı, %1'lik bir nPR oranı ve %68'lik bir PR oranı hesaplanmıştır. IRC ve araştırmacı değerlendirmeli CR oranları arasındaki farklılık, CT taramalarındaki residual adenopati yorumlamasından kaynaklanmıştır. Venetoklaks + rituksimab kolundaki 18 hasta ve bendamustin + rituksimab kolundaki 3 hastada <2 cm negatif kemik iliği ve lenf düğümleri görülmüştür.
Kombinasyon tedavisi sonundaki MRD, ASO-PCR ve/veya akım sitometrisi kullanılarak değerlendirilmiştir. MRD negatifliği 10 lökosit başına birden az KLL hücresi olarak tanımlanmıştır. Periferik kandaki MRD negatiflik oranları venetoklaks + rituksimab kolunda %62 (%95 GA: 55,2, 69,2), bendamustin + rituksimab kolunda %13 (%95 GA: 8,9, 18,9) olarak hesaplanmıştır. Periferik kanda MRD miktar tayini sonuçları mevcut bulunanlardan venetoklaks + rituksimab kolundaki hastaların %72'si (121/167) ve bendamustin + rituksimab kolundaki hastaların %20'sinin (26/128) MRD negatif olduğu bulunmuştur. Kemik iliğindeki MRD negatiflik oranları venetoklaks + rituksimab kolunda %16 (%95 GA: 10,7, 21,3), bendamustin + rituksimab kolunda %1 (%95 GA: 0,1, 3,7) olarak hesaplanmıştır. Kemik iliğinde MRD miktar tayini sonuçları mevcut bulunanlardan venetoklaks + rituksimab kolundaki hastaların %77'si (30/39) ve bendamustin + rituksimab kolundaki hastaların
%7'sinin (2/30) MRD negatif olduğu bulunmuştur.
Medyan OS'ye hiçbir tedavi kolunda ulaşılmamıştır. Venetoklaks + rituksimab alan hastaların %8'i (15/194) ve bendamustin + rituksimab alan hastaların %14'ünde (27/195) ölüm gözlenmiştir (tehlike oranı: 0,48 [%95 GA: 0,25, 0,90]).
Veri kesme tarihi itibarıyla venetoklaks + rituksimab kolundaki hastaların %12'si (23/194) ve bendamustin + rituksimab kolundaki hastaların %43'ü (83/195) yeni bir anti-lösemi tedavisine başlamış ya da ölmüştür (gruplandırılmış tehlike oranı: 0,19; [95% GA: 0,12, 0,31]). Yeni anti-lösemi tedavisine veya ölüme kadarki medyan süreye venetoklaks + rituksimab kolunda ulaşılmamış, bu süre bendamustin + rituksimab kolunda 26,4 ay olarak hesaplanmıştır.
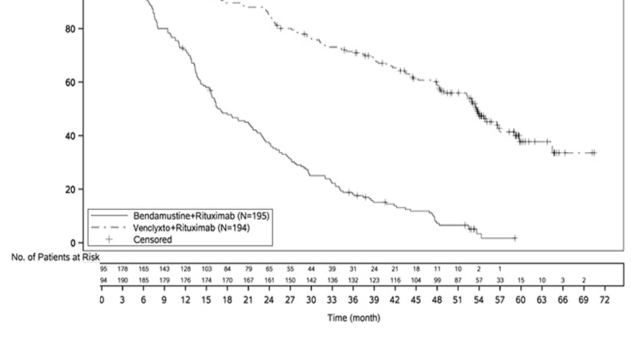
59 aylık takip
59 medyan takibin ardından etkililik değerlendirildi (8 Mayıs 2020 tarihli veri kesimi). MURANO 59 aylık takibinin etkililik sonuçları Tablo 11'de sunulmaktadır.
Tablo 11: MURANO'da araştırmacı tarafından değerlendirilen etkililik sonuçları (59 aylık takip)
Sonlanım noktası | Venetoklaks + rituksimab N = 194 | Bendamustin + rituksimab N = 195 |
Progresyonsuz sağkalım | ||
Olay sayısı (%) | 101 (52) | 167 (86) |
Medyan, ay (%95 GA) | 54 (48,4, 57) | 17 (15,5, 21,7) |
Risk oranı, katmanlandırılmış (%95 GA) | 0,19 (0,15, 0,26) | |
Genel sağkalım | ||
Olay sayısı (%) | 32 (16) | 64 (33) |
Risk oranı (%95 GA) | 0,40 (0,26, 0,62) | |
60 aylık tahmin (%95 GA) | 82 (76,4, 87,8) | 62 (54,8, 69,6) |
Bir sonraki anti lösemi tedavisine kadar geçen süre | ||
Olay sayısı (%) | 89 (46) | 149 (76) |
Medyan, ay (%95 GA) | 58 (55,1, NE) | 24 (20,7, 29,5) |
Risk oranı, katmanlandırılmış (%95 GA) | 0,26 (0,20, 0,35) | |
MRD negatifliği | ||
Çalışmanın sonunda periferik kan, n (%) | 83 (64) | NA |
Tedavi sonundan itibaren 3 yıllık tahmini PFS, % (%95 GA) | 61 (47,3, 75,2) | NA |
Tedavi sonundan itibaren 3 yıllık tahmini GS, % (%95 GA) | 95 (90, 100) | NA |
GA = güven aralığı; MRD = minimal kalıntı hastalık; NE = hesaplanabilir değildir; GS = genel sağkalım; PFS = progresyonsuz sağkalım; NA = mevcut değil.
Toplamda, venetoklaks + rituksimab kolundaki 130 hasta, 2 yıllık venetoklaks tedavisini progresyonsuz tamamlamıştır. Bu hastalar için tedavi sonrası 3 yıllık tahmini PFS %51'dir (%95 GA: 40,2, 61,9).
Araştırmacı tarafından değerlendirilen PFS'ye ilişkin Kaplan-Meier eğrisi Şekil 2'de gösterilmektedir.
Zaman (ay)
Progresyonsuz Sağkalım
Şekil 2: 59 aylık takip ile MURANO çalışmasında araştırmacı tarafından değerlendirilen progresyonsuz sağkalıma ilişkin Kaplan-Meier eğrisi (tedavi amaçlı popülasyon) (8 Mayıs 2020 tarihli veri kesim)
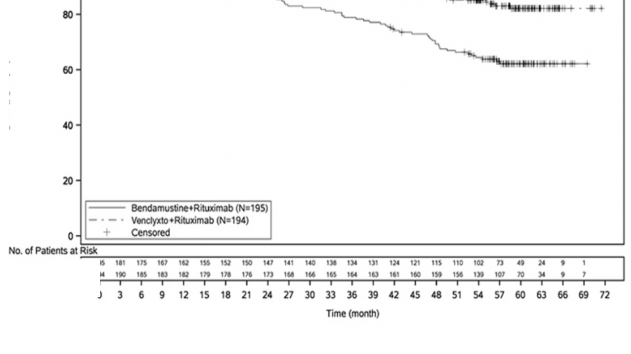
Genel sağkalım Kaplan-Meier eğrisi Şekil 3'te gösterilmektedir.
Zaman (ay)
Genel Sağkalım
Şekil 3: 59 aylık takip ile MURANO çalışmasında genel sağkalıma ilişkin Kaplan-Meier eğrisi (tedavi amaçlı popülasyon) (8 Mayıs 2020 tarihli veri kesimi)
Alt grup analizlerinin sonuçları
Bendamustin + rituksimaba kıyasla venetoklaks + rituksimabın gözlemlenen PFS faydası, 17p delesyonu/TP53 mutasyonu ve/veya mutasyona uğramamış IgHV'si olan yüksek riskli hastalar dahil olmak üzere, değerlendirilen bütün hasta alt gruplarında tutarlı bir şekilde gözlenmiştir (Şekil 4).
Şekil 4: 59 aylık takip ile MURANO çalışmasından alt gruplarda araştırmacı tarafından değerlendirilen progresyonsuz sağkalıma ilişkin meta analiz grafiği (8 Mayıs 2020 tarihli veri kesim)
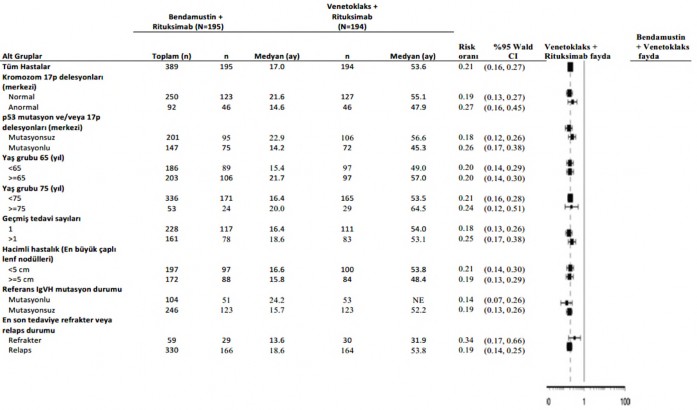
17p delesyon durumu merkezi laboratuvar test sonuçlarına dayanarak tespit edilmiştir. Katmanlandırılmamış risk oranı, logaritmik skalada X ekseninde gösterilmiştir.
NE = Hesaplanabilir değildir.
17p delesyonu veya TP53 mutasyonu bulunan KLL hastalarının tedavisi için venetoklaks monoterapisi – çalışma M13-982
Venetoklaksın etkililiği ve güvenliliği öncesinde tedavi almış 17p delesyonu bulunan 107 KLL hastasının katıldığı tek kollu, açık-etiketli, çok-merkezli bir çalışmada değerlendirilmiştir (M13-982). Hastalar günde bir defa bir 20 mg'lık başlangıç dozu ile 50 mg, 100 mg, 200 mg ve nihayetinde 400 mg'lık artan dozlar ile 4 ila 5 hafta doz titrasyonu takvimini takip etmişlerdi. Hastalar, hastalık progresyonuna ya da kabul edilemeyen toksisite gözlenene kadar günde bir defa 400 mg venetoklaks almaya devam ettiler. Medyan yaş 67 (aralık: 37 ila 85 yaş); %65'i erkek ve %97'si beyaz ırk idi. Tanıdan itibaren medyan süre 6,8 yıl idi (aralık: 0,1 ila 32 yıl; N=106). Önceki anti-KLL tedavilerinin medyan sayısı 2 (aralık: 1 ila 10 tedavi) idi; %49,5'u öncesinde bir nükleozid analoğu ile, %38'i öncesinde rituksimab ile, %94'ü öncesinde alkilatör ile (%33'ü öncesinde bendamustin ile dahil olmak üzere) tedavi edilmişlerdi. Başlangıçta hastaların %53'ünde ≥5 cm olan bir veya daha fazla nod ve
%51'inde ALC ≥ 25x10/L bulunuyordu. Hastaların %37'si (34/91) fludarabin refraktör iken, %81'i (30/37) mutasyona uğramamış IgHV geni bulunduruyordu ve %72'si (60/83) TP53 mutasyonuna sahipti. Tedavide değerlendirme zamanında medyan süre 12 ay idi (aralık: 0 ile 22 ay).
NCI-WG kılavuzları (2008) ile güncellenen ORR, IRC tarafından değerlendirilmiştir. Etkililik sonuçları Tablo 12'de gösterilmektedir. 107 hasta için 30 Nisan 2015 veri kilit noktasında etkililik verisi sunulmuştur. İlaveten, bir güvenlilik uzatma kohort çalışmasına 51 hasta kaydedilmiştir. 158 hasta için daha sonra 10 Haziran 2016 veri kilit noktasında araştırmacı değerlendirmeli etkililik sonuçları sunulmuştur. Tedavideki 158 hasta için medyan zaman 17 aydı (aralık: 0 ile 34 ay).
Tablo 12: 17p delesyonu bulunan öncesinde tedavi edilen KLL hastalarında) etkililik sonuçları (çalışma M13-982)
Sonlanım noktası | IRC değerlendirmesi (N=107) | Araştırmacı değerlendirmesi (N=158) |
Veri kesim tarihi | 30 Nisan 2015 | 10 Haziran 2016 |
ORR, % | 79 | 77 |
(%95 GA) | (70,5, 86,6) | (69,9, 83,5) |
% CR + CRi | 7 | 18 |
% nPR | 3 | 6 |
% PR | 69 | 53 |
DOR, ay, medyan (%95 GA) | NR | 27,5 (26,5, NR) |
% PFS (%95 GA) |
|
|
12- aylık tahmin | 72 (61,8, 79,8) | 77 (69,1, 82,6) |
24-aylık tahmin | NA | 52 (43, 61) |
PFS, ay, medyan (%95 GA) | NR | 27,2 (21,9, NR) |
TTR, ay, medyan (aralık) | 0,8 (0,1-8,1) | 1 (0,5-4,4) |
GA= güven aralığı; CR=Tam remisyon; CRi= tamamlanmamış kemik iliği iyileşmesi ile tam remisyon; DOR=cevap süresi; IRC = Bağımsız İnceleme Komitesi; nPR=nodüler PR; NA= mevcut değil; NR= ulaşılmadı; ORR=toplam cevap oranı; PFS= progresyonsuz sağkalım; PR= kısmi remisyon; TTR= ilk cevaba kadar geçen süre | ||
Minimal rezidüel hastalık (MRD), flow sitometri kullanılarak CR, CRi veya VENCLYXTO ile tedavisi limitli kalan PR gösteren 158 hastanın 93'ünde değerlendirilmiştir. MRD negativite 0,0001'in altındaki sonuçla tanımlanmıştır (örnekteki 10 lökosit başına < 1 KLL hücresi). Hastaların yüzde yirmi yedisi (42/158) periferik kanda MRD negatif iken 16 hastanın kemik iliğinde MRD negatif idi.
Bir B hücresi reseptör inhibitörünün başarısız olduğu KLL hastalarının tedavisi için venetoklaks monoterapisi – çalışma M14-032
Venetoklaksın ibrutinib veya idelalisib ile daha önce tedavi uygulanmış ve başarısız olunmuş KLL hastalarındaki etkililiği ve güvenliliği açık etiketli, çok merkezli, randomize olmayan bir faz 2 çalışmada (M14-032) değerlendirilmiştir. Hastalara önerilen bir doz titrasyonu programıyla venetoklaks uygulanmıştır. Hastalar hastalıkta ilerleme veya kabul edilemez toksisite gözlenene kadar günde bir kez 400 mg venetoklaks almaya devam etmiştir.
![]()
Veri kesim tarihi itibarıyla (26 Temmuz 2017) 127 hasta kaydedilmiş ve venetoklaks tedavisi görmüştü. Bu hastaların 91'i daha önce ibrutinib tedavisi görmüştür (Kol A), 36'sı ise daha önce idelalisib tedavisi almıştır (Kol B). Hastaların medyan yaşı 66 idi (aralık: 28–85 yaş), %70'i erkekti ve
%92'si beyazdı. Tanıdan itibaren geçen medyan süre 8,3 yıldı (aralık: 0,3 – 18,5 yıl; N=96). Kromozomal aberasyonlar 11q delesyonu (%34, 43/127), 17p delesyonu (%40, 50/126), TP53 mutasyonu (%38, 26/68) ve mutasyona uğramamış IgHV (%78, 72/92) şeklindeydi. Başlangıç noktasında hastaların % 41'i bir veya daha fazla ≥5 cm'lik noda sahipti %31'i ise ALC ≥25 x 10/L sergilemekteydi. Daha önce uygulanan onkoloji tedavilerinin medyan sayısı ibrutinible tedavi uygulanan hastalarda 4 (aralık: 1 ila 15), idelalisible tedavi uygulanan hastalarda ise 3'tü (aralık: 1 ila 11). Toplamda hastaların %65'i daha önce nükleosit analogu, %86'sı rituksimab, %39'u diğer monoklonal antikorlar, %72'si ise alkilleyici ajan (bendamustin alan %41 dahil) almıştır. Değerlendirme sırasında venetoklaks ile medyan tedavi süresi 14,3 aydır (aralık: 0,1 ile 31,4).
Primer etkililik sonlanım noktası IWCLL güncellenmiş NCI-WG kılavuzuna göre ORR'ydi. Yanıt değerlendirmeleri 8'inci haftada, 24'üncü haftada ve sonrasında her 12 haftada bir gerçekleştirilmiştir.
Tablo 13: Bir B hücresi reseptör inhibitörünün başarısız olduğu hastalarda araştırmacı tarafından değerlendirilen etkililik sonuçları (çalışma M14-032)
Sonlanım noktası | Kol A (ibrutinib tedavisi başarısız) (N=91) | Kol B (idelalisib tedavisi başarısız) (N=36) |
Toplam (N=127) |
ORR, % (%95 GA) |
65 (54,1, 74,6) |
67 (49, 81,4) |
65 (56,4, 73,6) |
CR + CRi, % | 10 | 11 | 10 |
nPR, % | 3 | 0 | 2 |
PR, % | 52 | 56 | 53 |
PFS, % (%95 GA) 12 aylık tahmin 24 aylık tahmin |
75 (64,7, 83,2) 51 (36,3, 63,9) |
80 (63,1, 90,1) 61 (39,6, 77,4) |
77 (68,1, 83,4) 54 (41,8, 64,6) |
PFS ay, medyan (% 95 GA) | 25 (19,2, NR) | NR (16,4, NR) | 25 (19,6, NR) |
OS % (%95 GA) 12 aylık tahmin | 91 (82,8, 95,4) | 94,2 (78,6, 98,5) | 92 (85,6 95,6) |
TTR, ay, medyan (aralık) | 2,5 (1,6-14,9) | 2,5 (1,6-8,1) | 2,5 (1,6-14,9) |
17 p delesyonu ve/veya TP53 mutasyonu durumu ORR, (%95 GA) | |||
Var | (n=28) 61 (45,4, 74,9) | (n=7) 58 (27,7, 84,8) | (n=35) 60 (46,6, 73) |
Yok | (n=31) 69 (53,4, 81,8) | (n=17) 71 (48,9, 87,4) | (n=48) 70 (57,3, 80,1) |
GA = güven aralığı; CR = tam remisyon; CRi = tam olmayan kemik iliği iyileşmesi ile tam remisyon, nPR = nodüler PR; NR= ulaşılmadı, ORR= genel yanıt oranı, OS= ortalama sağkalım, PFS=progresyonsuz sağkalım, PR = kısmi remisyon, TTR= ilk cevaba kadar geçen süre. | |||
Etkililik verileri bir IRC tarafından ilave şekilde incelenmiştir ve %70'lik bir birleşik ORR ortaya konmuştur (Kol A: %70; Kol B: %69). Bir hasta (ibrutinib başarısızlığı) CRi'ye ulaşmıştır. 17 p delesyonu ve/veya TP53 mutasyonu olan hastalarda ORR A Kol'unda %72 (33/46) (%95 GA: 56,5, 84,0), B Kol'unda %67 (8/12) (%95 GA: 34,9, 90,1) idi. 17p delesyonu ve/veya TP53 mutasyonu olmayan hastalarda ORR A Kol'unda %69 (31/45) (%95 GA:53,4, 81,8), B Kol'unda %71 (17/24) (%95 GA: 48,9, 87,4) idi.
Medyan takip ile yaklaşık olarak, A Kolu için 14,3 ayda ve B Kolu için 14,7 ayda medyan OS ve DOR'ye erişilemedi.
Hastaların yüzde yirmi beşinde (32/127) periferik kanda MRD negatiflik tespit edildi ve içlerinden 8 hasta aynı zamanda kemik iliğinde MRD negatif idi.
Akut miyeloid lösemi
Venetoklaks, ≥ 75 yaşında olan hastalarda veya aşağıdaki kriterlerden en az birine dayalı olarak yoğun indüksiyon kemoterapisi kullanımını engelleyen komorbiditeleri olan yetişkin hastalarda çalışılmıştır: başlangıç Doğu Kooperatif Onkoloji Grubu (ECOG) performans durumu 2-3, şiddetli kardiyak veya pulmoner komorbidite, orta derecede karaciğer yetmezliği, kreatinin klerensi (CrCl) < 45 mL/dk veya diğer komorbiditeler.
Yeni tanı almış AML hastalarının tedavisi için azasitidin ile kombine venetoklaks - M15-656 çalışması
(VIALE-A)
VIALE-A, yoğun kemoterapiye uygun olmayan yeni tanı almış AML hastalarında azasitidin ile kombine venetoklaksın etkililiği ve güvenliliğinin incelendiği bir randomize (2:1), çift kör, plasebo kontrollü, çok merkezli bir Faz 3 çalışmasıdır.
VIALE-A çalışmasındaki hastalar, ilk 28 günlük siklus sırasında 3 günlük bir titrasyon programını tamamlayarak günde bir kez 400 mg dozuna ulaşıp (bkz. Bölüm 4.2) sonraki, sikluslarda günde bir kez oral 400 mg venetoklaks tedavisi almıştır. 75 mg/m'de azasitidin, 1. siklusun 1. gününden başlayarak her 28 günlük döngünün 1-7. günlerinde intravenöz veya subkütan olarak uygulanmıştır. Plasebo oral olarak günde bir kez 1. kürün 1. gününden başlayarak her 28 günlük kürün 1-28. günlerinde ve 1-7. günlerinde 75 mg/m'de azasitidin ile uygulanmıştır. Titrasyon sırasında, hastalara TLS profilaksisi verilmiştir ve izlem için hastaneye yatırılmıştır. 1. siklus sonrası yapılan kemik iliği değerlendirmesinde remisyon elde edilip (blast oranının %5'in altında olduğu durum) eşlik eden derece 4 sitopeni olduğunda, venetoklaks veya plaseboya 14 gün boyunca veya ANC ≥500/mikroL ve platelet sayımı
>50x10/mikroL olana kadar ara verilmiştir. 1. siklusun sonunda dirençli hastalığı olan hastalar için, siklus 2 veya 3'ten sonra ve klinik olarak belirtildiği gibi bir kemik iliği değerlendirmesi yapılmıştır. Ara verildikten sonra azasitidin venetoklaks veya plaseboyla aynı gün tekrar başlatılmıştır (bkz. Bölüm 4.2). Hematolojik toksisite yönetimi için klinik çalışmada azasitidin dozu azaltılmıştır (bkz. Azasitidin Kısa Ürün Bilgisi). Hastalar hastalık progresyonu veya kabul edilemez toksisite olana kadar tedavi sikluslarına devam etmiştir.
286'sı venetoklaks ve azasitidin koluna, 145'i plasebo ve azasitidin koluna olacak şekilde toplam 431 hasta randomize edilmiştir. Başlangıçtaki demografik ve hastalık karakteristikleri venetoklaks ve azasitidin ile plasebo ve azasitidin kolları arasında benzerdir. Genel olarak, medyan yaş 76'dır (aralık: 49 ila 91), %76'sı beyazdır, %60'ı erkektir ve başlangıçtaki ECOG performans durumu hastaların
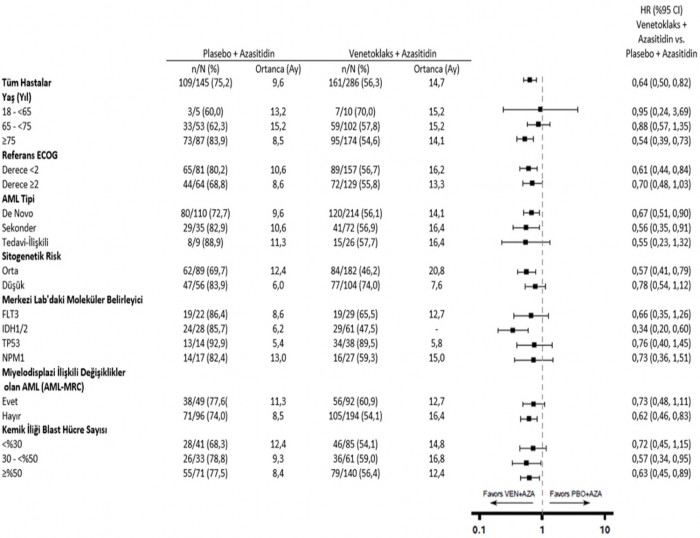
%55'inde 0 veya 1, %40'ında 2, %5'inde 3'tür. Hastaların %75'inde de novo AML, %25'inde sekonder AML vardır. Başlangıçta, hastaların %29'undaki kemik iliği blast sayımı <%30, %22'sindeki kemik iliği blast sayımı ≥%30 - <%50 ve %49'unda ≥%50'dir. Hastaların sırasıyla %63'ü ve %37'sinde orta dereceli veya zayıf sitogenetik riskler vardır. %21'inde TP53 mutasyonu (52/249), %24'ünde IDH1 ve/veya IDH2 mutasyonu (89/372), %9'unda IDH1 (34/372), %16'sında IDH2 (58/372), %16'sında FLT3 (51/314) ve %18'inde NPM1 (44/249) mutasyonları belirlenmiştir.
Çalışmadaki primer etkililik sonlanım noktaları, randomizasyon tarihinden herhangi bir nedenle ölüme kadar ölçülen genel sağkalım (OS) ve birleşik CR oranıdır (tam remisyon ve tamamlanmamış kemik iliği iyileşmesi ile tam remisyon [CR+CRi]). Analiz tarihindeki genel medyan takip 20,5 aydır (aralık:
<0,1 ila 30,7 ay).
Venetoklaks ve azasitidin, plasebo ve azasitidin ile karşılaştırıldığında, ölüm riskinde %34 düşüş göstermiştir (p <0,001). Sonuçlar Tablo 14'te gösterilmektedir.
Tablo 14: Etkililik Sonuçları VIALE-A
Sonlanım noktası | Venetoklaks ve azasitidin | Plasebo ve azasitidin |
Genel sağkalım | (N=286) | (N=145) |
Olay sayısı n (%) | 161 (56) | 109 (75) |
Medyan sağkalım, ay (%95 GA) | 14,7 (11,9, 18,7) | 9,6 (7,4, 12,7) |
Risk oranı (%95 GA) | 0,66 (0,52, 0,85) | |
p-değeri | <0,001 | |
CR+CRi oranı | (N=147) | (N=79) |
n (%) | 96 (65) | 20 (25) |
%95 GA p-değeri | (57, 73) | (16, 36) |
<0,001 | ||
GA = güven aralığı; CR = tam remisyon, >1,000/mikrolitre mutlak nötrofil sayımı, >100,000/mikrolitre platelet, alyuvar transfüzyonu bağımsızlığı ve kemik iliğinde <%5 blast; dolaşımda blast veya Auer çubuklu blast olmaması; ekstramedüller hastalık olmaması; CRi = tamamlanmamış kemik iliği iyileşmesi ile tam remisyon olarak tanımlanmıştır. | ||
Tehlikedeki sayı
Süre (ay)
Olay sayısı olasılığı
Şekil 5: VIALE-A'da genel sağkalıma ilişkin Kaplan-Meier eğrisi
Önemli sekonder etkililik sonlanım noktaları aşağıda Tablo 15'te sunulmaktadır.
Tablo 15: VIALE-A'daki ek etkililik sonlanım noktaları
Sonlanım noktası | Venetoklaks ve azasitidin N=286 | Plasebo ve azasitidin N=145 |
CR oranı |
|
|
n (%) | 105 (37) | 26 (18) |
%95 GA | (31, 43) | (12, 25) |
p değeri | ||
<0,001 | ||
Medyan DOR, ay %95 GA | ||
17,5 (15,3, -) | 13,3 (8,5, 17,6) | |
CR+CRi oranı |
|
|
n (%) | 190 (66) | 41(28) |
%95 GA | (61, 72) | (21, 36) |
Medyan DOR, ay | 17,5 | 13,4 |
%95 GA | (13,6, -) | (5,8, 15,5) |
CR+CRi oranı, 2. siklusun |
|
|
başlamasına kadar, n (%) | 124 (43) | 11 (8) |
%95 GA | (38, 49) | (4, 13) |
p değeri | <0,001 | |
Transfüzyon bağımsızlık oranı, |
|
|
trombositler |
|
|
n (%) | 196 (69) | 72 (50) |
%95 GA | (63, 74) | (41, 58) |
p değeri | <0,001 | |
Transfüzyon bağımsızlık oranı, |
|
|
alyuvar |
|
|
n (%) | 171 (60) | 51 (35) |
%95 GA | (54, 66) | (27, 44) |
p değeri | <0,001 | |
CR+CRi MRD yanıt oranı (% ) (95% CI) p değeri |
67 (23) |
11 (8) |
(19, 29) | (4, 13) | |
<0,001 | ||
Olaysız sağkalım |
|
|
Olayların sayısı, n (%) | 191 (67) | 122 (84) |
Medyan EFS, ay (%95 GA) | 9,8 | 7 |
| (8,4, 11,8) | (5,6, 9,5) |
Risk oranı (%95 GA) p değeri | ||
0,63 (0,50, 0,80) <0,001 | ||
GA = güven aralığı; CR = tam remisyon; CRi = tamamlanmamış kan sayımı iyileşmesi ile tam remisyon; DOR = yanıt süresi; EFS = olaysız sağkalım; MRD = minimal/ölçülebilir rezidüel hastalık; n = yanıt sayısı veya olay sayısı; - = ulaşılamadı.
CR (tam remisyon) mutlak nötrofil sayımı >1.000/mikrolitre, trombosit >100.000/mikrolitre, kırmızı kan hücresi transfüzyon bağımsızlığı ve <%5 blast bulunan kemik iliği olarak tanımlanmıştır. Dolaşımdaki blast ve Auer çubukları ile blast yokluğu; ekstramedüller hastalık yokluğu.
Transfüzyon bağımsızlığı, çalışma ilacının ilk dozundan sonra ve çalışma ilacının son gününde veya öncesinde + 30 günde, relapstan önce, hastalık progresyonundan önce veya tedavi sonrası tedaviye başlamadan önce (hangisi daha önceyse) transfüzsyon gerçekleştirilmeyen ardışık en az 56 günlük (≥56 gün) süre olarak tanımlanmıştır. | ||
![]()
FLT3 mutasyonu olan hastalarda sırasıyla venetoklaks + azasitidin ve plasebo + azasitidin kolları (p=0,021) CR+CRi oranları %72 (21/29; [%95 GA: 53, 87]) ve %36 (8/22; [%95 GA: 17, 59]) idi.
IDH1/IDH2 mutasyonlu hastalarda sırasıyla venetoklaks + azasitidin ve plasebo + azasitidin kolları (p<0,001) CR+CRi oranları %75 (46/61; [%95 GA: 63,86]) ve %11 (3/28; [%95 GA: 2, 28]) idi.
Başlangıç noktasında alyuvar transfüzyonuna bağımlı olan venetoklaks ve azasitidinle tedavi edilen hastaların %49'u (71/144) transfüzyondan bağımsız hale gelmiştir. Başlangıç noktasında platelet transfüzyonuna bağımlı olan venetoklaks ve azasitidinle tedavi edilen hastaların %50'si (34/68) transfüzyondan bağımsız hale gelmiştir.
Venetoklaks ve azasitidin tedavisinde ilk CR veya CRi yanıtına kadar geçen medyan süre 1,3 aydır (aralık: 0,6 ila 9,9 ay). En iyi CR veya CRi yanıtına kadar geçen medyan süre 2,3 aydır (aralık: 0,6 ila 24,5 ay).
Şekil 6: VIALE-A'da alt gruba göre genel sağkalım için meta analiz diyagramı
- = Ulaşılmadı.
IDH1/2 mutasyon alt grubunda önceden belirlenmiş ikincil son nokta OS için, p<0,0001 (katmanlanmamış log-sıra testi).
Sınıflandırılmamış tehlike oranı (HR), logaritmik ölçekle X ekseninde görüntülenmektedir.
Yeni tanı almış AML hastalarının tedavisi için azasitidin veya desitabin ile kombine venetoklaks - M14- 358 çalışması
M14-358 çalışması, yoğun kemoterapiye uygun olmayan yeni tanı almış AML hastalarında azasitidin (n=84) veya desitabinle (n=31) kombine venetoklaks ile gerçekleştirilen, randomize olmayan bir faz 1/2 çalışmasıdır. Hastalara günlük titrasyon yoluyla venetoklaks verilerek sonunda günde bir kez 400 mg dozuna ulaşılmıştır. M14-358 çalışmasındaki azasitidin uygulaması, VIALE-A randomize çalışmasındaki uygulamaya benzerdir. Desitabin, 1. siklusun 1. gününden başlayarak 28 günlük siklusun 1-5 günleri arasında intravenöz yoldan 20 mg/m uygulanmıştır.
Venetoklaks ve desitabin için medyan takip süresi 40,4 aydır (aralık: 0,7 ila 42,7 ay).
Venetoklaks ve desitabin ile tedavi edilen hastaların medyan yaşı 72'dir (aralık: 65-86). Hastaların
%87'si beyaz, %48'i erkektir ve %87'sinin ECOG skoru 0 veya 1'dir. CR+CRi oranı desitabin ile
kombinasyon için %74'tür (%95 GA: 55, 88).
Yeni tanı almış AML hastalarının tedavisi için düşük doz sitarabin ile kombine venetoklaks - M16-043 çalışması (VIALE-C)
VIALE-C, yoğun kemoterapiye uygun olmayan yeni tanı almış AML hastalarında düşük doz sitarabin ile kombine venetoklaksa karşı düşük doz sitarabin ile kombine plasebonun etkililiği ve güvenliliğinin değerlendirildiği, randomize (2:1), çift kör, plasebo kontrollü, çok merkezli bir Faz 3 çalışmasıdır.
VIALE-C çalışmasındaki hastalar, tedavinin ilk siklusu sırasında 4 günlük bir titrasyon programını tamamlayarak, ilk 28 günlük tedavi siklusunda günde bir kez 600 mg dozuna ulaşıp (bkz. Bölüm 4.2), takip eden sikluslarda da oral olarak günlük 600 mg venetoklaks almışlardır. 1. siklusun 1. gününden başlayarak her bir 28 günlük siklusun 1-10 günleri arasında subkütan yoldan düşük doz sitarabin 20 mg/m uygulanmıştır. 1-28 günler arasında günde bir kez oral plasebo ile 1-10 günleri arasında subkütan yoldan düşük doz sitarabin 20 mg/m uygulanmıştır. Titrasyon sırasında, hastalar TLS profilaksisi almış ve takip için hastaneye yatırılmıştır. 1. siklus sonrası yapılan kemik iliği değerlendirmesinde remisyon elde edilip (blast oranının %5'in altında olduğu durum) eşlik eden derece 4 sitopeni olduğunda, venetoklaks veya plaseboya 14 gün boyunca veya ANC ≥500/mikroL ve platelet sayımı
>25x10/mikroL olana kadar ara verilmiştir. 1. siklus'un sonunda dirençli hastalığı olan hastalar için, siklus 2 veya 3'ten sonra ve klinik olarak belirtildiği gibi bir kemik iliği değerlendirmesi yapılmıştır. Düşük doz sitarabin tedavisine ara verildikten sonra venetoklaks veya plasebo ile aynı gün yeniden başlanmıştır. Hastalar, hastalık progresyonu veya kabul edilemez toksisite olana kadar tedavi sikluslarına devam etmiştir. Klinik çalışmada düşük sitarabin için doz azaltma uygulanmamıştır.
143'ü düşük doz sitarabin ile kombine venetoklaks koluna, 68'i düşük doz sitarabin ile kombine plasebo koluna olmak üzere toplam 211 hasta randomize edilmiştir. Başlangıçtaki demografik ve hastalık karakteristikleri venetoklaks + düşük doz sitarabin + plasebo ve düşük doz sitarabin kolları arasında benzerdir. Medyan yaş 76'dır (aralık: 36 ila 93), %55'i erkektir, 71'i beyazdır ve başlangıçtaki ECOG performans durumu hastaların %51'inde 0 veya 1, %42'sinde 2, %7'sinde 3'tür. Hastaların %62'sinde de novo AML, %38'inde sekonder AML vardır. Başlangıçta, hastaların %27'sindeki kemik iliği blast sayımı ≥%30 - <%50, ve %44'ünde ≥%50'dir. Hastaların sırasıyla %63'ü ve %32'sinde orta dereceli veya zayıf sitogenetik riskler vardır. Numune alınan 164 hastanın %19'unda TP53 mutasyonu (31),
%20'sinde IDH1 veya IDH2 (33), %18'inde FLT3 (29) ve %15'inde NPM1 (25) mutasyonları belirlenmiştir.
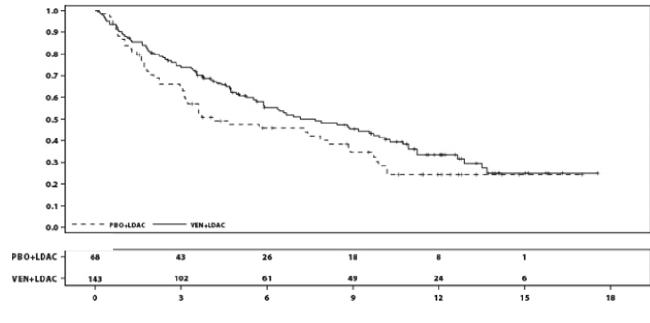
OS'ye ilişkin primer analiz tarihinde, hastaların medyan takip süresi 12 aydır (aralık: 0,1 ila 17,6 ay). Venetoklaks ve düşük doz sitarabin kolundaki medyan OS 7,2 aydır (%95 GA: 5,6, 10,1), plasebo ve düşük doz sitarabin kolunda 4,1 aydır (%95 GA: 3,1, 8,8). Risk oranı 0,75'tir (%95 GA: 0,52, 1,07; p=0,114) ve venetoklaks ve düşük doz sitarabinle tedavi edilen hastalar için ölüm riskinde %25 düşüş göstermektedir.
Tehlikedeki sayı
Süre (ay)
Olay sayısı olasılığı
Şekil 7: VIALE-C'de genel sağkalıma ilişkin Kaplan-Meier eğrileri (primer analiz)
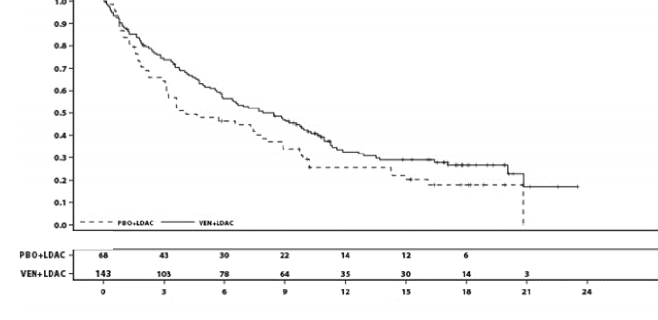
OS'ye ilişkin ek analiz tarihinde, hastaların medyan takip süresi 17,5 aydır (aralık: 0,1 ila 23,5 ay). Venetoklaks ve düşük doz sitarabin kolundaki medyan OS 8,4 aydır (%95 GA: 5,9, 10,1) ve plasebo ve düşük doz sitarabin kolunda 4,1 aydır (%95 GA: 3,1, 8,1). Risk oranı 0,70'tir (%95 GA: 0,50, 0,99, nominal p=0,040) ve venetoklaks ve düşük doz sitarabinle tedavi edilen hastalar için ölüm riskinde %30 düşüş göstermektedir.
Tehlikedeki sayı
Süre (ay)
Olay sayısı olasılığı
Şekil 8: VIALE-C'de genel sağkalıma ilişkin Kaplan-Meier eğrileri (6 aylık ek takip analizi)
OS'ye ilişkin ek 24 aylık analizde, medyan OS venetoklaks ve düşük doz sitarabin kolunda
8,4 ay (%95 GA: 5,9, 10,3) ve plasebo ve düşük doz sitarabin kolunda 4,1 aydır (%95 GA: 3,1, 8,1). Risk oranı 0,71 (%95 GA: 0,52, 0,98, nominal p= 0.036) olup venetoklaks ve düşük doz sitarabin ile tedavi edilen hastalar için ölüm riskinde % 29 düşüş göstermektedir.
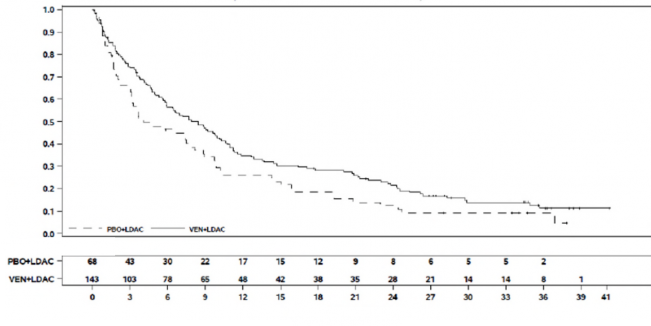
Tehlikedeki sayı
Süre (ay)
Olay sayısı olasılığı
Şekil 9: VIALE-C'de genel sağkalıma ilişkin Kaplan-Meier eğrileri (24 aylık takip analizi)
Primer analizde sekonder etkililik sonlanım noktalarına ilişkin etkililik sonuçları aşağıdaki Tablo 16'da sunulmaktadır.
Tablo 16: VIALE-C'deki primer analizde sekonder sonlanım noktalarının etkililik sonuçları
Sonlanım noktası | Venetoklaks ve düşük doz sitarabin N=143 | Plasebo ve düşük doz sitarabin N=68 |
CR, n (%) | 39 (27) | 5 (7) |
%95 GA | (20, 35) | (2, 16) |
Medyan DOR, ay | 11,1 | 8,3 |
%95 GA | (5,9, -) | (3,1, 8,3) |
CR+ CRi, n (%) | 68 (48) | 9 (13) |
%95 GA | (39, 56) | (6, 24) |
Medyan DOR (ay) | 10,8 | 6,2 |
%95 GA | (5,9, -) | (1,1,-) |
Transfüzyon bağımsızlığı, n (%) |
|
|
Trombosit | 68 (48) | 22 (32) |
(%95 GA) | (39, 56) | (22, 45) |
Alyuvar | 58 (41) | 12 (18) |
(%95 GA) | (32, 49) | (10, 29) |
Olaysız sağkalım |
|
|
Olayların sayısı, n (%) | 100 (70) | 54 (79) |
Medyan EFS, ay (%95 GA) | 4,7 (3,7, 6,4) | 2 (1,6, 3,1) |
Risk oranı (%95 GA) | 0,61 (0,44, 0,84) | |
GA = güven aralığı; CR = tam remisyon; CRi = tamamlanmamış kemik iliği iyileşmesi ile tam remisyon; DOR = yanıt süresi; n = yanıt sayısı veya olay sayısı; - = ulaşılamadı. | ||
progresyonu nedeniyle ölüm tarihine kadar (ilk önce hangisi olursa) geçen süre olarak
tanımlanmıştır. Medyan DoR Kaplan-Meier tahminine göredir.
siklusun başlangıcına kadar CR+CRi oranı venetoklaks ve düşük doz sitarabin için %34 (%95 GA: 27, 43), plasebo ve düşük doz sitarabin için %3'tür (%95 GA: 0,4, 10). Venetoklaks ve düşük doz sitarabin tedavisinde ilk CR+CRi yanıtına kadar geçen medyan süre 1,1 aydır (aralık: 0,8 ila 4,7 ay). En iyi CR+CRi yanıtına kadar geçen medyan süre 1,2 aydır (aralık: 0,8 ila 5,9 ay).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Çoklu oral uygulamanın ardından, dozdan sonraki 5 ila 8 saatte venetoklaksın maksimum plazma konsantrasyonuna ulaşılmıştır. Venetoklaks kararlı durum EAA'sı 150- 800 mg'lık doz aralığı arasında kademeli olarak artmıştır. Düşük yağlı yemek koşulları altında günde bir defa 400 mg dozda venetoklaks ortalama (±standart sapma) kararlı durum C2,1±1,1mcg/mL ve EAA32,8±16,9
mcg s/mL ve günde bir defa 600 mg dozda sırasıyla 2,7 ± 1,6 mcg/mL and 45,6 ± 30,6 mcg s/mL, idi.
Yiyeceklerin etkisi
Açlık koşullarına kıyasla düşük yağlı yiyeceklerin uygulaması venetoklaks maruziyetini yaklaşık 3,4 kat artırırken yüksek yağlı yiyeceklerin uygulaması venetoklaks maruziyetini yaklaşık 5,1 ila 5,3 kat artırır. Venetoklaksın yiyeceklerle birlikte uygulanması önerilir (bkz. Bölüm 4.2).
Dağılım:
Venetoklaks plazmada <0,01 bağlı olmayan fraksiyon ile insan plazma proteinlerine yüksek ölçüde bağlanır ve 1-30 mikromolar (0,87-26 mcg/mL) aralığında bulunur. Ortalama kan/plazma konsantrasyon oranı 0,57'dir. Venetoklaksın hastalarda dağılımın görünür hacmi (Vd/F) için popülasyonu tahmini 256-321 L arasındadır.
Biyotransformasyon:
In vitro çalışmalar venetoklaksın çoğunlukla sitokrom P450 CYP3A4 tarafından metabolize edildiğini göstermiştir. M27, In vitro plazmada tanımlanan BCL-2'ye karşı venetoklakstan en az 58 kat daha düşük inhibe edici etkililiği olan majör bir metabolittir.
In vitro etkileşim çalışmaları
CYP ve UGT substratları ile eşzamanlı uygulama
In vitro çalışmalar venetoklaksın klinik açıdan anlamlı konsantrasyonlarda CYP1A2, CYP2B6, CYP2C19, CYP2D6 veya CYP3A4'ün bir inhibitörü veya indükleyicisi olmadığına işaret etmiştir. Venetoklaks in vitro zayıf bir CYP2C8, CYP2C9 ve UGT1A1 inhibitörüdür fakat klinik açıdan anlamlı inhibisyona neden olması beklenmemektedir. Venetoklaks bir UGT1A4, UGT1A6, UGT1A9 ve UGT2B7 inhibitörü değildir.
Taşıyıcı substratları/inhibitörleri ile eşzamanlı uygulama
Venetoklaks in vitro bir P-gp ve BCRP substratı ve yanı sıra bir P-gp ve BCRP inhibitörüdür ve zayıf bir OATP1B1 inhibitörüdür (bkz. Bölüm 4.5). Venetoklaksın klinik olarak ilgili konsantrasyonlarda OATP1B3, OCT1, OCT2, OAT1, OAT3, MATE1 veya MATE2K'yi inhibe etmesi beklenmemektedir.
Eliminasyon:
Venetoklaksın terminal faz eliminasyon yarı-ömrü için popülasyon tahmini yaklaşık olarak 26 saattir. Venetoklaks 1,30-1,44 birikim oranı ile minimal birikim gösterir. Sağlıklı hastalarda tek bir oral 200 mg radyoaktif işaretli [C] venetoklaks dozu uygulamasından sonra dokuz gün içinde dozun > %99,9'u feçesle ve dozun < % 0,1'i 9 gün içerisinde idrarla atılmıştır. Değişmeden feçesle atılan venetoklaks, uygulanan radyoaktif işaretli dozun %20,8'ini oluşturmaktadır.
Doğrusallık/Doğrusal olmayan durum:
Venetoklaksın farmakokinetiği zamanla değişmez.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Hafif derecede böbrek yetmezliği (CrCl≥60 ve <90 mL/dk) olan 321 hasta, orta derecede böbrek yetmezliği (CrCl≥30 ve <60 mL/dk) olan 219 hasta, şiddetli böbrek yetmezliği (CrCl≥15 ve <30 mL/dak) olan 5 hasta ve normal böbrek fonksiyonuna sahip 224 hastayı (CrCl≥90 mL/dk) içeren bir popülasyonun farmakokinetik analizlerine göre hafif, orta ve şiddetli derecede böbrek yetmezliği bulunan hastalardaki venetoklaks maruziyeti normal böbrek fonksiyonuna sahip olan hastalarınki ile aynıdır. CrCl<15 mL/dk olan hastalar ya da diyaliz hastalarında venetoklaksın farmakokinetiği çalışılmamıştır (bkz. Bölüm 4.2).
Karaciğer yetmezliği:
Hafif derecede karaciğer yetmezliği bulunan 74 hasta orta derecede karaciğer yetmezliği bulunan 7 hasta ve normal karaciğer fonksiyonuna sahip 442 hastayı içeren bir popülasyonun farmakokinetik analizlerine göre hafif ila orta derecede karaciğer yetmezliği bulunan hastalardaki venetoklaks maruziyeti normal karaciğer fonksiyonuna sahip olan hastalardaki ile aynıdır. Hafif derecede karaciğer yetmezliği, normal total bilirubin ve aspartat transaminaz (AST) > üst normal sınır veya total bilirubin
> 1 ila 1,5 kat ULN (normal üst sınır), orta derecede karaciğer yetmezliği total bilirubin >1,5 ila 3 kat ULN ve şiddetli karaciğer yetmezliği total bilirubin >3 ULN olarak tanımlanmıştır.
Karaciğer yetmezliğine ilişkin özel bir çalışmada, 50 mg'lık tek bir venetoklaks dozunun alınmasını takiben, hafif (Child-Pugh A; n=6) veya orta dereceli (Child-Pugh B; n=6) karaciğer yetmezliği olan hastalarda venetoklaks Cve EAA değerleri, karaciğer işlevi normal olan hastalardaki değerler ile
benzer bulunmuştur. Şiddetli (Child-Pugh C; n=5) karaciğer yetmezliği olan gönüllülerde, ortalama venetoklaks Cdeğeri karaciğer işlevi normal olan hastalardaki ile benzerdir, ancak venetoklaks EAA değeri, karaciğer işlevi normal olan hastalarda elde edilen venetoklaks EAA değerinden ortalama 2,7 kat daha yüksektir (aralık: değişiklik yok – 5 kat daha yüksek) (bkz. Bölüm 4.2).
Yaş, cinsiyet ve kilonun etkisi:
Popülasyon farmakokinetik analizine göre yaş, cinsiyet ve kilonun venetoklaks klirensinin üzerinde bir etkisi bulunmamaktadır. Asyalı sağlıklı hastalarda maruz kalma, Asyalı olmayan sağlıklı hastalara kıyasla % 67 daha yüksektir. Bu fark klinik olarak anlamlı kabul edilmez.
5.3. Klinik öncesi güvenlilik verileri
Hayvan çalışmalarında venetoklaks ile gözlemlenen toksisiteler lenfositler ve kırmızı kan hücre kitlesinde doza bağlı azalmalardır. Her iki etki de, venetoklaks dozunun kesilmesinden sonra, tedaviden sonraki 18 haftada ortaya çıkan lenfositlerin geri kazanılmasıyla geri dönüşlü idi. B- ve T-hücrelerinin ikisi de etkilenmiş ancak en anlamlı düşüşler B-hücrelerinde gerçekleşmiştir.
Venetoklaks ayrıca doku bütünlüğünde dağılma veya organ fonksiyon bozukluğuna dair bir bulgu olmaksızın safra kesesi ve ekzokrin pankreas dahil olmak üzere çeşitli dokularda tek hücre nekrozuna neden olmuştur; bu bulguların önemi minimal ila hafif düzeyde idi.
Köpeklerde yaklaşık 3 ay süre ile günlük dozlama sonrasında, venetoklaks kıldaki melanin pigmentinin kaybına bağlı olarak saç tabakasında progresif beyaz diskolorasyona neden olmuştur.
Karsinojenisite/genotoksisite
Venetoklaks ve M27 majör insan metaboliti, 6 aylık transjenik (Tg.rasH2) farelerinde 400 mg/kg/güne kadar oral venetoklaks dozunda ve 250 mg/kg/gün tek M27 dozunda yapılan karsinojenisite çalışmasında karsinojenik değildir. 400 mg/gün dozundaki klinik EAA değerine göre maruziyet marjları (EAA) venetoklaks için yaklaşık 2 kat, M27 için 5,8 kattır.
Venetoklaks bakteriyel mutajenisite testinde, in vitro kromozomal aberasyon testinde ve in vivo fare kemik iliği mikronükleus testinde genotoksik değildi. M27 metaboliti bakteriyel mutajenisite ve kromozomal aberasyon testlerinde genotoksisite için negatif idi.
Üreme toksisitesi
Erkek ve dişi farelerdeki fertilite ve erken embriyonik gelişim çalışmalarında fertilite üzerine hiçbir etki gözlenmemiştir. 400 mg dozda, köpeklerdeki genel toksisite çalışmalarında insan EAA maruziyetinin 0,5 ile 18 katı maruziyetlerde testis toksisitesi (germ hücre kaybı) gözlenmiştir. Bu bulguların geri dönüşlülüğü kanıtlanmamıştır.
400 mg dozda insan EAA maruziyetinin 1,1 katı maruziyetlerde, embriyo-fötal gelişim çalışmalarında, farelerde venetoklaks artmış post-implantasyon kaybı ve azalmış fötal vücut ağırlığı ile ilişkilidir. Majör insan metaboliti olan M27, 400 mg venetoklaks dozundaki insan M27 EAA maruziyetinin yaklaşık 9 katı maruziyet düzeylerinde, implantasyon sonrası kayıp ve rezorpsiyonlarla ilişkilendirilmiştir. Venetoklaks, tavşanlarda maternal toksisiteye yol açmıştır ancak 400 mg dozda insan EAA maruziyetinin 0,1 katı maruziyette fetal toksisite meydana gelmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tablet çekirdeği Kopovidon, K değeri 28
Kolloidal susuz silika (E551) Polisorbat 80 (E433) Sodyum stearil fumarat
Anhidröz kalsiyum hidrojen fosfat (E341 (ii))
Film kaplama
Sarı demir oksit (E172) Polivinil alkol (E1203) Titanyum dioksit (E171) Makrogol 3350 (E1521) Talk (E553b)
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
36 ay
6.4. Saklamaya yönelik özel tedbirler
30°C altındaki oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
VENCLYXTO film kaplı tabletler 1, 2 veya 4 adet film kaplı tablet içeren PVC/PE/PCTFE alüminyum folyo blisterlerde sunulmaktadır.
Her bir karton kutu 7 adet, 14 adet film tablet veya 112 (4x28 tablet) tabletlik çoklu ambalaj.
Tıbbi üründen arta kalan maddelerin imhası
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır.
Yüksek Tansiyon
Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon
atardamarlarınızdaki kanın basıncıdır. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Rahim Boyu ( Serviks ) Kanseri Rahim boynu (serviks) kanseri 35 yaş altı kadınlarda görülen vakalarda meme kanserinden sonra ikinci sırayı alır.Serviks kanserinin gelişmesi yıllarca sürebilir. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
İLAÇ GENEL BİLGİLERİ
AbbVie Tibbi İlaçlar San. Tic. Ltd. Şti.
| Geri Ödeme Kodu | A16950 |
| Satış Fiyatı | 15886.18 TL [ 18 Apr 2025 ] |
| Önceki Satış Fiyatı | 15886.18 TL [ 14 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680656080469 |
| Etkin Madde | Venetoklaks |
| ATC Kodu | L01XX52 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 14 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Hollanda ) ve Beşeri bir ilaçdır. |