VENTACORT 100 mcg aerosol inhaler 1 adet 200 doz Kısa Ürün Bilgisi
{ Salbutamol }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
VENTACORT 100 mcg aerosol inhaler
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her püskürtmede 100 mcg Salbutamol'e eşdeğer 120,5 mcg Salbutamol sülfat içerir.
Yardımcı maddeler
Yardımcı maddeler için Bölüm 6.1'e bakınız
3. FARMASÖTİK FORMU
İnhalasyon için ölçülü dozlu aerosol. Aerosol tüpler halindedir.
İnhalasyon spreyinizi başparmağınız ağızlığın altında, inhalasyon spreyinizin tabanında olacak şekilde dik tutunuz.
Kuru bir bez veya kumaş ile ağızlığın içini ve dışını ve plastik gövdeyi siliniz.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Astımda bronkokonstriksiyonu azaltarak semptom giderici olarak kullanılan rahatlatıcı ilaçlardır. Kontrol edici ilaç olarak kullanılmamalıdırlar.
KOAH'ta semptomları azaltmak için ve rahatlatıcı ilaç olarak kullanılırlar. Düzenli tedavide tercih edilmezler.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresiVENTACORT'un birçok hastada etki süresi 4 - 6 saattir.
Artan betaagonist kullanımı astımın kötüleştiğinin bir işareti olabilir. Bu durumda hastanın tedavi planının yeniden değerlendirilmesi gerekebilir ve beraberinde glukokortikosteroid tedavisi düşünülmelidir.
Aşırı doz ile yan etkiler görülebileceğinden doz veya uygulama sıklığı sadece doktor tavsiyesi ile arttırılabilir.
Akut bronkospazmın rahatlatılmasında:
Yetişkinler: 100 veya 200 mikrogram.
Alerji veya egzersizin indüklediği bronkospazmın önlenmesi:
Yetişkinler: Alerjene maruz kalma veya egzersizin 10-15 dakika öncesinde 200 mikrogram
VENTACORT'un gerektikçe kullanımı günde 4 kezi geçmemelidir. Böyle gerektikçe kullanıma sürekli ihtiyaç duyma veya dozdaki ani artışlar astımın kötüleştiğini gösterir (bkz. Bölüm 4.4).
VENTACORT inhaler semptomlar oluştuğunda rahatlamak için hasta tarafından bilinen, astım krizinin ortaya çıkmasına neden olabilecek koşullarda (ör. egzersiz, kaçınılması mümkün olmayan, alerjene maruz kalma durumlarında) semptomları önleyici olarak kullanılabilir.
Uygulama şekli
VENTACORT inhaler, sadece inhalasyon yoluyla uygulanır.
İnhalasyon sırasında hastalar tercihen oturmalı veya ayakta durmalıdır. İnhalasyon spreyi dik konumda kullanım için tasarlanmıştır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek / Karaciğer yetmezliği:
Veri yoktur.
Pediyatrik popülasyon:
Akut bronkospazmın rahatlatılmasında:
2-12 yaş arasındaki çocuklarda: 100 mikrogram, gerekli olduğunda doz 200 mikrograma çıkarılabilir.
12 yaş ve üzeri çocuklarda: Yetişkin dozu uygulanır.
Alerji veya egzersizin indüklediği bronkospazmın önlenmesi:
2-12 yaş arasındaki çocuklarda: Alerjene maruz kalma veya egzersiz öncesi 100 mikrogram, gerekli olduğunda doz 200 mikrograma çıkarılabilir.
12 yaş ve üzeri çocuklarda: Yetişkin dozu uygulanır.
4 yaşın altındaki çocuklarda kullanım ile ilgili ilave bilgi için âFarmakodinamik özelliklerâ bölümüne bakınız.
5 yaşın altındaki çocuklarda uygulamayı kolaylaştırmak için yüz maskesine sahip bir yetişkin gerekebilir.
Geriyatrik popülasyon:
Veri yoktur.
4.3. Kontrendikasyonlar
VENTACORT bileşimindeki etkin maddeye veya Bölüm 6.1'de listelenen yardımcı maddelerden herhangi birine karşı aşırı duyarlılık hikayesi olan hastalarda kontrendikedir.
İntravenöz olmayan VENTACORT formülasyonları komplike olmayan erken doğum tehdidini gidermek için kullanılmamalıdır. Salbutamol preparatları düşük tehditlerinde kullanılmamalıdır.
4.4. Özel kullanım uyarıları ve önlemleri
Astımın tedavisinde basamaklı tedavi programı takip edilmeli ve hastanın cevabı klinik olarak
ve akciğer fonksiyon testleri ile gözlenmelidir.
Semptomları kontrol için kısa etkili betaagonist kullanımının artışı astım kontrolünün kötüleştiğini gösterir. Bu durumda hastanın tedavi planı yeniden değerlendirilmelidir.
Bronkodilatörler şiddetli veya stabil olmayan astımı olan hastalarda tek veya asıl tedavi olmamalıdır. Şiddetli astım, hastaların ağır atak geçirme hatta ölüm riski taşımaları nedeniyle akciğer fonksiyon testleri dahil olmak üzere düzenli tıbbi değerlendirme gerektirir. Hekimler bu hastalarda tavsiye edilen maksimum inhale kortikosteroid ve/veya oral kortikosteroid tedavisi dozunu kullanmayı düşünmelidir.
Astım kontrolündeki ani ve ilerleyici kötüleşme potansiyel olarak yaşamı tehdit edicidir ve kortikosteroid tedavisine başlanılması veya dozunun arttırılması düşünülmelidir. Risk altındaki hastalarda günlük doruk akım (peak flow) kontrollerine başlanabilir.
VENTACORT tirotoksikozlu hastalara dikkatle uygulanmalıdır.
Başlıca parenteral ve nebülize uygulamalar olmak üzere betaagonist tedavisi sonucu
potansiyel olarak ciddi hipokalemi gelişebilir.
Akut şiddetli astımda bu etki beraberinde ksantin türevleri, steroidler, diüretik kullanımı ve hipoksi nedeniyle şiddetlenebileceğinden özel dikkat gösterilmelidir. Bu gibi durumlarda serum potasyum düzeylerinin gözlenmesi önerilir.
Diğer inhalasyon tedavilerinde olduğu gibi inhalasyonu takiben hemen hırıltılı solunumda artış ile paradoksal bronkospazm görülebilir. Bu durum alternatif bir sunum şekli veya farklı bir hızlı etkili bronkodilatör ile tedavi edilmelidir. VENTACORT hemen kesilmeli, hasta
değerlendirilmeli, gerekirse sürekli tedavi için farklı bir hızlı etkili bronkodilatör kullanılmalıdır.
Dozaj veya uygulama sıklığı sadece doktor tavsiyesi ile artırılmalıdır.
İnhale VENTACORT'un daha önce kullanılan etkili dozları ile en az üç saat rahatlama sağlanmadığı takdirde hasta gerekli ilave önlemleri almak için doktora danışmalıdır.
İlacın akciğerlere optimum düzeyde ulaşması için hastanın inhalasyon tekniği kontrol edilerek
nefes alma ile aerosol uygulamasının senkronizasyonuna dikkat edilmelidir.
Salbutamol dahil sempatomimetik ilaçların kullanımıyla kardiyovasküler etkiler görülebilir. Salbutamol ile ilişkili olarak, miyokard iskemisinin nadir oluşumuna dair pazarlama sonrası veriler ve yayınlanmış literatürler bulunmaktadır. Şiddetli kalp hastalığı (örneğin iskemik kalp hastalığı, aritmi veya şiddetli kalp krizi) olan hastalar salbutamol aldıklarında; göğüslerinde ağrı veya kalp hastalığının kötüleştiğine dair belirtiler olduğunda tıbbi yardım almaları gerektiği konusunda uyarılmalıdır. Dispne ve göğüs ağrısı gibi belirtiler hem respiratuvar hem de kardiyak orjinli olabileceğinden bu belirtiler değerlendirilirken dikkatli olunmalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
VENTACORT ve propranolol gibi selektif olmayan beta blokör ilaçlar genellikle beraber verilmemelidir.
VENTACORT, monoamin oksidaz inhibitörleri (MAOI) ile tedavi edilen hastalarda kontrendike değildir.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlarda ve doğum kontrolü (kontrasepsiyon) uygulayanlarda kullanımına ilişkin herhangi bir veri yoktur.
Gebelik dönemi
İlaç kullanımı ancak anneye sağlaması beklenen yararı fetusa olan olası bir riskten fazla ise düşünülmelidir. Kesin gerekli olmadıkça hamilelik sırasında kullanılmamalıdır.
Hayvanlar üzerinde yapılan çalışmalar üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). Gebe kadınlarda güvenlilik belirlenmemiştir. Gebe kadınlarda salbutamol ile kontrollü klinik çalışmalar yapılmamıştır.
Dünya genelindeki pazarlama deneyimleri süresince,salbutamol ile tedavi edilen hastaların bebeklerinde yarık damak ve kol/bacak defektleri ve kardiyak anomaliler dahil çeşitli anomaliler bildirilmiştir. Bu defekt oluşumlarında istikrar görülmemiştir ve kongenital anomaliler için bazal oran %2-3'tür, salbutamol kullanımı ile aralarında bir bağlantı kurulamamıştır. Bazı anneler gebelikleri boyunca çoklu ilaç kullanmıştır. İlaç kesin gerekli olmadıkça gebelik sırasında kullanılmamalıdır.
Laktasyon dönemi
Salbutamol muhtemelen anne sütüne geçmektedir ve anne sütündeki salbutamolün yenidoğana zararlı bir etkisinin olup olmadığı bilinmemektedir, bu nedenle beklenen yararları herhangi bir potansiyel riskini dengelemedikçe emziren annelerde kullanımı tavsiye edilmez.
Üreme yeteneği/Fertilite
Salbutamol'ün insan fertilitesi üzerindeki etkilerine ilişkin bilgi bulunmamaktadır.
Hayvanlardaki fertilite üzerinde istenmeyen bir etkisi bulunmamaktadır (bkz. Bölüm 5.3)
4.7. Araç ve makine kullanımı üzerindeki etkiler
Veri yoktur.
4.8. İstenmeyen etkiler
Aşağıdaki advers etkiler organ sistemi sınıflandırması ve sıklığa göre verilmiştir. Sıklık sınıflandırması:
Çok yaygın ≥1/10 Yaygın ≥1/100 ve <1/10
Yaygın olmayan ≥1000 ve <1/100 Seyrek ≥1/10.000 ve <1/1000 Çok seyrek ≤ 1/10.000
Bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Çok yaygın ve yaygın olaylar genellikle klinik çalışma verilerinden belirlenmiştir. Seyrek ve çok seyrek ve bilinmeyen olaylar genellikle spontan verilere dayanmaktadır.
Bağışıklık sistemi hastalıkları
Çok seyrek: Anjiyoödem, ürtiker, bronkospazm, hipotansiyon ve kollaps dahil aşırı duyarlılık reaksiyonları
Metabolizma ve beslenme hastalıkları
Seyrek: Hipokalemi
Beta agonist tedavisi ile potansiyel olarak ciddi hipokalemiye neden olabilir.
Sinir sistemi hastalıkları
Yaygın: Titreme, baş ağrısı
Çok seyrek: Hiperaktivite
Kardiyak hastalıklar
Yaygın: Taşikardi Yaygın olmayan: Çarpıntı
Çok seyrek: Atrial fibrilasyon, supraventriküler taşikardi ve ekstrasistoller dahil
kardiyak aritmiler
Bilinmiyor: Miyokard iskemisi* (bkz. Özel kullanım uyarıları ve önlemleri)
* Pazarlama sonrası verilerde spontan olarak bildirilmiştir, bu nedenle sıklığı bilinmemektedir.
Vasküler hastalıkları
Seyrek: Periferal vazodilatasyon
Solunum, göğüs bozuklukları ve mediastinal hastalıkları
Çok seyrek: Paradoksal bronkospazm
Gastrointestinal hastalıklar
Yaygın olmayan: Ağızda ve boğazda iritasyon
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları
Yaygın olmayan: Kas krampları Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine
olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirilmesi gerekmektedir (www.titck.gov.tr; e-posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Salbutamol doz aşımında gözlenen en yaygın bulgu ve belirtiler farmakolojik olarak geçici betaagonist aktivitenin aracılık ettiği taşikardi, tremor, hiperaktivite ve hipokalemiyi de içeren metabolik etkilerdir (bkz. Bölüm 4.4 ve Bölüm 4.8).
VENTACORT aşırı dozunu takiben hipokalemi oluşabilir. Serum potasyum düzeyleri gözlenmelidir.
Hem yüksek terapötik dozlarla hem de kısa etkili beta-agonist tedavisinin doz aşımıyla ilişkili olarak laktik asidoz bildirildiğinden; doz aşımı halinde (özellikle de hışıltılı solunum gibi diğer bronkospazm bulgularının düzelmesine rağmen devam eden ya da kötüleşen taşipne varsa) yükselmiş serum laktat düzeylerinin ve buna bağlı olarak gelişebilecek metabolik asidozun takibi önerilebilir.
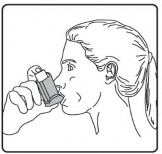
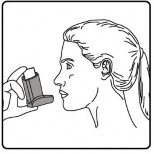
Ağızlığı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıca kapatınız.
Ağızlık kapağını doğru bir şekilde yerleştiriniz. Kapağı yerleştirmek için çok fazla güç uygulamayınız.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Selektif betaadrenerjik reseptör agonistleri ATC kodu: R03AC02
Etki mekanizması:
Salbutamol, selektif betaadrenoreseptör agonistidir. Terapötik dozlarda bronş düz kaslarındaki betaadrenoreseptörler üzerine etkilidir.
Farmakodinamik etkiler:
Salbutamol, bir selektif betaadrenoreseptör agonistidir. Terapötik dozlarda, reversibl havayolu obstrüksiyonunda hızlı etki ile (5 dakika içinde) birlikte kısa etkili (4 ila 6 saat) bronkodilasyon sağlayarak bronş kasındaki betaadrenoreseptörler üzerine etki eder.
Özel hasta popülasyonları
4 yaşın altındaki çocuklar:
Reversibl obstruktif havayolu hastalığı ile ilişkili bronkospazmı olan 4 yaşın altındaki hastalarda önerilen dozlarda yapılmış pediyatrik klinik çalışmalar (SB020001, SB030001,
SB030002), salbutamol inhaler'in 4 yaş ve üstü çocuklar, adölesanlar ve yetişkinlerdekine kıyasla, bu hasta grubunda da benzer bir güvenlik profiline sahip olduğunu göstermektedir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim
İnhale yoldan uygulamayı takiben dozun %10-20'si alt hava yollarına ulaşır. Geri kalanı ilaç uygulama sisteminde veya orofarinkste birikir ve buradan yutulur. Havayollarında biriken kısım pulmoner dokulara ve dolaşıma absorbe olur, fakat akciğerde metabolize olmaz.
Dağılım
Salbutamol plazma proteinlerine %10 oranında bağlanır.
Biyotransformasyon
Sistemik dolaşıma ulaştığında karaciğerde metabolize olur ve başlıca idrarla değişmemiş ilaç ve fenolik sülfat şeklinde atılır.
İnhale dozun yutulan kısmı gastrointestinal kanaldan emilir ve önemli ölçüde ilk geçiş metabolizmasına uğrayarak fenolik sülfata dönüşür. Değişmemiş ilaç ve konjugatı başlıca idrar ile atılır.
Eliminasyon
Salbutamol, intravenöz olarak uygulandığında yarılanma ömrü 4-6 saattir ve kısmen böbrekler yolu ile ve kısmen de başlıca idrarla atılan inaktif 4'-O-sülfata (fenolik sülfat) metabolize olarak temizlenir. Feçes atılımda minör yoldur. İntravenöz, oral veya inhalasyon ile verilen salbutamolün büyük kısmı 72 saat içinde atılır.
Hastalardaki karakteristik özellikler
Veri yoktur.
5.3. Klinik öncesi güvenlilik verileri
Diğer güçlü selektif betareseptör agonistleri gibi salbutamolün de subkütan yolla uygulandığında farelerde teratojenik olduğu gösterilmiştir. Reprodüktif bir çalışmada maksimum oral insan dozunun 4 katı olan 2,5 mg/kg dozunda verildiğinde fetusların
%9,3'ünde yarık damak tespit edilmiştir. Sıçanlarda gebelik boyunca oral yolla yapılan 0,5 , 2.32, 10,75 ve 50 mg/kg/gün'lük uygulama fetusta belirgin anormallik oluşturmamıştır. Tek toksik etki, en yüksek doz seviyelerinde görülen neonatal ölümlerdir, bu da annenin
bakımındaki azalmadan kaynaklanır. Tavşanlar üzerinde yapılan üreme çalışmalarında 50 mg/kg/gün dozda (maksimum oral insan dozundan çok daha yüksek) uygulandığında fetuslarda tedavi ile ilgili değişiklikler görülmüştür; bu değişiklikler doğuştan göz kapağı yokluğu (ablefari), sekonder damak yarıkları (palatoşizis), kafatasının ön kemiklerinde kemikleşmede değişiklikler (kraniyoşizis) ve ekstremite fleksürü olmuştur. Salbutamol'ün yeniden formüle edilmesi, salbutamolün bilinen toksikolojik profilini değiştirmemiştir. Tavşanlar üzerinde yapılan reprodüktif çalışmada maksimum oral insan dozunun 78 katı olan 50 mg/kg/gün uygulandığında fetusların %37'sinde kraniyal malformasyon oluşmuştur.
Bir oral fertilite ve genel reprodüktif performans çalışmasında, sıçanlarda, 2 ve 50 mg/kg/gün dozlarında, 50 mg/kg/gün dozda doğum sonrasında 21. günde hayatta olan sütten kesilmiş hayvanların sayısındaki bir azalma hariç, fertilite, embriyofetal gelişim, yavru boyutu, doğum ağırlığı veya gelişim hızı üzerine bir yan etkisi bulunmamıştır.
HFA134a'nın 2 yıl boyunca günlük olarak maruz kalan çok çeşitli hayvan türlerinde, çok yüksek buhar konsantrasyonlarında, hastalar tarafından yaşanması muhtemel olandan çok daha fazla, toksik olmadığı gösterilmiştir.
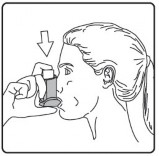
Ağzınızdan yavaş ve derin nefes alınız ve aynı anda bir puf doz boşaltmak için inhalasyon spreyinizin üst kısmına basınız.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Oleik asit
Etanol (susuz) Hidrofloroalkan (HFA) 134a
6.2. Geçimsizlikler
Bilinen bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
24 ay
6.4. Saklamaya yönelik özel tedbirler
25°C'nin altındaki oda sıcaklığında saklanmalıdır. Donmaktan ve direkt güneş ışığından korunmalıdır.
Kullanılmadığı zaman ağızlık kapağı sıkıca kapatılmalıdır.
Diğer inhale ilaçların çoğunda olduğu gibi aerosol tüpü fazla soğuk olduğunda ilacın terapötik etkisi azalabilir.
Aeresol tüpü boş olsa bile kırılmamalı, ezilmemeli veya yakılmamalıdır.
6.5. Ambalajın niteliği ve içeriği
VENTACORT 100 mcg Aerosol İnhaler, karton kutuda 1 adet bir toz kapağı donanımlı plastik püskürtücü (aktivatör) içine yerleştirilmiş 200 dozluk ölçme valfli alüminyum tüp ve kullanma talimatı ile birlikte sunulmaktadır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj Atıklarının Kontrolü Yönetmelik" lerine uygun olarak imha edilmelidir.İnhalasyon spreyinin kullanım talimatı
İnhalasyon spreyinin test edilmesi:
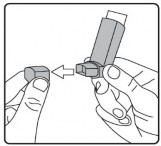
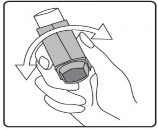
İlk kez kullanımdan önce hastalar ağızlık kapağını, kapağın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon spreyini iyi bir şekilde sallamalı, başparmak ağızlığın altında inhalasyon spreyinin tabanında olacak şekilde parmaklar ve başparmak arasında tutulmalı ve boşluğa sıkım yapmalıdır. İnhalasyon spreyi her sıkımdan önce sallanmalıdır.
İnhalasyon spreyi bir hafta veya daha uzun süre kullanılmadığında hastalar ağızlık kapağını çıkarmalı, inhalasyon spreyi ile boşluğa iki kez sıkım yapılmalıdır.
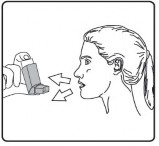
İnhalasyon spreyinizi kullanacağınız zaman oturunuz veya ayakta dik durunuz.
İlk resimde gösterildiği gibi ağızlık kapağını çıkarınız. Ağızlığın temiz olduğundan emin olmak için içini ve dışını kontrol ediniz.
Nefesinizi birkaç saniye veya rahatça tutabildiğiniz kadar tutunuz ve ağızlığı ağzınızdan çıkarıp parmağınızı inhalasyon spreyinizin üst kısmından çekiniz.
 Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir.
Omurilik zedelenmeleri
Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| ASTOSAL | 8699651521303 | 113.62TL |
| BERAST | 8699591570669 | 83.71TL |
| BRECUR | 8697929521659 | |
| RONKOTOL | 8699844521042 | 113.62TL |
| SALBULİN | 8699617520111 | |
| Diğer Eşdeğer İlaçlar |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Mesane Kanseri Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve hücre içindeki karsinom olarak nitelendirilir. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ GENEL BİLGİLERİ
World Medicine İlaç San. ve Tic. Ltd.Şti
| Geri Ödeme Kodu | A17098 |
| Satış Fiyatı | 594.43 TL [ 1 Dec 2025 ] |
| Önceki Satış Fiyatı | 594.43 TL [ 24 Nov 2025 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8680199522501 |
| Etkin Madde | Salbutamol |
| Yerli ve Beşeri bir ilaçdır. |