VERXANT 150 mg SC enjeksiyon için liyofilize toz içeren 1 flakon Kısa Ürün Bilgisi
{ Sekukinumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
VERXANT 150 mg SC enjeksiyon için liyofilize toz içeren flakon Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Secukinumab 150 mg
Secukinumab ; Çin Hamster Over (CHO) hücrelerinde üretilen bir rekombinant, tamamen
insan monoklonal antikordur.
Yardımcı maddeler
Sukroz 92,43 mg
Yardımcı maddelerin tam listesi için bölüm 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti için toz Toz beyaz, katı liyofilizattır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Plak psoriasis
VERXANT, siklosporin, metotreksat veya PUVA gibi geleneksel sistemik tedavilere yanıt vermeyen, tolere edemeyen ya da bu tür tedavilerin kontrendike olduğu erişkin hastalarda orta veya şiddetli derecede seyreden plak psoriasis tedavisinde endikedir.
Psoriatik artrit
VERXANT tek başına ya da metotreksat (MTX) ile kombinasyon halinde, önceki hastalığı modifiye edici anti-romatizmal ilaç (DMARD) tedavisine yanıtın yetersiz olduğu durumlarda aktif psoriatik artritli erişkin hastaların tedavisinde endikedir (bkz. Bölüm 5.1).
Aksiyal spondiloartrit (axSpA)
Ankilozan spondilit (AS, radyografik kanıtı olan aksiyal spondiloartrit)
VERXANT erişkinlerde konvansiyonel tedaviye yetersiz yanıt veren aktif ankilozan spondilitin tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
VERXANT endike olduğu durumların tanı ve tedavisinde deneyimli bir hekimin rehberliği ve
gözetimi altında kullanılmalıdır.
Pozoloji:
Plak psoriasis
Önerilen doz subkutan enjeksiyon yoluyla 300 mg secukinumab olup başlangıç dozları hafta 0, 1, 2, 3 ve 4'te uygulanır ve bunu aylık idame dozları takip eder. Her 300 mg doz, 150 mg'lık iki subkutan enjeksiyon halinde verilir.
Bazı hastalarda 150 mg da kullanılabilir.
Psoriatik artrit
Eşzamanlı orta ila şiddetli plak psoriasisi olan ya da anti-TNFα tedavisine yetersiz yanıt veren hastalarda (IR) önerilen doz subkutan enjeksiyon ile 300 mg olup başlangıç dozları hafta 0, 1, 2, 3 ve 4'te uygulanır ve bunu aylık idame dozları takip eder. Her bir 300 mg'lık doz, 150 mg'lık iki subkutan enjeksiyon şeklinde yapılır.
Diğer hastalarda önerilen doz subkutan enjeksiyon ile 150 mg olup başlangıç dozları hafta 0, 1, 2, 3 ve 4'te uygulanır ve bunu aylık idame dozları takip eder. Klinik yanıta göre doz 300 mg'a yükseltilebilir.
Aksiyal spondiloartrit (axSpA)
Ankilozan spondilit (AS, radyografik kanıtı olan aksiyal spondiloartrit)
Önerilen doz subkutan enjeksiyon ile 150 mg olup başlangıç dozları hafta 0, 1, 2, 3 ve 4'te uygulanır ve bunu aylık idame dozları takip eder. Hastalarda yanıtın yetersiz olduğu durumlarda (aktif ankilozan spondiliti devam eden hastalarda), doz 300 mg'a yükseltilebilir. Her bir 300 mg'lık doz, 150 mg'lık iki subkutan enjeksiyon şeklinde yapılır.
4.3. Kontrendikasyonlar
Etkin madde
Klinik olarak önemli, aktif enfeksiyonu olan hastalarda kontrendikedir (örn. aktif tüberküloz;
bkz. Bölüm 4.4).
4.4. Özel kullanım uyarıları ve önlemleri
Enfeksiyonlar
Secukinumab, enfeksiyon riskini artırma potansiyeline sahiptir. Pazarlama sonrası dönemde secukinumab alan hastalarda ciddi enfeksiyonlar gözlenmiştir. Kronik enfeksiyonu ya da tekrarlayan enfeksiyon öyküsü olan hastalarda secukinumab kullanımı planlanırken dikkatli olunmalıdır.
Enfeksiyona işaret edebilecek belirti ve semptomların ortaya çıkması durumunda hastalara tıbbi öneri almaları talimatı verilmelidir. Eğer hastada ciddi enfeksiyon gelişirse, yakından takip edilmelidir ve enfeksiyon düzelene kadar secukinumab uygulanmamalıdır.
Klinik çalışmalarda, secukinumab alan hastalarda enfeksiyonlar gözlenmiştir (bkz. Bölüm 4.8). Bunların çoğu nazofarenjit gibi hafif ila orta dereceli üst solunum yolu enfeksiyonları olmuştur ve tedavinin sonlandırılmasını gerektirmemiştir.
Secukinumab'ın etki mekanizması ile ilişkili olarak ciddi olmayan mukokutanöz kandida enfeksiyonları, psoriasis klinik çalışmalarında plasebo ile karşılaştırıldığında secukinumab için daha sık bildirilmiştir (secukinumab 300 mg için 3.55/100 hasta yılı karşısında plasebo için 1.00/100 hasta yılı) (bkz. Bölüm 4.8).
Klinik çalışmalardan, tüberküloza artmış duyarlılık bildirilmemiştir. Yine de, aktif tüberkülozu olan hastalara secukinumab verilmemelidir. Latent tüberkülozu olan hastalarda secukinumab tedavisine başlanmadan önce anti-tüberküloz tedavisi düşünülmelidir.
Enflamatuar bağırsak hastalığı (Crohn hastalığı ve ülseratif kolit dahil)
Secukinumab ile yeni bağırsak hastalığı vakaları ya da alevlenmeler bildirilmiştir (bkz. bölüm 4.8). Secukinumab, enflamatuar bağırsak hastalığı olan hastalarda önerilmemektedir. Eğer bir hasta enflamatuar bağırsak hastalığı işaret ve semptomları geliştirirse ya da daha önceden var olan enflamatuar bağırsak hastalığında bir alevlenme yaşarsa, secukinumab bırakılmalı ve uygun tıbbi tedavi başlatılmalıdır.
Aşırı duyarlılık reaksiyonları
Klinik çalışmalarda, secukinumab alan hastalarda nadir anafilaktik reaksiyon vakaları gözlenmiştir. Anafilaktik ya da başka bir ciddi alerjik reaksiyon ortaya çıkarsa, secukinumab uygulaması derhal durdurulmalı ve uygun tedavi başlatılmalıdır.
Aşılar
Canlı aşılar, secukinumab ile bir arada uygulanmamalıdır.
Secukinumab alan hastalar eşzamanlı olarak inaktif ya da canlı olmayan aşılar alabilir. Bir çalışmada, meningokok ve inaktif grip aşılamalarından sonra, 150 mg secukinumab uygulanan sağlıklı gönüllülerin, plasebo ile tedavi edilenlerle benzer bir oranı meningokok ve grip aşılarına antikor titrelerinde en az 4 katlık artışlar ile yeterli immün yanıtı verebilmiştir. Bu veriler, secukinumab'ın meningokok ve grip aşılarına humoral immün yanıtı baskılamadığına işaret etmektedir.
Eşzamanlı immün sistemi baskılayıcı tedavi
Psoriasis çalışmalarında, secukinumab'ın biyolojik ajanlar veya fototerapi dahil olmak üzere immün sistemi baskılayıcı tedaviler ile kombinasyon halinde uygulanması değerlendirilmemiştir. Secukinumab, artrit çalışmalarında (psoriatik artrit ve ankilozan spondiliti olan hastalarda yapılanlar dahil) metotreksat (MTX), sülfasalazin ve/veya kortikosteroidlerle eşzamanlı olarak uygulanmıştır. Diğer immünosüpresanlarla secukinumabın eşzamanlı kullanımı düşünüldüğünde dikkatli olunmalıdır. (ayrıca bkz. Bölüm 4.5).
Takip edilebilirlik
Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Canlı aşılar, secukinumab ile eşzamanlı uygulanmamalıdır (ayrıca bkz. Bölüm 4.4).
Plak psoriyasisi olan gönüllüler üzerinde gerçekleştirilen bir çalışmada, secukinumab ve
midazolam (CYP3A4 substratı) arasında etkileşim gözlenmemiştir.
Artrit çalışmalarında secukinumab, metotreksat (MTX) ve/veya kortikosteroidler ile eşzamanlı uygulandığında herhangi bir etkileşim görülmemiştir (psoriatik artrit ve aksiyal spondiloartrit hastaları da dahil).
4.6. Gebelik ve laktasyon
Gebelik kategorisi C'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeli bulunan kadınlar tedavi boyunca ve tedaviden sonra en az 20 hafta süreyle etkili bir doğum kontrol yöntemi kullanmalıdır.
Gebelik dönemi
Gebe kadınlarda secukinumab kullanımı ile ilgili yeterli veri mevcut değildir. Hayvan çalışmaları gebelik, embriyonik/fetal gelişim, doğum ve doğum sonrası gelişim üzerinde dolaylı ya da doğrudan zararlı etkiler göstermemektedir (bkz. Bölüm 5.3). Tedbir olarak gebelikte VERXANT kullanımından kaçınılması tercih edilir.
Laktasyon dönemi
Secukinumabın insan sütü ile atılıp atılmadığı bilinmemektedir. İmmünoglobulinler insan sütü ile atılır ve secukinumabın alındıktan sonra sistemik olarak emilip emilmediği bilinmemektedir. Emzirilen bebeklerde secukinumab kaynaklı advers reaksiyonlar potansiyeli nedeniyle, emzirmenin bebek için faydaları ve VERXANT tedavisinin anne için faydaları göz önünde bulundurularak, tedavi süresince ve tedaviden sonra 20 haftaya kadar süreyle emzirmenin durdurulup durdurulmayacağına veya VERXANT tedavisinin durdurulup durdurulmayacağına karar verilmelidir.
Üreme yeteneği/Fertilite
Secukinumabın insan fertilitesi üzerindeki etkisi değerlendirilmemiştir. Hayvan çalışmaları, fertilite açısından doğrudan veya dolaylı zararlı etkiler göstermemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
VERXANT'ın araç ve makine kullanımı üzerinde etkisi yoktur veya göz ardı edilebilir etkileri vardır.
4.8. İstenmeyen etkiler
Güvenlilik profilinin özetiEn sık bildirilen advers ilaç reaksiyonları (ADR'ler) üst solunum yolu enfeksiyonları (en sık olarak nazofarenjit, rinit) olmuştur.
Advers reaksiyonların tablo halinde listesi
Klinik çalışmalarda ve pazarlama sonrası raporlarda tespit edilen advers ilaç reaksiyonları (Tablo 1) MedDRA sistem organ sınıfına göre listelenmektedir. Her bir sistem organ sınıfı içinde ADR'ler sıklığa göre sıralanmakta olup en sık reaksiyonlar başta listelenmektedir. Her bir sıklık grubu dahilinde advers ilaç reaksiyonları, azalan ciddilik derecesine göre gösterilmektedir. Ayrıca, her bir advers ilaç reaksiyonunun karşılık geldiği sıklık kategorisi, aşağıdaki sisteme göredir:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Çeşitli endikasyonlara (plak psoriasis, psoriatik artrit, aksiyal spondiloartrit ve diğer otoimmün hastalıklar) yönelik toplam 30.565 hasta yılı maruziyete karşılık gelen kör ve açık etiketli klinik çalışmalarda, 18.000'den fazla hasta secukinumab ile tedavi edilmiştir. Bu
hastaların 11.700'den fazlası en az bir yıl süreyle secukinumab'a maruz kalmıştır. Secukinumabın güvenlilik profili tüm endikasyonlarda tutarlıdır.
Tablo 1: Klinik çalışmalarda ve pazarlama sonrası deneyimde advers
reaksiyonların listesi
Sistem organ sınıfı | Sıklık | Advers reaksiyon |
Enfeksiyonlar ve enfestasyonlar | Çok yaygın | Üst solunum yolu enfeksiyonları |
Yaygın | Oral herpes | |
Tinea pedis | ||
Yaygın olmayan | Oral kandidiyazis | |
Otitis externa | ||
Alt solunum yolu enfeksiyonları | ||
Bilinmiyor | Mukozal ve kütanöz kandidiyazis (özofageal kandidiyazis dahil) | |
Kan ve lenf sistemi hastalıkları | Yaygın olmayan | Nötropeni |
Bağışıklık sistemi hastalıkları | Seyrek | Anafilaktik reaksiyonlar |
Sinir sistemi hastalıkları | Yaygın | Baş ağrısı |
Göz hastalıkları | Yaygın olmayan | Konjunktivit |
Solunum, göğüs hastalıkları ve mediastinal hastalıklar | Yaygın | Rinore |
Gastrointestinal hastalıklar | Yaygın | Diyare |
Bulantı | ||
Yaygın olmayan | Enflamatuar bağırsak hastalığı | |
Deri ve deri altı doku hastalıkları | Yaygın olmayan | Ürtiker |
Seyrek | Eksfoliyatif dermatit | |
Genel bozukluklar ve uygulama yeri rahatsızlıkları | Yaygın | Yorgunluk |
Seçilen advers reaksiyonların tanımı
Enfeksiyonlar
Plak psoriasis klinik çalışmalarının plasebo kontrollü döneminde (12 hafta süreyle toplam 1382 hastaya secukinumab ve 694 hastaya plasebo uygulanmıştır) secukinumab ile tedavi edilen hastaların %28,7'sinde enfeksiyonlar bildirilirken aynı oran plasebo uygulanan hastalarda %18,9 olmuştur. Enfeksiyonların çoğu nazofarenjit gibi hafif ila orta dereceli üst solunum yolu enfeksiyonları olmuştur ve tedavinin sonlandırılmasını gerektirmemiştir. Etki mekanizması ile uyumlu olarak mukozal veya kutanöz kandidiyazda artış olmuştur ancak bu olgular hafif ila orta şiddetlidir, ciddi boyutta değildir ve standart tedaviye yanıt vermiş, tedavinin kesilmesini gerektirmemiştir. Ciddi enfeksiyonlar, secukinumab uygulanan
hastaların %0,14'ünde ve plasebo uygulanan hastaların %0,3'ünde görülmüştür (bkz. Bölüm 4.4).
Çalışma döneminin tamamında (hastaların büyük çoğunluğu için 52 hafta süreyle toplamda 3.430 hastaya secukinumab uygulanmıştır), secukinumab ile tedavi edilen hastaların
%47,5'inde enfeksiyonlar bildirilmiştir (hasta yılı başına 0,9'luk izlem). secukinumab uygulanan hastaların %1,2'sinde ciddi enfeksiyonlar bildirilmiştir (hasta yılı başına 0,015 izlem).
Psoriatik artrit ve aksiyal spondiloartrit (ankilozan spondilit ve radyografik kanıtı olmayan aksiyal spondiloartrit) klinik çalışmalarında gözlenen enfeksiyon oranı, psoriasis çalışmalarında gözlenenler ile benzerdir.
Nötropeni
Psoriasis faz III klinik çalışmalarında, nötropeni, plaseboya kıyasla secukinumab ile daha sık gözlenmiştir fakat olguların çoğu hafif, geçici ve geri dönüşlü olmuştur. <l,0-0,5x10/l (CTCAE Derece 3) nötropeni, secukinumab tedavisindeki 3.430 hastanın 18'inde (%0,5) bildirilmiş olup 18 olgunun 15'inde doza bağımlılık veya enfeksiyonlar ile zamansal ilişki söz konusu olmamıştır. Bildirilmiş herhangi bir şiddetli nötropeni vakası bulunmamaktadır. Diğer üç olguda standart tedaviye normal yanıt veren ve secukinumab tedavisinin kesilmesini gerektirmeyen, ciddi olmayan enfeksiyonlar bildirilmiştir.
Psoriatik artrit ve aksiyal spondiloartrit (ankilozan spondilit ve radyografik kanıtı olmayan aksiyal spondiloartrit)teki nötropeni sıklığı, psoriasisteki ile benzerdir.
Seyrek nötropeni <0,5x10/l (CTCAE Derece 4) olguları bildirilmiştir.
Aşırı duyarlılık reaksiyonları
Secukinumab'la yapılan klinik çalışmalarda, ürtiker ve nadir olarak anaflaktik reaksiyon vakaları gözlenmiştir (ayrıca bkz. Bölüm 4.4).
İmmünojenisite
Psoriasis, psoriatik artrit ve aksiyal spondiloartrit (ankilozan spondilit ve radyografik kanıtı olmayan aksiyal spondiloartrit) klinik çalışmalarında secukinumab ile tedavi edilen hastaların
%1'inden azı, 52 haftaya kadarki tedavide secukinumaba antikorlar geliştirmiştir. Tedavi kaynaklı anti-ilaç antikorlarının yaklaşık yarısı nötralizan olmuştur ancak bu durum, etkililik kaybı ya da farmakokinetik anormallikler ile ilişkilendirilmemiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99)
4.9. Doz aşımı ve tedavisi
Klinik çalışmalarda, 30 mg/kg'a kadarki dozlar (yaklaşık 2000 ila 3000 mg), doz sınırlayıcı toksisite olmaksızın intravenöz yolla uygulanmıştır. Doz aşımı durumunda hastanın advers
reaksiyonlara dair belirti ve işaretler açısından izlenmesi ve derhal uygun semptomatik tedavinin başlatılması önerilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: İmmün sistemi baskılayıcı ajanlar, interlökin inhibitörleri ATC kodu: L04AC10
Etki mekanizması:
Secukinumab; proenflamatuvar sitokin interlökin-17A'ya (IL-17A) selektif olarak bağlanan ve nötrleştiren IgG1/κ yapısında olan tamamen insan monoklonal antikorudur. Secukinumab, IL-17A'yı hedef alır ve IL-17A'nın keratinositler dahil çeşitli hücre tiplerinde eksprese olan IL-17 reseptörü ile etkileşimini inhibe ederek etki gösterir. Bunun sonucu olarak secukinumab; proenflamatuvar sitokinlerin, kemokinlerin ve doku hasarı aracılarının salıverilmesini inhibe eder ve otoimmün ve enflamatuvar hastalıklarda IL-17 aracılı etkileri azaltır. Klinik açıdan anlamlı sonuç elde edilecek düzeylerde secukinumab deriye ulaşır ve lokal enflamatuvar belirteçleri azaltır. Bunun doğrudan sonucu olarak secukinumab tedavisi, plak psoriasis lezyonlarındaki eritemi, indurasyonu ve deskuamasyonu azaltır.
IL-17A; normal enflamatuvar ve immün yanıtlarında rol oynayan doğal bir sitokindir. IL-17A, plak psoriasis, psoriatik artrit ve aksiyal spondiloartrit (ankilozan spondilit ve radyografik kanıtı olmayan aksiyal spondiloartrit) patojenezinde önemli bir role sahiptir ve plak psoriasis hastalarının lezyonlu olmayan derileri ile karşılaştırıldığında lezyonlu derilerinde ve psoriatik artrit hastalarının sinoviyal dokusunda artmış düzeydedir. IL-17 üreten hücrelerin sıklığı da ankilozan spondilit hastalarından alınan faset eklemlerinin subkondral kemik iliğinde anlamlı düzeyde daha yüksek olmuştur. Radyografik kanıtı olmayan aksiyal spondiloartritli hastalarda artmış sayıda IL-17A üreten lenfosit de bulunmuştur. IL-17A'nın inhibisyonunun ankilozan spondilit tedavisinde etkili olduğu gösterilerek bu sitokinin aksiyal spondiloartritte anahtar rolü olduğu netleştirilmiştir.
Farmakodinamik etkiler:
Secukinumab alan hastalarda 2 ila 7 gün içinde, toplam IL-17A (serbest ve secukinumaba bağlı IL-17A) serum düzeyleri ilk olarak, secukinumaba bağlı IL-17A'nın azalmış klirensi nedeniyle artarak secukinumabın, plak psoriasis patojenezinde kilit bir rol oynayan serbest IL- 17A'yı selektif olarak yakaladığını gösterir.
Secukinumab ile yürütülen bir çalışmada infiltre eden epidermal nötrofiller ve plak psoriasis hastalarının lezyonlu derilerinde artmış olan nötrofil ilişkili çeşitli belirteçler, bir ila iki haftalık tedaviden sonra anlamlı düzeyde azalmıştır.
Secukinumabın, bir enflamasyon göstergesi olan C-reaktif protein düzeylerini düşürdüğü gösterilmiştir (tedavinin 1 ila 2 haftası içinde).
Klinik etkililik ve güvenlilik: Plak psoriasis
Secukinumab'ın güvenliliği ve etkililiği, orta ila şiddetli derecede plak psoriasis hastası olup fototerapi ve sistemik tedavi adayı olan hastalardaki dört randomize, çift kör, plasebo kontrollü faz 3 çalışmada değerlendirilmiştir [ERASURE, FIXTURE, FEATURE, JUNCTURE]. Secukinumab 150 mg ve 300 mg'ın güvenliliği ve etkililiği plasebo ya da etanersept karşısında incelenmiştir. Bunlara ek olarak, bir çalışmada âgerektikçe yeniden tedavi' rejimi karşısında kronik tedavi rejimi değerlendirilmiştir [SCULPTURE].
Plasebo kontrollü çalışmalara dahil edilen 2.403 hastanın %79'u önceden biyolojik ürün kullanmamış, %45'inde biyolojik olmayan yaklaşımlar ile başarısız olunmuş, %8'inde biyolojik yaklaşımlar ile başarısız olunmuştur (%6'sında anti-TNF ile ve %2'sinde anti-p40 ile başarısız olunmuştur). Faz III çalışmalardaki hastaların yaklaşık %15 ila %25'inde başlangıçta psoriatik artrit (PsA) olduğu tespit edilmiştir.
Psoriasis Çalışması 1'de (ERASURE) 738 hasta değerlendirilmiştir. Secukinumab tedavisine randomize edilen hastalar 0, 1, 2, 3 ve 4. haftalarda 150 mg veya 300 mg dozları almış, ardından, aynı doz ayda bir uygulanmıştır. Psoriasis Çalışması 2'de (FIXTURE) 1306 hasta değerlendirilmiştir. Secukinumab'a randomize edilen hastalar 0, 1, 2, 3 ve 4. haftalarda 150 mg veya 300 mg dozları almış, ardından, aynı dozlar ayda bir uygulanmıştır. Etanersepte randomize edilen hastalar, 12 hafta süreyle haftada iki kez 50 mg dozları, ardından haftada bir 50 mg almışlardır. Gerek Çalışma 1 gerekse Çalışma 2'de 12. haftada yanıtsız olan ve plasebo alacakları gruplara randomize edilen hastalar daha sonra, 12, 13, 14 ve 15. haftalarda secukinumab alacakları (150 mg ya da 300 mg), ardından, 16. haftada başlanarak her ay aynı dozu alacakları VERXANT koluna aktarılmıştır. Tüm hastalar, çalışma ilacının ilk uygulamasını takiben 52 haftaya kadar takip edilmiştir.
Psoriasis Çalışması 3'te (FEATURE), kullanıma hazır enjektör ile secukinumab'ın hasta tarafından uygulanmasının güvenliliği, tolerabilitesi ve kullanılabilirliğini değerlendirmek üzere, 12 hafta sonrasında plasebo karşısında kullanıma hazır enjektörler kullanılarak 177 hasta değerlendirilmiştir. Psoriasis Çalışması 4'te (JUNCTURE), kullanıma hazır enjektör ile secukinumab'ın hasta tarafından uygulanmasının güvenliliği, tolerabilitesi ve kullanılabilirliğini değerlendirmek üzere, 12 hafta sonrasında plasebo karşısında kullanıma hazır enjektörler kullanılarak 182 hasta değerlendirilmiştir. Gerek Çalışma 3 gerekse Çalışma 4'te secukinumab'a randomize edilen hastalar 0, 1, 2, 3 ve 4. haftalarda 150 mg veya 300 mg
dozları almış, ardından, aynı dozlar ayda bir uygulanmıştır. Hastalar ayrıca 0, 1, 2, 3 ve 4. haftalarda ve ardından, ayda bir aynı dozları alacakları plasebo koluna randomize edilmiştir.
Psoriasis Çalışması 5'te (SCULPTURE) 966 hasta değerlendirilmiştir. Tüm hastalar 0, 1, 2, 3,
4, 8 ve 12. haftalarda secukinumab 150 mg veya 300 mg almış, ardından, 12. haftadan başlayarak her ay aynı dozun uygulanacağı idame rejimi alacakları ya da aynı dozun âgerektikçe yeniden tedavi' rejimini alacakları gruplara randomize edilmiştir. âGerektikçe yeniden tedavi' rejimine randomize edilen hastalarda yeterli yanıtın devamlılığı sağlanamamıştır ve dolayısıyla sabit aylık idame rejimi önerilmektedir.
Plasebo kontrollü ve aktif kontrollü çalışmalarda eş birincil sonlanma noktaları 12. haftada plasebo karşısında PASI 75 (Psoriasis Alanı ve Şiddeti İndeksi) yanıtına ve IGA (Investigator Global Assessment- Araştırıcı Global Değerlendirmesi) mod 2011 âtemiz' ya da âneredeyse temiz' yanıtlarına ulaşan hastaların oranı olmuştur (bkz. Tablo 2 ve 3). 300 mg dozu ile tüm çalışmalarda PASI 75/90/100, ve IGA mod 2011 âtemiz' ya da âneredeyse temiz' yanıtları
olarak belirlenen etkililik sonlanma noktalarının tümünde daha iyi cilt düzelmesi elde edilmiş, pik etkiler 16. haftada görülmüştür: bu nedenle bu doz önerilmektedir.
Tablo 2 : Psoriasis Çalışmaları 1, 3 ve 4'te (ERASURE, FEATURE ve JUNCTURE) PASI 50/75/90/100 & IGAâ° mod 2011 âtemiz' âneredeyse temiz' klinik yanıt özeti
| 12. Hafta | 16. Hafta | 52. Hafta | ||||
Çalışma 1 | Placebo | 150 mg | 300 mg | 150 mg | 300 mg | 150 mg | 300 mg |
Hasta sayısı | 246 | 244 | 245 | 244 | 245 | 244 | 245 |
PASI 50 yanıtı n (%) | 22 (%8,9) | 203 (%83,5) | 222 (%90,6) | 212 (%87,2) | 224 (%91,4) | 187 (%77) | 207 (%84,5) |
PASI 75 yanıtı n (%) | 11 (%4,5) | 174 (%71,6)** | 200 (%81,6)** | 188 (%77,4) | 211 (%86,1) | 146 (%60,1) | 182 (%74,3) |
PASI 90 yanıtı n (%) | 3 (%1,2) | 95 (%39,1)** | 145 (%59,2)** | 130 (%53,5) | 171 (%69,8) | 88 (%36,2) | 147 (%60) |
PASI 100 yanıtı n (%) | 2 (%0,8) | 31 (%12,8) | 70 (%28,6) | 51 (%21) | 102 (%41,6) | 49 (%20,2) | 96 (%39,2) |
IGA mod 2011 âtemizâ veya âneredeyse temizâ yanıtı n (%) |
6 (%2,4) |
125 (%51,2)** |
160 (%65,3)** |
142 (%58,2) |
180 (%73,5) |
101 (%41,4) |
148 (%60,4) |
Çalışma 3 |
|
|
|
|
|
|
|
Hasta sayısı | 59 | 59 | 58 | - | - | - | - |
PASI 50 yanıtı n (%) | 3 (%5,1) | 51 (%86,4) | 51 (%87,9) | ||||
PASI 75 yanıtı n (%) | 0 (%0) | 41 (%69,5)** | 44 (%75,9)** | ||||
PASI 90 yanıtı n (%) | 0 (%0) | 27 (%45,8) | 35 (%60,3) | ||||
PASI 100 yanıtı n (%) | 0 (%0) | 5 (%8,5) | 25 (%43,1) | ||||
IGA mod 2011 âtemizâ veya âneredeyse temizâ yanıtı n (%) |
0 (%0) |
31 (%52,5)** |
40 (%69)** |
- |
- |
- |
- |
Çalışma 4 |
|
|
|
|
|
|
|
Hasta sayısı | 61 | 60 | 60 | - | - | - | - |
PASI 50 yanıtı n (%) | 5 (%8,2) | 48 (%80) | 58 (%96,7) | ||||
PASI 75 yanıtı n (%) | 2 (%3,3) | 43 (%71,7)** | 52 (%86,7)** | ||||
PASI 90 yanıtı n (%) | 0 (%0) | 24 (%40) | 33 (%55) | ||||
PASI 100 yanıtı n (%) | 0 (%0) | 10 (%16,7) | 16 (%26,7) | ||||
IGA mod 2011 âtemizâ veya âneredeyse temizâ yanıtı n (%) |
0 (%0) |
32 (%53,3)** |
44 (%73,3)** |
- |
- |
- |
- |
*IGA mod 2011, beş kategorili bir ölçek olup â0 = temizâ, â1 = neredeyse temizâ, â2 = hafifâ, â3 = ortaâ ve â4 = şiddetliâ kategorilerini içerir: bu kategoriler, hastanın, indurasyon, eritem ve pullanmaya odaklı genel psoriasis şiddeti değerlendirmesini yansıtır. âTemizâ veya âneredeyse temizâ şeklindeki tedavi başarısı psoriasis belirtisi olmaması, normal veya pembe renkli lezyon rengi, plakta kalınlaşma olmaması ve fokal pullanmanın olmaması veya minimal olmasını içerir.
** p değerleri plaseboya karşıdır ve multiplisite(çeşitlilik) için düzeltilmiştir: p<0,0001
Tablo 3 : Psoriasis Çalışması 2'de klinik yanıt özeti (FIXTURE)
| ||||||||||
| ||||||||||
** p değerleri etanersepte karşıdır: p=0,025
Yapılan ilave bir psoriasis çalışmasında (CLEAR) 676 hasta değerlendirilmiştir. Secukinumab 300 mg, 16. haftada PASI 90 yanıtı(birincil sonlanım noktası) 4. haftada PASI 75 yanıtının ortaya çıkma hızı ve 52. haftada uzun süreli PASI 90 yanıtına dayalı olarak, ustekinumaba göre üstünlük sergileyerek birincil ve ikincil sonlanım noktalarını sağlamıştır. PASI 75/90/100 ve IGA mod 2011 0 ya da 1 yanıtı (âtemizâ veya âneredeyse temizâ) sonlanım noktalarına göre, ustekinumabla karşılaştırıldığında secukinumab için daha yüksek bir etkililik gözlenmiş ve bu durum 52. haftaya kadar sürdürülmüştür.
Tablo 4: CLEAR çalışmasında gözlenen klinik yanıtın özeti
| 4. Hafta | 16. Hafta | 52. Hafta | |||
| Secukinumab 300 mg | Ustekinumab* | Secukinumab 300 mg | Ustekinumab* | Secukinumab 300 mg | Ustekinumab* |
Hastaların sayısı | 334 | 335 | 334 | 335 | 334 | 335 |
PASI 75 yanıtı n (%) | 166 (%49,7)** | 69 (%20,6) | 311 (%93,1) | 276 (%82,4) | 306 (%91,6) | 262 (%78,2) |
PASI 90 yanıtı n (%) | 70 (%21,0) | 18 (%5,4) | 264 (%79)** | 192 (%57,3) | 250 (%74,9)*** | 203 (%60,6) |
PASI 100 yanıtı n (%) | 14 (%4,2) | 3 (%0,9) | 148 (%44,3) | 95 (%28,4) | 150 (%44,9) | 123 (%36,7) |
IGA mod 2011 âtemizâ veya | 128 (%38,3) | 41 (%12,2) | 278 (%83,2) | 226 (%67,5) | 261 (%78,1) | 213 (%63,6) |
âneredeyse temizâ yanıt n (%) |
|
|
|
|
|
|
* Secukinumabla tedavi edilen hastalar 0., 1., 2. ve 3 ve 4. haftalarda 300 mg dozunu, ardından 52. haftaya kadar her 4 haftada bir aynı dozu almışlardır. Ustekinumabla tedavi edilen hastalar, 0. ve 4. haftalarda ve ardından 52. haftaya kadar 12 haftada bir 45 mg ya da 90 mg ilaç almıştır (onaylanmış pozolojiye uygun olarak kiloya göre doz uygulaması yapılmıştır).
** Ustekinumabla karşılaştırıldığında p değerleri; Hafta 16'da PASI 90 birincil sonlanım noktası için ve Hafta 4'te PASI 75 ikincil sonlanım noktası için p < 0,0001
*** Ustekinumab karşısında p değerleri; Hafta 52'de PASI 90 ikincil sonlanım noktası için p=0,0001
Secukinumab önceden biyolojik ajan kullanılmamış, biyolojik ajanlara/anti-TNF'e maruz kalmış ve biyolojik ajanlar/anti-TNF ile başarısız olunmuş hastalarda etkili olmuştur. Başlangıçta eşzamanlı psoriatik artriti olan hastalarda PASI 75 düzelmeleri, genel plak psoriasis popülasyonundaki ile benzer olmuştur.
Secukinumab, 300 mg dozunda 3. hafta itibariyle ortalama PASI skorunda %50 düşüş görülmüş ve bu durum hızlı etkililik başlangıcı ile ilişkilendirilmiştir.
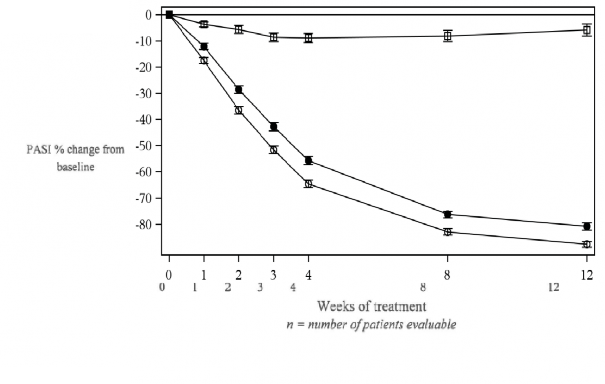
Secukinumab 150 mg (n=243) â Secukinumab 300 mg (n=245) â¡ Plasebo
5.2. Farmakokinetik özellikler
Genel özellikler:Plak psoriasis, psoriatik artrit ve ankilozan spondilit hastalarında gözlemlenen çoğu farmakokinetik özellik benzerdir.
Emilim:
Sağlıklı gönüllülerde 300 mg'lık tek subkutan dozunun sıvı formülasyon halinde uygulanmasının ardından secukinumab, dozdan 2 ila 14 gün sonra 43,2 ± 10,4 µg/ml pik serum konsantrasyonlarına ulaşmıştır.
Popülasyon farmakokinetiği analizine dayanılarak, plak psoriasis hastalarında 150 mg ya da 300 mg'lık tek subkutan dozunun ardından secukinumab, dozdan 5 ila 6 sün sonra sırasıyla 13,7 ± 4,8 μg/ml ya da 27,3 ± 9,5 μg/ml pik serum konsantrasyonlarına ulaşmıştır.
Popülasyon farmakokinetiği analizine dayanılarak, ilk ay boyunca başlangıç haftalık dozlarından sonra maksimum konsantrasyona ulaşma için geçen süre 31 ile 34 gün arasında olmuştur.
Simüle verilere dayalı olarak, 150 mg ya da 300 mg dozlarının subkutan uygulanmasının ardından kararlı durumdaki pik konsantrasyonları (C,) sırasıyla 27,6 μg/ml ve 55,2 μg/ml olmuştur. Popülasyon farmakokinetiği, aylık doz rejimleri ile kararlı duruma 20 hafta sonra ulaşıldığını göstermektedir.
Popülasyon farmakokinetiğinin gösterdiği üzere, tek doz sonrasındaki maruziyet ile karşılaştırıldığında, idame süresince tekrarlı aylık dozlardan sonra hastalar pik serum konsantrasyonlarında ve eğri altındaki alan (EAA) değerinde 2 kat artış sergilemiştir.
Popülasyon farmakokinetiği analizi, secukinumabın plak psoriasis hastalarında ortalama %73 mutlak biyoyararlanım ile emildiğini göstermiştir. Çalışmalar arasında %60 ile %77 aralığında mutlak biyoyararlanım değerleri hesaplanmıştır.
Dağılım:
Plak psoriasis hastalarında tek intravenöz uygulamanın ardından terminal faz (V) süresinde ortalama dağılım hacmi 7,1 - 8,6 litre aralığında bulunmuş olup bu, secukinumabın periferik kompartmanlara dağılımının sınırlı olduğuna işaret etmektedir.
Biyotransformasyon:
lgG eliminasyonunun büyük kısmı hücre içi katabolizma yoluyla, sıvı faz veya reseptör aracılı endositoz şeklinde gerçekleşmektedir.
Eliminasyon:
Plak psoriasis hastalarına tek intravenöz uygulama sonrasında ortalama sistemik klirens (CL) 0,13 ila 0,36 l/gün aralığında bulunmuştur. Bir popülasyon farmakokinetiği analizinde plak psoriasis hastalarında ortalama sistemik klirens (CL) 0,19 l/gün olmuştur. CL değeri cinsiyetten etkilenmemiştir. Klirens doza ve zamana bağlı olmuştur.
Bir popülasyon farmakokinetiği analizinde hesaplandığı üzere, intravenöz uygulamanın kullanıldığı psoriasis çalışmalarında plak psoriasis hastalarında ortalama eliminasyon yarı ömrü 27 gün olup 18 ile 46 gün arasında değişmektedir.
Doğrusallık/doğrusal olmayan durum:
Plak psoriasis hastalarında secukinumabın tek doz ve çoklu doz farmakokinetiği, 1 x 0,3 mg/kg ila 3 x 10 mg/kg aralığındaki intravenöz dozların ve 1 x 25 mg ila 300 mg'lık çoklu doz aralığındaki doz aralığının kullanıldığı çeşitli çalışmalarda belirlenmiştir. Tüm doz rejimlerinde maruziyetin doz ile orantılı olduğu görülmüştür.
Hastalardaki karakteristik özellikler
Yaşlı hastalar:
Sınırlı sayıda yaşlı hastanın (≥ 65 yaş için n=71 ve ≥ 75 yaş için n=7) dahil olduğu popülasyon farmakokinetiği analizine dayanılarak, yaşlı hastalar ve 65 yaş altı hastalardaki klirensin benzer olduğu belirlenmiştir.
Böbrek veya karaciğer yetmezliği olan hastalar:
Böbrek veya karaciğer yetmezliği olan hastalar ile ilgili farmakokinetik veri bulunmamaktadır. Bir IgG monoklonal antikoru olan değişmemiş VERXANT'ın renal eliminasyonunun düşük olması ve minör öneme sahip olması beklenir. IgG'ler temelde katabolizma yoluyla elimine olur ve karaciğer bozukluğunun VERXANT klirensini etkilemesi beklenmez.
Farmakokinetik üzerinde kilonun etkisi
Secukinumabın klirensi ve dağılım hacmi artan vücut ağırlığı ile artar.
5.3. Klinik öncesi güvenlilik verileri
Klinik dışı veriler, doku çapraz reaktivitesi, güvenlilik farmakolojisi, tekrarlı doz ve üreme toksisitesi konvansiyonel çalışmalarına dayalı olarak insanlar için özel bir tehlike göstermemiştir.
Secukinumabın karsinojen potansiyelini değerlendiren hayvan çalışmaları gerçekleştirilmemiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Sukroz
L-histidin
L-histidin hidroklorür monohidrat Polisorbat 80
Enjeksiyonluk su
6.2. Geçimsizlikler
Bu tıbbi ürün, bölüm 6.6'da bahsedilen tıbbi ürünler haricinde başka tıbbi ürünler ile
karıştırılmamalıdır.
6.3. Raf ömrü
36 ay
Sulandırılarak kullanıma hazırlandıktan sonra:
Çözelti hazırlandıktan sonra kimyasal ve fiziksel stabilitesinin 2°C-8°C'de 24 saat devam ettiği gösterilmiştir.
Mikrobiyolojik açıdan, sulandırılarak kullanıma hazırlama metodu mikrobiyal kontaminasyona engel olmadığı taktirde, infüzyon çözeltisinin hemen kullanılması gerekir.
6.4. Saklamaya yönelik özel tedbirler
Buzdolabında 2-8 ºC'de saklayınız.
Sulandırılarak kullanıma hazırlanmış tıbbi ürünün saklama koşulları için bkz. bölüm 3.
6.5. Ambalajın niteliği ve içeriği
VERXANT, gri kaplama kauçuk tıpalı ve beyaz flip-off bileşenli alüminyum kapaklı, 150 mg
secukinumab içeren renksiz cam flakonda sunulmaktadır.
Ambalaj büyüklüğü: 1 flakon içeren kutu.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâne uygun olarak imha edilmelidir.
Tek kullanımlık flakonlar, steril enjeksiyonluk su ile sulandırılarak kullanıma hazırlanmak için 150 mg secukinumab içermektedir. Final çözelti, berrak ve renksiz ila hafif sarı olmalıdır. Liyofilize toz tamamen çözülmez ya da sıvı, gözle kolayca görülebilen partiküller içerirse, bulutlu bir görünümü olursa ya da belirgin biçimde kahverengi ise kullanmayınız. Uygulamaya yönelik ayrıntılı açıklamalar kullanma talimatında yer almaktadır.
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Parkinson Hastalığı Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
İLAÇ GENEL BİLGİLERİ
Farmanova Sağlık Hizmetleri Ltd. Şti
| Geri Ödeme Kodu | A16798 |
| Satış Fiyatı | 10103.47 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 11771.77 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699074790508 |
| Etkin Madde | Sekukinumab |
| ATC Kodu | L04AC10 |
| Birim Miktar | 150 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Antineoplastik ve İmmünomodülatör Ajanlar > İmmünsupresif Ajanlar |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |