VOTRIENT 200 mg 30 tablet { Novartis } Kısa Ürün Bilgisi
{ Pazopanib }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
VOTRIENTTM 200 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her film kaplı tablette:
Pazopanib 200 mg (216,7 mg pazopanib hidroklorür olarak)
Yardımcı maddeler
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Bir yüzünde GS JT işareti bulunan pembe, kapsül şeklinde film kaplı tablet
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Pazopanib, daha önce herhangi bir VEGF-TKI (Vasküler endotelyal büyüme faktörü- Tirozin kinaz inhibitörü) kullanmamış rezeke edilemeyen lokal relaps veya metastatik renal hücreli kanseri olan hastalarda tek ajan olarak progresyona kadar kullanımda endikedir.
4.2. Pozoloji ve uygulama şekli
VOTRIENT tedavisi ancak kanser ilaçlarının uygulamasında deneyimli bir hekim tarafından başlatılmalıdır.
Renal hücre karsinomu (Renal Cell Carcinoma; RCC) veya yumuşak doku sarkomu (Soft Tissue Sarkoma; STS) tedavisi için önerilen pazopanib dozu günde bir kez oral alınan 800 mg'dır.
Dozun Değiştirilmesi
İstenmeyen etkilerin kontrolü için sonraki doz değişiklikleri bireysel tolerabiliteye göre kademeli şekilde artırılarak 200 mg'lık dozlarla değiştirilmelidir. Pazopanib günlük dozu 800 mg'ı aşmamalıdır.
Uygulama şekli:
Pazopanib aç karnına (yemeklerden en az bir saat önce veya iki saat sonra) uygulanmalıdır (bkz. Bölüm 5.2). Tabletler, bölünmeden, parçalanmadan ve çiğnenmeden bütün olarak bol su ile yutularak alınmalıdır.
Bir dozun alınması unutulursa ve sonraki doza 12 saatten daha az bir süre kaldıysa unutulan doz alınmamalıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Pazopanib ve metabolitlerinin renal yolla atılmasının düşük olduğu göz önüne alındığında böbrek yetmezliğinin pazopanib farmakokinetiğinde klinik açıdan anlamlı bir etki yapması beklenmez (bkz. Bölüm 5.2). Kreatinin klirensi 30 mL/dak'nın üzerinde olan hastalarda dozaj ayarlaması gerekli değildir. Ancak kreatin klirensi 30 ml/dak değerinin altında olan hastalarda pazopanib kullanılacaksa dikkatli olunmalıdır.
Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda dozaj önerileri, değişik derecelerde karaciğer fonksiyon bozukluğu olan hastalarda pazopanib ile yapılan farmakokinetik çalışmalara dayanmaktadır (bkz. Bölüm 5.2). Pazopanib tedavisine başlanmadan önce ve tedavi sırasında karaciğer bozukluklarının olup olmadığını belirlemek üzere tüm hastalara karaciğer fonksiyon testleri uygulanmalıdır (bkz. Bölüm 4.4). Hafif ila orta şiddette karaciğer yetmezliği olan hastalar, potansiyel olarak ilaca maruziyetin artması sebebiyle dikkatle ele alınmalı ve izlenmelidirler. Karaciğer fonksiyon testlerinde hafif anormallik bulunan (normal bilirubin ve herhangi bir düzeyde alanin aminotransferaz (ALT) artışı veya ALT değerinden bağımsız olarak üst normal sınırın (ULN) 1,5 katı bilirubin (> % 35 direkt) artışı olarak tanımlanan) hastalarda tedaviye günde bir kez 800 mg pazopanib dozu ile başlanılması önerilir. Orta şiddetli karaciğer yetmezliği olan hastalarda (ALT değerlerinden bağımsız olarak bilirubinde > 1,5 x ila 3 x ULN kat artış olarak tanımlanır) pazopanib dozunun günde bir kez 200 mg'a düşürülmesi önerilmektedir (bkz. Bölüm 5.2).
Pazopanib, şiddetli karaciğer yetmezliği (ALT düzeyinden bağımsız olarak total bilirubin değerinin > 3 x ULN kat artışı şeklinde tanımlanır) olan hastalarda kontrendikedir (bkz. Bölüm 4.3).
Karaciğer fonksiyonlarının izlenmesi ve ilaçla indüklenen karaciğer toksisitesi olan hastalarda doz ayarlaması için Bölüm 4.4'e bakınız.
Pediatrik popülasyon:
Organ büyümesi ve matürasyonu ile ilgili güvenlilik endişeleri nedeniyle pazopanib 2 yaş altı çocuklarda kullanılmamalıdır (bkz. Bölüm 4.4 ve 5.3).
Pazopanibin 2 ile 18 yaş arası çocuklardaki güvenliliği ve etkililiği belirlenmemiştir (bkz. Bölüm 5.1).
Halihazırda mevcut veriler, Bölüm 4.8, 5.1 ve 5.2'de açıklanmıştır. Fakat pozoloji konusunda herhangi bir öneride bulunulamaz.
Geriyatrik popülasyon:
65 yaş ve üstündeki hastalarda pazopanib kullanımına ilişkin sınırlı veri mevcuttur. Pazopanib ile yapılan klinik çalışmalarda en az 65 yaşın üzerindeki hastalar ile daha genç hastalar arasında pazopanibin güvenliliğine ilişkin klinik açıdan anlamlı fark bulunmamıştır. Bildirilen diğer klinik deneyimde yaşlı hastalar ile genç hastalar arasında yanıt açısından bir fark tanımlanmamakla birlikte bazı yaşlı hastaların daha duyarlı olabileceği göz ardı edilemez.
4.3. Kontrendikasyonlar
Etkin madde
VOTRIENT gebelik döneminde kullanılmamalıdır (bkz. Bölüm 4.6). 2 yaş altındaki çocuklarda kullanılmamalıdır.
4.4. Özel kullanım uyarıları ve önlemleri
Hepatik etkiler:
Pazopanib kullanımı sırasında karaciğer yetmezliği vakaları (ölümle sonuçlananlar dahil) bildirilmiştir. Hafif ila orta şiddette karaciğer yetmezliği olan hastalara pazopanib uygulaması dikkatli yapılmalı ve bu hastalar yakından izlenmelidir.
Serum karaciğer testlerinde hafif anormallik (ya normal bilirubin ve herhangi bir derece ALT yükselmesi ya da ALT değeri fark etmeksizin 1,5 x ULN'ye kadar bilirubin yükselmesi şeklinde) olan hastalarda tedaviye günde bir kez 800 mg pazopanib dozu ile başlanması önerilir. Orta şiddette karaciğer yetmezliği olan hastalarda günde 200 mg'lık azaltılmış pazopanib dozu önerilmektedir (ALT değeri fark etmeksizin > 1,5 ila 3 x ULN bilirubin yükselmesi) (bkz. Bölüm 4.2 ve 5.2). Pazopanib, şiddetli karaciğer yetmezliği olan hastalarda önerilmez (ALT değeri fark etmeksizin toplam bilirubin > 3 x ULN) (bkz. Bölüm 4.2 ve 5.2). Bu hastalarda 200 mg'lık dozda maruziyet, her ne kadar oldukça değişken olsa da, belirgin şekilde azalmaktadır; değerlerin, klinik açıdan anlamlı bir etki elde etmek için yeterli olmadığı düşünülmektedir.
Pazopanib ile yapılan klinik çalışmalarda serum transaminazlar (ALT, aspartat aminotransferaz [AST]) ve bilirubin düzeylerinde artışlar gözlenmiştir (bkz. Bölüm 4.8). Olguların çoğunda, alkalin fosfataz ya da bilirubin artışlarının eşlik etmediği izole ALT ve AST yükselmeleri bildirilmiştir. 60 yaşın üzerindeki hastalar hafif (>3xULN) ila şiddetli (>8xULN) ALT yükselmesi açısından daha yüksek risk altında olabilir. HLA-B*57:01 aleli taşıyan hastalar pazopanib ile ilişkili ALT yükselmeleri açısından daha yüksek risk altındadır. Genotip ya da yaşa bakılmaksızın pazopanib kullanan tüm hastalarda karaciğer işlevi izlenmelidir (bkz. Bölüm 5.1).
Pazopanib ile tedaviye başlanmadan önce ve tedavinin 3, 5, 7 ve 9. haftalarında serum karaciğer testi izlenmelidir. Serum karaciğer testi daha sonra 3 ve 4. aylarda da yapılmalı ve klinik durumun gerektirdiği durumlarda diğer testler de izlenmelidir. Periyodik izlem, 4. ay sonrasında devam etmelidir.
Aşağıdaki kılavuzlar, başlangıçta toplam bilirubin değerleri ï‚£ 1,5 x ULN ve AST ve ALT ï‚£ 2 x ULN olan hastalara yöneliktir.
Serum transaminaz düzeylerinde 3 x ULN ila 8 x ULN arasında izole artışlar görülen hastalarda, serum transaminaz değerleri evre 1 (NCI CTCAE) veya başlangıç düzeyine dönene kadar karaciğer fonksiyonu haftalık olarak izlenerek pazopanib tedavisine devam edilebilir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Diğer ilaçların pazopanib üzerindeki etkileri
İn vitro çalışmalar insan karaciğer mikrozomlarında pazopanibin oksidatif metabolizmasına temelde CYP3A4 enziminin aracılık ettiğini ve CYP1A2 ve CYP2C8 enzimlerinin minör katkıda bulunduğunu düşündürmüştür. Bu nedenle CYP3A4 inhibitörleri ve indükleyicileri pazopanib metabolizmasını değiştirebilir.
CYP3A4, P-gp, BCRP inhibitörleri
Pazopanib, CYP3A4, P-gp ve BCRP için bir substrattır.
Pazopanibin (günde bir kez 400 mg) güçlü CYP3A4 ve P-gp inhibitörü, ketokonazol (günde bir kez 400 mg) ile birlikte art arda 5 gün uygulanması sonucunda; pazopanibin tek başına verilmesine (7 gün boyunca günde bir kez 400 mg) kıyasla, ortalama pazopanib Eğri Altı Alan (EAA)ve Cdeğerlerinde sırasıyla % 66 ve % 45 artış meydana gelmiştir. Tek başına pazopanib 800 mg uygulamasından sonra ve pazopanib 400 mg artı ketokonazol 400 mg uygulamasından sonra yapılan pazopanib C(ortalamalar aralığı 27,5 ila 58,1 mikrogram/ml) ve EAA(ortalamalar aralığı 48,7 ila 1040 mikrogram*h/ml) farmakokinetik parametreleri karşılaştırmaları (ortalama C59,2 mikrogram/ml, ortalama EAA1300 mikrogram*h/ml), güçlü CYP3A4 ve P-gp inhibitörü varlığında günde bir kez pazopanib 400 mg dozuna azaltmanın çoğu hastada, tek başına günde bir kez pazopanib 800 mg uygulamasından sonra gözlenen ile benzer sistemik maruziyet ile sonuçlanacağını
göstermiştir. Ancak bazı hastalar tek başına günlük 800 mg pazopanib uygulaması sonrasında gözlenenden daha fazla sistemik maruziyet gösterebilmektedir.
Pazopanib ile birlikte diğer güçlü CYP3A4 inhibitörlerinin kullanılması (örn, itrakonazol, klaritromisin, atazanavir, indinavir, nefazodon, nelfinavir, ritonavir, saquinavir, telitromisin, vorikonazol) pazopanib konsantrasyonlarını artırabilir. Greyfurt suyu bir CYP3A4 inhibitörü içermekte olup ayrıca plazmadaki pazopanib konsantrasyonlarını artırabilir.
1500 mg lapatinib (CYP3A4 ve P-gp'nin zayıf bir inhibitörü ve BCRP'nin potent bir inhibitörü) ile 800 mg pazopanib uygulaması tek başına 800 mg pazopanib uygulamasına kıyasla ortalama pazopanib EAAve Cdeğerlerinde yaklaşık % 50 ila % 60 artışa neden olmuştur. Lapatinib tarafından P-gp ve/veya BCRP inhibisyonu, muhtemelen pazopanibe maruziyetin artışına katkıda bulunmuştur.
Pazopanibin lapatinib gibi CYP3A4, P-gp ve BCRP inhibitörleri ile birlikte uygulanması plazma pazopanib konsantrasyonlarında artışla sonuçlanacaktır. Güçlü P-gp veya BCRP inhibitörleriyle birlikte uygulama ayrıca, merkezi sinir sistemine (MSS) dağılım da dahil olmak üzere pazopanibe maruziyeti ve pazopanibin dağılımını değiştirebilir. Pazopanibin güçlü bir CYP3A4 inhibitörü ile eş zamanlı kullanımından kaçınılmalıdır (bkz. Bölüm 4.4). Eğer güçlü bir CYP3A4 inhibitörüne tıbbi olarak uygun bir alternatif bulunması söz konusu değilse, eş zamanlı kullanım süresince pazopanibin dozu günlük 400 mg'a azaltılmalıdır. Bu durumda advers reaksiyonlar açısından yakından izlem yapılmalıdır ve ilave doz azaltımları, ilaca bağlı yan etkilerin gözlenmesi halinde eğer uygunsa göz ününde bulundurulabilir.
Güçlü P-gp veya BCRP inhibitörleri ile kombinasyondan kaçınılmalıdır veya P-gp veya BCRP için minimum inhibisyon potansiyeli olan veya hiç olmayan alternatif eşzamanlı ilaç seçilmesi önerilmektedir.
CYP3A4, P-gp, BCRP indükleyiciler
Rifampin gibi CYP3A4 indükleyicileri plazma pazopanib konsantrasyonlarını düşürebilir. Pazopanibin potent P-gp veya BCRP indükleyiciler ile birlikte kullanımı pazopanib maruziyetini ve MSS'ne yayılma da dahil olmak üzere pazopanib dağılımını değiştirebilir. Enzim veya taşıyıcı indüksiyonu potansiyeli en düşük düzeyde olan veya hiç bulunmayan alternatif eşzamanlı ilaç seçilmesi önerilmektedir.
Pazopanibin diğer ilaçlar üzerindeki etkileri
İnsan karaciğer mikrozomları ile yapılan in vitro çalışmalar pazopanibin CYP enzimleri 1A2, 3A4, 2B6, 2C8, 2C9, 2C19 ve 2E1'i inhibe ettiğini göstermiştir. İnsan CYP3A4 enzimlerinin potansiyel indüksiyonu bir in vitro insan Pregnane X Receptor (PXR) testinde gösterilmiştir. Günde bir kez 800 mg pazopanib ile yapılan klinik farmakoloji çalışmaları pazopanibin kanser hastalarında kafein (CYP1A2 prob substratı), varfarin (CYP2C9 prob substratı) veya omeprazol (CYP2C19 prob substratı) farmakokinetiğinde klinik açıdan anlamlı bir etkiye sahip olmadığını göstermiştir. Pazopanib ortalama midazolam EAA ve C(CYP3A4 prob substratı) değerlerinde yaklaşık % 30 artışa ve oral yolla dekstrometorfan (CYP2D6 prob substratı) uygulandıktan sonra idrardaki dekstrometorfan-dekstorfan konsantrasyonu oranında
% 33 ila % 64 artışa neden olmuştur. Günde bir kez 800 mg pazopanib ve haftada bir kez 80 mg/m2 paklitakselin (CYP3A4 ve CYP2C8 substratı) birlikte uygulanması paklitaksel EAA ve Cdeğerlerinde sırasıyla ortalama % 26 ve % 31 artışa neden olmuştur.
In vitro ICve in vivo Cdeğerlerine dayanarak, pazopanibin GSK1268992 ve GSK1268997 metabolitleri, pazopanibin BCRP üzerinden net inhibitör etkisine katkı sağlayabilmektedirler. Ayrıca, gastrointestinal kanalda BCRP ve P-gp'nin pazopanib kullanımı ile oluşabilecek inhibisyonu göz ardı edilemez. Pazopanibin diğer oral BCRP ve P- gp substratları ile birlikte kullanılması durumunda dikkatli olunmalıdır.
İn vitro koşullarda pazopanib, insan organik anyon taşıyıcı polipeptidi (OATP1B1) inhibe etmiştir. Pazopanibin, OATP1B1 substratlarının (örn. statinler, bkz. aşağıda “Eşzamanlı Pazopanib ve Simvastatin kullanımı üzerindeki etkisiâ€) farmakokinetik özelliklerini değiştirme olasılığı göz ardı edilemez.
Pazopanib, in vitro ortamda üridin difosfoglukuronil-transferaz 1A1 (UGT1A1) enziminin bir inhibitörüdür. İrinotekanın aktif metaboliti SN-38 OATP1B1 ve UGT1A1 substratıdır. Günde bir kez pazopanib 400 mg'ın setuksimab 250 mg/m2 ve irinotekan 150 mg/m2 ile bir arada uygulanması, SN-38'e sistemik maruziyette yaklaşık % 20'lik bir artış ile sonuçlanmıştır. Yabanıl tip aleli olan bireyler ile karşılaştırıldığında UGT1A1*28 polimorfizmi olan bireylerde pazopanib, SN-38 dispozisyonu üzerinde daha büyük bir etkiye sahip olabilir. Ancak UGT1A1 genotipinin SN-38 dispozisyonu üzerindeki etkisinde her zaman prediktif niteliğinin olmadığı görülmüştür. Pazopanib, UGT1A1 substratları ile bir arada uygulanırken dikkatli olunmalıdır.
Pazopanib ve simvastatinin eşzamanlı kullanımının etkisi
Pazopanib ve simvastatinin eşzamanlı kullanımı, ALT değerlerinde yükseliş insidansını artırmaktadır. Pazopanib ile yapılan klinik çalışmalardan toplanan veriler kullanılarak yapılan bir meta-analizin sonuçları, eşzamanlı simvastatin kullanımı olan 11/41 (% 27) hastayla karşılaştırıldığında statin kullanmamış 126/895 (% 14) hastada ALT >3x ULN bildirildiğini göstermektedir (p = 0,038). Eşzamanlı simvastatin alan bir hastada ALT düzeyleri artarsa, pazopanib dozaj kılavuzları takip edilmeli ve simvastatin kesilmelidir (bkz. Bölüm 4.4). Diğer statinlerle pazopanib eşzamanlı uygulanırken dikkatli olunmalıdır çünkü ALT düzeyleri üzerine etkilerini belirlemek için yeterli veri mevcut değildir. Pazopanibin diğer statinlerin (örn. atorvastatin, fluvastatin, pravastatin, rosuvastatin) farmakokinetiğini etkileme olasılığı dışlanamaz.
Yiyecek ve içecek ile kullanılması
Yüksek oranda veya düşük oranda yağ içeren öğünlerle birlikte pazopanib uygulanması, EAA ve Cdeğerlerinde yaklaşık 2 kat artışa neden olmuştur. Bu nedenle pazopanib öğünlerden en az 1 saat önce veya 2 saat sonra uygulanmalıdır.
Mide asiditesini yükselten ilaçlar
Pazopanibin esomeprazol ile birlikte kullanımı, pazopanibin biyoyararlanımını yaklaşık olarak % 40 (EAA ve C) düşürmektedir. Pazopanibin mide asiditesini yükselten ilaçlar ile birlikte uygulanmasından kaçınılmalıdır. Eğer proton pompa inhibitörü (PPI) ile birlikte kullanımı tıbbi açıdan gerekliyse, pazopanib dozunun günde 1 kez akşam saatlerinde aç karnına PPI ile birlikte alınması önerilmektedir. Eğer H2-reseptör antagonisti ile birlikte uygulanması tıbbi açıdan gerekliyse, pazopanib H2-reseptör antagonist dozundan en az 2 saat önce veya en az 10 saat sonra aç karnına alınmalıdır. Pazopanib, kısa etkili antiasit alınmasından 1 saat önce veya 2 saat sonra alınmalıdır. PPI ve H2-reseptör antagonistlerinin birlikte nasıl uygulanacağı ile ilgili tavsiyeler fizyolojik değerlendirmelere bağlıdır.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi: D
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Doğurganlık çağındaki kadınlar, pazopanib tedavisi sırasında ve tedaviden en az 2 hafta sonrasına kadar yeterli kontrasepsiyon kullanmaları ve gebelikten kaçınmaları konusunda uyarılmalıdır.
Erkek hastalar (vasektomi yaptırmış olanlar dahil) pazopanib kullanırken ve son pazopanib dozunu takiben en az 2 hafta boyunca, üreme potansiyeline sahip kadın partnerlerine ve gebe partnerlerine potansiyel ilaç maruziyetinden kaçınmak üzere cinsel ilişki sırasında prezervatif kullanmalıdır.
Gebelik dönemi
Gebe kadınlarda pazopanib kullanımına ilişkin yeterli veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalarda üreme toksisitesi görülmüştür (bkz. Bölüm 5.3). İnsanlara yönelik potansiyel risk bilinmemektedir.
Gebelik sırasında pazopanib kullanılırsa veya hasta pazopanib alırken hamile kalırsa, fetüse yönelik potansiyel tehlike hastaya açıklanmalıdır.
VOTRIENT, hastanın klinik durumu pazopanib ile tedaviyi gerektirmedikçe gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Laktasyon sırasında pazopanibin güvenli kullanımı belirlenmemiştir. Pazopanibin veya metabolitlerinin insan sütü ile atılıp atılmadığı bilinmemektedir. Pazopanibin hayvan sütü ile atılımına ilişkin bilgi bulunmamaktadır. Emzirilen çocuk açısından risk göz ardı edilemez. Pazopanib tedavisi sırasında emzirme kesilmelidir.
Üreme yeteneği / Fertilite
Hayvan çalışmaları pazopanib ile tedavinin erkek ve kadın fertilitesini etkileyebileceğini göstermektedir (bkz. Bölüm 5.3).
4.7. Araç ve makine kullanımı üzerindeki etkiler
VOTRIENT'in araç ve makine kullanımı üzerinde etkisi yoktur ya da etki ihmal edilebilir düzeydedir. Pazopanib farmakolojisi göz önüne alındığında bu aktiviteler üzerinde zararlı bir etkisi olup olmadığı öngörülemez. Hastanın muhakeme, motor veya kognitif yetenekler gerektiren işleri yapabilme becerisi hastanın klinik durumu ve pazopanibin istenmeyen etki profili göz önünde bulundurularak değerlendirilmelidir. Hastalar, baş dönmesi, yorgunluk ya da halsizlik hissettiklerinde araç ya da makine kullanımından kaçınmalıdır.
4.8. İstenmeyen etkiler
RRC'li hastalarda pazopanibin (toplam n=1149) güvenliliği ve tolerabilitesinin genel değerlendirilmesinde pivotal RCC çalışması (VEG105192, n=290), uzatma çalışması (VEG107769, n=71), destekleyici Faz II çalışma (VEG102616, n=225) ve randomize, açık
etiketli, paralel grup Faz III eşit etkililik çalışmasının (VEG108844, n=557) birleştirilmiş verileri değerlendirilmiştir (bkz. Bölüm 5.1).
Öncü STS çalışması (VEG110727, n=369) ve destekleyici Faz II çalışmadan (VEG20002, n=142) elde edilen birleştirilmiş veriler, STS'li hastalarda (toplam güvenlilik popülasyonu sayısı=382) pazopanibin genel güvenlilik ve tolerabilite incelemesinde değerlendirilmiştir (bkz. Bölüm 5.1).
RCC veya STS çalışmalarında tespit edilmiş, pazopanib tedavisi ile ilişkili en önemli istenmeyen etkiler, geçici iskemik atak, iskemik inme, miyokard iskemisi, miyokard infarktüsü ve serebral infarktüs, kardiyak disfonksiyon, gastrointestinal perforasyon ve fistül, QT uzaması, Torsade de Pointes ve pulmoner, gastrointestinal ve serebral hemoraji olup bu olayların tümü tedavi uygulanan hastaların % 1'inden daha azında bildirilmiştir. STS çalışmalarında tanımlanmış diğer önemli ciddi istenmeyen etkiler, venöz tromboembolik olaylar, sol ventrikül disfonksiyonu ve pnömotoraks olarak belirtilmiştir.
Pazopanib ile muhtemelen ilişkili olduğu düşünülen ölümcül olaylar arasında gastrointestinal hemoraji, pulmoner hemoraji/hemoptizi, anormal hepatik fonksiyon, intestinal perforasyon ve iskemik inme bulunmaktadır.
RCC ve STS çalışmalarındaki, tedavi ile ilişkili herhangi bir evredeki en yaygın istenmeyen etkiler (hastaların en az % 10'unda meydana gelen) aşağıdakilerden oluşmaktadır: Diyare, saç renginde değişiklik, ciltte hipopigmentasyon, eksfolyatif döküntü, hipertansiyon, bulantı, baş ağrısı, yorgunluk, anoreksi, kusma, tat alma duyusunda bozulma, stomatit, kilo azalması, ağrı, alanin aminotransferaz düzeyinde artış ve aspartat aminotransferaz düzeyinde artış.
RCC ve STS hastalarında bildirilen tedavi ile ilişkili tüm evrelerdeki yan etkiler aşağıda MedDRA vücut organ sistemi sınıfına göre liste halinde sunulmaktadır. Sıklık kategorilendirilmesi için aşağıdaki kategori ölçeği kullanılmıştır:
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kategoriler klinik çalışma verilerindeki mutlak sıklıklar temelinde değerlendirilmiştir. Tüm pazopanib klinik çalışmalarından ve spontan bildirimlerden güvenlilik ve tolerabiliteye ilişkin pazarlama sonrası veriler de değerlendirilmiştir. Her bir sistem organ sınıfı içinde, aynı sıklığa sahip advers reaksiyonlar azalan ciddiyet derecesine göre sunulmaktadır.
RCC çalışmasında (n=1149) veya pazarlama sonrası dönemde rapor edilen tedavi ile ilişkili advers reaksiyonlar:
Enfeksiyonlar ve enfestasyonlar
Yaygın: Enfeksiyonlar (nötropeninin eşlik ettiği veya etmediği)†Yaygın olmayan: Diş eti enfeksiyonu, enfeksiyöz peritonit
İyi huylu ve kötü huylu neoplazmalar (kist ve polipler dahil)
Yaygın olmayan: Tümör ağrısı
Kan ve lenf sistemi hastalıkları
Yaygın: Trombositopeni, nötropeni, lökopeni
Yaygın olmayan: Polisitemi
Seyrek: Trombotik mikroanjiyopati (trombotik trombositopenik purpura ve hemolitik üremik sendrom dahil) â€
Endokrin hastalıkları
Yaygın: Hipotiroidizm
Metabolizma ve beslenme hastalıkları
Çok yaygın: İştah azalmasıe
Yaygın: Dehidrasyon, hipofosfatemi Yaygın olmayan: Hipomagnezemi Bilinmiyor: Tümör lizis sendromu*
Psikiyatrik hastalıklar
Yaygın: Uykusuzluk
Sinir sistemi hastalıkları
Çok yaygın: Tat alma duyusunda bozulmac, baş ağrısı
Yaygın: Sersemlik, letarji, parestezi, periferik duyusal nöropati
Yaygın olmayan: Hipoestezi, geçici iskemik atak, uyuklama, serebrovasküler olay, iskemik inme
Seyrek: Posterior geri dönüşlü ensefalopati sendromu / Geri dönüşlü posterior lökoensefalopati sendromu â€
Göz hastalıkları
Yaygın: Bulanık görme
Yaygın olmayan: Retina dekolmanı †, retina yırtılması †, Kirpikte renksizleşme
Kardiyak hastalıklar
Yaygın olmayan: Bradikardi, kardiyak disfonksiyonf, miyokard infarktüsü, miyokard iskemisi
Vasküler hastalıklar
Çok yaygın: Hipertansiyon
Yaygın: Sıcak basması, al basması, venöz tromboembolik olaylarg Yaygın olmayan: Hemoraji, hipertansif kriz
Seyrek: Anevrizmalar ve arter diseksiyonlarıâ€
Solunum, göğüs bozuklukları ve mediastinal hastalıklar Yaygın: Epistaksis, disfoni, dispne, hemoptizi Yaygın olmayan: Pulmoner hemoraji, rinore, pnömotoraks Seyrek: İnterstisyel akciğer hastalığı/ pnömoni â€
Gastrointestinal hastalıklar
Çok yaygın: Diyare, bulantı, kusma, karın ağrısıa
Yaygın: Dispepsi, stomatit, flatulans (karında gaz ve şişkinlik), abdominal distansiyon, ağız kuruluğu, ağızda ülser
Yaygın olmayan: Pankreatit, rektal hemoraji, hematokezi, gastrointestinal hemoraji, melena, sık bağırsak hareketleri, anal hemoraji, kalın bağırsak perforasyonu, ağızda hemoraji, üst gastrointestinal hemoraji,
enterokutan fistül, hematemez, hemoroidal hemoraji, ileum perforasyonu, özofagus hemorajisi, retroperitoneal hemoraji
Hepato-biliyer hastalıklar
Yaygın: Anormal hepatik fonksiyon, hiperbilirubinemi, hepatotoksisite Yaygın olmayan: Sarılık, karaciğer yetmezliği†, ilaca bağlı karaciğer hasarı
Deri ve deri altı doku hastalıkları
Çok yaygın: Saç renginde değişiklik, palmar-plantar eritrodizestezi sendromu, alopesi, döküntü
Yaygın: Deride hipopigmentasyon, eritem, prurit, deride depigmentasyon, ciltte kuruluk, hiperhidroz
Yaygın olmayan: Tırnak bozuklukları, foto-duyarlılık reaksiyonu, deride eksfolyasyon (soyulma), kabarcıklı döküntü, jeneralize pruritus, papüler döküntü, plantar eritema, eritematöz döküntü, jeneralize döküntü, maküler döküntü, pruritik döküntü, cilt bozukluğu, cilt ülseriâ€
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın: Miyalji, kas spazmları, artralji Yaygın olmayan: Kas-iskelet ağrısı
Böbrek ve idrar yolu hastalıkları
Çok yaygın: Proteinüri
Yaygın olmayan: Üriner sistemde hemoraji
Üreme ve meme hastalıkları
Yaygın olmayan: Menoraji, metroraji, vajinal hemoraji
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın: Yorgunluk
Yaygın: Asteni, mukozal inflamasyon, ödemb, göğüs ağrısı Yaygın olmayan: Mukoz membran bozukluğu, ürperme
Araştırmalar
Çok yaygın: Alanin aminotransferaz artışı, aspartat aminotransferaz artışı
Yaygın: Kilo kaybı, kanda kreatinin artışı, kanda bilirubin artışı, beyaz kan hücresi sayısında azalmad, lipaz artışı, kan basıncında artış, kanda tiroidi uyarıcı hormon artışı, gama-glutamiltransferaz artışı, amilaz artışı, anormal karaciğer fonksiyon testi, kanda üre artışı
Yaygın olmayan: Elektrokardiyogram QT uzaması, kan glukozunda azalma, transaminaz artışı, diastolik kan basıncında artış, anormal tiroid fonksiyon testi, sistolik kan basıncında artış, hepatik enzim artışı
Advers reaksiyonların tablo halinde listesi
Tablo 1. RCC çalışmasında (n=1149) veya pazarlama sonrası dönemde rapor edilen tedavi ile ilişkili advers reaksiyonlar:
Sistem Organ Sınıfı | Sıklık (tüm evrelerde) | Advers reaksiyon | Tüm evreler | Evre 3 Sayı (%) | Evre 4 Sayı (%) |
Enfeksiyonlar ve enfestasyonlar | Yaygın | Enfeksiyonlar (nötropeninin eşlik ettiği veya etmediği)†| Bilinmiyor | Bilinmiyor | Bilinmiyor |
| Yaygın olmayan | Diş eti enfeksiyonu | 1 (<% 1) | 0 | 0 |
|
| Enfeksiyöz peritonit | 1 (<% 1) | 0 | 0 |
İyi huylu ve kötü huylu neoplazmalar (kist ve polipler dahil) | Yaygın olmayan | Tümör ağrısı | 1 (<% 1) | 1 (<% 1) | 0 |
Kan ve lenf sistemi hastalıkları | Yaygın | Trombositopeni | 80 (% 7) | 10 (<% 1) | 5 (<% 1) |
|
| Nötropeni | 79 (% 7) | 20 (% 2) | 4 (<% 1) |
|
| Lökopeni | 63 (% 5) | 5 (<% 1) | 0 |
| Yaygın olmayan | Polisitemi | 6 (% 0,03) | 1 | 0 |
| Seyrek | Trombotik mikroanjiyopati (trombotik trombositopenik purpura ve hemolitik üremik sendrom dahil) †| Bilinmiyor | Bilinmiyor | Bilinmiyor |
Endokrin hastalıkları | Yaygın | Hipotiroidizm | 83 (% 7) | 1 (<% 1) | 0 |
Metabolizma ve beslenme hastalıkları | Çok yaygın | İştah azalması | 317 (% 28) | 14 (% 1) | 0 |
| Yaygın | Dehidrasyon | 16 (% 1) | 5 (<% 1) | 0 |
|
| Hipofosfatemi | 21 (% 2) | 7 (<% 1) | 0 |
| Yaygın olmayan | Hipomagnezemi | 10 (<% 1) | 0 | 0 |
| Bilinmiyor | Tümör lizis sendromu* | Bilinmiyor | Bilinmiyor | Bilinmiyor |
Psikiyatrik hastalıklar | Yaygın | Uykusuzluk | 30 (% 3) | 0 | 0 |
Sinir sistemi hastalıkları | Çok yaygın | Tat alma duyusunda bozulma | 254 (% 22) | 1 (<% 1) | 0 |
|
| Baş ağrısı | 122 (% 11) | 11 (<% 1) | 0 |
| Yaygın | Sersemlik | 55 (% 5) | 3 (<% 1) | 1 (<% 1) |
|
| Letarji | 30 (% 3) | 3 (<% 1) | 0 |
|
| Parestezi | 20 (% 2) | 2 (<% 1) | 0 |
|
| Periferik duyusal nöropati | 17 (% 1) | 0 | 0 |
| Yaygın olmayan | Hipoestezi | 8 (<%1) | 0 | 0 |
|
| Geçici iskemik atak | 7 (<%1) | 4 (<%1) | 0 |
|
| Uyuklama | 3 (<%1) | 1 (<%1) | 0 |
|
| Serebrovasküler olay | 2 (<%1) | 1 (<%1) | 1 (<%1) |
|
| İskemik inme | 2 (<%1) | 0 | 1 (<%1) |
| Seyrek | Posterior geri dönüşlü ensefalopati sendromu / Geri dönüşlü posterior lökoensefalopati sendromu †| Bilinmiyor | Bilinmiyor | Bilinmiyor |
Göz hastalıkları | Yaygın | Bulanık görme | 19 (% 2) | 1 (<% 1) | 0 |
| Yaygın olmayan | Retina dekolmanı †| 1 (<% 1) | 1 (<% 1) | 0 |
|
| Retina yırtılması †| 1 (<% 1) | 1 (<% 1) | 0 |
|
| Kirpikte renksizleşme | 4 (<% 1) | 0 | 0 |
Kardiyak hastalıklar | Yaygın olmayan | Bradikardi | 6 (<% 1) | 0 | 0 |
|
| Kardiyak disfonksiyon | 4 (<% 1) | 1 (<% 1) | 0 |
|
| Miyokard infarktüsü | 5 (<% 1) | 1 (<% 1) | 4 (<% 1) |
|
| Miyokard iskemisi | 3 (<% 1) | 1 (<% 1) | 0 |
Vasküler hastalıklar | Çok yaygın | Hipertansiyon | 473 (% 41) | 115 (% 10) | 1 (<% 1) |
| Yaygın | Sıcak basması | 16 (% 1) | 0 | 0 |
|
| Al basması | 12 (% 1) | 0 | 0 |
|
| Venöz tromboembolik olaylar | 13 (% 1) | 6 (<% 1) | 7 (<% 1) |
| Yaygın olmayan | Hemoraji | 1 (<% 1) | 0 | 0 |
|
| Hipertansif kriz | 6 (<% 1) | 0 | 2 (<% 1) |
| Seyrek | Anevrizmalar ve arter diseksiyonları†| Bilinmiyor | Bilinmiyor | Bilinmiyor |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | Yaygın | Epistaksis | 50 (% 4) | 1 (<% 1) | 0 |
|
| Disfoni | 48 (% 4) | 0 | 0 |
|
| Dispne | 42 (% 4) | 8 (<% 1) | 1 (<% 1) |
|
| Hemoptizi | 15 (% 1) | 1 (<% 1) | 0 |
| Yaygın olmayan | Pulmoner hemoraji | 2 (<% 1) | 0 | 0 |
|
| Rinore | 8 (<% 1) | 0 | 0 |
|
| Pnömotoraks | 1 (<% 1) | 0 | 0 |
| Seyrek | İnterstisyel akciğer hastalığı/ pnömoni †| Bilinmiyor | Bilinmiyor | Bilinmiyor |
Gastrointestinal hastalıklar | Çok yaygın | Diyare | 614 (% 53) | 65 (% 6) | 2 (<% 1) |
|
| Bulantı | 386 (% 34) | 14 (% 1) | 0 |
|
| Kusma | 225 (% 20) | 18 (% 2) | 1 (<% 1) |
|
| Karın ağrısı | 139 (% 12) | 15 (% 1) | 0 |
| Yaygın | Dispepsi | 83 (% 7) | 2 (<% 1) | 0 |
|
| Stomatit | 96 (% 8) | 4 (<% 1) | 0 |
|
| Flatulans (karında gaz ve şişkinlik) | 43 (% 4) | 0 | 0 |
|
| Abdominal distansiyon | 36 (% 3) | 2 (<% 1) | 0 |
|
| Ağız kuruluğu | 28 (% 2) | 3 (<% 1) | 0 |
|
| Ağızda ülser | 27 (% 2) | 0 | 0 |
| Yaygın olmayan | Pankreatit | 8 (<% 1) | 4 (<% 1) | 0 |
|
| Rektal hemoraji | 8 (<% 1) | 2 (<% 1) | 0 |
|
| Hematokezi | 6 (<% 1) | 0 | 0 |
|
| Gastrointestinal hemoraji | 4 (<% 1) | 2 (<% 1) | 0 |
|
| Melena | 4 (<% 1) | 1(<% 1) | 0 |
|
| Sık bağırsak hareketleri | 3 (<% 1) | 0 | 0 |
|
| Anal hemoraji | 2 (<% 1) | 0 | 0 |
|
| Kalın bağırsak perforasyonu | 2 (<% 1) | 1 (<% 1) | 0 |
|
| Ağızda hemoraji | 2 (<% 1) | 0 | 0 |
|
| Üst gastrointestineal hemoraji | 2 (<% 1) | 1 (<% 1) | 0 |
|
| Enterokutan fistül | 1 (<% 1) | 0 | 0 |
|
| Hematemez | 1 (<% 1) | 0 | 0 |
|
| Hemoroidal hemoraji | 1 (<% 1) | 0 | 0 |
|
| İleum perforasyonu | 1 (<% 1) | 0 | 1 (<% 1) |
|
| Özofagus hemorajisi | 1 (<% 1) | 0 | 0 |
|
| Retroperitoneal hemoraji | 1 (<% 1) | 0 | 0 |
Hepato-biliyer | Yaygın | Anormal hepatik | 29 (% 3) | 13 (% 1) | 2 (<% 1) |
hastalıklar |
| fonksiyon |
|
|
|
|
| Hiperbilirubinemi | 38 (% 3) | 2 (<% 1) | 1 (<% 1) |
|
| Hepatotoksisite | 18 (% 2) | 11(<% 1) | 2 (<% 1) |
| Yaygın olmayan | Sarılık | 3 (<% 1) | 1 (<% 1) | 0 |
|
| Karaciğer yetmezliği†| 1 (<% 1) | 0 | 1 (<% 1) |
|
| İlaca bağlı karaciğer hasarı | 2 (<% 1) | 2 (<% 1) | 0 |
Deri ve deri altı doku hastalıkları | Çok yaygın | Saç renginde değişiklik | 404 (% 35) | 1 (<% 1) | 0 |
|
| Palmar-plantar eritrodizestezi sendromu | 206 (% 18) | 39 (% 3) | 0 |
|
| Alopesi | 130 (% 11) | 0 | 0 |
|
| Döküntü | 129 (% 11) | 7 (<% 1) | 0 |
| Yaygın | Deride hipopigmentasyon | 52 (% 5) | 0 | 0 |
|
| Eritem | 25 (% 2) | 0 | 0 |
|
| Prurit | 29 (% 3) | 0 | 0 |
|
| Deride depigmentasyon | 20 (% 2) | 0 | 0 |
|
| Ciltte kuruluk | 50 (% 4) | 0 | 0 |
|
| Hiperhidroz | 17 (% 1) | 0 | 0 |
| Yaygın olmayan | Tırnak bozuklukları | Nail disorders | 11 (<% 1) | 0 |
|
| Foto-duyarlılık reaksiyonu | 7 (<% 1) | 0 | 0 |
|
| Deride eksfolyasyon (soyulma | 10 (<% 1) | 0 | 0 |
|
| Kabarcıklı döküntü | 6 (<% 1) | 0 | 0 |
|
| Jeneralize pruritus | 2 (<% 1) | 0 | 0 |
|
| Papüler döküntü | 2 (<% 1) | 0 | 0 |
|
| Plantar eritema | 1 (<% 1) | 0 | 0 |
|
| Eritematöz döküntü | 6 (<% 1) | 0 | 0 |
|
| Jeneralize döküntü | 2 (<% 1) | 1 (<% 1) | 0 |
|
| Maküler döküntü | 4 (<% 1) | 0 | 0 |
|
| Pruritik döküntü | 3 (<% 1) | 0 | 0 |
|
| Cilt bozukluğu | 5 (<% 1) | 0 | 0 |
|
| Cilt ülseri†| Bilinmiyor | Bilinmiyor | Bilinmiyor |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | Yaygın | Miyalji | 35 (% 3) | 2 (<% 1) | 0 |
|
| Kas spazmları | 25 (% 2) | 0 | 0 |
|
| Artralji | 48 (% 4) | 8 (<% 1) | 0 |
| Yaygın olmayan | Kas-iskelet ağrısı | 9 (<% 1) | 1 (<% 1) | 0 |
Böbrek ve idrar yolu hastalıkları | Çok yaygın | Proteinüri | 135 (% 12) | 32 (% 3) | 0 |
| Yaygın olmayan | Üriner sistemde hemoraji | 1 (<% 1) | 0 | 0 |
Üreme ve meme hastalıkları | Yaygın olmayan | Menoraji | 3 (<% 1) | 0 | 0 |
|
| Metroraji | 1 (<% 1) | 0 | 0 |
|
| Vajinal hemoraji | 3 (<% 1) | 0 | 0 |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Çok yaygın | Yorgunluk | 415 (% 36) | 65 (% 6) | 1 (<% 1) |
| Yaygın | Asteni | 82 (% 7) | 20 (% 2) | 1 (<% 1) |
|
| Mukozal inflamasyon | 86 (% 7) | 5 (<% 1) | 0 |
|
| Ödem | 72 (% 6) | 1 (<% 1) | 0 |
|
| Göğüs ağrısı | 18 (% 2) | 2 (<% 1) | 0 |
| Yaygın olmayan | Mukoz membran bozukluğu | 1 (<% 1) | 0 | 0 |
|
| Ürperme | 4 (<% 1) | 0 | 0 |
Araştırmalar | Çok yaygın | Alanin aminotransferaz artışı | 246 (% 21) | 84 (% 7) | 14 (% 1) |
|
| Aspartat aminotransferaz artışı | 211 (% 18) | 51 (% 4) | 10 (<% 1) |
| Yaygın | Kilo kaybı | 96 (% 8) | 7 (<% 1) | 0 |
|
| Kanda kreatinin artışı | 55 (% 5) | 3 (<% 1) | 0 |
|
| Kanda bilirubin artışı | 61 (% 5) | 6 (<% 1) | 1 (<% 1) |
|
| Beyaz kan hücresi sayısında azalma | 51 (% 4) | 3 (<% 1) | 0 |
|
| Lipaz artışı | 51 (% 4) | 21 (% 2) | 7 (<% 1) |
|
| Kan basıncında artış | 15 (% 1) | 2 (<% 1) | 0 |
|
| Kanda tiroidi uyarıcı hormon artışı | 36 (% 3) | 0 | 0 |
|
| Gama- glutamiltransferaz artışı | 31 (% 3) | 9 (<% 1) | 4 (<% 1) |
|
| Amilaz artışı | 35 (% 3) | 7 (<% 1) | 0 |
|
| Anormal karaciğer fonksiyon testi | 12 (% 1) | 6 (<% 1) | 1 (<% 1) |
|
| Kanda üre artışı | 12 (% 1) | 1 (<% 1) | 0 |
| Yaygın olmayan | Elektrokardiyogram QT uzaması | 7 (<% 1) | 2 (<% 1) | 0 |
|
| Kan glukozunda azalma | 7 (<% 1) | 0 | 1 (<% 1) |
|
| Transaminaz artışı | 7 (<% 1) | 1 (<% 1) | 0 |
|
| Diastolik kan basıncında artış | 2 (<% 1) | 0 | 0 |
|
| Anormal tiroid fonksiyon testi | 3 (<% 1) | 0 | 0 |
|
| Sistolik kan basıncında artış | 1 (<% 1) | 0 | 0 |
|
| Hepatik enzim artışı | 11 (<% 1) | 4 (<% 1) | 3 (<% 1) |
†Pazarlama sonrası dönemde bildirilen tedavi ile ilişkili advers reaksiyon (tüm pazopanib klinik çalışmalarından spontan olgu raporları ve ciddi advers reaksiyonlar).
*Yalnızca pazarlama sonrası dönemde bildirilmiş tedaviyle ilişkili advers reaksiyon. Sıklık mevcut verilerden tahmin edilemez.
Aşağıdaki terimler birleştirilerek sunulmuştur.
a Karın ağrısı, üst karın ağrısı ve alt karın ağrısı
b Ödem, periferal ödem, gözde ödem, lokalize ödem ve yüzde ödem
c Disguzi, aguzi ve hipoguzi
d Beyaz hücre sayısında azalma, nötrofil sayısında azalma ve lökosit sayısında azalma
e İştah azalması ve anoreksi
f Kardiyak disfonksiyon, sol ventrikül disfonksiyonu, kardiyak yetmezlik ve restriktif kardiyomiyopati
g Venöz tromboembolik olay, derin ven trombozu, pulmoner emboli ve tromboz
Nötropeni, trombositopeni ve palmar- plantar eritrodisestezi sendromu Doğu Asya kökenli hastalarda daha sıklıkla gözlenmiştir.
STS çalışmalarında (n=382) ya da pazarlama sonrası dönemde raporlanan tedavi ile ilişkili advers reaksiyonlar
Enfeksiyonlar ve enfestasyonlar
Yaygın: Gingiva enfeksiyonu
İyi huylu ve kötü huylu neoplazmalar ile tanımlanmamış (kist ve polipler dahil)
Çok yaygın: Tümör ağrısı
Kan ve lenf sistemi hastalıkları
Çok yaygın: Lökopeni, trombositopeni, nötropeni
Yaygın olmayan: Trombotik mikroanjiyopati (trombotik trombositopenik purpura ve hemolitik üremik sendrom dahil)
Endokrin hastalıkları
Yaygın: Hipotiroidizm
Metabolizma ve beslenme hastalıkları
Çok yaygın: Hipoalbuminemif, iştah azalması
Yaygın: Dehidratasyon Yaygın olmayan: Hipomagnezemi
Bilinmiyor: Tümör lizis sendromu*
Psikiyatrik hastalıklar
Yaygın: İnsomnia
Sinir sistemi hastalıkları
Çok yaygın: Tat alma duyusunda bozulmac, baş ağrısı Yaygın: Periferik duyusal nöropati, sersemlik Yaygın olmayan: Somnolans, serebral infarktüs, parestezi
Göz hastalıkları
Yaygın: Bulanık görme
Kardiyak hastalıklar
Yaygın: Kardiyak disfonksiyong, sol ventrikül disfonksiyonu, bradikardi
Yaygın olmayan: Miyokard infarktüsü
Vasküler hastalıklar
Çok yaygın: Hipertansiyon
Yaygın: Venöz tromboembolik olayd, sıcak basması, al basması Yaygın olmayan: Hemoraji
Seyrek: Anevrizmalar ve arter diseksiyonları
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygın: Epistaksis, disfoni, dispne, öksürük, pnömotoraks, hıçkırık, pulmoner hemoraji
Yaygın olmayan: Orofaringeal ağrı, bronşiyal hemoraji, rinore, hemoptizi Seyrek: İnterstisyel akciğer hastalığı/pnömoni†â€
Gastrointestinal hastalıklar
Çok yaygın: Diyare, bulantı, kusma, karın ağrısıa, stomatit
Yaygın: Karın şişliği, ağız kuruluğu, dispepsi, ağızda hemoraji, flatulans,anal hemoraji
Yaygın olmayan: Gastrointestinal hemoraji, rektal hemoraji, enterokutanöz fistül, gastrik hemoraji, melena, özofagus hemorajisi, peritonit, retroperitoneal hemoraji, üst gastrointestinal hemoraji, ileum perforasyonu
Hepato-biliyer hastalıklar
Yaygın olmayan: Anormal hepatik fonksiyon Bilinmiyor: Karaciğer yetmezliği*
Deri ve deri altı doku hastalıkları
Çok yaygın: Saç renginde değişiklik, deride hipopigmentasyon, eksfolyatif döküntü Yaygın: Alopesi, cilt bozukluğuc, cilt kuruluğu, tırnak bozukluğu, pruritus,
eritem, hiperhidrozis
Yaygın olmayan: Cilt ülseri, palmar-plantar eritrodizestezi sendromu, ışığa duyarlılık reaksiyonu, papüler döküntü, döküntü
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları Yaygın: Kas-iskelet ağrısı, miyalji, kas spazmları Yaygın olmayan: Artralji
Böbrek ve idrar yolu hastalıkları
Yaygın olmayan: Proteinüri
Üreme sistemi ve meme hastalıkları
Yaygın olmayan: Vajinal hemoraji, menoraji
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın: Yorgunluk
Yaygın: Ödemb, göğüs ağrısı, ürperme Yaygın olmayan: Mukoza enflamasyonu e, asteni
Araştırmalar
Çok yaygın: Kilo kaybı
Yaygın: Anormal kulak, burun, boğaz muayenesi e, alanin aminotransferaz artışı, anormal kan kolesterol düzeyi, aspartat aminotransferaz artışı, gama glutamiltransferaz artışı
Yaygın olmayan: Kan bilirubin seviyelerinde artış, aspartat aminotransferaz, alanin aminotransferaz, trombosit sayısında düşüş, elektrokardiyogramda QT uzaması
Advers reaksiyonların tablo halinde listesi
Tablo 2. STS çalışmalarında (n=382) ya da pazarlama sonrası dönemde raporlanan tedavi ile ilişkili advers reaksiyonlar
Sistem Organ Sınıfı | Sıklık (tüm evrelerde) | Advers reaksiyon | Tüm evreler | Evre 3 Sayı (%) | Evre 4 Sayı (%) |
Enfeksiyonlar ve enfestasyonlar | Yaygın | Diş eti enfeksiyonu | 4 (<% 1) | 0 | 0 |
İyi huylu ve kötü huylu neoplazmalar (kist ve polipler dahil) | Çok yaygın | Tümör ağrısı | 121 (% 32) | 32 (% 8) | 0 |
Kan ve lenf sistemi hastalıkları | Çok yaygın | Trombositopeni | 86 (% 36) | 7 (% 3) | 2 (<% 1) |
|
| Nötropeni | 79 (% 33) | 10 (% 4) | 0 |
|
| Lökopeni | 106 (% 44) | 3 (% 1) | 0 |
| Yaygın olmayan | Trombotik mikroanjiyopati (trombotik trombositopenik purpura ve hemolitik üremik sendrom | 1 (<% 1) | 1 (<% 1) | 0 |
|
| dahil) |
|
|
|
Endokrin hastalıkları | Yaygın | Hipotiroidizm | 18 (% 5) | 0 | 0 |
Metabolizma ve beslenme hastalıkları | Çok yaygın | İştah azalması | 108 (% 28) | 12 (% 3) | 0 |
|
| Hipoalbüminemi | 81 (% 34) | 2 (<% 1) | 0 |
| Yaygın | Dehidrasyon | 4 (% 1) | 2 (<% 1) | 0 |
| Yaygın olmayan | Hipomagnezemi | 1 (<% 1) | 0 | 0 |
| Bilinmiyor | Tümör lizis sendromu* | Bilinmiyor | Bilinmiyor | Bilinmiyor |
Psikiyatrik hastalıklar | Yaygın | Uykusuzluk | 5 (% 1) | 1 (<% 1) | 0 |
Sinir sistemi hastalıkları | Çok yaygın | Tat alma duyusunda bozulma | 79 (% 21) | 0 | 0 |
|
| Baş ağrısı | 54 (% 14) | 2 (<% 1) | 0 |
| Yaygın | Sersemlik | 15 (% 4) | 0 | 0 |
|
| Periferik duyusal nöropati | 30 (% 8) | 1 (<% 1) | 0 |
| Yaygın olmayan | Parestezi | 1 (<%1) | 0 | 0 |
|
| Uyuklama | 3 (<%1) | 0 | 0 |
|
| Serebral infarktüs | 1 (<%1) | 0 | 1 (<%1) |
Göz hastalıkları | Yaygın | Bulanık görme | 15 (% 4) | 0 | 0 |
Kardiyak hastalıklar | Yaygın | Bradikardi | 4 (% 1) | 0 | 0 |
|
| Kardiyak disfonksiyon | 21 (<% 5) | 3 (<% 1) | 1 (<% 1) |
|
| Sol ventrikül disfonksiyonu | 13 (% 3) | 3 (<% 1) | 0 |
| Yaygın olmayan | Miyokard infarktüsü | 1 (<% 1) | 0 | 0 |
Vasküler hastalıklar | Çok yaygın | Hipertansiyon | 152 (% 40) | 26 (% 7) | 0 |
| Yaygın | Sıcak basması | 12 (% 3) | 0 | 0 |
|
| Al basması | 4 (% 1) | 0 | 0 |
|
| Venöz tromboembolik olaylar | 13 (% 3) | 4 (% 1) | 5 (% 1) |
| Yaygın olmayan | Hemoraji | 2 (<% 1) | 1 (<% 1) | 0 |
| Seyrek | Anevrizmalar ve arter diseksiyonları | Bilinmiyor | Bilinmiyor | Bilinmiyor |
Solunum, göğüs bozuklukları ve mediastinal hastalıklar | Yaygın | Epistaksis | 22 (% 6) | 0 | 0 |
|
| Disfoni | 20 (% 6) | 0 | 0 |
|
| Dispne | 14 (% 4) | 3 (<% 1) | 0 |
|
| Öksürük | 12 (% 3) | 0 | 0 |
|
| Pnömotoraks | 7 (% 2) | 2 (<% 1) | 1 (<% 1) |
|
| Hıçkırık | 4 (% 1) | 0 | 0 |
|
| Pulmoner hemoraji | 4 (% 1) | 1 (<% 1) | 0 |
| Yaygın olmayan | Orofaringeal ağrı | 3 (<% 1) | 0 | 0 |
|
| Bronşiyal hemoraji | 2 (<% 1) | 0 | 0 |
|
| Rinore | 1 (<% 1) | 0 | 0 |
|
| Hemoptizi | 1 (<% 1) | 0 | 0 |
| Seyrek | İnterstisyel akciğer hastalığı/ pnömoni †| Bilinmiyor | Bilinmiyor | Bilinmiyor |
Gastrointestinal hastalıklar | Çok yaygın | Diyare | 174 (% 46) | 17 (% 4) | 0 |
|
| Bulantı | 167 (% 44) | 8 (% 2) | 0 |
|
| Kusma | 96 (% 25) | 7 (% 2) | 0 |
|
| Karın ağrısı | 55 (% 14) | 4 (% 1) | 0 |
|
| Stomatit | 41 (% 11) | 1 (<% 1) | 0 |
| Yaygın | Karın şişliği | 16 (% 4) | 2 (% 1) | 0 |
|
| Ağız kuruluğu | 14 (% 4) | 0 | 0 |
|
| Dispepsi | 12 (% 3) | 0 | 0 |
|
| Ağızda hemoraji | 5 (% 1) | 0 | 0 |
|
| Flatulans | 5 (% 1) | 0 | 0 |
|
| Anal hemoraji | 4 (% 1) | 0 | 0 |
| Yaygın olmayan | Gastrointestinal hemoraji | 2 (<% 1) | 0 | 0 |
|
| Rektal hemoraji | 2 (<% 1) | 0 | 0 |
|
| Enterokutan fistül | 1 (<% 1) | 1 (<% 1) | 0 |
|
| Gastrik hemoraji | 1 (<% 1) | 0 | 0 |
|
| Melena | 2 (<% 1) | 0 | 0 |
|
| Özofagus hemorajisi | 1 (<% 1) | 0 | 1 (<% 1) |
|
| Peritonit | 1 (<% 1) | 0 | 0 |
|
| Retroperitoneal hemoraji | 1 (<% 1) | 0 | 0 |
|
| Üst gastrointestineal hemoraji | 1 (<% 1) | 1 (<% 1) | 0 |
|
| İleum perforasyonu | 1 (<% 1) | 0 | 1 (<% 1) |
Hepato-biliyer hastalıklar | Yaygın olmayan | Anormal hepatik fonksiyon | 2 (<% 1) | 0 | 1 (<% 1) |
| Bilinmiyor | Karaciğer yetmezliği* | Bilinmiyor | Bilinmiyor | Bilinmiyor |
Deri ve deri altı doku hastalıkları | Çok yaygın | Saç renginde değişiklik | 93 (% 24) | 0 | 0 |
|
| Deride hipopigmentasyon | 80 (% 21) | 0 | 0 |
|
| Eksfolyatif döküntü | 52 (% 14) | 2 (<% 1) | 0 |
| Yaygın | Alopesi | 30 (% 8) | 0 | 0 |
|
| Cilt bozukluğu | 26 (% 7) | 4 (% 1) | 0 |
|
| Cilt kuruluğu | 21 (% 5) | 0 | 0 |
|
| Tırnak bozukluğu | 13 (% 3) | 0 | 0 |
|
| Pruritus | 11 (% 3) | 0 | 0 |
|
| Eritem | 4 (% 1) | 0 | 0 |
|
| Hiperhidroz | 18 (% 5) | 0 | 0 |
| Yaygın olmayan | Cilt ülseri | 3 (<% 1) | 1 (<% 1) | 0 |
|
| Palmar-plantar eritrodizestezi sendromu | 2 (<% 1) | 0 | 0 |
|
| Işığa duyarlılık reaksiyonu | 1 (<% 1) | 0 | 0 |
|
| Papüler döküntü | 1 (<% 1) | 0 | 0 |
|
| Döküntü | 1 (<% 1) | 0 | 0 |
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları | Yaygın | Kas-iskelet ağrısı | 35 (% 9) | 2 (<% 1) | 0 |
|
| Miyalji | 28 (% 7) | 2 (<% 1) | 0 |
|
| Kas spazmları | 8 (% 2) | 0 | 0 |
| Yaygın olmayan | Artralji | 2 (<% 1) | 0 | 0 |
Böbrek ve idrar yolu hastalıkları | Yaygın olmayan | Proteinüri | 2 (<% 1) | 0 | 0 |
Üreme ve meme hastalıkları | Yaygın olmayan | Vajinal hemoraji | 3 (<% 1) | 0 | 0 |
|
| Menoraji | 1 (<% 1) | 0 | 0 |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | Çok yaygın | Yorgunluk | 178 (% 47) | 34 (% 9) | 1 (<% 1) |
| Yaygın | Ödem | 18 (% 5) | 1 (<% 1) | 0 |
|
| Göğüs ağrısı | 12 (% 3) | 4 (% 1) | 0 |
|
| Ürperme | 10 (% 3) | 0 | 0 |
| Yaygın olmayan | Mukoza enflamasyonu | 1 (<% 1) | 0 | 0 |
|
| Asteni | 1 (<% 1) | 0 | 0 |
Araştırmalar | Çok yaygın | Kilo kaybı | 86 (% 23) | 5 (% 1) | 0 |
| Yaygın | Anormal kulak, burun, boğaz muayenesi | 29 (% 8) | 4 (% 1) | 0 |
|
| Alanin aminotransferaz artışı | 8 (% 2) | 4 (% 1) | 0 |
|
| Anormal kan kolesterol düzeyi | 6 (% 2) | 0 | 0 |
|
| Aspartat aminotransferaz artışı | 5 (% 1) | 2 (<% 1) | 2 (<% 1) |
|
| Gama glutamiltransferaz artışı | 4 (% 1) | 0 | 3 (<% 1) |
| Yaygın olmayan | Kan bilirubin seviyelerinde artış | 2 (<% 1) | 0 | 0 |
|
| Aspartat aminotransferaz | 2 (<% 1) | 0 | 2 (<% 1) |
|
| Alanin aminotransferaz | 1 (<% 1) | 0 | 1 (<% 1) |
|
| Trombosit sayısında düşüş | 1 (<% 1) | 0 | 0 |
|
| Elektrokardiyogramda QT uzaması | 2 (<% 1) | 1 (<% 1) | 0 |
†Pazarlama sonrası dönemde bildirilen tedavi ile ilişkili advers reaksiyon (tüm pazopanib klinik çalışmalarından spontan olgu raporları ve ciddi advers reaksiyonlar).
*Yalnızca pazarlama sonrası dönemde bildirilmiş tedaviyle ilişkili advers reaksiyon. Sıklık mevcut verilerden tahmin edilemez.
Aşağıdaki terimler birleştirilmiştir:
a Karın ağrısı, üst karın ağrısı ve gastrointestinal ağrı
b Ödem, periferik ödem, gözkapağı ödemi
c Bu olguların büyük çoğunluğu Palmar-plantar eritrodisestezi sendromudur
d Venöz tromboembolik olaylar –Derin ven trombozu, Pulmoner embolizm ve Tromboz terimlerini içerir
e Bu olayların büyük çoğunluğu mukozit tariflemektedir
f Sıklık, VEG110727 çalışmasının laboratuvar değerleri tablolarına dayanmaktadır (N=240). Bunlar araştırmacılar tarafından advers olay olarak laboratuvar değerleri tablolarının gösterdiğinden daha düşük sıklıkla bildirilmiştir.
g Kardiyak fonksiyon bozukluğu olayları – Sol ventriküler disfonksiyon, Kalp yetmezliği ve Restriktif kardiyomiyopati terimlerini içerir.
h Sıklık, araştırmacılar tarafından bildirilen advers olaylara dayanmaktadır. Laboratuvar anormallikleri araştırmacılar tarafından advers olay olarak laboratuvar değerleri tablolarının gösterdiğinden daha düşük sıklıkla bildirilmiştir.
Nötropeni, trombositopeni ve palmar- plantar eritrodisestezi sendromu Doğu Asya kökenli hastalarda daha sıklıkla gözlenmiştir.
Pediatrik popülasyon
Pediyatrik hastalardaki güvenlilik profili, ADVL0815 Faz I çalışmasından 44 pediyatrik hasta ve PZP034X2203 Faz II çalışmasından 57 pediyatrik hastadan alınan verilere dayalı olarak onaylanmış endikasyonlarda erişkinlerde pazopanib ile bildirilenle benzerdir (bkz. Bölüm 5.1).
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
2000 mg'a kadar olan pazopanib dozları klinik çalışmalarda değerlendirilmiştir. Günde 2000 mg ve 1000 mg doz uygulanmış 3 hastadan 1'inde sırasıyla Derece 3 yorgunluk (doz sınırlayıcı toksisite) ve Derece 3 hipertansiyon gözlenmiştir.
Tedavisi
Pazopanib doz aşımı için spesifik antidot mevcut değildir ve doz aşımı vakalarında genel destekleyici önlemlerle tedavi uygulanmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Antineoplastik ve immunomodülatör ajanlar, antineoplastik ajanlar, protein kinaz inhibitörleri, diğer protein-kinaz inhibitörleri
ATC kodu: L01EX03
Etki mekanizması
Pazopanib oral yolla uygulamaya yönelik, sırasıyla 10, 30, 47, 71, 84 ve 74 nanomolarlık ICdeğerleri ile Vasküler Endotelyal Büyüme Faktör Reseptörleri (VEGFR)-1, -2 ve -3, platelet- kaynaklı büyüme faktörü (PDGFR)-α ve –β ve kök hücre faktör reseptörünün (c-KIT) potent çok hedefli tirozin kinaz inhibitörüdür (TKI). Preklinik deneylerde pazopanib hücrelerde VEGFR-2, c-Kit ve PDGFR-β reseptörlerin ligand kaynaklı oto-fosforilasyonunu doza bağlı şekilde inhibe etmiştir. İn vivo, pazopanib fare akciğerlerinde VEGF-kaynaklı VEGFR-2 fosforilasyonu, çeşitli hayvan modellerinde anjiyogenezi ve farelerde çoklu insan tümör ksenogreftlerinin büyümesini inhibe etmiştir.
Farmakogenomik
Monoterapi olarak ya da başka ajanlarla kombinasyon halinde uygulanan pazopanib ile yürütülen 31 klinik çalışmanın verileri üzerinde gerçekleştirilen bir farmakogenomik meta- analizde 5 x ULN'nin üzerinde (NCI CTC Derece 3) ALT değerleri, HLA-B*57:01 alel taşıyıcılarının %19'unda ve taşıyıcı olmayanların %10'unda görülmüştür. Bu veri grubunda hastaların 133/2235'i (%6) HLA-B*57:01 aleli taşıyıcısıdır (bkz. Bölüm 4.4).
Klinik Çalışmalar
Renal Hücre Kanseri (RCC)
Pazopanibin güvenlilik ve etkililiği bir randomize, çift kör, plasebo kontrollü çok merkezli çalışmada renal hücre kanserinde (RCC) değerlendirilmiştir. Lokal olarak ilerlemiş ve/veya metastatik RCC hastaları (N= 435) günde bir kez pazopanib 800 mg veya plasebo uygulanmak üzere randomize edilmiştir. Çalışmanın birincil amacı, progresyonsuz sağkalım (PFS) açısından iki tedavi kolunu değerlendirmek ve karşılaştırmak olmuştur ve ana ikincil sonlanma noktası genel sağkalım (OS) olarak belirlenmiştir. Diğer amaçlar, genel yanıt oranını ve yanıt süresini değerlendirmek olmuştur.
Bu çalışmadaki toplam 435 hastadan 233'üne daha önce tedavi uygulanmamış olup 202 hastada daha önce bir IL-2 veya INFα-bazlı tedavi uygulanmıştır. Performans durumu (ECOG), pazopanib ve plasebo grupları arasında benzer olmuştur (ECOG 0: % 42'ye karşı % 41, ECOG 1: % 58'e karşı % 59). Hastaların büyük çoğunluğunda ya olumlu (% 39) ya da orta (% 54) MSKCC (Memorial Sloan Kettering Kanser Merkezi) / Motzer prognostik faktörleri söz konusu olmuştur. Tüm hastalarda berrak hücreli histoloji veya ağırlıklı olarak berrak hücreli histoloji belirlenmiştir. Hastaların yaklaşık yarısında 3 veya daha fazla organda hastalık tutulumu tespit edilmiştir ve çoğu hastada, çalışma başlangıcında metastaz yeri olarak akciğer (% 74) ve/veya lenf düğümleri (% 54) söz konusu olmuştur.
Her iki kolda benzer oranda hasta önceden tedavi görmemiştir veya sitokin ön tedavisi almıştır (pazopanib kolunda % 53 ve % 47, plasebo kolunda % 54 ve % 46 ). Sitokin ön tedavisi alan alt grupta hastaların büyük çoğunluğu (% 75) interferon bazlı tedavi görmüştür.
Her iki kolda benzer oranlarda hasta önceden nefrektomi olmuş (pazopanib ve plasebo kollarında sırasıyla % 89 ve % 88) ve/veya önceden radyoterapi görmüştür (pazopanib ve plasebo kollarında sırasıyla % 22 ve % 15).
Birincil sonlanma noktası PFS'nin birincil analizi, tüm çalışma popülasyonunda (tedavi görmemiş veya sitokin ön tedavisi almış) bağımsız radyolojik değerlendirme ile hastalık değerlendirmesine dayalıdır.
Tablo 3. Bağımsız değerlendirme ile RCC'de genel etkililik bulguları (VEG105192)
Sonlanma Noktaları/Çalışma Popülasyonu | Pazopanib | Plasebo | HR (% 95 GA) | P değeri (tek yönlü) |
PFS |
|
|
|
|
Genel * ITT | N = 290 | N = 145 |
|
|
Ortalama (ay) | 9,2 | 4,2 | 0,46 (0,34; 0,62) | <0,0000001 |
Yanıt oranı | N = 290 | N = 145 |
|
|
% (% 95 GA) | 30 (25,1; 35,6) | 3 (0,5, 6,4) | – | <0,001 |
HR = Risk oranı; ITT = Tedavi amaçlı; PFS = İlerlemesiz sağkalım. * - Tedavi Uygulanmamış ve Sitokin Uygulanmış Popülasyonlar, GA = Güven Aralığı | ||||
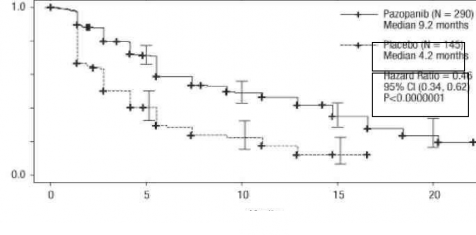
Şekil 1. Genel popülasyon için (tedavi uygulanmamış ve sitokin uygulanmış popülasyonlar) bağımsız değerlendirme ile ilerlemesiz sağkalım için Kaplan-Meier eğrisi (VEG105192)
Şekil 2. Tedavi uygulanmamış popülasyon için bağımsız değerlendirme ile ilerlemesiz sağkalım için Kaplan-Meier eğrisi (VEG105192)
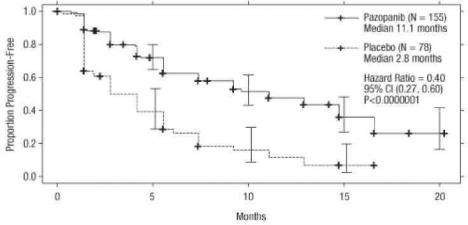
Şekil 3. Sitokin uygulanmış popülasyon için bağımsız değerlendirme ile ilerlemesiz sağkalım için Kaplan-Meier eğrisi
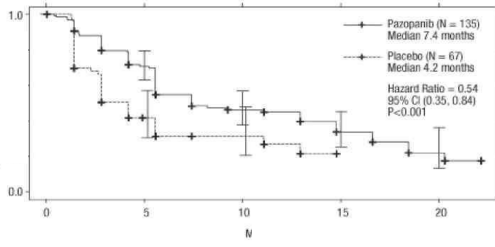
Tedaviye yanıt veren hastalar için yanıt elde edilene kadar geçen ortalama süre bağımsız incelemeye göre 11,9 hafta ve ortalama yanıt süresi 58,7 haftaydı (VEG105192). Protokolde belirtilmiş nihai sağ kalım analizindeki ortalama genel sağkalım (OS) verisi, pazopanib ve plasebo kollarına randomize edilmiş hastalar için sırasıyla 22,9 ay ve 20,5 aydır [HR = 0,91 (% 95 GA: 0,71, 1,16; p = 0,224)]. Plasebo kolundaki hastaların % 54'ü, hastalığın ilerlemesi üzerine bu çalışmanın uzatma kısmında pazopanib almış oldukları için, OS sonuçları potansiyel sapmaya tabidir. Plasebo hastalarının % 66'sı, pazopanib alan hastaların % 30'una kıyasla, çalışma sonrası tedavi almışlardır.
EORTC QLQ-C30 ve EuroQoL EQ-5D kullanılarak ölçülen Global Yaşam Kalitesinde tedavi grupları arasında istatistiksel farklılıklar gözlenmemiştir.
Lokal nükslü ya da metastatik berrak hücreli renal hücre karsinomu olan 225 hastanın yer aldığı bir Faz 2 çalışmada, bağımsız değerlendirmeye göre objektif yanıt oranı % 35 ve medyan yanıt süresi 68 hafta olmuştur. Medyan PFS 11,9 ay bulunmuştur.
Sunitinibe karşı pazopanibin güvenliliği, etkililiği ve kalitesi randomize, açık etiketli, paralel gruplu Faz III bir “eşdeğerlik†çalışmasında (VEG108844) değerlendirilmiştir.
VEG108844'te, daha önce sistemik tedavi görmemiş lokal ilerleme gösteren ve/veya metastatik RCC'li hastalar (N = 1110), 4 haftalık tedaviyi takiben 2 haftalık tedavisiz dönem şeklinde 6 haftalık sikluslar ile günde bir kez 50 mg sunitinib veya kesintisiz günde 1 kez 800 mg pazopanib kullanımına randomize edilmiştir.
Bu çalışmanın birincil hedefi pazopanib ile tedavi edilen hastalarda PFS'nin değerlendirilmesi ve sunitinib ile tedavi edilenlerle karşılaştırılmasıdır. Demografik özellikler tedavi kolları arasında benzerdir. İlk tanıda ve taramadaki hastalık özellikleri tedavi kolları arasında dengeli olup, hastaların büyük kısmında berrak hücreli histoloji ve Evre IV hastalık mevcuttur.
VEG108844 birincil sonlanım noktası PFS'yi elde etmiş ve tehlike oranı için % 95 GA'nın üst sınırı protokolde belirtilen eşdeğerlik sınırı 1,25 değerinden düşük olduğu için pazopanibin sunitinibe eşdeğer olduğunu kanıtlamıştır. Genel etkililik bulguları Tablo 2'de özetlenmektedir.
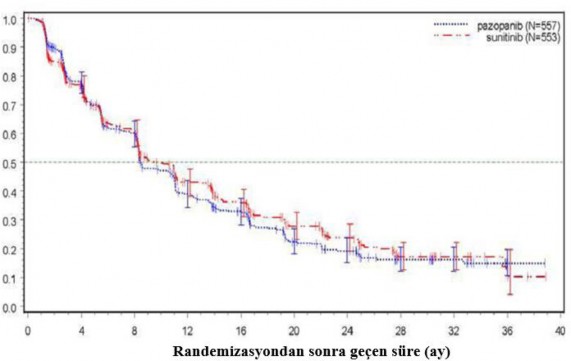
Tablo 4. Genel etkililik bulguları (VEG108844)
Sonlanım noktası | Pazopanib N=557 | Sunitinib N=553 | HR (% 95 GA) |
PFS |
|
|
|
Genel |
|
|
|
Medyan (ay) | 8,4 | 9,5 | 1,047 |
(% 95 GA) | (8,3, 10,9) | (8,3, 11) | (0,898, 1,22) |
Genel Sağkalım |
|
|
|
Medyan (ay) | 28,3 | 29,1 | 0,915 |
(% 95 GA) | (26, 35,5) | (25,4, 33,1) | (0,786, 1,065) |
HR = Tehlike Oranı; PFS = Bağımsız inceleme komitesi (IRC) değerlendirmesine dayalı olarak Progresyonsuz Sağkalım, GA = Güven Aralığı P değeri = 0,245 (çift yönlü) | |||
Şekil 4. Genel popülasyon için bağımsız değerlendirme ile progresyonsuz sağ kalım için Kaplan-Meier eğrisi (VEG108844)
20 demografik ve prognostik faktör için PFS'nin alt grup analizleri gerçekleştirilmiştir. Tüm alt grupların % 95 güven aralıkları 1 risk oranını içermektedir. Bu 20 alt grubun en küçük üçünde risk oranı için nokta tahmini 1,25'i aşmıştır; yani önceden nefrektomi olmamış(n=186, HR=1,403, % 95 GA (0,955, 2,061)), başlangıç LDH değeri > 1,5 x ULN (n=68, HR=1,72, % 95 GA (0,943, 3,139)) ve MSKCC: zayıf risk (n=119, HR=1,472, 95 %
GA (0,937, 2,313)) değerleri olan hastalar.
Yumuşak Doku Sarkomu (Soft Tissue Sarcoma – STS)
Pazopanibin STS'deki etkililiği ve güvenliliği randomize, çift kör, plasebo kontrollü, çok merkezli bir pivot faz III çalışmada değerlendirilmiştir (VEG110727). İlerlemiş STS'si olan toplam 369 hasta günde bir kez pazopanib 800 mg veya plasebo almak üzere randomize
edilmiştir. Önemli bir nokta olarak, bu çalışmaya sadece STS'nin selektif histolojik alt tiplerine sahip hastaların katılmasına izin verilmiştir; bu nedenle, pazopanibin etkililiği ve güvenliliğinin sadece bu alt STS grupları için tespit edildiği kabul edilebilir ve pazopanib ile tedavinin bu STS alt tipleri ile sınırlandırılması gerekir.
Aşağıdaki tümör tipleri uygun görülmüştür:
Fibroblastik (erişkin fibrosarkomu, miksofibrosarkomu, sklerozan epitelioid fibrosarkom, malign soliter fibroz tümörler), fibrohistiyositik (pleomorfik malign fibröz histiositom [MFH], dev hücreli MFH (indiferansiye pleomorfik sarkom (UPS) olarak da bilinir), enflamatuvar MFH), leiomyosarkom, malign glomus tümörleri, iskelet kasları (pleomorfik ve alveolar rabdomiosarkom), vasküler (epitelioid hemanjioendotelyoma, anjiyosarkom), kesin olmayan diferansiyasyon (sinoviyal, epitelioid, alveolar yumuşak kısım, berrak hücre, desmoplastik küçük yuvarlak hücre, ekstra-renal rabdoid, malign mezenkimom, PEComa, intimal sarkom), malign periferik sinir kılıfı tümörleri, başka bir tanıma uymayan (NOS) farklılaşmamış (indiferansiye) yumuşak doku sarkomları ve diğer sarkom tipleri (uygun olmayan listesine dahil edilmeyen).
Aşağıdaki tümör tiplerinin uygun olmadığı değerlendirilmiştir:
Adipositik sarkom (tüm alt tipleri), alveolar veya pleomorfik olmayan tüm rabdomiosarkomlar, kondrosarkom, osteosarkom, Ewing tümörleri/Primitif nöroektodermal tümörler (PNET), GIST, dermofibromatoz sarkom protüberans, enflamatuvar miyofibroblastik sarkom, malign mezoteliom ve karma mezodermal rahim tümörleri.
Not: Adipositik sarkomu olan hastalar, bir preliminer faz II çalışmada (VEG20002) olduğu gibi pivot faz III çalışmanın da dışında tutulmuştur; adipositikte pazopanib ile gözlenen aktivite (hafta 12'de PFS), ek klinik testlere izin verilmesi için gerekli ön şart olan oranı karşılamamıştır.
VEG110727 çalışmasının diğer önemli uygunluk kriterleri şunlardır: Metastatik hastalığa yönelik tedavinin ilk 6 ayı içerisinde yüksek ya da orta dereceli malign STS yönünde histolojik kanıt veya hastalık progresyonu veya (neo)-/adjuvan tedavinin ilk 12 ayı içerisinde tekrarlama.
Gönüllülerin % 98'si önceden doksorubisin, % 70'i önceden ifosfamid almıştır ve % 65'i çalışmaya alınmadan önce en az 3 veya daha fazla kemoterapi ajanı kullanmıştır.
Hastalar, başlangıçtaki WHO performans durumu (WHO PS) (0 veya 1) faktörlerine ve ilerlemiş hastalığa yönelik önceki sistemik tedavi basamağı sayısına (0 veya 1 karşısında 2+) göre sınıflandırılmıştır. Her tedavi grubunda ilerlemiş hastalık için önceden 2+ basamak sistemik tedavi görmüş olan hastaların yüzdesi, önceden 0 veya 1 basamak sistemik tedavi görmüş olan hastalar ile karşılaştırıldığında (plasebo ve pazopanib tedavi kolları için sırasıyla
% 42 ve % 45) hafif daha yüksek bulunmuştur (plasebo ve pazopanib tedavi kolları için sırasıyla % 58 ve % 55). Hastaların medyan takip süresi (randomizasyon tarihinden son iletişim veya ölçüme kadar geçen süre şeklinde tanımlı) iki tedavi kolu arasında benzer olmuştur (plasebo için 9,36 ay [aralık: 0,69 ila 23 ay] ve pazopanib için 10,04 ay [aralık: 0,2 ila 24,3 ay].
Çalışmanın birincil amacı progresyonsuz sağkalım değerlendirmesidir (bağımsız radyolojik inceleme ile değerlendirilen PFS); ikincil sonlanma noktaları genel sağkalımı (OS), genel yanıt oranını ve yanıt süresini içermiştir.
Tablo 5. Bağımsız değerlendirme ile STS'de genel etkinlik bulguları (VEG110727)
Sonlanma noktaları/ çalışma popülasyonu | Pazopanib | Plasebo | HR (% 95 GA) | P değeri (çift taraflı) | ||
PFS |
|
|
|
| ||
Genel ITT | N = 246 | N = 123 |
|
| ||
Medyan (ay) | 20,0 | 7,0 | 0,35 (0,26, 0,48) | < 0,001 | ||
Leiomyosarkom | N = 109 | N = 49 |
|
| ||
Medyan (ay) | 20,1 | 8,1 | 0,37 (0,23, 0,60) | < 0,001 | ||
Sinoviyal grupları | sarkom | alt | N = 25 | N = 13 |
|
|
Medyan (ay) | 17,9 | 4,1 | 0,43 (0,19, 0,98) | 0,005 | ||
‘Diğer STS' alt grupları | N = 112 | N = 61 |
|
| ||
Medyan (ay) | 20,1 | 4,3 | 0,39 (0,25, 0,6) | < 0,001 | ||
OS |
|
|
|
| ||
Genel ITT | N = 246 | N = 123 | 0,87 (0,67, 1,12) | 0,256 | ||
Medyan (ay) | 12,6 | 10,7 |
|
| ||
Leiomyosarkom* | N = 109 | N = 49 | 0,84 (0,56, 1,26 | 0,363 | ||
Medyan (ay) | 16,7 | 14,1 |
|
| ||
Sinoviyal | sarkom | alt | N = 25 | N = 13 | 1,62 (0,79, 3,33) | 0,115 |
grupları* | 8,7 | 21,6 |
|
| ||
Medyan (ay) |
|
|
|
| ||
| N = 112 | N = 61 | 0,84 (0,59, 1,21) | 0,325 | ||
‘Diğer STS' alt grupları* | 10,3 | 9,5 |
|
| ||
Medyan (ay) |
|
|
|
| ||
Yanıt Oranı (CR+PR) |
|
0 (0,0, 3) |
|
| ||
% (% 95 GA) | 4 (2,3, 7,9) | |||||
Yanıt süresi |
| |||||
Medyan (hafta) (% 95 GA) | 38,9 (16,7, 40) | |||||
HR = Tehlike oranı; ITT = Tedavi amaçlı; PFS = Progresyonsuz sağ kalım; CR = Tam yanıt; PR = Kısmi yanıt, GA = Güven Aralığı; OS = Genel sağkalım * İlgili STS histolojik alt grupları (leiomysosarkom, sinoviyal sarkom ve “Diğer†STS) için genel sağkalım, düşük olgu sayısı ve geniş güven aralıkları nedeniyle dikkatle yorumlanmalıdır. | ||||||
Plasebo kolu ile karşılaştırıldığında pazopanib kolunda, araştırmacı değerlendirmesine dayalı olarak PFS'de benzer bir iyileşme gözlenmiştir (genel ITT popülasyonunda HR: 0,39; % 95 GA, 0.30 ila 0.52, p <0.001).
Şekil 5. Genel popülasyon için bağımsız değerlendirme ile STS'de progresyonsuz sağ kalım için Kaplan-Meier eğrisi (VEG110727)
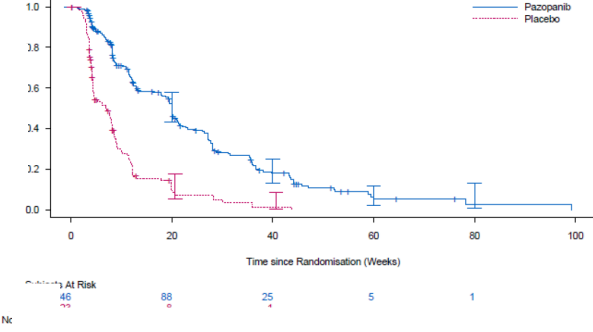
Olayların % 76'sı (280/369) meydana geldikten sonra yürütülen nihai OS analizinde iki tedavi kolu arasında OS açısından anlamlı bir fark gözlenmemiştir (HR 0,87, % 95 GA 0,67, 1,12 p=0,256).
Pediatrik popülasyon
Pazopanib ile ilgili bir Faz I çalışma (ADVL0815), çeşitli tekrarlayan veya dirençli katı tümörleri olan 44 pediatrik hastada yürütülmüştür. Birincil amaç, çocuklarda pazopanibin maksimum tolere edilen dozu (MTD), güvenlilik profilini ve farmakokinetik özelliklerini araştırmak olmuştur. Bu çalışmada medyan maruz kalma süresi 3 aydır (1-23 ay).
Rabdomyosarkom (N=12), rabdomyosarkom dışı yumuşak doku sarkomu (N=11), Ewing sarkomu/pPNET (N=10), osteosarkom (N=10), nöroblastom (N=8) ve hepatoblastom (N=6) dahil olmak üzere refrakter solid tümörü olan 57 pediatrik hastada pazopanib ile ilgili bir Faz
II çalışma (PZP034X2203) yürütülmüştür. Çalışma, pazopanibin 1 ila <18 yaş arası çocuklarda ve adölesanlarda terapötik aktivitesini belirlemek için yapılan tek ajanlı, kontrolsüz, açık etiketli bir çalışmadır. Pazopanib tablet olarak günlük 450 mg/m2/doz dozunda veya oral süspansiyon olarak 225 mg/m2/doz olarak uygulanmıştır. İzin verilen maksimum günlük doz, tablet için 800 mg ve oral süspansiyon için 400 mg'dır. Medyan maruz kalma süresi 1.8 aydır (1 gün-29 ay).
Bu çalışmanın sonuçları, ilgili pediatrik popülasyonda herhangi bir anlamlı anti-tümör aktivitesi göstermemiştir. Bu nedenle pazopanib, pediatrik popülasyonda bu tümörlerin tedavisi için önerilmemektedir (pediatrik kullanım hakkında bilgi için bkz. Bölüm 4.2).
Avrupa İlaç Ajansı, böbrek ve renal pelvis karsinomunun (nefroblastom, nefroblastomatozis, berrak hücreli sarkom, mezoblastik nefrom, renal medüller karsinom ve böbreğin rabdoid tümörü hariç) tedavisinde pediatrik popülasyonun tüm alt gruplarında Votrient ile yapılan çalışmaların sonuçlarını sunma zorunluluğundan vazgeçmiştir (pediatrik kullanım hakkında bilgi için bkz. bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
800 mg tek doz pazopanibin solid tümörlü hastalara oral yoldan uygulanmasını takiben, ortalama 3,5 saat sonra (1 ila 11,9 saat aralığında) yaklaşık 19 ± 13 mikrogram/mL'lik maksimum plazma konsantrasyonu (C) ve yaklaşık 650 ± 500 mikrogram.saat/ml'lik EEAelde edilmiştir. Günlük dozlama EAA'da 1,23- ila 4 kat artışa neden olur.
EAA veya Cdeğerlerinde 800 mg'ın üstündeki pazopanib dozlarında tutarlı artış mevcut değildir.
Pazopanib için sistemik maruziyet gıdalarla birlikte uygulandığında artmaktadır. Yüksek oranda veya düşük oranda yağ içeren öğünlerle birlikte pazopanib uygulanımı EAA ve Cdeğerlerinde yaklaşık 2 kat artışa neden olmuştur. Bu nedenle pazopanib öğünlerden en az 1 saat önce veya 2 saat sonra uygulanmalıdır (bkz. Bölüm 4.2).
Bütün olarak uygulanan tablet ile kıyaslandığında, parçalanmış bir tek pazopanib 400 mg tabletin uygulanması, EAA'yı % 46 ve C'ı yaklaşık 2 kat artırmış ve t'ı yaklaşık 2 saat azaltmıştır. Bu sonuçlar, tabletlerin bütün uygulanmasına kıyasla parçalanarak uygulanmasının ardından biyoyararlanımın ve pazopanibin oral absorpsiyon hızının arttığını göstermektedir (bkz. Bölüm 4.2).
Dağılım:
Pazopanibin insan plazma proteinine in vivo bağlanması % 99'dan yüksek olup, 10-100 mikrogram/mL üzerindeki aralıkta konsantrasyona bağlı değildir. İn vitro çalışmalar pazopanibin P-gp ve BCRP için bir substrat olduğunu düşündürmektedir.
Biyotransformasyon:
İn vitro çalışmalar pazopanib metabolizmasına esas olarak CYP3A4'ün aracılık ettiğini ve CYP1A2 ve CYP2C8 enzimlerinin minör katkıda bulunduğunu göstermiştir. Dört temel pazopanib metaboliti plazmadaki maruziyetin sadece % 6'sını oluşturmaktadır. Bu metabolitlerden biri, VEGF ile uyarılan insan umblikal ven endotel hücrelerinin çoğalmasını pazopanibinkine benzer bir potens ile inhibe ederken diğerleri 10 ila 20 kat daha az aktiftirler. Bu nedenle, pazopanibin aktivitesi temel olarak ana pazopanib maruziyetine dayanmaktadır.
Eliminasyon:
Pazopanib önerilen 800 mg dozunun uygulanmasından sonra ortalama 30,9 saatlik yarılanma ömrü ile yavaş elimine edilmektedir. Eliminasyon esas olarak feçes aracılığıyla gerçekleşmekte olup, renal eliminasyon yolu uygulanan dozun < % 4'ünü oluşturmaktadır.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Sonuçlar, oral uygulanmış pazopanib dozunun % 4'den azının pazopanib ve metabolitleri şeklinde idrar ile atıldığını göstermektedir. Popülasyon farmakokinetik modellemesinden elde edilen sonuçlar doğrultusunda (başlangıç CLCR değerleri 30.8 mL/dak ila 150 mL/dak aralığında değişen deneklerden elde edilen veriler) böbrek yetmezliğinin pazopanib farmakokinetiği üzerinde klinik olarak anlamlı bir etkisinin olması beklenmemektedir. Kreatinin klirensi 30 mL/ dakika'nın üzerinde olan hastalarda dozaj ayarlaması gerekli değildir. Kreatinin klirensi 30 ml/dakika'nın altında olan hastalarda, bu hasta popülasyonunda
pazopanib ile deneyim bulunmadığı için dikkatli olunması tavsiye edilir (bkz. Bölüm 4.2).
Karaciğer yetmezliği:
Hafif:
Günde bir kez 800 mg uygulandıktan sonra karaciğer parametrelerinde hafif anormallikler (normal bilirubin ve herhangi bir derece ALT yükselmesi şeklinde veya ALT değeri fark etmeksizin bilirubin düzeyinde 1,5 x ULN'ye kadar yükselme şeklinde tanımlı) olan hastalarda pazopanibin medyan kararlı durum Cve EAAdeğerleri, karaciğer fonksiyonu normal olan hastalardaki medyan değere benzerdir (bkz. Tablo 4). Günde bir kez 800 mg pazopanib, serum karaciğer testlerinde hafif anormallikler olan hastalarda önerilen dozdur (bkz. Bölüm 4.2).
Orta dereceli:
Orta dereceli karaciğer bozukluğu (ALT değeri fark etmeksizin bilirubin düzeyinde >1,5 x ila 3 x ULN yükselme şeklinde tanımlı) olan hastalarda maksimum tolere edilen pazopanib dozu (MTD) günde bir kez 200 mg olmuştur. Günde bir kez 200 mg uygulandıktan sonra orta dereceli karaciğer bozukluğu olan hastalarda pazopanibin medyan kararlı durum Cve EAAdeğerleri, karaciğer fonksiyonu normal olan hastalarda günde bir kez 800 mg uygulanmasından sonraki karşılık gelen medyan değerlerin sırasıyla yaklaşık % 44 ve % 39'udur (bkz. Tablo 4).
Güvenlilik ve tolerabilite verilerine dayalı olarak, orta dereceli karaciğer bozukluğu olan hastalarda pazopanib dozajı günde bir kez 200 mg'a düşürülmelidir (bkz. Bölüm 4.2).
Şiddetli:
Günde bir kez 200 mg uygulandıktan sonra şiddetli karaciğer bozukluğu olan hastalarda pazopanibin medyan kararlı durum Cve EAAdeğerleri, karaciğer fonksiyonu normal olan hastalarda günde bir kez 800 mg uygulanmasından sonraki karşılık gelen medyan değerlerin sırasıyla yaklaşık % 18 ve % 15'idir. Azalan maruziyete ve sınırlı hepatik rezerve dayalı olarak pazopanib, şiddetli karaciğer bozukluğu (ALT değeri fark etmeksizin toplam bilirubin düzeyinin > 3 × ULN olması) olan hastalarda önerilmemektedir (bkz. Bölüm 4.2).
Tablo 6. Karaciğer bozukluğu olan hastalarda ölçülen medyan kararlı durum pazopanib farmakokinetiği
Grup | İncelenen doz | C(mikrogram/ml) | EAA (0-24) (mikrogram × saat/ml) | Önerilen doz |
Normal hepatik fonksiyon | 800 mg OD | 52 (17,1-85,7) | 888,2 (345,5-1482) | 800 mg OD |
Hafif karaciğer bozukluğu | 800 mg OD | 33,5 (11,3-104,2) | 774,2 (214,7-2034,4) | 800 mg OD |
Orta dereceli karaciğer bozukluğu | 200 mg OD | 22,2 (4,2-32,9) | 256,8 (65,7-487,7) | 200 mg OD |
Şiddetli karaciğer bozukluğu | 200 mg OD | 9,4 (2,4-24,3) | 130,6 (46,9-473,2) | Kullanımı önerilmez |
OD – Günde bir kez | ||||
Pediatrik popülasyon
Pediatrik hastalarda pazopanib 225 mg/m2 (oral süspansiyon olarak) uygulandığında,
farmakokinetik parametreler (C, Tve EAA), 800 mg pazopanib ile tedavi edilen erişkin hastalarda daha önce bildirilenlere benzer bulunmuştur. Sonuçlar, çocuklar ve erişkinler arasında vücut yüzey alanı ile normalize edilen pazopanib klirensinde belirgin bir fark olmadığını göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Pazopanibin klinik dışı güvenlilik profili fare, sıçan, tavşan ve maymunlarda değerlendirilmiştir. Kemirgenlerde yapılan tekrarlı doz çalışmalarında çeşitli dokulardaki (kemik, dişler, tırnak yatakları, üreme organları, hematolojik dokular, böbrek ve pankreas) etkilerin VEGFR inhibisyon farmakolojisi ve/veya VEGF sinyal ileti yolağının bozulması ile ilişkili olduğu düşünülmekte olup bu etkilerin büyük bir bölümü klinikte gözlenen değerin altındaki plazma maruziyet düzeylerinde meydana gelmiştir. Diğer gözlenmiş etkiler, kilo kaybı, yüksek lokal mukozal ilaç maruziyetinin (maymunlarda) veya farmakolojik etkilerin (kemirgenlerde) neden olduğu lokal gastrointestinal etkilere bağlı ikincil sonuçlar olan diyare ve/veya morbiditeyi içermektedir. İnsan maruziyetinin EAA'sının 2,5 katı maruziyetlerde dişi farelerde proliferatif hepatik lezyonlar (eozinofilik odaklar ve adenom) görülmüştür.
Jüvenil hayvanlarda yapılan toksisite çalışmalarında, sütten kesilme öncesi sıçanlara doğumdan sonra 9. günden başlayarak 14. güne kadar doz uygulandığında pazopanib, erişkin insanlarda EAA değerine dayanarak klinik maruziyetin yaklaşık 0,1 katı dozda mortaliteye ve böbrek, akciğer, karaciğer ve kalpte anormal organ büyümesi/matürasyonuna neden olmuştur. Sütten kesilme dönemi sonrasındaki sıçanlara doğumdan sonraki 21. günden başlanarak doğumdan sonraki 62. güne kadar dozlama yapıldığında toksikolojik bulgular, karşılaştırılabilir maruziyetlerde yetişkin sıçanlardakiler ile benzer olmuştur. Pediatrik hastalar, erişkin hastalara kıyasla kemik ve diş etkileri açısından daha yüksek risk altındadır zira büyüme baskılanması (daha kısa uzuvlar), kırılgan kemikler ve dişlerin yeniden modellenmesi dahil bu değişiklikler ≥ 10 mg/kg/gün dozlarında (erişkin insanlarda EAA'nın klinik maruziyetin yaklaşık 0,1-0,2 katına eşit) jüvenil sıçanlarda görülmüştür (bkz. Bölüm 4.4).
Üreme, fertilite ve teratojenik etkiler
Pazopanibin sıçanlara ve tavşanlara, insan maruziyetinden > 300 kat daha düşük maruziyetlerde (EAA'ya göre) uygulandığında embriyotoksik ve teratojenik olduğu gösterilmiştir. Bu etkiler dişilerde azalan fertilite, artan preimplantasyon ve postimplantasyon kaybı, erken rezorpsiyon, embriyoletalite, ölümcül düzeyde azalan vücut ağırlığı ve kardiyovasküler malformasyonu içermiştir. Ayrıca, kemirgenlerde azalan korpora lutea, kistlerde artış ve over atrofisi gözlenmiştir. Bir erkek sıçan fertilite çalışmasında çiftleşme ya da fertilite üzerinde etki olmamış fakat insan maruziyetinin EAA bazında 0,3 katı maruziyetlerde sperm üretim hızı, sperm motilitesi ve epididimal ve testiküler sperm konsantrasyonlarında düşüşler ile birlikte testiküler ve epididimal ağırlıklarda azalmalar gözlenmiştir.
Genotoksisite
Pazopanib genotoksisite testlerinde (Ames testi, insan periferik lenfosit kromozom aberasyon testi ve sıçanlarda in vivo mikronükleus testi) genetik hasara neden olmamıştır. Bitmiş üründe de düşük miktarlarda bulunan, pazopanib üretiminde bir ara ürün, Ames testinde mutajenik
bulunmamıştır fakat fare lenfoma ve in vivo fare mikronükleus testinde genotoksik olduğu görülmüştür.
Karsinojenisite
Pazopanib ile yürütülen iki yıllık karsinojenisite çalışmalarında, farelerde karaciğer adenomları ve sıçanlarda duodenal adenokarsinomların sayısında artış olduğu belirlenmiştir. Kemirgenlere özgü patojeneze ve bu bulguların mekanizmasına dayanarak, bunların pazopanib alan hastalarda daha yüksek bir karsinojenik risk oluşturduğu düşünülmemektedir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tablet çekirdeği:
Mikrokristalin selüloz Sodyum nişasta glikolat Magnezyum stearat Povidon (K30)
Tablet kaplaması:
Titanyum dioksit (E171) Hipromelloz
Makrogol 400 Polisorbat
Kırmızı Demir Oksit (E172) Saf su
6.2. Geçimsizlikler
Geçerli değildir.
6.3. Raf ömrü
:
36 ay
6.4. Saklamaya yönelik özel tedbirler
30°C'nin altındaki oda sıcaklığında saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
30 veya 90 tabletlik, çocuk emniyetli polipropilen kapaklı yüksek yoğunluklu polietilen (HDPE) şişeler.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Tüm kullanılmayan ürün ve atık maddeler “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliği†ne uygun olarak imha edilmelidir.
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır.
Diyabet Hastalığı
Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| VOPAZZI | 8699525099716 | 9,702.70TL |
| VOTRIENT | 8699522091041 | |
| Diğer Eşdeğer İlaçlar |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A12802 |
| Satış Fiyatı | 9702.77 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 9702.77 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504092134 |
| Etkin Madde | Pazopanib |
| ATC Kodu | L01EX03 |
| Birim Miktar | 200 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 30 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ve Beşeri bir ilaçdır. |