VOTRIENT 400 mg 60 tablet { Novartis } Farmakolojik Özellikler
{ Pazopanib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Antineoplastik ve immunomodülatör ajanlar, antineoplastik ajanlar, protein kinaz inhibitörleri, diğer protein-kinaz inhibitörleri
ATC kodu: L01EX03
Etki mekanizması
Pazopanib oral yolla uygulamaya yönelik, sırasıyla 10, 30, 47, 71, 84 ve 74 nanomolarlık ICdeğerleri ile Vasküler Endotelyal Büyüme Faktör Reseptörleri (VEGFR)-1, -2 ve -3, platelet- kaynaklı büyüme faktörü (PDGFR)-α ve –β ve kök hücre faktör reseptörünün (c-KIT) potent çok hedefli tirozin kinaz inhibitörüdür (TKI). Preklinik deneylerde pazopanib hücrelerde VEGFR-2, c-Kit ve PDGFR-β reseptörlerin ligand kaynaklı oto-fosforilasyonunu doza bağlı şekilde inhibe etmiştir. İn vivo, pazopanib fare akciğerlerinde VEGF-kaynaklı VEGFR-2 fosforilasyonu, çeşitli hayvan modellerinde anjiyogenezi ve farelerde çoklu insan tümör ksenogreftlerinin büyümesini inhibe etmiştir.
Farmakogenomik
Monoterapi olarak ya da başka ajanlarla kombinasyon halinde uygulanan pazopanib ile yürütülen 31 klinik çalışmanın verileri üzerinde gerçekleştirilen bir farmakogenomik meta- analizde 5 x ULN'nin üzerinde (NCI CTC Derece 3) ALT değerleri, HLA-B*57:01 alel taşıyıcılarının %19'unda ve taşıyıcı olmayanların %10'unda görülmüştür. Bu veri grubunda hastaların 133/2235'i (%6) HLA-B*57:01 aleli taşıyıcısıdır (bkz. Bölüm 4.4).
Klinik Çalışmalar
Renal Hücre Kanseri (RCC)
Pazopanibin güvenlilik ve etkililiği bir randomize, çift kör, plasebo kontrollü çok merkezli çalışmada renal hücre kanserinde (RCC) değerlendirilmiştir. Lokal olarak ilerlemiş ve/veya metastatik RCC hastaları (N= 435) günde bir kez pazopanib 800 mg veya plasebo uygulanmak üzere randomize edilmiştir. Çalışmanın birincil amacı, progresyonsuz sağkalım (PFS) açısından iki tedavi kolunu değerlendirmek ve karşılaştırmak olmuştur ve ana ikincil sonlanma noktası genel sağkalım (OS) olarak belirlenmiştir. Diğer amaçlar, genel yanıt oranını ve yanıt süresini değerlendirmek olmuştur.
Bu çalışmadaki toplam 435 hastadan 233'üne daha önce tedavi uygulanmamış olup 202 hastada daha önce bir IL-2 veya INFα-bazlı tedavi uygulanmıştır. Performans durumu (ECOG), pazopanib ve plasebo grupları arasında benzer olmuştur (ECOG 0: % 42'ye karşı % 41, ECOG 1: % 58'e karşı % 59). Hastaların büyük çoğunluğunda ya olumlu (% 39) ya da orta (% 54) MSKCC (Memorial Sloan Kettering Kanser Merkezi) / Motzer prognostik faktörleri söz konusu
olmuştur. Tüm hastalarda berrak hücreli histoloji veya ağırlıklı olarak berrak hücreli histoloji belirlenmiştir. Hastaların yaklaşık yarısında 3 veya daha fazla organda hastalık tutulumu tespit edilmiştir ve çoğu hastada, çalışma başlangıcında metastaz yeri olarak akciğer (% 74) ve/veya lenf düğümleri (% 54) söz konusu olmuştur.
Her iki kolda benzer oranda hasta önceden tedavi görmemiştir veya sitokin ön tedavisi almıştır (pazopanib kolunda % 53 ve % 47, plasebo kolunda % 54 ve % 46 ). Sitokin ön tedavisi alan alt grupta hastaların büyük çoğunluğu (% 75) interferon bazlı tedavi görmüştür.
Her iki kolda benzer oranlarda hasta önceden nefrektomi olmuş (pazopanib ve plasebo kollarında sırasıyla % 89 ve % 88) ve/veya önceden radyoterapi görmüştür (pazopanib ve plasebo kollarında sırasıyla % 22 ve % 15).
Birincil sonlanma noktası PFS'nin birincil analizi, tüm çalışma popülasyonunda (tedavi görmemiş veya sitokin ön tedavisi almış) bağımsız radyolojik değerlendirme ile hastalık değerlendirmesine dayalıdır.
Tablo 3. Bağımsız değerlendirme ile RCC'de genel etkililik bulguları (VEG105192)
Sonlanma Noktaları/Çalışma Popülasyonu | Pazopanib | Plasebo | HR (% 95 GA) | P değeri (tek yönlü) |
PFS |
|
|
|
|
Genel * ITT | N = 290 | N = 145 |
|
|
Ortalama (ay) | 9,2 | 4,2 | 0,46 (0,34; 0,62) | <0,0000001 |
Yanıt oranı | N = 290 | N = 145 |
|
|
% (% 95 GA) | 30 (25,1; 35,6) | 3 (0,5, 6,4) | – | <0,001 |
HR = Risk oranı; ITT = Tedavi amaçlı; PFS = İlerlemesiz sağkalım. * - Tedavi Uygulanmamış ve Sitokin Uygulanmış Popülasyonlar, GA = Güven Aralığı | ||||
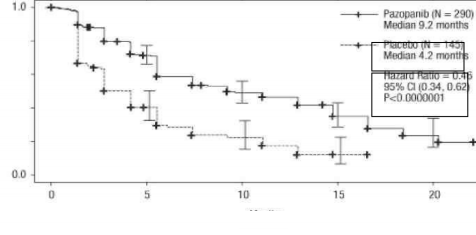
Şekil 1. Genel popülasyon için (tedavi uygulanmamış ve sitokin uygulanmış popülasyonlar) bağımsız değerlendirme ile ilerlemesiz sağkalım için Kaplan-Meier eğrisi (VEG105192)
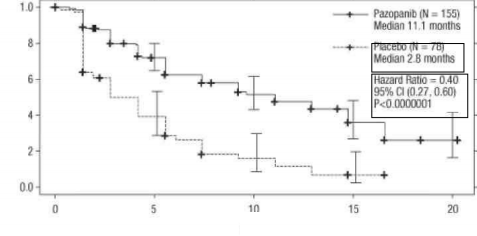
Şekil 2. Tedavi uygulanmamış popülasyon için bağımsız değerlendirme ile ilerlemesiz sağkalım için Kaplan-Meier eğrisi (VEG105192)
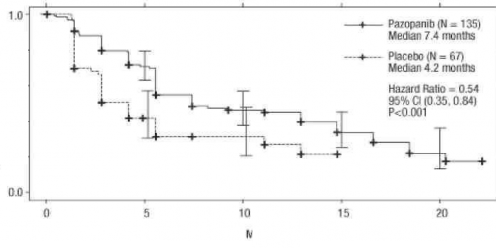
Şekil 3. Sitokin uygulanmış popülasyon için bağımsız değerlendirme ile ilerlemesiz sağkalım için Kaplan-Meier eğrisi
Tedaviye yanıt veren hastalar için yanıt elde edilene kadar geçen ortalama süre bağımsız incelemeye göre 11,9 hafta ve ortalama yanıt süresi 58,7 haftaydı (VEG105192). Protokolde belirtilmiş nihai sağ kalım analizindeki ortalama genel sağkalım (OS) verisi, pazopanib ve plasebo kollarına randomize edilmiş hastalar için sırasıyla 22,9 ay ve 20,5 aydır [HR = 0,91 (% 95 GA: 0,71, 1,16; p = 0,224)]. Plasebo kolundaki hastaların % 54'ü, hastalığın ilerlemesi üzerine bu çalışmanın uzatma kısmında pazopanib almış oldukları için, OS sonuçları potansiyel sapmaya tabidir. Plasebo hastalarının % 66'sı, pazopanib alan hastaların % 30'una kıyasla, çalışma sonrası tedavi almışlardır.
EORTC QLQ-C30 ve EuroQoL EQ-5D kullanılarak ölçülen Global Yaşam Kalitesinde tedavi grupları arasında istatistiksel farklılıklar gözlenmemiştir.
Lokal nükslü ya da metastatik berrak hücreli renal hücre karsinomu olan 225 hastanın yer aldığı bir Faz 2 çalışmada, bağımsız değerlendirmeye göre objektif yanıt oranı % 35 ve medyan yanıt süresi 68 hafta olmuştur. Medyan PFS 11,9 ay bulunmuştur. Sunitinibe karşı pazopanibin
güvenliliği, etkililiği ve kalitesi randomize, açık etiketli, paralel gruplu Faz III bir “eşdeğerlik†çalışmasında (VEG108844) değerlendirilmiştir.
VEG108844'te, daha önce sistemik tedavi görmemiş lokal ilerleme gösteren ve/veya metastatik RCC'li hastalar (N = 1110), 4 haftalık tedaviyi takiben 2 haftalık tedavisiz dönem şeklinde 6 haftalık sikluslar ile günde bir kez 50 mg sunitinib veya kesintisiz günde 1 kez 800 mg pazopanib kullanımına randomize edilmiştir.
Bu çalışmanın birincil hedefi pazopanib ile tedavi edilen hastalarda PFS'nin değerlendirilmesi ve sunitinib ile tedavi edilenlerle karşılaştırılmasıdır. Demografik özellikler tedavi kolları arasında benzerdir. İlk tanıda ve taramadaki hastalık özellikleri tedavi kolları arasında dengeli olup, hastaların büyük kısmında berrak hücreli histoloji ve Evre IV hastalık mevcuttur.
VEG108844 birincil sonlanım noktası PFS'yi elde etmiş ve tehlike oranı için % 95 GA'nın üst sınırı protokolde belirtilen eşdeğerlik sınırı 1,25 değerinden düşük olduğu için pazopanibin sunitinibe eşdeğer olduğunu kanıtlamıştır. Genel etkililik bulguları Tablo 2'de özetlenmektedir.
Tablo 4. Genel etkililik bulguları (VEG108844)
Sonlanım noktası | Pazopanib N=557 | Sunitinib N=553 | HR (% 95 GA) |
PFS |
|
|
|
Genel |
|
|
|
Medyan (ay) | 8,4 | 9,5 | 1,047 |
(% 95 GA) | (8,3, 10,9) | (8,3, 11) | (0,898, 1,22) |
Genel Sağkalım |
|
|
|
Medyan (ay) | 28,3 | 29,1 | 0,915 |
(% 95 GA) | (26, 35,5) | (25,4, 33,1) | (0,786, 1,065) |
HR = Tehlike Oranı; PFS = Bağımsız inceleme komitesi (IRC) değerlendirmesine dayalı olarak Progresyonsuz Sağkalım, GA = Güven Aralığı | |||
Şekil 4. Genel popülasyon için bağımsız değerlendirme ile progresyonsuz sağ kalım için Kaplan-Meier eğrisi (VEG108844)
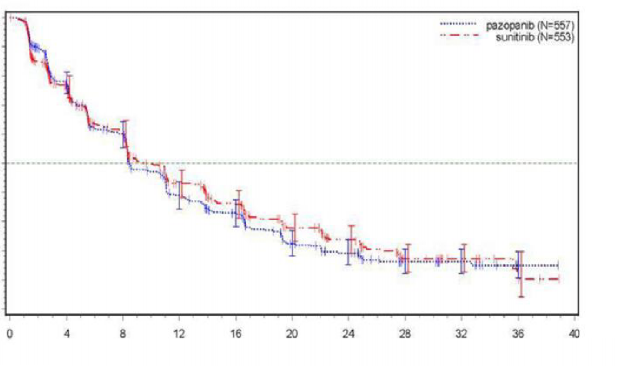
Randomizasyondan sonra geçen süre (ay)
20 demografik ve prognostik faktör için PFS'nin alt grup analizleri gerçekleştirilmiştir. Tüm alt grupların % 95 güven aralıkları 1 risk oranını içermektedir. Bu 20 alt grubun en küçük üçünde risk oranı için nokta tahmini 1,25'i aşmıştır; yani önceden nefrektomi olmamış (n=186, HR=1,403, % 95 GA (0,955, 2,061)), başlangıç LDH değeri > 1,5 x ULN (n=68, HR=1,72, % 95 GA (0,943, 3,139)) ve MSKCC: zayıf risk (n=119, HR=1,472, 95 % GA (0,937, 2,313))
değerleri olan hastalar.
Yumuşak Doku Sarkomu (Soft Tissue Sarcoma – STS)
Pazopanibin STS'deki etkililiği ve güvenliliği randomize, çift kör, plasebo kontrollü, çok merkezli bir pivot faz III çalışmada değerlendirilmiştir (VEG110727). İlerlemiş STS'si olan toplam 369 hasta günde bir kez pazopanib 800 mg veya plasebo almak üzere randomize edilmiştir. Önemli bir nokta olarak, bu çalışmaya sadece STS'nin selektif histolojik alt tiplerine sahip hastaların katılmasına izin verilmiştir; bu nedenle, pazopanibin etkililiği ve güvenliliğinin sadece bu alt STS grupları için tespit edildiği kabul edilebilir ve pazopanib ile tedavinin bu STS alt tipleri ile sınırlandırılması gerekir.
Aşağıdaki tümör tipleri uygun görülmüştür:
Fibroblastik (erişkin fibrosarkomu, miksofibrosarkomu, sklerozan epitelioid fibrosarkom, malign soliter fibroz tümörler), fibrohistiyositik (pleomorfik malign fibröz histiositom [MFH], dev hücreli MFH (indiferansiye pleomorfik sarkom (UPS) olarak da bilinir), enflamatuvar MFH), leiomyosarkom, malign glomus tümörleri, iskelet kasları (pleomorfik ve alveolar rabdomiosarkom), vasküler (epitelioid hemanjioendotelyoma, anjiyosarkom), kesin olmayan diferansiyasyon (sinoviyal, epitelioid, alveolar yumuşak kısım, berrak hücre, desmoplastik küçük yuvarlak hücre, ekstra-renal rabdoid, malign mezenkimom, PEComa, intimal sarkom), malign periferik sinir kılıfı tümörleri, başka bir tanıma uymayan (NOS) farklılaşmamış (indiferansiye) yumuşak doku sarkomları ve diğer sarkom tipleri (uygun olmayan listesine dahil edilmeyen).
Aşağıdaki tümör tiplerinin uygun olmadığı değerlendirilmiştir:
Adipositik sarkom (tüm alt tipleri), alveolar veya pleomorfik olmayan tüm rabdomiosarkomlar, kondrosarkom, osteosarkom, Ewing tümörleri/Primitif nöroektodermal tümörler (PNET), GIST, dermofibromatoz sarkom protüberans, enflamatuvar miyofibroblastik sarkom, malign mezoteliom ve karma mezodermal rahim tümörleri.
Not: Adipositik sarkomu olan hastalar, bir preliminer faz II çalışmada (VEG20002) olduğu gibi pivot faz III çalışmanın da dışında tutulmuştur; adipositikte pazopanib ile gözlenen aktivite (hafta 12'de PFS), ek klinik testlere izin verilmesi için gerekli ön şart olan oranı karşılamamıştır.
VEG110727 çalışmasının diğer önemli uygunluk kriterleri şunlardır: Metastatik hastalığa yönelik tedavinin ilk 6 ayı içerisinde yüksek ya da orta dereceli malign STS yönünde histolojik kanıt veya hastalık progresyonu veya (neo)-/adjuvan tedavinin ilk 12 ayı içerisinde tekrarlama.
Gönüllülerin % 98'si önceden doksorubisin, % 70'i önceden ifosfamid almıştır ve % 65'i çalışmaya alınmadan önce en az 3 veya daha fazla kemoterapi ajanı kullanmıştır.
Hastalar, başlangıçtaki WHO performans durumu (WHO PS) (0 veya 1) faktörlerine ve ilerlemiş hastalığa yönelik önceki sistemik tedavi basamağı sayısına (0 veya 1 karşısında 2+) göre sınıflandırılmıştır. Her tedavi grubunda ilerlemiş hastalık için önceden 2+ basamak sistemik tedavi görmüş olan hastaların yüzdesi, önceden 0 veya 1 basamak sistemik tedavi görmüş olan hastalar ile karşılaştırıldığında (plasebo ve pazopanib tedavi kolları için sırasıyla
% 42 ve % 45) hafif daha yüksek bulunmuştur (plasebo ve pazopanib tedavi kolları için sırasıyla % 58 ve % 55). Hastaların medyan takip süresi (randomizasyon tarihinden son iletişim veya ölçüme kadar geçen süre şeklinde tanımlı) iki tedavi kolu arasında benzer olmuştur (plasebo için 9,36 ay [aralık: 0,69 ila 23 ay] ve pazopanib için 10,04 ay [aralık: 0,2 ila 24,3 ay].
Çalışmanın birincil amacı progresyonsuz sağkalım değerlendirmesidir (bağımsız radyolojik inceleme ile değerlendirilen PFS); ikincil sonlanma noktaları genel sağkalımı (OS), genel yanıt oranını ve yanıt süresini içermiştir.
Tablo 5. Bağımsız değerlendirme ile STS'de genel etkinlik bulguları (VEG110727)
Sonlanma noktaları/ çalışma popülasyonu | Pazopanib | Plasebo | HR (% 95 GA) | P değeri (çift taraflı) |
PFS |
|
|
|
|
Genel ITT | N = 246 | N = 123 |
|
|
Medyan (ay) | 20,0 | 7,0 | 0,35 (0,26, 0,48) | < 0,001 |
Leiomyosarkom |
N = 109 |
N = 49 |
|
|
Medyan (ay) | 20,1 | 8,1 | 0,37 (0,23, 0,60) | < 0,001 |
Sinoviyal sarkom alt grupları |
N = 25 |
N = 13 |
|
|
Medyan (ay) | 17,9 | 4,1 | 0,43 (0,19, 0,98) | 0,005 |
‘Diğer STS' alt grupları |
N = 112 |
N = 61 |
|
|
Medyan (ay) | 20,1 | 4,3 | 0,39 (0,25, 0,6) | < 0,001 |
OS |
|
|
|
|
Genel ITT |
N = 246 |
N = 123 |
0,87 (0,67, 1,12) |
0,256 |
Medyan (ay) | 12,6 | 10,7 |
|
|
Leiomyosarkom* |
N = 109 |
N = 49 |
0,84 (0,56, 1,26 |
0,363 |
Medyan (ay) | 16,7 | 14,1 |
|
|
Sinoviyal sarkom alt grupları* |
N = 25 |
N = 13 |
1,62 (0,79, 3,33) |
0,115 |
Medyan (ay) | 8,7 | 21,6 |
|
|
‘Diğer STS' alt grupları* |
N = 112 |
N = 61 |
0,84 (0,59, 1,21) |
0,325 |
Medyan (ay) | 10,3 | 9,5 |
|
|
Yanıt Oranı (CR+PR) |
4 (2,3, 7,9) |
0 (0,0, 3) |
|
|
% (% 95 GA) | ||||
Yanıt süresi |
Medyan (hafta) (% 95 GA) | 38,9 (16,7, 40) |
|
|
|
HR = Tehlike oranı; ITT = Tedavi amaçlı; PFS = Progresyonsuz sağ kalım; CR = Tam yanıt; PR = Kısmi yanıt, GA = Güven Aralığı; OS = Genel sağkalım * İlgili STS histolojik alt grupları (leiomysosarkom, sinoviyal sarkom ve “Diğer†STS) için genel sağkalım, düşük olgu sayısı ve geniş güven aralıkları nedeniyle dikkatle yorumlanmalıdır. | ||||
Plasebo kolu ile karşılaştırıldığında pazopanib kolunda, araştırmacı değerlendirmesine dayalı olarak PFS'de benzer bir iyileşme gözlenmiştir (genel ITT popülasyonunda HR: 0,39; % 95 GA, 0.30 ila 0.52, p <0.001).
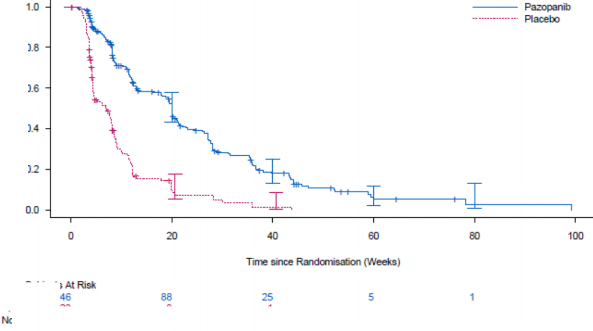
Şekil 5. Genel popülasyon için bağımsız değerlendirme ile STS'de progresyonsuz sağ kalım için Kaplan-Meier eğrisi (VEG110727)
Olayların % 76'sı (280/369) meydana geldikten sonra yürütülen nihai OS analizinde iki tedavi kolu arasında OS açısından anlamlı bir fark gözlenmemiştir (HR 0,87, % 95 GA 0,67, 1,12 p=0,256).
Pediatrik popülasyon
Pazopanib ile ilgili bir Faz I çalışma (ADVL0815), çeşitli tekrarlayan veya dirençli katı tümörleri olan 44 pediatrik hastada yürütülmüştür. Birincil amaç, çocuklarda pazopanibin maksimum tolere edilen dozu (MTD), güvenlilik profilini ve farmakokinetik özelliklerini araştırmak olmuştur. Bu çalışmada medyan maruz kalma süresi 3 aydır (1-23 ay).
Rabdomyosarkom (N=12), rabdomyosarkom dışı yumuşak doku sarkomu (N=11), Ewing sarkomu/pPNET (N=10), osteosarkom (N=10), nöroblastom (N=8) ve hepatoblastom (N=6) dahil olmak üzere refrakter solid tümörü olan 57 pediatrik hastada pazopanib ile ilgili bir Faz
II çalışma (PZP034X2203) yürütülmüştür. Çalışma, pazopanibin 1 ila <18 yaş arası çocuklarda ve adölesanlarda terapötik aktivitesini belirlemek için yapılan tek ajanlı, kontrolsüz, açık etiketli bir çalışmadır. Pazopanib tablet olarak günlük 450 mg/m2/doz dozunda veya oral süspansiyon olarak 225 mg/m2/doz olarak uygulanmıştır. İzin verilen maksimum günlük doz, tablet için 800 mg ve oral süspansiyon için 400 mg'dır. Medyan maruz kalma süresi 1.8 aydır (1 gün-29 ay).
Bu çalışmanın sonuçları, ilgili pediatrik popülasyonda herhangi bir anlamlı anti-tümör aktivitesi göstermemiştir. Bu nedenle pazopanib, pediatrik popülasyonda bu tümörlerin tedavisi için önerilmemektedir (pediatrik kullanım hakkında bilgi için bkz. Bölüm 4.2).
Avrupa İlaç Ajansı, böbrek ve renal pelvis karsinomunun (nefroblastom, nefroblastomatozis, berrak hücreli sarkom, mezoblastik nefrom, renal medüller karsinom ve böbreğin rabdoid tümörü hariç) tedavisinde pediatrik popülasyonun tüm alt gruplarında Votrient ile yapılan çalışmaların sonuçlarını sunma zorunluluğundan vazgeçmiştir (pediatrik kullanım hakkında bilgi için bkz. bölüm 4.2).
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
800 mg tek doz pazopanibin solid tümörlü hastalara oral yoldan uygulanmasını takiben, ortalama 3,5 saat sonra (1 ila 11,9 saat aralığında) yaklaşık 19 ± 13 mikrogram/mL'lik maksimum plazma konsantrasyonu (C) ve yaklaşık 650 ± 500 mikrogram.saat/ml'lik EEA
EAA veya Cdeğerlerinde 800 mg'ın üstündeki pazopanib dozlarında tutarlı artış mevcut değildir.
Pazopanib için sistemik maruziyet gıdalarla birlikte uygulandığında artmaktadır. Yüksek oranda veya düşük oranda yağ içeren öğünlerle birlikte pazopanib uygulanımı EAA ve Cdeğerlerinde yaklaşık 2 kat artışa neden olmuştur. Bu nedenle pazopanib öğünlerden en az 1 saat önce veya 2 saat sonra uygulanmalıdır (bkz. Bölüm 4.2).
Bütün olarak uygulanan tablet ile kıyaslandığında, parçalanmış bir tek pazopanib 400 mg tabletin uygulanması, EAA'yı % 46 ve C'ı yaklaşık 2 kat artırmış ve t'ı yaklaşık 2 saat azaltmıştır. Bu sonuçlar, tabletlerin bütün uygulanmasına kıyasla parçalanarak uygulanmasının ardından biyoyararlanımın ve pazopanibin oral absorpsiyon hızının arttığını göstermektedir (bkz. Bölüm 4.2).
Dağılım:
Pazopanibin insan plazma proteinine in vivo bağlanması % 99'dan yüksek olup, 10-100 mikrogram/mL üzerindeki aralıkta konsantrasyona bağlı değildir. İn vitro çalışmalar pazopanibin P-gp ve BCRP için bir substrat olduğunu düşündürmektedir.
Biyotransformasyon:
İn vitro çalışmalar pazopanib metabolizmasına esas olarak CYP3A4'ün aracılık ettiğini ve CYP1A2 ve CYP2C8 enzimlerinin minör katkıda bulunduğunu göstermiştir. Dört temel pazopanib metaboliti plazmadaki maruziyetin sadece % 6'sını oluşturmaktadır. Bu metabolitlerden biri, VEGF ile uyarılan insan umblikal ven endotel hücrelerinin çoğalmasını
pazopanibinkine benzer bir potens ile inhibe ederken diğerleri 10 ila 20 kat daha az aktiftirler. Bu nedenle, pazopanibin aktivitesi temel olarak ana pazopanib maruziyetine dayanmaktadır.
Eliminasyon:
Pazopanib önerilen 800 mg dozunun uygulanmasından sonra ortalama 30,9 saatlik yarılanma ömrü ile yavaş elimine edilmektedir. Eliminasyon esas olarak feçes aracılığıyla gerçekleşmekte olup, renal eliminasyon yolu uygulanan dozun < % 4'ünü oluşturmaktadır.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği:
Sonuçlar, oral uygulanmış pazopanib dozunun % 4'den azının pazopanib ve metabolitleri şeklinde idrar ile atıldığını göstermektedir. Popülasyon farmakokinetik modellemesinden elde edilen sonuçlar doğrultusunda (başlangıç CLCR değerleri 30,8 mL/dak ila 150 mL/dak aralığında değişen deneklerden elde edilen veriler) böbrek yetmezliğinin pazopanib farmakokinetiği üzerinde klinik olarak anlamlı bir etkisinin olması beklenmemektedir. Kreatinin klirensi 30 mL/dakika'nın üzerinde olan hastalarda dozaj ayarlaması gerekli değildir. Kreatinin klirensi 30 ml/dakika'nın altında olan hastalarda, bu hasta popülasyonunda pazopanib ile deneyim bulunmadığı için dikkatli olunması tavsiye edilir (bkz. Bölüm 4.2).
Karaciğer yetmezliği:
Hafif:
Günde bir kez 800 mg uygulandıktan sonra karaciğer parametrelerinde hafif anormallikler (normal bilirubin ve herhangi bir derece ALT yükselmesi şeklinde veya ALT değeri fark etmeksizin bilirubin düzeyinde 1,5 x ULN'ye kadar yükselme şeklinde tanımlı) olan hastalarda pazopanibin medyan kararlı durum Cve EAAdeğerleri, karaciğer fonksiyonu normal olan hastalardaki medyan değere benzerdir (bkz. Tablo 4). Günde bir kez 800 mg pazopanib, serum karaciğer testlerinde hafif anormallikler olan hastalarda önerilen dozdur (bkz. Bölüm 4.2).
Orta dereceli:
Orta dereceli karaciğer bozukluğu (ALT değeri fark etmeksizin bilirubin düzeyinde >1,5 x ila 3 x ULN yükselme şeklinde tanımlı) olan hastalarda maksimum tolere edilen pazopanib dozu (MTD) günde bir kez 200 mg olmuştur. Günde bir kez 200 mg uygulandıktan sonra orta dereceli karaciğer bozukluğu olan hastalarda pazopanibin medyan kararlı durum Cve EAAdeğerleri, karaciğer fonksiyonu normal olan hastalarda günde bir kez 800 mg uygulanmasından sonraki karşılık gelen medyan değerlerin sırasıyla yaklaşık % 44 ve % 39'udur (bkz. Tablo 4). Güvenlilik ve tolerabilite verilerine dayalı olarak, orta dereceli karaciğer bozukluğu olan hastalarda pazopanib dozajı günde bir kez 200 mg'a düşürülmelidir (bkz. Bölüm 4.2).
Şiddetli:
Günde bir kez 200 mg uygulandıktan sonra şiddetli karaciğer bozukluğu olan hastalarda pazopanibin medyan kararlı durum Cve EAAdeğerleri, karaciğer fonksiyonu normal olan hastalarda günde bir kez 800 mg uygulanmasından sonraki karşılık gelen medyan değerlerin sırasıyla yaklaşık % 18 ve % 15'idir. Azalan maruziyete ve sınırlı hepatik rezerve dayalı olarak pazopanib, şiddetli karaciğer bozukluğu (ALT değeri fark etmeksizin toplam bilirubin düzeyinin > 3 × ULN olması) olan hastalarda önerilmemektedir (bkz. Bölüm 4.2).
Tablo 6. Karaciğer bozukluğu olan hastalarda ölçülen medyan kararlı durum pazopanib
farmakokinetiği
Grup | İncelenen doz | C(mikrogram/ml) | EAA (0-24) (mikrogram × saat/ml) | Önerilen doz |
Normal hepatik fonksiyon | 800 mg OD | 52 (17,1-85,7) | 888,2 (345,5-1482) | 800 mg OD |
Hafif karaciğer bozukluğu | 800 mg OD | 33,5 (11,3-104,2) | 774,2 (214,7-2034,4) | 800 mg OD |
Orta dereceli karaciğer bozukluğu | 200 mg OD | 22,2 (4,2-32,9) | 256,8 (65,7-487,7) | 200 mg OD |
Şiddetli karaciğer bozukluğu | 200 mg OD | 9,4 (2,4-24,3) | 130,6 (46,9-473,2) | Kullanımı önerilmez |
OD – Günde bir kez | ||||
Pediatrik popülasyon
Pediatrik hastalarda pazopanib 225 mg/m2 (oral süspansiyon olarak) uygulandığında, farmakokinetik parametreler (C, Tve EAA), 800 mg pazopanib ile tedavi edilen erişkin hastalarda daha önce bildirilenlere benzer bulunmuştur. Sonuçlar, çocuklar ve erişkinler arasında vücut yüzey alanı ile normalize edilen pazopanib klirensinde belirgin bir fark olmadığını göstermiştir.
5.3. Klinik öncesi güvenlilik verileri
Pazopanibin klinik dışı güvenlilik profili fare, sıçan, tavşan ve maymunlarda değerlendirilmiştir. Kemirgenlerde yapılan tekrarlı doz çalışmalarında çeşitli dokulardaki (kemik, dişler, tırnak yatakları, üreme organları, hematolojik dokular, böbrek ve pankreas) etkilerin VEGFR inhibisyon farmakolojisi ve/veya VEGF sinyal ileti yolağının bozulması ile ilişkili olduğu düşünülmekte olup bu etkilerin büyük bir bölümü klinikte gözlenen değerin altındaki plazma maruziyet düzeylerinde meydana gelmiştir. Diğer gözlenmiş etkiler, kilo kaybı, yüksek lokal mukozal ilaç maruziyetinin (maymunlarda) veya farmakolojik etkilerin (kemirgenlerde) neden olduğu lokal gastrointestinal etkilere bağlı ikincil sonuçlar olan diyare ve/veya morbiditeyi içermektedir. İnsan maruziyetinin EAA'sının 2,5 katı maruziyetlerde dişi farelerde proliferatif hepatik lezyonlar (eozinofilik odaklar ve adenom) görülmüştür.
Jüvenil hayvanlarda yapılan toksisite çalışmalarında, sütten kesilme öncesi sıçanlara doğumdan sonra 9. günden başlayarak 14. güne kadar doz uygulandığında pazopanib, erişkin insanlarda EAA değerine dayanarak klinik maruziyetin yaklaşık 0,1 katı dozda mortaliteye ve böbrek, akciğer, karaciğer ve kalpte anormal organ büyümesi/matürasyonuna neden olmuştur. Sütten kesilme dönemi sonrasındaki sıçanlara doğumdan sonraki 21. günden başlanarak doğumdan sonraki 62. güne kadar dozlama yapıldığında toksikolojik bulgular, karşılaştırılabilir maruziyetlerde yetişkin sıçanlardakiler ile benzer olmuştur. Pediatrik hastalar, erişkin hastalara kıyasla kemik ve diş etkileri açısından daha yüksek risk altındadır zira büyüme baskılanması (daha kısa uzuvlar), kırılgan kemikler ve dişlerin yeniden modellenmesi dahil bu değişiklikler
≥ 10 mg/kg/gün dozlarında (erişkin insanlarda EAA'nın klinik maruziyetin yaklaşık 0,1-0,2 katına eşit) jüvenil sıçanlarda görülmüştür (bkz. Bölüm 4.4).
Üreme, fertilite ve teratojenik etkiler
Pazopanibin sıçanlara ve tavşanlara, insan maruziyetinden > 300 kat daha düşük maruziyetlerde (EAA'ya göre) uygulandığında embriyotoksik ve teratojenik olduğu gösterilmiştir. Bu etkiler dişilerde azalan fertilite, artan preimplantasyon ve postimplantasyon kaybı, erken rezorpsiyon, embriyoletalite, ölümcül düzeyde azalan vücut ağırlığı ve kardiyovasküler malformasyonu içermiştir. Ayrıca, kemirgenlerde azalan korpora lutea, kistlerde artış ve over atrofisi gözlenmiştir. Bir erkek sıçan fertilite çalışmasında çiftleşme ya da fertilite üzerinde etki olmamış fakat insan maruziyetinin EAA bazında 0,3 katı maruziyetlerde sperm üretim hızı, sperm motilitesi ve epididimal ve testiküler sperm konsantrasyonlarında düşüşler ile birlikte testiküler ve epididimal ağırlıklarda azalmalar gözlenmiştir.
Genotoksisite
Pazopanib genotoksisite testlerinde (Ames testi, insan periferik lenfosit kromozom aberasyon testi ve sıçanlarda in vivo mikronükleus testi) genetik hasara neden olmamıştır. Bitmiş üründe de düşük miktarlarda bulunan, pazopanib üretiminde bir ara ürün, Ames testinde mutajenik bulunmamıştır fakat fare lenfoma ve in vivo fare mikronükleus testinde genotoksik olduğu görülmüştür.
Karsinojenisite
Pazopanib ile yürütülen iki yıllık karsinojenisite çalışmalarında, farelerde karaciğer adenomları ve sıçanlarda duodenal adenokarsinomların sayısında artış olduğu belirlenmiştir. Kemirgenlere özgü patojeneze ve bu bulguların mekanizmasına dayanarak, bunların pazopanib alan hastalarda daha yüksek bir karsinojenik risk oluşturduğu düşünülmemektedir.
 Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir.
Travma Sonrası Bunalımı
Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden
rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A12803 |
| Satış Fiyatı | 38432.12 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 38432.12 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504092165 |
| Etkin Madde | Pazopanib |
| ATC Kodu | L01EX03 |
| Birim Miktar | 400 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 60 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Ağız Kanseri Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren yanak içi veya damak bölgelerini de içine alır. |
 |
Omurilik zedelenmeleri Omurilik zedelenmesini takip eden birkaç gün içinde, hiçkimse hasarin ne kadar olacagini tahmin edemez. Buradaki sorun, omuriligin herhangi bir zedelenmesinden hemen sonra, bir omurilik sokunun olusmasidir. |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |