XEPLION 75 mg/0.75 ml IM uzun salımlı süspansiyon içeren kullanıma hazır enjektör Farmakolojik Özellikler
{ Paliperidon }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Psikoleptikler, diğer antipsikotikler ATC kodu: N05AX13
XEPLION paliperidonun (+)- ve (-)- rasemik karışımını içerir. Etki mekanizması:
5. FARMAKOLOJİK ÖZELLİKLER
reseptörlerin antagonisti olarak etki eder. (+)- ve (-)- paliperidon enantiyomerlerinin farmakolojik aktivitesi, kalitatif ve kantitatif olarak benzerdir.
Paliperidon kolinerjik reseptörlere bağlanmaz. Şizofreninin pozitif semptomlarını hafiflettiğine inanılan paliperidon güçlü bir D2-antagonist olsa da geleneksel nöroleptiklerden daha az motor fonksiyonlarını azaltır ve daha az katalepsiye neden olur. Baskın santral serotonin antagonizma, paliperidonun ekstrapiramidal yan etki oluşturma eğilimini azaltabilir.
Klinik Etkililik
Şizofreninin akut tedavisi
XEPLION'un şizofreninin akut tedavisinde etkililiği, şizofreni için DSM-IV kriterlerini karşılayan akut nüks gelişmiş yatan erişkin hastalarda yapılan kısa süreli (biri 9 haftalık ve üçü 13 haftalık) çift-kör, randomize, plasebo kontrollü, sabit dozlu dört çalışmada değerlendirilmiştir. Bu çalışmalarda I XEPLION'un sabit dozları, 9 haftalık çalışmada 1. , 8. ve 36. günlerde ve 13 haftalık çalışmalarda ek olarak 64. günde verilmiştir. XEPLION ile akut şizofreni tedavisi sırasında oral antipsikotik takviyesine ihtiyaç olmamıştır. Primer etkinlik bitiş noktası, toplam skorların aşağıda tabloda gösterildiği Pozitif ve Negatif Sendrom Ölçekleri (PANSS) azalması olarak tanımlanır.
PANSS, pozitif semptomları, negatif semptomları, dağınık düşünceleri, kontrol edilemeyen saldırganlık/heyecan ve anksiyete/depresyonu değerlendirmek için beş faktörden oluşan valide edilmiş çok maddeli bir ölçektir. Fonksiyon, Kişisel ve Sosyal Performans (PSP) ölçeği kullanılarak değerlendirilmiştir. PSP, sosyal olarak yararlı aktivite alanlarında 4 etkide kişisel ve sosyal fonksiyonu ölçen ve klinisyenin derecelendirdiği valide edilmiş bir ölçektir: Faydalı sosyal aktiviteler (iş ve çalışma), kişisel ve sosyal ilişkiler, kendi kendine bakım ve rahatsız edici ve agresif davranışlar.
XEPLION'un üç sabit dozunu (başlangıçta 150 mg'lık deltoid enjeksiyon ve bunu takiben 25 mg/4 hafta, 100 mg/4 hafta veya 150 mg/4 hafta şeklinde 3 gluteal veya deltoid doz) plasebo ile karşılaştıran 13 haftalık çalışmada (n=636), XEPLION'un üç dozu da, PANSS toplam puanını düzeltmek açısından plaseboya göre üstün bulunmuştur. Bu çalışmada, hem 100 mg/4 hafta hem de 150 mg/4 haftalık tedavi grupları PSP puanı açısından plaseboya göre istatistiksel olarak anlamlı üstünlük göstermişken, 25 mg/4 haftalık tedavi grubu üstünlük göstermemiştir. Bu bulgular, tedavi süresi boyunca etkililiği ve PANSS'de düzelmeyi desteklemektedir ve
dördüncü gün kadar erken dönemde gözlenmiştir. Sekizinci günde ise 25 mg ve 150 mg'lık XEPLION gruplarında plaseboya göre anlamlı farklılık gözlenmiştir.
Diğer çalışmaların sonuçları XEPLION lehine istatistiksel olarak anlamlı sonuçlar vermiştir; 50 mg doz ile yapılan bir çalışma hariç (aşağıdaki tabloya bakınız).
Şizofreni için Pozitif ve Negatif Sendrom Ölçeği (PANSS) Toplam Skor â Ana hattan son noktaya değişim- Araştırmalar R092670-SCH-201, R092670-PSY-3003, R092670-PSY- 3004 ve R092670-PSY-3007: Primer Etkinlik Analiz | |||||
| Placebo | 25 mg | 50 mg | 100 mg | 150 mg |
R092670-PSY-3007* | n=160 | n=155 |
| n=161 | n=160 |
Temel baseline | 86,8 | 86,9 (11,99) | ------ | 86,2 ( 10,77 ) | 88,4 ( 11,70 ) |
Temel değişiklik | (10,,31)-2,9 | -8,0 ( 19,90) |
| -11,6 ( 17,63) | -13,2 ( 18,48) |
P-değeri | (19,26) |
0,034 |
|
<0, 001 |
< 0,001 |
(placeboya göre) | ----- |
|
|
|
|
R092670-PSY-3003 | n=132 |
| n=93 | n=94 | n=30 |
Temel baseline | 92,4 ( 12,55) | ----- | 89,9 (10,78) | 90,1 (11,66) | 92,2(11,72) |
Temel değişiklik | -4,1 ( 21,01) |
| -7,9 ( 18,71) | -11,00 (19,06) | -5,5( 19,78) |
P-değeri | ----- |
| 0,193 | 0,019 | ----- |
(placeboya göre) |
|
|
|
|
|
R092670-PSY-3004 | n=125 | n=129 | n=128 | n=131 |
|
Temel baseline | 90,7 (12,22) | 90,7 (12,25) | 91,2 (12,02) | 90,8(11,70) | ----- |
Temel değişiklik | -7,0 (20,07) | -13,6 (21,45) | -13,2 (20,14) | -16,1 ( 20,36) |
|
P-değeri | ----- | 0,015 | 0,017 | <0,001 |
|
(placeboya göre) |
|
|
|
|
|
R092670-SCH-201 | n=66 |
| n=63 | n=68 |
|
Temel baseline | 87,8 (13,90) | ----- | 88,0 ( 12,39) | 85,2 (11,09) | ----- |
Temel değişiklik | 6,2( 18,25) |
| -5,2 ( 21,52) | -7,8 (19,40) |
|
P-değeri | ----- |
| 0,001 | <0,0001 |
|
(placeboya göre) |
|
|
|
|
|
* R092670-PSY-3007 çalışmsı için XEPLION tedavi grubundaki tüm deneklere belirlenen dozdan sonra takip eden ilk gün 150 mg başlangıç dozu verildi.
Not: Skorda negatif değişiklik gelişmeyi gösterir.
Semptom kontrolünü idame etmek ve şizofreni relapsını geciktirmek
XEPLION'un şizofrenide semptomatik kontrolü idame etmek ve şizofrenide relapsı geciktirme açısından etkililiği, şizofreni için DSM-IV kriterlerini karşılayan 849 yaşlı olmayan erişkin gönüllüleri içeren uzun süreli çift-kör, plasebo kontrollü, esnek dozlu bir çalışmada belirlenmiştir. Bu çalışma, 33 haftalık açık etiketli akut tedavi ve stabilizasyon fazı, randomize, plasebo kontrollü bir faz ve 52 haftalık açık etiketli uzatma dönemini içermiştir. Bu çalışmada, XEPLION dozları ayda bir defa uygulanan 25, 50, 75 ve 100 mg dozlarını içermiştir; 75 mg dozuna yalnızca 52 haftalık açık etiketli uzatmada izin verilmiştir. Hastalar, başlangıçta 9 haftalık bir geçiş dönemi sırasında esnek dozlarda (25-100 mg) XEPLION almıştır. 24 haftalık koruma dönemine girmek için hastaların PANSS skorunun ≤ 75 olması gerekmiştir. Dozlama ayarlamalarına yalnızca koruma döneminin ilk 12 haftasında izin verilmiştir. Değişken uzunlukta çift-kör faz esnasında, stabilizasyon fazında aldıkları aynı XEPLION'un doz grubuna (ortanca süre 171 gün [aralıklar 1 gün-407 gün]) veya plasebo grubuna (ortalama süre 105 gün [aralıklar 8 gün-441 gün] toplam 410 hasta şizofreni semptomlarında nüks oluşana kadar randomize olarak ayrılmıştır.
Plasebo ile karşılaştırıldığında XEPLION ile tedavi edilen hastalarda görülen belirgin relaps (p
<0.0001, Şekil 1) zamanını uzatan etkinlik nedenleri için çalışma erken durduruldu. (risk oranı
=4,32; %95 Cl: 2,4-7,7).
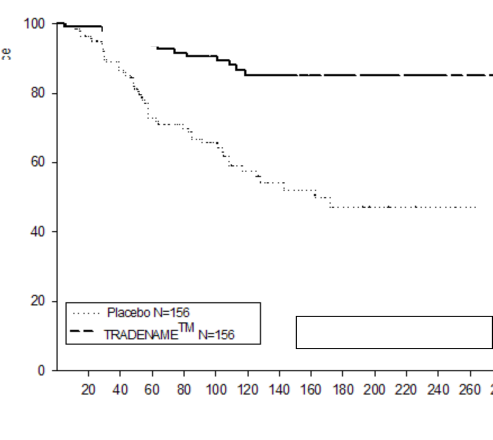
Log-sıra sınaması, p değeri<0,0001
Randomizasyondan beri geçen süre (gün)
Plasebo N=156
XEPLION N=156
Nüks görülmeyen bireylerin tahmini oranı
Şekil 1. Zamana karşı nüksü kıyaslayan Kaplan-Meier Grafiği â Ara Analizi (Tedaviyi amaçlayan analiz seti)
Pediyatrik popülasyon
Pediyatrik kullanım ile ilgili bilgi için Bkz Bölüm 4.2
5.2. Farmakokinetik özellikler
Genel ÖzelliklerEmilim:
Paliperidon palmitat paliperidonun ön ilacı olan bir palmitat esteridir. Sudaki çözünürlüğünün aşırı düşük olmasına bağlı olarak paliperidon palmitat, intramüsküler enjeksiyondan sonra paliperidona hidroliz olmadan önce yavaşça çözünür ve sistemik dolaşıma absorbe olur. Tek bir intramüsküler enjeksiyonu takiben paliperidonun plazma konsantrasyonları, 13 günlük ortalama tsüresi içinde yavaş yavaş yükselerek maksimum plazma konsantrasyonlarına yükselir. İlacın salınması, birinci gün kadar erken bir zamanda başlar ve 4 ay kadar sürer.
Deltoid kas içine tek doz intramüsküler enjeksiyonunu takiben (25 mg-150 mg), gluteal kas içine enjeksiyonla karşılaştırıldığında ortalama olarak %28 daha yüksek bir Cgözlenmiştir.
1. günde 150 mg ve 8. günde 100 mg'ın iki başlangıç deltoid intramüsküler enjeksiyonu, terapötik konsantrasyonlara hızla ulaşılmasına yardımcı olur. XEPLION'un salım profili ve doz rejimi, terapötik konsantrasyonların devam etmesini sağlamaktadır. 100 mg'lık XEPLION dozu için ortalama kararlı durum doruk noktası: İki dalga arasındaki çukur oranı, gluteal uygulamayı takiben 1.8 ve deltoid uygulamayı takiben 2.2 olmuştur. 25 mg-150 mg'lık doz aralığında XEPLION uygulamasını takiben paliperidonun görünen ortalama yarılanma ömrü 25 ile 49 gün arasında değişmiştir.
XEPLION uygulanmasının ardından paliperidon palmitat mutlak biyoyararlanımı % 100'dür.
Paliperidon palmitat uygulamasını takiben paliperidonun (+) ve (-) enantiyomerleri birbirine dönüşür ve yaklaşık olarak 1.6-1.8'lik bir EAA (+)/(-) oranına ulaşır.
Dağılım:
Rasemik paliperidon plazma proteinine %74 oranında bağlanır. Biyotransformasyon:
1 mg hızlı salımlı 14C-paliperidonun tek bir oral dozunun uygulanmasından 1 hafta sonra, dozun
%59'u idrarla değişmeden atılmıştır. Bu durum, paliperidonun karaciğerde ileri derecede metabolize olmadığını göstermektedir. Hiçbirisi verilen dozun %6,5'inden fazlasını kapsamayan in vivo dört metabolik yolak tanımlanmıştır: Dealkilasyon, hidroksilasyon, dehidrojenasyon ve benzisoksazolün bölünmesi. In vitro çalışmalar, paliperidon metabolizmasında CYP2D6 ve CYP3A4'ün rol oynadığını göstermesine rağmen, paliperidonun metabolizmasında in vivo olarak bu izoenzimlerin önemli bir rol oynadığına dair bir kanıt yoktur. Popülasyon farmakokinetik analizleri, oral paliperidonun uygulanmasından sonra paliperidonun görünen klerensinde CYP2D6 substratlarının hızlı metabolize edicileri ile yavaş metabolize edicileri arasında ayırt edilebilir fark göstermemiştir. İnsan karaciğer mikrozomlarında yapılan in vitro çalışmalar, paliperidonun, CYP1A2, CYP2A6, CYP2C8/9/10, CYP2D6, CYP2E1, CYP3A4 ve CYP3A5'i içeren sitokrom P450 izoenzimleri tarafından metabolize edilen ilaçların metabolizmasını büyük ölçüde inhibe etmediğini göstermiştir.
In vitro çalışmalar, paliperidonun bir P-gp substratı olduğunu ve yüksek konsantrasyonlarda P- gp'nin zayıf bir inhibitörü olduğunu göstermiştir. In vivo veriler yoktur ve klinik ilişki bilinmemektedir.
Eliminasyon:
Uygulanan radyoaktivitenin yaklaşık %80'i idrarda ve %11'i feçeste bulunmuştur. Doğrusallık/Doğrusal olmayan durum:
XEPLION uygulamasını takiben toplam paliperidon maruziyeti, 25 mg-150 mg'lık doz aralığının üzerinde dozla orantılı olmuştur ve 50 mg'ı aşan dozlarda Ciçin dozla-orantıdan düşüktür.
Uzun etkili paliperidon palmitat enjeksiyonu ile oral uzatılmış salımlı paliperidonun karşılaştırılması
XEPLION, paliperidonu ayda bir uygulamak üzere tasarlanmıştır. Uzatılmış salımlı oral paliperidon ise günde bir kere uygulanır. XEPLION'un başlangıç rejimi (1. gün/8. günde deltoid kas içine 150 mg/100 mg), tedaviyi oral destek kullanmaksızın başlatırken kararlı durum paliperidon konsantrasyonlarına hızla ulaşmak üzere tasarlanmıştır.
Genel olarak, XEPLION ile gözlenen genel başlangıç plazma düzeyleri, 6 mg-12 mg uzatılmış salımlı oral paliperidon ile gözlenen maruziyet sınırları içinde bulunmuştur. XEPLION başlangıç rejiminin kullanılması, en düşük değerlerin görüldüğü doz öncesi günlerde bile (8. gün ve 36. gün) hastaların, 6 mg-12 mg uzatılmış salımlı oral paliperidonun bu maruziyet penceresinde kalmalarını sağlamıştır. İki ürün arasındaki ortanca farmakokinetik profillerindeki fark nedeni ile farmakokinetik özelliklerini direkt olarak karşılaştırılırken dikkatli olmak gerekir.
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği:
Paliperidon, karaciğerde yaygın şekilde metabolize edilmemektedir. XEPLION, karaciğer yetmezliği olan hastalarda incelenmemiş olmasına rağmen, hafif veya orta derece karaciğer yetmezliği olan hastalarda doz ayarlaması gerekli değildir. Orta derecede karaciğer yetmezliği olan (Child-Pugh sınıf B) hastalarda oral paliperidon ile yapılan bir çalışmada, serbest paliperidonun plazma konsantrasyonu, sağlıklı deneklerle benzerdir. Paliperidon, ağır karaciğer yetmezliği olan hastalarda incelenmemiştir.
Böbrek yetmezliği:
Değişik derecelerde böbrek yetmezliği olan deneklerde, tek bir oral 3 mg uzatılmış salımlı tablet paliperidon dozunun dağılımı incelenmiştir. Paliperidon eliminasyonu, azalan kreatinin klerensi ile birlikte azalmıştır. Paliperidonun toplam klerensi, bozulmuş böbrek fonksiyonu olan hastalar arasında hafif böbrek yetmezliğinde (CrCl =50 - <80 ml/dak) ortalama %32, orta böbrek yetmezliğinde (CrCl= 30 - <50 ml/dak) ortalama %64 ve ağır böbrek yetmezliğinde (CrCl=10 - <30 ml/dak) ortalama %71 azalmıştır. Bu durum sağlıklı deneklerle karşılaştırıldığında, maruziyette (EAA) sırası ile 1,5, 2,6 ve 4,8 kat ortalama artışa denk düşer. Hafif böbrek yetmezliği olan deneklerde XEPLION ile sınırlı sayıda gözleme ve farmakokinetik simülasyonlara göre, azalan doz önerilir. (Bkz. Bölüm 4.2).
Yaşlılarda:
Popülasyon farmakokinetik analiz, yaşa bağlı farmakokinetik farklılık olduğuna dair kanıt göstermemiştir.
Vücut Kitle İndeksi ( VKİ) / Kilo
Paliperidon palmitat farmakokinetik çalışmaları, normal ağırlığa sahip hastalarla kıyaslandığında obez veya fazla kilolu hastalardaki paliperidon plazma konstantrasyonlarının kısmen daha düşük olduğunu göstermiştir (%10-20).
Irk:
Oral paliperidon ile yapılan çalışmaların popülasyon farmakokinetiği analiz verileri, XEPLION uygulamasını takiben paliperidonun farmakokinetiğinde ırka bağlı farklılıkların kanıtını göstermemiştir.
Cinsiyet:
Erkekler ve kadınlar arasında klinik olarak anlamlı fark gözlenmemiştir. Sigara kullanım durumu:
İnsan karaciğer enzimleri kullanılan in vitro çalışmalar temel alınarak, paliperidon CYP1A2 için bir substrat değildir; dolayısıyla sigara kullanımının paliperidon farmakokinetiğine bir etkisi olmamalıdır. Sigara kullanımının paliperidon farmakokinetiğine olan etkisi XEPLION ile çalışılmamıştır. Oral paliperidon uzatılmış salımlı tablet ile elde edilen verilere dayanarak popülasyon farmakokinetik değerlendirmesi, sigara kullananlarda kullanmayanlara kıyasla
paliperidon için biraz daha düşük bir maruziyet göstermiştir. Farkın klinik ile ilişki olasılığı muhtemel değildir.
5.3. Klinik öncesi güvenlilik verileri
Toksikoloji
Sıçan ve köpeklerde oral uygulanan ve intramüsküler olarak uygulanan paliperidon palmitat (1 aylık formülasyon) tekrarlanan-doz toksisitesi çalışmaları sedasyon ve meme bezlerinde, genital organlarda prolaktin aracılı etkiler gibi temel farmakolojik etkiler göstermiştir. Paliperidon palmitat ile tedavi edilen hayvanların intramüsküler enjeksiyon yerinde bir enflamasyon reaksiyonu görülmüştür. Ara sıra apse oluşumu meydana gelmiştir.
Sıçanlarda ve insanlarda yaygın olarak paliperidona dönüştürülen oral risperidon ile sıçan üreme çalışmalarında, doğum ağırlığı ve yavruların hayatta kalması üzerinde advers etkiler görülmüştür. 150 mg tavsiye edilen maksimum dozda, insanda 4,1 kez maruz kalma seviyesine tekabül eden en yüksek doza kadar hamile farelere (160 mg / kg / gün) paliperidon palmitatın kas içi uygulanmasından sonra embriyotoksisite veya malformasyonlar gözlenmemiştir. Gebe hayvanlara uygulandığında diğer dopamin antagonistleri, öğrenme ve yavrularda motor gelişimi üzerinde olumsuz etkilere neden olmuştur.
Paliperidon palmitat ve paliperidon genotoksik değildirler. Sıçanlarda ve farelerde risperidonun oral karsinojenisite çalışmalarında, hipofiz bezi adenomlarında artış (farelerde), pankreas endokrin adenomlarında artış (sıçanlarda) ve meme bezi adenomlarında (her iki türde de) artış gözlenmiştir. İntramüsküler olarak enjekte edilen paliperidon palmitatın karsinojenik potansiyeli sıçanlarda değerlendirilmiştir. 10, 30 ve 60 mg/kg/ay'lık dozlarda dişi sıçanlarda meme bezi adenokarsinomlarında istatistiksel olarak anlamlı bir artış olmuştur. Erkek sıçanlarda, XEPLION'un mg/kg esas alınarak 150 mg'lık maksimum önerilen insan dozunun 1,2 ve 2,2 katı olan 30 ve 60 mg/kg/ay'lık dozlarda meme bezi adenomları ve karsinomlarında istatistiksel olarak anlamlı bir artış görülmüştür. Bu artış uzatılmış dopamin Dantagonizması ve hiperprolaktinemi ile ilgili olabilir. Kemirgenlerde bu tümör bulgularının insan riski ile ilişkisi bilinmemektedir.
İğnenin kılıfını düz bir şekilde çekerek iğneden ayırınız. İğne gevşeyerek enjektörden çıkabileceği için kılıfı bükmeyiniz.
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
İLAÇ GENEL BİLGİLERİ
Johnson & Jonhson Sıhhi Malzeme San. ve Tic.Ltd.Şti.
| Geri Ödeme Kodu | A13604 |
| Satış Fiyatı | 2902.39 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 2902.39 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699593950056 |
| Etkin Madde | Paliperidon |
| ATC Kodu | N05AX13 |
| Birim Miktar | 75+0,75 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 1 |
| Sinir Sistemi > Antipsikotikler > Paliperidon |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Şizofrenlik Şizofrenliğin psikiatrik teşhisi hakkında çok fazla anlaşmazlık vardır. Bu sayfadaki bilgiler, şizofrenliğin teşhisi, nedenleri ve tedavisi hakkındaki faklı teoriler hakkında bilgi verecektir. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |