XOLAIR 150 mg/ml enjeksiyonluk çözelti içeren kullanımahazır enjektör (1 adet) Kısa Ürün Bilgisi
{ Omalizumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
XOLAİR® 150 mg/ml Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Enjektör Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Omalizumab 150 mg (1 mL'de 150 mg).
Omalizumab, Çin hamster yumurtalık (ÇHY) memeli hücre dizisinde rekombinant DNA teknolojisi ile üretilen bir hümanize monoklonal antikordur.
Yardımcı maddeler
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Enjeksiyonluk çözelti.
Bir kullanıma hazır enjektör içerisinde; berrak ile hafif opak arası görünüşe sahip, soluk kahverengimsi - sarı renkte çözelti.
Enjeksiyon bölgesini bir alkollü bezle temizleyiniz.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Alerjik astım
XOLAİR erişkinlerde, ergenlerde ve çocuklarda (6 - <12 yaş arası) endikedir.
XOLAİR tedavisi sadece kanıtlanmış IgE (immünoglobülin E) aracılı astımı olan hastalarda düşünülmelidir (bkz. Bölüm 4.2).
Erişkinler ve ergenler (12 yaş ve üzeri):
XOLAİR, perennial aeroalerjenlere duyarlılığı pozitif deri testi veya in vitro testler ile gösterilmiş ve akciğer fonksiyonları kısıtlı (FEV1< %80), serum IgE düzeyi 30-1500 IU olan; günlük yüksek doz inhale kortikosteroid ve uzun etkili beta 2 agonist kullanmasına rağmen sık gündüz semptomları veya gece uyanmaları yaşayan ve birden fazla belgelenmiş ağır astım alevlenmesi bulunan ağır persistan alerjik astımı olan hastalarda astım kontrolünü iyileştirmek için ek tedavi olarak endikedir.
XOLAİR'in, astımın bu hastalardaki alevlenme dönemlerinin insidansını azalttığı gösterilmiştir. Diğer alerjik durumlardaki etkililiği ve güvenliliği saptanmış değildir.
Çocuklar (6 - <12 yaş arası):
XOLAİR, bir perennial aeroalerjene karşı pozitif deri testi veya in vitro reaktivitesi olan perennial aeroalerjenlere duyarlılığı pozitif deri testi veya in vitro testler ile gösterilmiş ve ayrıca, günlük yüksek doz inhale kortikosteroid artı uzun etkili inhale beta2-agonistleri ile tedavisine rağmen sık gündüz semptomları veya gece uyanmaları yaşayan ve birden fazla belgelenmiş ağır astım alevlenmesi bulunan ağır persistan alerjik astımı olan hastalarda astım kontrolünü iyileştirmek için ek tedavi olarak endikedir.
Nazal polipli kronik rinosinüzit (NP'li KRS)
XOLAİR, intranazal kortikosteroidler ile tedavinin yeterli hastalık kontrolü sağlamadığı şiddetli NP'li KRS'li erişkinlerin (18 yaş ve üzeri) tedavisi için intranazal
kortikosteroidlere ek bir tedavi olarak endikedir.
Kronik İdiyopatik Ürtiker (KİÜ)
XOLAIR (omalizumab), H1 antihistaminik tedaviye yetersiz yanıt veren erişkin ve ergen (12 yaş ve üzeri) hastalarda kronik spontan (idiyopatik) ürtiker tedavisi için ek tedavi olarak endikedir.
4.2. Pozoloji ve uygulama şekli
Yalnızca subkutan uygulama içindir. İntravenöz veya intramüsküler yolla uygulanmaz.
XOLAİR tedavisi, ağır persistan astım, nazal polipli kronik rinosinüzit (NP'li KRS) ve kronik spontan ürtiker tanı ve tedavisinde deneyimli hekimler tarafından başlatılmalıdır.
Pozoloji/uygulama sıklığı ve süresi:
Alerjik astım ve nazal polipli kronik rinosinüzit (NP'li KRS)
Alerjik astım ve nazal polipli kronik rinosinüzit için doz belirlenmesinde, aynı doz ilkeleri izlenir. Bu durumlar için uygun XOLAIR dozu ve sıklığı, tedavinin başlangıcından önce ölçülen başlangıç IgE (IU/mL) ve vücut ağırlığı (kg) ile belirlenir. Bu ölçüm sonuçlarına göre, her uygulamada 1-4 enjeksiyonla 75-600 mg XOLAİR verilmesi gerekebilir.
IgE düzeyi 76 IU/mL'den daha düşük olan alerjik astımlı hastaların fayda sağlama olasılığı daha düşük olmuştur (bkz. Bölüm 5.1). Reçeteyi yazan hekim, tedavi başlamadan önce 76 IU/mL'den daha düşük IgE'ye sahip yetişkin ve ergen hastaların (12 yaş ve üzeri) ve 200 IU/mL'den daha düşük IgE'ye sahip çocuk hastaların (6 - <12 yaş arası) bir perennial alerjene kesin in vitro reaktivite (RAST) verdiğinden emin olmalıdır.
Uygulanacak dozun, uygulama sıklığının, her uygulamada kullanılacak enjektör ve enjeksiyon sayısı ile toplam enjeksiyon hacminin belirlenmesi için aşağıdaki tablolara bakınız.
Dönüşüm çizelgesi için Tablo 1'e ve doz belirleme çizelgesi için Tablo 2 ve 3'e bakınız.
Tedavi başlangıcındaki IgE düzeyleri veya kilogram olarak vücut ağırlıkları doz tablosunda belirtilen sınırların dışında kalan hastalara XOLAİR verilmemelidir.
Önerilen maksimum doz her iki haftada bir 600 mg Omalizumab'dır.
Tablo 1 Belirlenen dozun her uygulamada kullanılacak kullanıma hazır enjektör sayısına, enjeksiyon sayısına ve toplam enjeksiyon hacmine dönüştürülmesi
Doz (mg) | Enjektör sayısı 150 mg | Enjeksiyon sayısı | Toplam enjeksiyon hacmi (ml) |
75 150 | 0 1 | 1 1 | 0.5 1.0 |
225 | 1 | 2 | 1.5 |
300 | 2 | 2 | 2.0 |
375 | 2 | 3 | 2.5 |
450 | 3 | 3 | 3.0 |
525 | 3 | 4 | 3.5 |
600 | 4 | 4 | 4.0 |
Tablo 2 HER 4 HAFTADA BİR UYGULAMA
Her 4 haftada bir subkutan enjeksiyonla verilecek olan XOLAİR dozları (doz başına miligram)
| Vücut Ağırlığı (kg) | |||||||||
Başlangıç taki |
|
|
|
|
|
|
|
|
|
|
IgE (IU/ml) | 20- 25* | >25- 30* |
>30-40 |
>40-50 | >50- 60 |
>60-70 | >70- 80 | >80- 90 | >90- 125 | >125- 150 |
30–100 | 75 | 75 | 75 | 150 | 150 | 150 | 150 | 150 | 300 | 300 |
>100–200 | 150 | 150 | 150 | 300 | 300 | 300 | 300 | 300 | 450 | 600 |
>200–300 | 150 | 150 | 225 | 300 | 300 | 450 | 450 | 450 | 600 |
|
>300–400 | 225 | 225 | 300 | 450 | 450 | 450 | 600 | 600 |
| |
>400–500 | 225 | 300 | 450 | 450 | 600 | 600 |
| |||
>500–600 | 300 | 300 | 450 | 600 | 600 |
| ||||
>600–700 | 300 |
| 450 | 600 | 2 HAFTADA BİR UYGULAMA için | |||||
>700–800 >800–900 | BKZ. Tablo 3 | |||||||||
>900– |
| |||||||||
1000 |
| |||||||||
>1000– |
| |||||||||
1100 |
| |||||||||
*30 kg'ın altındaki vücut ağırlıkları, nazal polipli kronik rinosinüzit (NP'li KRS) için önemli çalışmalarda incelenmemiştir.
Tablo 3 HER 2 HAFTADA BİR UYGULAMA.
Her 2 haftada bir subkutan enjeksiyonla verilecek XOLAİR dozları (doz
başına miligram)
| Vücut ağırlığı (kg) | |||||||||
Başlangıç IgE'si (IU/ml) |
20- 25* |
>25-30* |
>30-4 0 |
>40- 5 0 |
>50- 60 |
>60- 7 0 |
>70- 8 0 |
>80- 9 0 |
>90- 125 |
>125- 150 |
 30-100 | 4 HAFTADA BİR UYGULAMA için BKZ. Tablo 2 | |||||||||
> 100-200 | ||||||||||
> 200-300 |
| 375 | ||||||||
> 300-400 |
| 450 | 525 | |||||||
> 400-500 |
|
|
|
|
|
| 375 | 375 | 525 | 600 |
> 500-600 |
|
|
|
|
| 375 | 450 | 450 | 600 |
|
> 600-700 |
| 225 |
|
| 375 | 450 | 450 |
525 |
|
|
> 700-800 | 225 | 225 | 300 | 375 | 450 | 450 | 525 | 600 |
|
|
> 800-900 | 225 | 225 | 300 | 375 | 450 | 525 | 600 |
|
|
|
> 900-1000 | 225 | 300 | 375 | 450 | 525 | 600 |
|
|
|
|
> 1000- 1100 | 225 | 300 | 375 | 450 | 600 |
| UYGULAMAYINIZ doz önerisi için veri mevcut değildir. | |||
> 1100- 1200 | 300 | 300 | 450 | 525 | 600 | |||||
> 1200- 1300 | 300 | 375 | 450 | 525 |
|
|
| |||
> 1300- 1500 | 300 | 375 | 525 | 600 |
|
|
| |||
![]()
*30 kg'ın altındaki vücut ağırlıkları, nazal polipli kronik rinosinüzit (NP'li KRS) için önemli çalışmalarda incelenmemiştir.
Tedavi süresi, hastaların izlenmesi ve doz ayarlanması
Alerjik astım
XOLAİR, uzun süreli tedavide kullanılmak amacıyla geliştirilmiştir. Klinik çalışmalar, XOLAİR tedavisinin etkinlik göstermesi için en az 12-16 hafta süre gerektiğini göstermiştir. XOLAİR tedavisine başladıktan 16 hafta sonra hastalar sonraki enjeksiyonlar uygulanmadan önce tedavi etkinliği açısından doktorları tarafından değerlendirilmelidir. 16 haftalık zaman noktasından sonra veya sonraki durumlarda XOLAİR 'e devam etme kararı, genel astım kontrolünde belirgin bir iyileşme görülüp görülmediğine dayanmalıdır.
Nazal polipli kronik rinosinüzit (NP'li KRS)
NP'li KRS için yapılan klinik çalışmalarda, 4 haftada nazal polip skorunda (NPS) ve nazal konjesyon skorunda (NKS) değişiklikler gözlenmiştir. Devam eden tedaviye duyulan ihtiyaç, hastanın hastalık ciddiyetine ve semptom kontrol düzeyine göre periyodik olarak yeniden değerlendirilmelidir.
Alerjik astım ve nazal polipli kronik rinosinüzit (NP'li KRS)
Tedavinin durdurulması genellikle, serbest IgE düzeylerinin yükselmesiyle ve bununla ilişkili semptomların ortaya çıkması ile sonuçlanır.
Total IgE düzeyleri tedavi sırasında yükseldiğinden ve tedavi kesildikten sonra da, 1 yıla varan süreler boyunca yüksek değerlerde kaldığından IgE düzeylerinin tedavi sırasında tekrar ölçülmesi, doz belirlenmesinde yol gösterici olamaz. Tedaviye 1 yıldan daha kısa süre ara verildikten sonra yeniden başlanması durumunda, dozu belirlemek için önceki tedavinin başlangıcında doz hesaplaması için kullanılan serum IgE düzeyinden faydalanılır. XOLAİR tedavisine 1 yıl veya daha uzun süre ara verildiyse, kullanılacak dozun belirlenmesi için serum total IgE düzeyi yeniden ölçülmelidir.
Vücut ağırlığında önemli değişiklikler olduğunda doz, buna göre ayarlanmalıdır (bkz Tablo 2 ve 3).
Kronik İdiyopatik Ürtiker (KİÜ)
Önerilen doz dört haftada bir subkutan enjeksiyon yoluyla 300 mg'dır.
Reçete eden hekimlerin, tedavi devamının gerekip gerekmediğini periyodik olarak değerlendirmesi önerilir.
Bu endikasyonda 6 ayın ötesindeki uzun süreli tedavi ile ilgili klinik çalışma deneyimi
kısıtlıdır.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/karaciğer yetmezliği:
Bozulmuş böbrek ya da karaciğer fonksiyonunun omalizumab farmakokinetiği üzerindeki etkileri ile ilgili herhangi bir çalışma yapılmamıştır. Klinik dozlarda omalizumab klirensinden başlıca retiküler endotelyal sistem (RES) sorumlu olduğundan, bunun böbrek ya da karaciğer bozukluğu ile değişmesi beklenmez. Belirli bir doz ayarlaması önerilmiyor olsa da, XOLAİR bu hastalarda dikkatli uygulanmalıdır (bkz. bölüm 4.4).
Pediyatrik popülasyon:
Alerjik astımda, XOLAİR'in 6 yaşından daha küçük hastalarda kullanılmasının güvenliliği ve etkililiği saptanmamıştır. Veri mevcut değildir. Bu nedenle, bu yaş grubundaki hastalarda XOLAİR'in kullanımı önerilmez.
Nazal polipli kronik rinosinüzitte (NP'li KRS), XOLAİR'in 18 yaşından daha küçük hastalarda kullanılmasının güvenliliği ve etkililiği saptanmamıştır.
KİÜ'de XOLAİR'in 12 yaşın altındaki çocuklarda kullanılmasının güvenliliği ve etkililiği saptanmamıştır.
Geriyatrik popülasyon:
XOLAİR'in 65 yaşından daha ileri yaştaki hastalarda kullanılması konusundaki veriler kısıtlıdır ama yaşlı hastalardaki dozun, gençlerdekinden farklı olması gerektiğine dair herhangi bir kanıt yoktur.
Uygulama şekli:
XOLAİR, sadece subkutan uygulanır. İntravenöz ya da intramüsküler yoldan uygulanmaz.
150 mg'dan yüksek dozlar (Tablo 1), iki veya daha fazla enjeksiyon bölgesine bölünmelidir.
Eğer hekim uygun olduğuna karar verirse, bilinen bir anafilaksi öyküsü bulunmayan hastalar, 4.dozdan itibaren XOLAİR'i kendi kendine enjekte edebilir veya XOLAİR, hastadan sorumlu kişi tarafından da enjekte edilebilir (bkz. Bölüm 4.4). Hasta veya hastadan sorumlu kişi, doğru enjeksiyon tekniği ve ciddi alerjik reaksiyonların erken belirti ve semptomlarının tanınması konusunda eğitilmiş olmalıdır.
Hastalara veya hastadan sorumlu kişilere, kullanma talimatında verilen talimatlara uygun olarak, XOLAİR'in tam miktarını doğru uygulama adımlarıyla enjekte etmeleri konusunda bilgilendirme yapılmalıdır.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
Genel:
XOLAİR, astımın akut alevlenme dönemlerinin, akut bronkospazmın ya da status astmatikusun tedavisinde kullanılmaz.
XOLAİR, hiperimmünoglobülin E sendromu veya alerjik bronkopulmoner aspergillosis vakalarında ya da atopik dermatit, alerjik rinit ya da besin alerjisi ile provoke olan anafilaktik reaksiyonların önlenmesinde araştırılmamıştır. XOLAİR bu durumların tedavisi için endike değildir.
XOLAİR tedavisi otoimmün hastalığı olan hastalarda, immün kompleks aracılığıyla gelişen sağlık sorunlarında ya da böbrek veya karaciğer fonksiyon bozukluğu olan hastalarda incelenmemiştir (bkz. Bölüm 4.2). XOLAİR'in bu gibi hasta popülasyonlarında ihtiyatla kullanılması gerekir.
Alerjik astım veya NP'li KRS'de XOLAİR tedavisine başlandıktan sonra sistemik veya inhale kortikosteroidler aniden kesilmemelidir. Kortikosteroidler, doğrudan hekim gözetiminde ve kademeli olarak azaltılmalıdır.
İmmün sistem bozuklukları:
Tip 1 Alerjik Reaksiyonlar
Omalizumab alırken, uzun bir tedavi süresinden sonra bile, anafilaksi ve anafilaktik şok dahil olmak üzere tip I lokal veya sistemik alerjik reaksiyonlar ortaya çıkabilir. Bununla birlikte, bu reaksiyonların çoğu, XOLAİR'in ilk ve sonraki enjeksiyonlarından 2 saat sonra meydana gelmiştir, fakat bazıları enjeksiyondan 2 saat sonra ve hatta 24 saat sonra başlamıştır. Anafilaktik reaksiyonların çoğu XOLAİR'in ilk 3 dozunda görülmüştür. Bu nedenle, ilk 3 doz bir sağlık uzmanı tarafından veya bir sağlık uzmanının gözetimi altında uygulanmalıdır. Omalizumab ile ilgisi olmayan bir anafilaksi öyküsü, XOLAİR uygulamasını takiben anafilaksi için bir risk faktörü olabilir. Bu nedenle, bilinen anafilaksi öyküsü olan hastalarda XOLAİR, bir sağlık uzmanı tarafından uygulanmalıdır ve bu sağlık uzmanının elinin altında, XOLAİR uygulamasını takiben hemen kullanılabileceği, anafilaktik reaksiyonların tedavisine yönelik tıbbi ürünler bulunmalıdır. Anafilaktik veya diğer ciddi alerjik reaksiyonlar meydana gelirse, XOLAİR uygulaması derhal kesilmeli ve uygun tedavi başlatılmalıdır. Hastalar bu tür reaksiyonların mümkün olduğu ve alerjik reaksiyonlar meydana geldiği takdirde derhal tıbbi yardım almaları gerektiği konusunda bilgilendirilmelidir.
Klinik çalışmalarda az sayıda hastada omalizumaba karşı antikor gelişmiştir (bkz. bölüm 4.8). Anti-XOLAİR antikorlarının klinikle ilişkisi yeterli anlaşılmamıştır.
Serum Hastalığı
Gecikmiş tip III aşırı duyarlılık reaksiyonlarına neden olan serum hastalığı ve serum hastalığı benzeri reaksiyonlar, omalizumab dahil hümanize monoklonal antikorlar ile tedavi edilen hastalarda görülmüştür. Öne sürülen patofizyolojik mekanizma omalizumaba karşı antikor gelişimine bağlı immün kompleks oluşumunu ve birikimini içerir. Reaksiyon tipik olarak ilk ya da takip eden enjeksiyonların uygulanmasından 1-5 gün sonra başlar, uzun dönem tedavi sonrasında da gelişebilir. Serum hastalığını
düşündüren belirtiler, artrit/artralji, döküntü (ürtiker ya da diğer şekillerde), ateş ve lenfadenopatidir. Antihistaminikler ve kortikosteroidler, bu hastalığın önlenmesi ya da tedavisi için yararlı olabilir. Hastalara, herhangi bir şüpheli belirtiyi bildirmeleri konusunda tavsiyede bulunulmalıdır.
Churg-Strauss sendromu ve hipereozinofilik sendrom
Ağır astım hastalarında seyrek olarak, her ikisi de genellikle sistemik kortikosteroidlerle tedavi edilen, sistemik hipereozinofilik sendrom ya da alerjik eozinofilik granülomatöz vaskulit (Churg-Strauss sendromu) bulunabilir.
Nadir vakalarda, omalizumabın da dahil olduğu astıma karşı kullanılan tıbbi ürünler ile tedavi görmekte olan hastalarda sistemik eozinofili veya vaskulit bulunabilir ya da gelişebilir. Bu olaylar genellikle oral kortikosteroid tedavisinin azaltılması ile ilişkilidir.
Bu hastalarda hekimler; belirgin eozinofili, vaskulite bağlı döküntü, pulmoner semptomlarda kötüleşme, paranazal sinüs anomalileri, kardiyak komplikasyonlar ve/veya nöropati gelişimi açısından dikkatli olmalıdır.
Yukarıdaki immün sistem bozukluklarının şiddetli düzeyde olduğu tüm olgularda omalizumabın kesilmesi düşünülmelidir.
Parazit (helmint) enfeksiyonları:
IgE, bazı helmint enfeksiyonlarına verilen immünolojik yanıt sürecinde yer alabilir. Helmint enfeksiyonları bakımından kronik yüksek riske sahip hastalarda yapılan plasebo kontrollü bir çalışma, enfeksiyon hızında omalizumab ile hafif bir artış olduğunu, ancak enfeksiyonun seyrinin, şiddetinin ve tedaviye verdiği yanıtın değişmediğini göstermiştir. Helmint enfeksiyon hızı, bu gibi enfeksiyonları saptamak için tasarlanmamış olan tüm klinik program boyunca 1.000'de 1'den azdı. Ancak özellikle helmint enfeksiyonlarının endemik olduğu yerlere seyahat edildiğinde yüksek helmint enfeksiyon riskine sahip hastalarda önlem alınmalıdır. Önerilen anti-helmintik tedaviye yanıt alınmazsa XOLAİR tedavisinin kesilmesi düşünülmelidir.
Latekse duyarlı kişiler:
Kullanıma hazır enjektörün çıkarılabilir iğne kapağı, doğal kauçuk lateksin bir türevini içermektedir. Çıkarılabilir iğne kapağında bugüne kadar doğal kauçuk lateks tespit edilmemiştir. Bununla birlikte, latekse duyarlı kişilerde kullanıma hazır enjektör içindeki XOLAİR enjeksiyonluk çözeltinin kullanımı çalışılmamıştır ve dolayısıyla aşırı duyarlılık reaksiyon riski potansiyel bir risk olarak bulunmakta olup; bu potansiyel risk tamamıyla olasılık dışı bırakılamamaktadır.
İzlenebilirlik:
Biyoteknolojik ürünlerin takip edilebilirliğinin sağlanması için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
IgE bazı helmint enfeksiyonlarında immünolojik yanıtta yer alabileceğinden XOLAİR, helmintik veya diğer parazitik enfeksiyonların tedavisinde kullanılan tıbbi ürünlerin etkililiğini dolaylı yoldan azaltabilir (bkz. Bölüm 4.4).
Sitokrom P450 enzimleri, effluks pompaları ve proteinlere bağlanma mekanizmaları omalizumabın klirensinde rol oynamadığından, bu rekombinant DNA türevinin kullanılması sırasında ilaç-ilaç etkileşimleriyle karşılaşılma olasılığı çok azdır. XOLAİR'in diğer ilaçlarla ve aşılarla etkileşimi araştırılmamıştır. Astım, NP'li KRS ya
da KİÜ tedavisinde yaygın olarak kullanılan ilaçların omalizumabla etkileşime girmesinin beklenmesini gerektiren farmakolojik bir neden söz konusu değildir.
Alerjik Astım
Klinik çalışmalarda XOLAİR genellikle; inhale ve oral kortikosteroidlerle, kısa veya uzun etkili inhale beta-2 agonistleriyle, lökotrien modifiye edicilerle, teofilinlerle ve oral antihistaminiklerle birlikte kullanılmıştır. XOLAİR ilaç güvenliliğinin, bu sık kullanılan astım ilaçlarına bağlı olarak değiştiğine dair bulgu yoktur. XOLAİR'in spesifik immünoterapi (hipo-sensitizasyon tedavisi) ile birlikte kullanılması konusunda veriler sınırlıdır. XOLAİR'in spesifik immünoterapi ile bir arada uygulandığı bir klinik çalışmada, spesifik immünoterapi ile kombinasyon halindeki XOLAİR'in güvenliliği ve etkililiğinin tek başına XOLAİR ile gözlenenden farklı olmadığı bulunmuştur.
Nazal polipli kronik rinosinüzit (NP'li KRS)
Klinik çalışmalarda XOLAİR, protokole göre intranazal mometazon spreyi ile birlikte kullanılmıştır. Yaygın olarak kullanılan diğer tıbbi ürünler arasında diğer intranazal kortikosteroidler, bronkodilatörler, antihistaminikler, lökotrien reseptör antagonistleri, adrenerjikler/ sempatomimetikler ve lokal nazal anestezikler yer almaktadır. XOLAİR'in güvenliliğinin, bu diğer yaygın olarak kullanılan tıbbi ürünlerin eşzamanlı kullanımıyla değiştiğine dair hiçbir gösterge yoktur.
Kronik İdiyopatik Ürtiker (KİÜ)
KİÜ ile ilgili klinik çalışmalarda, XOLAİR antihistaminikler (anti-H1, anti-H2) ve lökotrien reseptör antagonistleri (LTRA'lar) ile birlikte kullanılmıştır. Faz III çalışmalar Q4881g ve Q4882g'de tüm hastalar XOLAİR veya plaseboya ek olarak H1 antihistaminik ilaçlar almıştır. Faz III çalışma Q4883g'de tüm hastalar XOLAİR veya plaseboya ek olarak bir ya da daha fazla H1 antihistaminik(ler) ve/veya H2 antihistaminikler ve/veya LTRA'lar almıştır. Alerjik astımda bilinen güvenlilik profili ile karşılaştırıldığında bu tıbbi ürünlerle birlikte uygulanan omalizumabın güvenliliğinin değiştiğine dair herhangi bir kanıt yoktur. Ayrıca bir popülasyon farmakokinetiği analizi, H2 antihistaminiklerin ve LTRA'ların omalizumab farmakokinetiği üzerinde anlamlı bir etki yapmadığını göstermiştir (bkz. Bölüm 5.2).
İmmünosüpresif tedavilerle kombinasyon halinde XOLAİR kullanımı araştırılmamıştır.
Özel popülasyonlara ilişkin ek bilgiler
Pediyatrik popülasyon
KİÜ klinik çalışmalarında XOLAİR'in antihistaminikler (anti-H1, anti-H2) ve LTRA'lar ile birlikte kullanan 12-17 yaş arası bazı hastalar yer almıştır. 12 yaşın altındaki çocuklarda herhangi bir çalışma gerçekleştirilmemiştir.
4.6. Gebelik ve laktasyon
Genel TavsiyeGebelik kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Çocuk doğurma potansiyeline sahip kadınlar uygun bir doğum kontrol yöntemi uygulamalı, eğer hamile kalmaya karar verirlerse hekimlerine danışmalıdır. XOLAİR'in doğum kontrol yöntemleri ile bilinen bir etkileşimi yoktur.
Gebelik dönemi
Omalizumab için gebelikte maruz kalmaya ilişkin klinik veri mevcut değildir. Hayvanlar üzerinde yapılan çalışmalar, gebelik/ embriyonal/ fetal gelişim/ doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da dolaylı zararlı etkiler olduğunu göstermemektedir.
Gebelik kayıt sistemine ve pazarlama sonrası spontan raporlara dayanılarak, gebe kadınlar (300-1.000 arası gebelik sonucu) ile ilgili orta düzeyde veri, malformasyon veya fetüs/neonatal toksisiteye işaret etmemektedir. XOLAİR'e maruz kalan astımı olan 250 gebe kadına yönelik prospektif gebelik kayıt çalışması (EXPECT), majör konjenital anomalilerin prevalansının EXPECT grubu ile hastalık eşleşmeli (orta ve ağır astım) hastalar arasında benzer olduğunu (%8,1'e karşı %8,9) göstermiştir. Küçük örneklem büyüklüğü ve randomize olmayan tasarım dahil olmak üzere çalışmanın metodolojik sınırlamaları, verilerin yorumlanmasına etki edebilir.
Omalizumab plasenta bariyerinden geçer.
Omalizumab insan dışı primatlarda kan trombositlerinde yaşa bağlı düşüşler ile ilişkilendirilmiş olup yavru hayvanlarda duyarlılığın daha fazla olduğu saptanmıştır (bkz. Bölüm 5.3).
XOLAİR gebelik sırasında yalnızca mutlaka gerekli olduğunda kullanılmalıdır. Gebe kadınlara verilirken tedbirli olunmalıdır.
Laktasyon dönemi
İmmünoglobulinler G (IgG'ler) anne sütünde bulunur ve bu nedenle omalizumabın anne sütünde bulunması beklenir. İnsan dışı primatlardaki mevcut veriler, omalizumabın süte geçtiğini göstermiştir (bkz. Bölüm 5.3).
Gebelik sırasında ve emzirme yoluyla XOLAİR'e maruz kalan 154 bebeğin incelendiği EXPECT çalışması, emzirilen bebek üzerinde yan etkiler olduğunu göstermemiştir. Küçük örneklem büyüklüğü ve randomize olmayan tasarım dahil olmak üzere çalışmanın metodolojik sınırlamaları, verilerin yorumlanmasına etki edebilir.
Oral olarak verildiğinde, immünoglobulin G proteinleri bağırsak proteolizine uğrar ve zayıf biyoyararlanıma sahiptir. Emzirilen yenidoğanlarda/bebeklerde herhangi bir etki beklenmemektedir. Sonuç olarak, klinik olarak ihtiyaç duyulursa, emzirme sırasında XOLAİR kullanımı düşünülebilir.
Üreme yeteneği / Fertilite
Omalizumab için insan fertilite verileri mevcut değildir. İnsan dışı primatlarda çiftleşme çalışmaları da dahil olmak üzere spesifik olarak tasarlanmış preklinik fertilite çalışmalarında, 75 mg/kg'a kadar olan doz düzeylerinde omalizumabla yapılan tekrarlı doz uygulamasını takiben erkek ya da dişi fertilitesinde bozulma gözlenmemiştir. Ayrıca, ayrı klinik dışı genotoksisite çalışmalarında genotoksik etki gözlenmemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
XOLAİR'in araç ve makine kullanma becerisi üzerinde etkisi yoktur ya da göz ardı edilebilir derecede bir etkiye sahiptir.
4.8. İstenmeyen etkiler
Alerjik Astım ve nazal polipli kronik rinosinüzit (NP'li KRS)
Güvenlilik profilinin özeti
Erişkinler ile 12 yaş ve üzeri ergenlerdeki klinik çalışmalar sırasında en fazla bildirilmiş olan advers reaksiyonlar; enjeksiyon yerinde gelişen ağrı, şişlik, eritem ve kaşıntı gibi
reaksiyonlarla baş ağrısıdır. 6 ila <12 yaş arası çocuklarda yapılan klinik çalışmalarda, en yaygın olarak bildirilen advers reaksiyonlar baş ağrısı, ateş ve üst karın ağrısı olmuştur. Bunların neredeyse tümü hafif ya da orta şiddette olmuştur. NP'li KRS'li 18 yaş ve üzeri hastalarda yapılan klinik çalışmalarda, en yaygın olarak bildirilen advers reaksiyonlar baş ağrısı, baş dönmesi, artralji, üst karın ağrısı ve enjeksiyon bölgesi reaksiyonlarıdır.
Advers reaksiyonların tablolaştırılmış listesi
Klinik çalışmalarda, XOLAİR ile tedavi edilen toplam alerjik astım ve NP'li KRS ilaç güvenliliği popülasyonunda bildirilen advers olaylar, organ sistemi sınıfına ve sıklık derecelerine göre aşağıda listelenmiştir.
Advers ilaç reaksiyonları, en sık görülen advers reaksiyon ilk sırada olacak şekilde sıklıklarına göre aşağıda sıralanmıştır. Her sıklık grubunda advers reaksiyonlar azalan ciddiyet derecesine göre sıralanmıştır.
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Enfeksiyonlar ve enfestasyonlar
Yaygın olmayan: Farenjit Seyrek: Parazit infeksiyonları Kan ve lenf sistemi hastalıkları
Bilinmiyor: Şiddetli vakalar dahil, idiopatik trombositopeni
Bağışıklık sistemi hastalıkları
Seyrek: Anafilaktik reaksiyon ve diğer ciddi alerjik durumlar, anti-omalizumab antikor gelişimi
Bilinmiyor: Serum hastalığı; ateş ve lenfadenopatiyi kapsayabilir
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı*
Yaygın olmayan: Baş dönmesi#, uyku hali, parestezi, senkop
Vasküler hastalıklar
Yaygın olmayan: Postüral hipotansiyon, deride kızarıklık Solunum, göğüs hastalıkları ve mediastinal hastalıklar Yaygın olmayan: Öksürük, alerjik bronkospazm
Seyrek: Larenks ödemi
Bilinmiyor: Alerjik granülomatöz vaskülit (örn, Churg-Strauss sendromu)
Gastrointestinal hastalıklar
Yaygın: Üst karın ağrısı**,#
Yaygın olmayan: Bulantı, ishal, dispepsi belirti ve bulguları
Deri ve deri altı doku hastalıkları
Yaygın olmayan: Ürtiker, deri döküntüsü, kaşıntı, fotosensitivite Seyrek: Anjiyoödem
Bilinmiyor: Alopesi
Kas-iskelet sistemi, bağ doku ve kemik hastalıkları
Yaygın: Artralji â€
Seyrek: Sistemik lupus eritematozus (SLE) Bilinmiyor: Miyalji, eklemlerde şişlik
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Çok yaygın: Pireksi**
Yaygın: Ağrı, eritem, kaşıntı, şişlik gibi enjeksiyon yeri reaksiyonları Yaygın olmayan: Kilo artışı, halsizlik, kollarda şişme, gribe benzer hastalık
*: 6 - <12 yaş arası çocuklarda çok yaygın
**: 6 - <12 yaş arası çocuklarda
#: POLYP 1 ve 2 çalışmalarında yaygın
†: Alerjik astım çalışmalarında bilinmiyor Kronik İdiyopatik Ürtiker (KİÜ) Güvenlilik profilinin özeti
Omalizumabın güvenlilik ve tolerabilitesi, 975 KİÜ hastasında dört haftada bir 75 mg, 150 mg ve 300 mg dozlarla araştırılmıştır; bunların 242'sine plasebo uygulanmıştır. 733 hasta 12 haftaya kadar ve 490 hasta 24 haftaya kadar omalizumabla tedavi edilmiştir. Bunlardan, 12 haftaya kadar 412 hasta ve 24 haftaya kadar 333 hasta 300 mg dozda tedavi edilmiştir.
Advers reaksiyonların tablolaştırılmış listesi
KİÜ endikasyonunda, dozaj ve tedavi popülasyonlarındaki (önemli derece farklı risk faktörlerine, komorbiditelere, eş zamanlı ilaç kullanımına ve yaşa [örn. astım çalışmalarında 6-12 yaş çocuklar yer almıştır] bağlı) farklılıklardan kaynaklanan istenmeyen etkiler ayrı bir tablo (Tablo 4) ile listelenmektedir.
Üç birleştirilmiş Faz III çalışmada önerilen 300 mg doz ile bildirilen istenmeyen etkiler (tıbbi incelemeden sonra herhangi bir tedavi grubunda hastaların ≥%1'inde meydana gelen olaylar ve herhangi bir omalizumab tedavi grubunda plasebo grubuna göre ≥%2 daha yüksek sıklıkta meydana gelen olaylar) MedDRA sistem organ sınıfına göre Tablo 4'te listelenmektedir. Her bir sistem organ sınıfı içinde advers reaksiyonlar sıklığına göre sıralanmaktadır; en sık gözlenen reaksiyonlar ilk olarak listelenmektedir. Sunulan istenmeyen etkiler 12 haftalık ve 24 haftalık tedavi periyotları şeklinde iki grup olarak tanımlanmıştır.
Çok yaygın (≥1/10); yaygın (≥1/100 ila <1/10); yaygın olmayan (≥1/1.000 ila <1/100); seyrek (≥1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Tablo 4 300 mg omalizumabda birleştirilmiş KİÜ güvenlilik veri tabanından (1. gün ila 24. hafta) advers reaksiyonlar
12 hafta | Birleştirilmiş 1, 2 ve 3. Omalizumab çalışmaları | Sıklık kategorisi |
| Plasebo N=242 | 300 mg N=412 |
|
Enfeksiyonlar ve enfestasyonlar | |||
Sinüzit | 5 (%2,1) | 20 (%4,9) | Yaygın |
Sinir sistemi hastalıkları | |||
Baş ağrısı | 7 (%2,9) | 25 (%6,1) | Yaygın |
Kas-iskelet sistemi, bağ doku ve kemik hastalıkları | |||
Artralji | 1 (%0,4) | 12 (%2,9) | Yaygın |
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar | |||
Enjeksiyon yeri reaksiyonları* | 2 (%0,8) | 11 (%2,7) | Yaygın |
24 hafta | Birleştirilmiş 1 ve 3. Omalizumab çalışmaları | Sıklık kategorisi | |
Plasebo N=163 | 300 mg N=333 |
| |
Enfeksiyonlar ve enfestasyonlar | |||
Üst solunum yolu enfeksiyonları | 5 (%3,1) | 19 (%5,7) | Yaygın |
* Plaseboya göre %2'lik bir fark göstermemesine rağmen, tüm vakalar çalışma tedavisine bağlı olarak nedensel olarak değerlendirildiği için enjeksiyon bölgesi reaksiyonları dahil edilmiştir.
Seçilmiş advers reaksiyonların tanımı Bağışıklık sistemi hastalıkları:
Detaylı bilgi için, bkz. Bölüm 4.4.
Anafilaksi:
![]()
Anafilaktik reaksiyonlar klinik çalışmalarda nadirdir. Bununla birlikte, güvenlik veritabanında yapılan kümülatif bir araştırmanın ardından pazarlama sonrası verilerde toplam 898 anafilaksi vakası tespit edilmiştir. Tahmini 566,.923 hasta tedavi yılı maruziyetine dayanarak, bu yaklaşık %0,20 raporlama oranına karşılık gelmektedir.
Maligniteler:
Erişkinler ve 12 yaş ve üzerindeki ergenlerde yürütülen ilk klinik çalışmalar sırasında gelişen kanser sayısı bakımından aktif tedavi grubuyla kontrol grubu arasında dengesizlik bulunmuştur. Her iki grupta da kanserlere seyrek olarak (<1/100) rastlanmıştır.
5 yıla kadar takip edilmiş, 5.007 XOLAİR ile tedavi edilmiş ve 2.829 XOLAİR ile tedavi edilmemiş hastayı karşılaştıran daha sonra yapılmış bir gözlemsel çalışmada 1.000 hasta- yılı başına primer malignitelerin insidans oranları sırasıyla 16,01 (295/18.426 hasta yılı) ve 19,07 (190/9.963 hasta yılı) olmuştur; bu durum, artmış bir malignite riskine işaret etmemektedir (oranların oranı 0,84; %95 güven aralığı, 0,62-1,13). XOLAİR alan 4.254 hasta ve plasebo alan 3.178 hastayı kapsayan, randomize, çift kör, plasebo kontrollü çalışmalar üzerinde yapılan ilave bir analizde, XOLAİR tedavisi, XOLAİR ile tedavi edilmiş hastalar için 4,14 (14/3.382 hasta-yılı) ve plasebo hastaları için 4,45 (11/2.474 hasta-yılı) olan 1.000 hasta-yılı başına insidans oranlarına dayalı olarak artmış bir
malignite riskiyle ilişkilendirilmemiştir (oranların oranı 0,93, %95 güven aralığı 0,39- 2,27).
XOLAİR klinik çalışma programındaki malignite insidansı (%0,5), genel popülasyonla
karşılaştırılabilir düzeydedir.
Arteriyel Tromboembolik Olaylar (ATE):
Kontrollü klinik çalışmalarda ve gözlemsel bir çalışmanın ara analizleri sırasında, ATE'lerde sayısal bir dengesizlik gözlenmiştir. ATE'ler şunları kapsamaktadır: inme, geçici iskemik atak, miyokard infarktüsü, stabil olmayan angina ve kardiyovasküler ölüm (bilinmeyen bir nedenden dolayı ölümü de kapsamaktadır). Gözlemsel çalışmanın son analizinde, 1.000 hasta-yılı başına ATE oranı, XOLAİR ile tedavi edilmiş hastalar için 7,52 (115/15.286 hasta-yılı) ve kontrol hastaları için 5,12 (51/9.963 hasta-yılı) olmuştur. Mevcut başlangıç kardiyovasküler risk faktörleri için kontrolün yapıldığı bir çok değişkenli analizde tehlike oranı 1,32'dir (%95 güven aralığı 0,91-1,91). 8 hafta ya da daha fazla süreli tüm randomize, çift kör, plasebo kontrollü klinik çalışmaları kapsayan birleştirilmiş (pooled) bir analizde, 1.000 hasta yılı başına ATE oranı XOLAİR ile tedavi edilmiş hastalar için 2,69 (5/1.856 hasta-yılı) ve plasebo hastaları için 2,38 (4/1.680 hasta- yılı) olmuştur (oranların oranı 1,13, %95 güven aralığı 0,24-5,71).
Trombositler:
Klinik çalışmalarda az sayıda hastada trombosit sayısı normal değerlerin altına inmiştir. Bu hastaların hiçbirinde kanama epizodları gözlenmemiş, hemoglobin düzeyi azalmamıştır. Pazarlama sonrası tespitlerde izole idiyopatik trombositopeni olguları bildirilmiş olsa bile, insan-dışı primatlarda görülen trombosit sayısındaki inatçı azalma profili insanlarda (6 yaş ve üzeri hastalar) saptanmamıştır (bkz. Bölüm 5.3).
Parazit enfeksiyonları:
Helmint enfeksiyonları bakımından kronik yüksek riske sahip alerjik hastalardaki plasebo kontrollü bir çalışma, omalizumab ile enfeksiyon hızında istatiksel açıdan anlamlı olmayan sayısal olarak hafif bir artış olduğunu göstermiştir. Enfeksiyonun seyri, şiddeti ve tedaviye alınan yanıt değişmeden kalmıştır (bkz. Bölüm 4.4.).
Sistemik Lupus Eritematozus:
Orta ila ağır astımı ve KİÜ'sü olan hastalarda klinik çalışmalarda ve pazarlama sonrasında sistemik lupus eritematozus (SLE) vakaları bildirilmiştir. SLE patogenezi iyi anlaşılmamıştır.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonlarının raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar / risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir. (www.titck.gov.tr; e- posta: tufam@titck.gov.tr; tel: 0 800 314 00 08; faks: 0 312 218 35
99)
4.9. Doz aşımı ve tedavisi
Doz aşımı görülen bir olgu bildirilmemiştir. XOLAİR'in tolere edilen en yüksek dozu belirlenmemiştir. 4.000 miligrama kadar çıkabilen tek intravenöz dozlar, hastalarda, doz sınırlayıcı toksisite bulguları gelişmeksizin uygulanabilmiştir. Hastalara verilmiş olan en
yüksek kümülatif omalizumab dozu, 20 hafta içerisinde 44.000 miligramdır ve istenmeyen hiçbir akut etkiye neden olmamıştır.
Eğer doz aşımından şüphe ediliyorsa, hasta anormal belirti ve semptomlar açısından izlenmelidir. Gerektiği şekilde tıbbi tedavi aranmalı ve başlatılmalıdır.
Plastik tepsiyi kutudan çıkarınız ve kâğıt kapağını geriye doğru soyunuz. Pembe enjektör muhafazasını ortasından tutarak, enjektörü tepsiden çıkarınız.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstrüktif hava yolu hastalıklarında kullanılan diğer sistemik ilaçlar.
ATC Kodu: R03DX05.
Omalizumab, insanlardaki immünoglobülin E (IgE)'ye selektif olarak bağlanan, rekombinant DNA türevi, insan monoklonal antikorudur. Bu antikor; IgG1 kappa yapısındadır; ana iskeleti insan kökenli olup IgE'ye bağlanan komplementer-belirleyici bölgeleri murin ana antikorundan köken almaktadır.
Alerjik Astım ve Nazal polipli kronik rinosinuzit (NP'li KRS)
Etki mekanizması:
Omalizumab, IgE'ye bağlanır ve bu immünoglobülinin yüksek affiniteli IgE reseptörlerine (Fcï¥R1) bağlanmasını önleyerek, alerjik olaylar dizisini tetikleyecek serbest IgE miktarını azaltır. Atopik deneklerin omalizumabla tedavisi, bazofillerin yüzeyindeki Fcï¥R1 reseptörlerinin belirgin azalmasıyla sonuçlanmıştır. XOLAİR ile tedavi, düşük kan ve doku eozinofilleri ve innate (doğal), adaptive (edinilmiş) ve immün olmayan hücreler tarafından IL-4, IL-5 ve IL-13 dahil olmak üzere azalmış enflamatuvar mediyatörler ile kanıtlandığı üzere IgE aracılı enflamasyonu inhibe eder.
Farmakodinamik etki:
Alerjik astım
Tedavi öncesi değerler ile karşılaştırıldığında XOLAİR ile tedavi edilen hastalarda bir alerjen ile stimulasyonu takiben bazofillerden in vitro histamin salıverilmesi yaklaşık %90 azalmaktadır.
Astımlı hastalardaki klinik çalışmalarda serumdaki serbest IgE düzeyleri ilk dozdan sonra, doza bağlı olarak azalmış ve doz aralarında düşük değerlerde kalmıştır. XOLAİR tedavisinin durdurulmasından bir yıl sonra, IgE düzeyleri tedavi öncesindeki değerlere dönmüştür ve tıbbi ürünün vücuttan temizlenmesinden sonra IgE düzeylerinde rebound gözlenmemiştir.
Nazal polipli kronik rinosinuzit (NP'li KRS)
NP'li KRS hastalarında yapılan klinik çalışmalarda, XOLAİR tedavisi, alerjik astımı olan hastalarda gözlemlenenle benzer ölçüde, serumdaki serbest IgE düzeylerinde bir azalmaya (yaklaşık %95) ve serum total IgE düzeylerinde bir artışa yol açmıştır. Serbest IgE'ye göre daha yavaş eliminasyon hızına sahip omalizumab-IgE komplekslerinin oluşması nedeniyle serumdaki total IgE seviyeleri artmıştır.
Kronik İdiyopatik Ürtiker (KİÜ)
Etki mekanizması:
Omalizumab, IgE'ye bağlanır ve serbest IgE düzeylerini düşürür. Bunun sonucunda, hücreler üzerindeki IgE reseptörlerinin (Fcï¥R1) sayısı azalır. Bunun KİÜ semptomlarında bir iyileşme ile nasıl sonuçlandığı tam olarak anlaşılmamıştır.
Farmakodinamik etki:
KİÜ hastaları üzerinde yapılan klinik çalışmalarda, maksimum serbest IgE baskılanması ilk subkutan dozdan 3 gün sonra gözlenmiştir. 4 haftada bir kere tekrarlı doz uygulamasından sonra, doz öncesi serumdaki serbest IgE düzeyleri 12. ila 24. tedavi haftaları arasında sabit kalmıştır. XOLAİR tedavisinin bırakılmasından sonra, 16 haftalık tedavisiz takip dönemi boyunca tedavi öncesi düzeylere doğru serbest IgE düzeyleri artmıştır.
Klinik etkililik ve güvenlilik:
Alerjik Astım
Erişkinler ve ergenler (12 yaş ve üzeri):
XOLAİR'in etkililik ve güvenliliği, yüksek dozda inhale kortikosteroid ve uzun etkili beta2-agonisti kullanımına rağmen yetersiz astım kontrolü ve azalmış akciğer fonksiyonuna (FEV1 %40-80 öngörülen) sahip 12-79 yaşındaki 419 ağır alerjik astım hastasını içeren 28 haftalık çift kör plasebo kontrollü bir çalışmada (çalışma 1) gösterilmiştir. Seçilen hastalar önceki yılda yüksek dozda inhale kortikosteroid ve uzun etkili bir beta2-agonist ile kesintisiz tedaviye rağmen sistemik kortikosteroid tedavisi gerektiren çok sayıda astım alevlenmeleri yaşamış ya da ağır astım alevlenmesi nedeniyle hastaneye yatırılmış veya acil servise getirilmiştir. Subkutan XOLAİR veya plasebo
>1.000 mikrogram beklometazon dipropiyonat (veya eşdeğeri) artı uzun etkili bir beta2- agoniste ilave tedavi olarak uygulanmıştır. Oral kortikosteroid, teofilin ve lökotrien modifiye edici idame tedavilerine izin verilmiştir (sırasıyla hastaların %22, %27 ve
%35'i).
Sistemik kortikosteroidlerle tedavi gerektiren astım alevlenmelerinin oranı birincil sonlanım noktasıdır. Omalizumab astım alevlenmelerinin oranını %19 azaltmıştır (p = 0,153). XOLAİR lehine istatistiksel anlam (p<0,05) gösteren ilave değerlendirmeler ağır alevlenmeler (hastanın akciğer fonksiyonunun kendi en iyi değerinin %60 altına azaldığı ve sistemik kortikosteroid gerektiren) ve astımla ilişkili acil servis başvurularında (hastaneye yatırılma, acil servis ve planlı olmayan doktor vizitlerinden oluşur) azalmalar ve hekimin genel tedavi etkililiği değerlendirmesi, Astımla ilişkili Yaşam Kalitesi (AQL), astım semptomları ve akciğer fonksiyonunda iyileşmeleri içermiştir.
Bir alt grup analizinde, tedavi öncesi total IgE değeri ≥76 IU/ml olan hastaların XOLAİR'den klinik olarak anlamlı bir fayda elde etme olasılığının daha yüksek olduğu bulunmuştur. Çalışma 1'deki bu hastalarda XOLAİR astım alevlenmeleri oranını %40 azaltmıştır (p = 0,002). Ayrıca XOLAİR ağır astım programında toplam IgE ≥76 IU/ml popülasyonunda daha fazla hasta klinik olarak anlamlı yanıtlar elde etmiştir. Tablo 5'te çalışma 1 popülasyonunun bulguları yer almaktadır.
Tablo 5: Çalışma 1'in bulguları
| Tam çalışma 1 popülasyonu | |
| XOLAİR N=209 | Plasebo N=210 |
Astım alevlenmeleri |
|
|
28 haftalık periyot başına oran | 0,74 | 0,92 |
% azalma, oran için p-değeri | %19,4, p=0,153 | |
Ağır astım alevlenmeleri |
|
|
28 haftalık periyot başına oran | 0,24 | 0,48 |
% azalma, oran için p-değeri | %50,1, p=0,002 | |
Acil servis ziyaretleri |
|
|
28 haftalık periyot başına oran | 0,24 | 0,43 |
% azalma, oran için p-değeri | %43,9, p=0,038 | |
Hekimin genel değerlendirmesi |
|
|
%yanıt veren* | %60,5 | %42,8 |
p-değeri** | <0,001 | |
AQL iyileşmesi |
|
|
≥0,5 iyileşme görülen hasta yüzdesi | %60,8 | %47,8 |
p-değeri | 0,008 | |
*belirgin iyileşme veya tam kontrol
**genel değerlendirme dağılımı için p-değeri
Çalışma 2'de çalışma 1'deki popülasyonla eşleştirilmiş 312 ağır alerjik astım hastasından oluşan bir popülasyonda XOLAİR'in etkililik ve güvenliliği değerlendirilmiştir. Bu açık etiketli çalışmada XOLAİR ile tedavi tek başına güncel astım tedavisine kıyasla klinik olarak anlamlı astım alevlenmesi oranında %61 azalmaya yol açmıştır.
1.722 yetişkin ve ergende 28 ila 52 haftalık dört ilave büyük plasebo kontrollü destekleyici çalışmada (çalışma 3, 4, 5, 6) ağır persistan astımı olan hastalarda XOLAİR'in etkililik ve güvenliliği değerlendirilmiştir. Çoğu hasta yetersiz düzeyde kontrol edilmekle birlikte çalışma 1 veya 2'deki hastalardan daha az eşzamanlı astım tedavisi görmektedir. Çalışma 3-5'de birincil sonlanım noktası olarak alevlenme kullanılırken, çalışma 6'da başlıca inhale kortikosteroidden kurtulma değerlendirilmiştir.
Çalışma 3, 4 ve 5'de XOLAİR ile tedavi edilen hastalar astım alevlenmelerinde plaseboya kıyasla sırasıyla %37,5 (p=0,027), %40,3 (p<0,001) ve %57,6 (p<0,001) azalma sağlamıştır.
Çalışma 6'da plasebo grubuna (%45,8) kıyasla istatiksel anlamlı düzeyde (p<0,05) daha fazla sayıda XOLAİR kullanan ağır allerjik astım hastası (%60,3), astım kontrolünde bozulma olmaksızın flutikazon dozlarını ≤500 mikrogram/güne azaltabilmiştir.
Yaşam kalitesi skorları Juniper Astımla İlişkili Yaşam Kalitesi Anketi kullanılarak ölçülmüştür. Altı çalışmanın tümü için plasebo veya kontrol grubuna karşı XOLAİR hastaları için yaşam kalitesi skorlarında başlangıca göre istatistiksel olarak anlamlı bir iyileşme görülmüştür.
Hekimin genel tedavi etkililiği değerlendirmesi:
Hekimin genel değerlendirmesi tedaviden sorumlu hekim tarafından yürütülen kapsamlı bir astım kontrolü ölçümü olarak yukarıdaki çalışmaların beşinde yürütülmüştür. Hekim PEF (pik ekspiratuar akış), gündüz ve gece semptomları, kurtarma ilacı kullanımı, spirometri ve alevlenmeleri dikkate alabilmiştir. Beş çalışmanın tümünde plasebo hastalarına kıyasla XOLAİR ile tedavi edilen anlamlı olarak daha yüksek oranda hastanın
astımlarında belirgin bir iyileşme veya tam kontrol sağladıkları sonucuna varılmıştır.
6 - <12 yaş arası çocuklar
XOLAİR'in 6 - <12 yaş grubundaki güvenlilik ve etkililiği için primer destek randomize, çift kör, plasebo kontrollü, çok merkezli bir çalışmadan (çalışma 7) gelmektedir.
Çalışma 7, yüksek doz inhale kortikosteroidler (≥500 μg/gün flutikazon eşdeğeri) artı uzun etkili beta agonist ile tedavi edilmiş, mevcut endikasyonda tanımlanan belirli bir hasta alt grubunu (n=235) içeren plasebo kontrollü bir çalışmadır.
Klinik açıdan anlamlı bir alevlenme, araştırmacı tarafından klinik olarak değerlendirildiği üzere, astım semptomlarında, en az 3 gün süreyle başlangıç inhale kortikosteroid dozunun iki katına çıkarılması ve/veya en az 3 gün süreyle kurtarma sistemik (oral veya intravenöz) kortikosteroidlerle tedavi gerektiren kötüleşme olarak tanımlanmıştır.
Yüksek doz inhale kortikosteroid kullanan spesifik hasta alt grubunda, omalizumab grubunun, plasebo grubuna göre istatistiksel olarak anlamlı derecede daha düşük bir klinik açıdan anlamlı astım alevlenme oranına sahip olduğu görülmüştür. 24. haftada, tedavi grupları arasında oranlar açısından fark, omalizumab hastaları için plaseboya göre
%34'lük (oran oranı 0,662, p = 0,047) bir azalmayı temsil etmiştir. 28 haftalık ikinci çift kör tedavi döneminde, tedavi grupları arasında oranlar açısından fark, omalizumab hastaları için plaseboya göre %63'lük (oran oranı 0,37, p<0,001) bir düşüşü temsil etmiştir.
52 haftalık çift kör tedavi dönemi sırasında (24 haftalık sabit doz steroid fazı ve 28 haftalık steroid ayarlama fazını kapsar) tedavi grupları arasında oran farkı, omalizumab hastaları için alevlenmelerde %50 düzeyinde (oran oranı 0,504, p<0,001) rölatif bir azalmayı temsil etmiştir.
Omalizumab grubu, tedavi grupları arasındaki fark istatistiksel olarak anlamlı olmasa da, 52 haftalık tedavi süresinin sonunda beta-agonist kurtarma ilacı kullanımında plasebo grubuna göre daha yüksek düşüşler göstermiştir. Yüksek doz inhale kortikosteroidler ve uzun etkili beta agonistleri alan ağır hastalardan oluşan bir alt grupta 52 haftalık çift kör tedavi süresinin sonunda tedavi etkinliğinin genel değerlendirmesi için, plasebo grubuna kıyasla omalizumab grubunda 'mükemmel' tedavi etkinliğine sahip olarak değerlendirilen hastaların oranı daha yüksektir ve 'orta' veya 'kötü' tedavi etkinliğine sahip olanların oranı daha düşüktür; gruplar arasındaki fark istatistiksel olarak anlamlı (p<0,001) olmuştur; diğer yandan hastaların öznel Yaşam Kalitesi derecelendirmeleri açısından omalizumab ve plasebo grupları arasında fark yoktur.
Nazal polipli kronik rinosinüzit (NP'li KRS)
XOLAİR'in güvenliliği ve etkililiği, NP'li KRS'li hastalardaki iki randomize, çift kör, plasebo kontrollü çalışmada değerlendirilmiştir (Tablo 7). Hastalar her 2 veya 4 haftada bir subkutan olarak XOLAİR veya plasebo almıştır (bkz. Bölüm 4.2). Tüm hastalar, çalışma boyunca arka planda intranazal mometazon tedavisi almıştır. Çalışmalara dahil edilmek için önceki sino-nazal cerrahi veya önceden sistemik kortikosteroid kullanımı gerekli olmamıştır. Hastalar 24 hafta boyunca XOLAİR veya plasebo almış, bunu 4 haftalık bir takip dönemi izlemiştir. Alerjik komorbiditeler dahil olmak üzere demografik özellikler ve çalışma başlangıcındaki karakteristikler Tablo 6'da açıklanmaktadır.
Tablo 6 POLYP 1 ve 2 çalışmalarının demografik özellikleri ve çalışma başlangıcındaki karakteristikleri
Parametre | POLYP 1 N=138 | POLYP 2 N=127 |
Ortalama yaş (yıl) (SD) | 51 (13,2) | 50,1 (11,9) |
% Erkek | 63,8 | 65,4 |
Önceki yıl sistemik kortikosteroid kullanımı olan hastalar (%) | 18,8 | 26 |
Bilateral endoskopik nazal polip skoru (NPS): ortalama (SD), aralık 0-8 | 6,2 (1) | 6,3 (0,9) |
Nazal konjesyon skoru (NKS): ortalama (SD), aralık 0-3 | 2,4 (0,6) | 2,3 (0,7) |
Koku duyusu puanı: ortalama (SS), aralık 0-3 | 2,7 (0,7) | 2,7 (0,7) |
SNOT-22 toplam puanı: ortalama (SD) aralık 0-110 | 60,1 (17,7) | 59,5 (19,3) |
Kan eozinofilleri (hücre/µl): ortalama (SD) | 346,1 (284,1) | 334,6 (187,6) |
Total IgE IU/ml: ortalama (SD) | 160,9 (139,6) | 190,2 (200,5) |
Astım (%) | 53,6 | 60,6 |
Hafif (%) | 37,8 | 32,5 |
Orta (%) | 58,1 | 58,4 |
Ağır (%) | 4,1 | 9,1 |
Aspirin ile tetiklenen solunum hastalıkları (%) | 19,6 | 35,4 |
Alerjik rinit | 43,5 | 42,5 |
SD = standart sapma; SNOT-22 = Sino-Nazal Sonuç Testi 22 Anketi; IgE = İmmünoglobulin E; IU = uluslararası birimler. NPS, NKS ve SNOT-22 için daha yüksek puanlar, daha yüksek hastalık şiddetini gösterir.
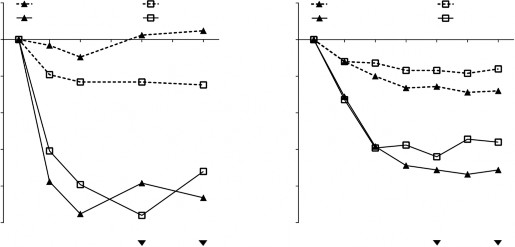
Ortak birincil sonlanım noktaları, 24. haftada bilateral nazal polip skoru (NPS) ve ortalama günlük nazal konjesyon skoru (NKS) olmuştur. POLYP 1 ve 2 çalışmalarında, XOLAİR alan hastaların NPS'de 24. haftada başlangıca göre iyileşmeleri ve haftalık ortalama NKS'leri plasebo alan hastalara göre istatistiksel olarak anlamlı düzeyde daha fazla olmuştur. POLYP 1 ve 2 çalışmalarının sonuçları Tablo 7'de gösterilmektedir.
Tablo 7 POLYP 1, POLYP 2 ve birleştirilmiş (pooled) verilerden elde edilen klinik skorlarda 24. haftada başlangıca göre değişiklik
POLYP 1 |
POLYP 2 | POLYP 1 ve POLYP 2 çalışmalarının birleştirilmiş (pooled) sonuçları | ||||
| Plasebo | Xolair | Plasebo | Xolair | Plasebo | Xolair |
N | 66 | 72 | 65 | 62 | 131 | 134 |
Nazal polip skoru | ||||||
Başlangıçtaki ortalama | 6,32 | 6,19 | 6,09 | 6,44 | 6,21 | 6,31 |
24. haftada LS ortama değişimi | 0,06 | -1,08 | -0,31 | -0,9 | -0,13 | -0,99 |
Fark (%95) GA | -1,14 (-1,59, -0,69) | -0,59 (-1,05, -0,12) | -0,86 (-1,18, -0,54) | |||
p değeri |
<0,0001 |
0,014 |
<0,0001 | |||
7 günlük ortalama günlük nazal konjesyon skoru | ||||||
Başlangıçtaki ortalama | 2,46 | 2,4 | 2,29 | 2,26 | 2,38 | 2,34 |
24. haftada LS ortama değişimi | -0,35 | -0,89 | -0,2 | -0,7 | -0,28 | -0,8 |
Fark (%95) GA | -0,55 (-0,84, -0,25) | -0,5 (-0,8, -0,19) | -0,52 (-0,73, -0,31) | |||
p değeri |
0,0004 |
0,0017 |
<0,0001 | |||
TNSS | ||||||
Başlangıçtaki ortalama | 9,33 | 8,56 | 8,73 | 8,37 | 9,03 | 8,47 |
24. haftada LS ortama değişimi | -1,06 | -2,97 | -0,44 | -2,53 | -0,77 | -2,75 |
Fark (%95) | -1,91 (-2,85, -0,96) | -2,09 (-3, -1,18) | -1,98 (-2,63, -1,33) | |||
p değeri | 0,0001 | <0,0001 | <0,0001 | |||
SNOT-22 | ||||||
Başlangıçtaki ortalama | 60,26 | 59,82 | 59,8 | 59,21 | 60,03 | 59,54 |
24. haftada LS ortama değişimi | -8,58 | -24,7 | -6,55 | -21,59 | -7,73 | -23,1 |
Fark (%95) | -16,12 (-21,86, - 10,38) | -15,04 (-21,26, -8,82) | -15,36 (-19,57, - 11,16) | |||
p değeri | <0,0001 | <0,0001 | <0,0001 | |||
(MID = 8,9) |
|
|
| |||
UPSIT | ||||||
Başlangıçtaki ortalama | 13,56 | 12,78 | 13,27 | 12,87 | 13,41 | 12,82 |
24. haftada LS ortama değişimi | 0,63 | 4,44 | 0,44 | 4,31 | 0,54 | 4,38 |
Fark (%95) | 3,81 (1,38, 6,24) | 3,86 (1,57, 6,15) | 3,84 (2,17, 5,51) | |||
p değeri | 0,0024 | 0,0011 | <0,0001 | |||
LS = en küçük kare; GA = güven aralığı; TNSS = Toplam nazal semptom skoru; SNOT-22 = Sino-Nazal Sonuç Testi 22 Anketi; UPSIT = Pennsylvania Üniversitesi Koku Tanımlama Testi; MID = minimum önemli fark.
Şekil 1 POLYP 1 ve 2 çalışmalarında tedavi grubuna göre nazal konjesyon skorunda başlangıca göre ortalama değişim ve nazal polip skorunda başlangıca göre ortalama değişim
0.25
0.25
0.00 0.00
-0.25 -0.25
-0.50 -0.50
-0.75 -0.75
-1.00 -1.00
-1.25
-1.25
|
|
|
|
|
|
|
|
24 haftalık tedavi periyodu sırasında kurtarma tedavisinin önceden belirlenmiş bir birleştirilmiş (pooled) analizinde (ardışık 3 gün sistemik kortikosteroidler veya nazal polipektomi), XOLAİR'de kurtarma tedavisi gerektiren hastaların oranı plaseboya kıyasla daha düşük olmuştur (sırasıyla %2,3'e karşı %6,2). Plaseboya kıyasla XOLAİR'de kurtarma tedavisi almış olma olasılık oranı 0,38'dir (%95 GA: 0,10, 1,49). Her iki çalışmada da bildirilen hiçbir sino-nazal ameliyatı söz konusu olmamıştır.
POLYP 1 ve 2 çalışmalarına katılan NP'li KRS'li hastalarda XOLAİR'in uzun vadeli etkililiği ve güvenliliği, açık etiketli bir uzatma çalışmasında değerlendirilmiştir. Bu çalışmadan elde edilen etkililik verileri, 24. Haftada sağlanan klinik yararın 52. Haftaya kadar sürdüğünü göstermektedir. Güvenlilik verileri genel olarak omalizumabın bilinen güvenlilik profili ile tutarlıdır.
Kronik İdiyopatik Ürtiker (KİÜ)
Onaylanmış dozda HI antihistaminik tedavisine rağmen semptomatik kalan KİÜ görülen hastalarda XOLAİR'in etkililiği ve güvenliliği iki randomize, plasebo kontrollü faz III çalışmada (çalışma 1 ve 2) gösterilmiştir. Üçüncü bir çalışmada (çalışma 3) öncelikli olarak onaylanmış dozun dört katına kadar HI antihistaminikler ve H2 antihistamin ve/veya LTRA tedavisine rağmen semptomatik kalan KİÜ görülen hastalarda XOLAİR'in güvenliliği değerlendirilmiştir. Üç çalışmaya yaşları 12 ile 75 arasında olan 975 hasta (ortalama yaş 42,3; 39 hasta 12-17 yaş, 54 hasta ≥ 65 yaş; 259 erkek ve 716 kadın) dahil edilmiştir. Tüm hastalar, önceden en az 2 hafta boyunca bir antihistamin kullanmış olmasına rağmen randomizasyondan önceki 7 gün boyunca değerlendirildiğinde semptom kontrolünün yetersiz olması ile haftalık ürtiker aktivite skoru (UAS7, aralık 0-42) ≥ 16 ve haftalık kaşıntı şiddeti skorunun (UAS7'nin bir bileşenidir; 0-21 aralığı) ≥ 8 olması gerekmiştir
Çalışma 1 ve 2'de, hastaların haftalık ortalama kaşıntı şiddeti skoru başlangıçta 13,7 ile 14,5 arasında ve ortalama UAS7 skoru sırasıyla 29,5 ve 31,7 olmuştur. Güvenlilik çalışması 3'teki hastaların haftalık ortalama kaşıntı şiddeti skorunun 13,8 ve başlangıçta ortalama UAS7 skorunun 31,2 olduğu belirlenmiştir. Her üç çalışmada da hastalar çalışmaya dahil edilmeden önce KİÜ semptomları için ortalama 4 ila 6 ilaç (HI antihistaminikler dahil) aldıklarını bildirmişlerdir. Hastalar, çalışma 1 ve 2'de sırasıyla 24
ve 12 hafta boyunca 4 haftada bir subkutan enjeksiyon yoluyla 75 mg, 150 mg veya 300 mg dozunda XOLAİR veya plasebo ve çalışma 3'te 24 hafta boyunca her 4 haftada bir subkutan enjeksiyonla 300 mg veya plasebo almıştır. Tüm çalışmalarda 16 haftalık tedavisiz bir takip süresi yer almıştır.
Birincil sonlanım noktası, haftalık kaşıntı şiddeti skorunda başlangıç ile 12. hafta arasındaki değişimdir. Plasebo ile 3,63 ila 5,14'lük azalmaya kıyasla 300 mg dozunda omalizumab, haftalık kaşıntı şiddeti skorunu 8,55 ila 9,77 (p <0,0001) azaltmıştır (bkz. Tablo 8). UAS7 ≤ 6 (12. haftada) için yanıt veren oranlarında da 300 mg tedavi grupları için daha yüksek ve plasebo grupları için %11-19'a kıyasla %52-66 (p<0,0001) arasında bulunan istatistiksel olarak anlamlı sonuçlar gözlemlenmiş ve plasebo gruplarındaki hastaların %5-9'una kıyasla 300 mg ile tedavi edilen hastaların %34-44'ünde (p<0,0001) tam yanıt (UAS7=0) elde edilmiştir. 300 mg tedavi gruplarındaki hastalar, plasebo gruplarıyla (%88,1-89,2) karşılaştırıldığında, 4. haftadan 12. haftaya kadar en yüksek ortalama anjiyoödemsiz gün oranına (%91-96,1; p<0,001) ulaşmıştır. 300 mg tedavi grupları için toplam DLQI'de başlangıca göre 12. haftaya kadar ortalama değişim, plaseboya göre daha büyük olup (p<0,001) karşılık gelen plasebo grupları için 5,1-6,1 puana kıyasla 9,7-10,3 puan arasında değişen bir iyileşme göstermiştir.
Tablo 8 Haftalık kaşıntı şiddeti skorunda başlangıç ile 12. hafta arasındaki değişim, çalışma 1,2 ve 3 (mITT popülasyonu*)
|
Plasebo | Omalizumab 300 mg |
Çalışma 1 |
|
|
N | 80 | 81 |
Ortalama (SS) | -3,63 (5,22) | -9,4 (5,73) |
Plasebo karşısında LS ortalamalarında fark |
| -5,8 |
fark için %95 GA |
| -7,49, -4,1 |
Plasebo karşısında p değeri |
| <0,0001 |
Çalışma 2 |
|
|
N | 79 | 79 |
Ortalama (SS) | -5,14(5,58) | -9,77 (5,95) |
Plasebo karşısında LS ortalamalarında fark |
| -4,81 |
fark için %95 GA |
| -6,49, -3,13 |
Plasebo karşısında p değeri |
| <0,0001 |
Çalışma 3 |
|
|
N | 83 | 252 |
Ortalama (SS) | -4,01 (5,87) | -8,55 (6,01) |
Plasebo karşısında LS ortalamalarında fark |
| -4,52 |
fark için %95 GA |
| -5,97, -3,08 |
Plasebo karşısında p değeri |
| <0,0001 |
*Modifiye edilmiş tedavi amaçlı (mITT) popülasyon: randomize edilmiş ve en az bir doz çalışma ilacı alan tüm hastaları içermiştir.
Kayıp verileri hesaplamak için BOCF (İleriye Taşınan Başlangıçtaki Gözlem) kullanılmıştır.
1 LS ortalaması, bir ANCOVA modeli kullanılarak hesaplanmıştır. Katmanlar, başlangıç haftalık kaşıntı şiddeti skoru (<13'e karşı ≥ 13) ve başlangıç ağırlığıdır (<80 kg'a karşı ≥ 80 kg).
2 p-değeri ANCOVA t-testinden türetilmiştir.
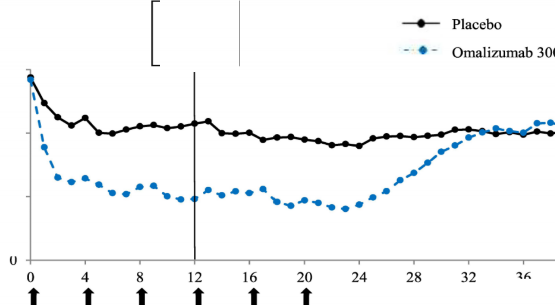
Şekil 2'de, çalışma 1'de zaman içindeki ortalama haftalık kaşıntı şiddeti skoru gösterilmektedir. Ortalama haftalık kaşıntı şiddeti skorları, 24 haftalık tedavi periyodu boyunca sürdürülen ve 12. hafta civarında maksimum olan etki ile önemli ölçüde azalmıştır. Çalışma 3'te de sonuçlar benzerdir.
Her üç çalışmada da ortalama haftalık kaşıntı şiddeti skoru, 16 haftalık tedavisiz takip süresi boyunca, semptomların yeniden ortaya çıkmasıyla tutarlı olarak kademeli şekilde artmıştır. Takip süresinin sonundaki ortalama değerler, plasebo grubuna benzer ancak ilgili ortalama başlangıç değerlerinden daha düşük olmuştur.
Hafta
Plasebo
Hafta 12 Birincil Sonlanım Noktası
Ortalama haftalık kaşıntı şiddeti skoru
Şekil 2 Zaman içinde haftalık ortalama kaşıntı şiddeti skoru, çalışma 1 (mITT popülasyonu)
Omalizumab veya plasebo uygulanmıştır
BOCF=ileriye taşınan başlangıçtaki gözlem; mITT=modifiye tedavi amaçlı popülasyon
24 haftalık tedaviden sonra etkililik
Tedavinin 24. haftasında gözlemlenen etkililik sonuçlarının boyutu, 12. haftada gözlemlenenlerle benzerdir:
300 mg için, 1. ve 3. çalışmalarda, haftalık kaşıntı şiddeti skorunda başlangıca göre ortalama düşüş sırasıyla 9,8 ve 8,6, UAS7 ≤ 6 olan hastaların oranı %61,7 ve %55,6 ve tam yanıt veren hastaların oranı (UAS7=0) %48,1 ve %42,5 olmuştur (plaseboya kıyasla tümü p<0,0001).
Hastaların omalizumab ile yeniden tedavisinde sınırlı klinik deneyim mevcuttur.
Adölesanlar (12 ila 17 yaş) hakkındaki klinik çalışma verileri, 11'i 300 mg doz alan toplam 39 hastayı içermiştir. 300 mg için sonuçlar 12. haftada 9 hasta ve 24. haftada 6 hasta için mevcuttur ve erişkin popülasyona kıyasla omalizumab tedavisine benzer bir yanıt büyüklüğü göstermektedir. Haftalık kaşıntı şiddeti skorunda başlangıca göre ortalama değişiklik 12. haftada 8,25 ve 24. haftada 8,95 azalma göstermiştir. Yanıt veren
oranları: UAS7=0 için 12. haftada %33 ve 24. haftada %67 ve UAS7<6 için 12. haftada
%56 ve 24. haftada %67'dir.
5.2. Farmakokinetik özellikler
Genel özelliklerOmalizumabın farmakokinetiği, alerjik astımı olan erişkin ve ergen hastalarda ve nazal polipli erişkin hastalarda çalışılmıştır. Omalizumabın genel farmakokinetik özellikleri bu hasta popülasyonlarında benzerdir.
Emilim:
Omalizumabın, subkutan uygulama sonrası, ortalama mutlak biyoyararlanım oranı
%62'dir. Astımlı erişkin ve ergen hastalarda tek bir subkutan dozun ardından omalizumab, yavaşça kana karışmış ve maksimum serum düzeylerine 6 ila 8 gün sonra ulaşmıştır. Çoğul omalizumab dozlarının ardından, sıfırıncı günle kararlı serum düzeylerinin elde edildiği 14. gün arasındaki serum konsantrasyonu-zaman eğrisinin altında kalan alan (EAA) değeri, ilk doz sonrası değerin 6 katı bulunmuştur.
Omalizumabın farmakokinetiği, 0,5 mg/kg'ın üzerindeki dozlarda doğrusaldır. KİÜ'lü hastalarda her 4 haftada bir 75 mg, 150 mg veya 300 mg dozlarını takiben, omalizumabın en düşük serum konsantrasyonları doz düzeyiyle orantılı olarak artmıştır.
XOLAİR'in likid veya liyofilize formülasyonlarının uygulanması benzer omalizumab serum konsantrasyon-zaman profillerine neden olmuştur.
Dağılım:
Omalizumab in vitro olarak, IgE ile sınırlı boyutta kompleksler oluşturur. In vitro ya da in vivo, presipitasyon gösteren ve molekül ağırlığı bir milyon Dalton'u aşan kompleksler gözlenmez. Popülasyon farmakokinetiğine dayalı olarak, omalizumab dağılımı alerjik astımı olan hastalar ile KİÜ hastalarında benzerdir. Astım hastalarında subkutan uygulamayı izleyen sanal dağılım hacmi, 78 ± 32 ml/kg olarak hesaplanmıştır.
Biyotransformasyon:
Karaciğer yoluyla metabolize edilir. IgG, retiküloendotelyal sistem (RES) ve endotel hücreleri tarafından parçalanır.
Eliminasyon:
Omalizumab klirensi, IgG klirensiprosesine uyar, ayrıca hedef ligandı olan IgE ile bağlanarak kompleks oluşturması da, omalizumabın eliminasyon yollarındandır. IgG'nin karaciğerdeki eliminasyonu retiküloendotelyal sistem ve endotel hücrelerinde parçalanmayı içerir. Değişikliğe uğramamış IgG safra ile de atılır. Omalizumabın astım hastalarındaki serum eliminasyon yarılanma ömrü ortalama 26 gün olmuş, günlük görünen klirensin ise ortalama 2,4 ± 1,1 ml/kg olduğu hesaplanmıştır. Vücut ağırlığının iki katına çıkması sanal klirensi yaklaşık ikiye katlamıştır. KİÜ hastalarında, popülasyon farmakokinetik simülasyonlarına dayalı olarak, kararlı durumda omalizumab serum eliminasyon yarı ömrü ortalama 24 gün ve 80 kg ağırlığındaki bir hasta için kararlı durumda görünür klirens 3 mL/kg/gün olmuştur.
Doğrusallık/Doğrusal Olmayan Durum:
Omalizumab, 0,5 mg/kg'ı aşan dozlarda lineer farmakokinetiğe sahiptir.
Hastalardaki karakteristik özellikler
Böbrek/Karaciğer yetmezliği:
Alerjik astım ya da kronik idiyopatik ürtikeri (KİÜ) olup, böbrek veya karaciğer yetmezliği görülen hastalarda elde edilmiş farmakokinetik veya farmakodinamik veriler mevcut değildir (bkz. Bölüm 4.2 ve Bölüm 4.4).
Pediyatrik popülasyon:
XOLAİR'in astımlı hastalarda 6, Nazal polipli kronik rinosinüzit(NP'li KRS)li hastalarda
18 ve KİÜ'sü olan hastalarda 12 yaşından daha küçük çocuklarda kullanılmasının güvenliliği ve etkililiği saptanmamıştır. Bu nedenle bu yaş grubundaki hastalarda XOLAİR'in kullanımı önerilmez.
Geriyatrik popülasyon:
XOLAİR'in 65 yaşın üzerindeki hastalarda kullanılması konusundaki tecrübeler sınırlıdır ama yaşlı hastalardaki dozun, gençlerdekinden farklı olması gerektiğine dair herhangi bir kanıt yoktur.
Yaş, Irk/Etnik köken, Cinsiyet, Vücut Kitle İndeksi:
Alerjik Astımlı ve Nazal polipli kronik rinosinüzitli (NP'li KRS) hastalar
XOLAİR'in popülasyon farmakokinetiği, demografik özelliklerin etkilerini değerlendirmek amacıyla analiz edilmiş ve eldeki bu sınırlı verilerin analizi; yaş (alerjik astımlı hastalar için 6-76 yaş; NP'li KRS'li hastalar için 18-75 yaş), ırk/etnik köken, cinsiyet veya vücut kitle indeksi için doz ayarlamasının gerekli olmadığını göstermektedir (bkz Bölüm 4.2).
KİÜ görülen hastalar
Demografik özelliklerin ve diğer faktörlerin omalizumab maruziyeti üzerindeki etkileri, popülasyon farmakokinetiğine dayalı olarak değerlendirilmiştir. Ek olarak, omalizumab konsantrasyonları ile klinik yanıtlar arasındaki ilişki analiz edilerek ortak değişken etkileri değerlendirilmiştir. Bu analizler, yaş (12 ila 75 yaş), ırk/etnisite, cinsiyet, vücut ağırlığı, vücut kitle indeksi, başlangıç IgE, anti-Fcï¥RI otoantikorları ya da H2 antihistaminikleri ya da lökotrien reseptör antagonistleri (LTRA'lar) ile eş zamanlı kullanım için doz ayarlamalarına gerek olmadığına işaret etmektedir.
5.3. Klinik öncesi güvenlilik verileri
Omalizumab, cynomolgus ve insan IgE'sine benzer afinite ile bağlandığından, omalizumabın güvenliliği cynomolgus maymununda incelenmiştir. Tekrarlanan subkutan veya intravenöz uygulamayı takiben bazı maymunlarda omalizumab antikorları saptanmıştır. Ancak, immün kompleks aracılığıyla gelişen hastalık veya komplemana bağımlı sitotoksite gibi belirgin bir toksisiteye rastlanmamıştır. Erişkin ve ergen cynomolgus maymunlarında mast hücresi degranülasyonuna bağlı sistemik anafilaksi reaksiyonu geliştiğine dair kanıt yoktur.
250 mg/kg'a kadar (önerilen doz tablosundaki mg/kg'a göre önerilen en yüksek klinik dozun en az 14 katı) kronik omalizumab uygulanması, insan-dışı primatlarda (hem erişkin hem de ergen hayvanlar) iyi tolere edilmiş ve yalnızca ergen hayvanlarda daha yüksek bir sensivite ile trombosit sayısının, doza ve yaşa bağımlı olarak azaldığı görülmüştür. Yetişkin cynomolgus maymunlarında başlangıca göre trombositlerde % 50'lik bir düşüş elde etmek için gereken serum konsantrasyonu beklenen maksimum klinik serum konsantrasyonlarından yaklaşık 4 ila 20-kat daha fazladır. Ayrıca, cynomolgus maymunundaki enjeksiyon yerinde, akut kanama ve inflamasyon gelişmiştir.
Omalizumab kullanılarak formal karsinojen etki çalışmaları yapılmamıştır.
Cynomolgus maymunlarında omalizumab kullanılarak üreme çalışmaları yapılmıştır. Bu çalışmalar sırasında subkutan olarak verilen 75 mg/kg'a varabilen (4 haftalık süre boyunca mg/kg olarak en yüksek klinik dozun en az 8 katına eşdeğer) dozlar organogenez döneminde kullanıldıklarında maternal toksisiteye, embriyotoksisiteye veya teratojen etkiye neden olmamış; gebeliğin geç döneminde, doğum sırasında veya emzirme döneminde kullanıldığında fetus ya da yenidoğanın gelişmesini olumsuz yönde etkilememiştir.
Omalizumab cynomolgus maymunlarında anne sütünde bulunur. Omalizumab'ın süt düzeyleri, maternal serum konsantrasyonunun % 0,15 idi.
Enjektörü inceleyiniz. Sıvı berrak ila hafif bulutlu olmalıdır. Rengi renksizden soluk kahverengimsi sarıya kadar değişebilir. Bir hava kabarcığı görebilirsiniz; bu normaldir. Enjektör kırılmışsa veya sıvı belirgin şekilde bulutlu veya belirgin kahverengi görünüyorsa ya da partikül içeriyorsa KULLANMAYINIZ. Tüm bu durumlarda, paketin tamamını eczaneye iade ediniz.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
L-arginin hidroklorür L-histidin hidroklorür L-histidin
Polisorbat 20
Enjeksiyonluk su
Nitrojen (işlem yardımcısı olarak)
6.2. Geçimsizlikler
XOLAİR, başka hiçbir ilaçla karıştırılmamalıdır.
6.3. Raf ömrü
18 ay
6.4. Saklamaya yönelik özel tedbirler
Buzdolabında (2ºC-8ºC arasında) ve ışıktan korumak için orijinal ambalajında muhafaza edilmelidir. Dondurulmamalıdır. Son kullanma tarihinden sonra kullanılmamalıdır.
Gerekirse ürün buzdolabından çıkarıldıktan sonra, daha sonra kullanılmak üzere tekrar buzdolabına konabilir; fakat bu durum birden çok defa tekrarlanmamalıdır.
Ürünün oda sıcaklığında (25°C) kaldığı süre 48 saatten çok olmamalıdır. Çocukların göremeyeceği ve erişemeyeceği yerlerde muhafaza edilmelidir. Raf ömrü potansiyel sıcaklık sapmalarını içerir.
6.5. Ambalajın niteliği ve içeriği
Her bir paket plastik bir kap içerisinde 1 adet kullanıma hazır dolu enjektör içermektedir.
Sert bir plastik kabukla kaplanmış kauçuk iğne kılıfından oluşan sert bir iğne kapağı ve ürünle temas eden yüzeyi bir floro reçineyle kaplanmış, lateks içermeyen bromobütil kauçuk bir piston tıpasına sahip kullanıma hazır dolu enjektörde (tip I cam) 1 ml steril çözelti.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
XOLAİR 150 mg enjeksiyonluk çözelti, bireysel kullanım için tek kullanımlık çözelti içeren kullanıma hazır enjektör şeklinde tedarik edilir. Enjektör, oda sıcaklığına ulaşması için enjeksiyondan 20 dakika önce buzdolabından çıkarılmalıdır.
XOLAİR® Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Enjektör Kullanım Talimatı
Enjekte etmeden önce TÜM bu talimatları okuyunuz. Doktorunuz sizin veya hastadan sorumlu kişinin XOLAİR enjeksiyonlarınızı evde uygulayabileceğine karar verirse, kendinize veya başkalarına enjeksiyon yapmadan önce doktorunuz, hemşireniz veya eczacınız tarafından eğitilmeniz gerekir. Kutu, plastik bir tepsiye ayrı ayrı kapatılmış XOLAİR kullanıma hazır enjektör içerir.
XOLAİR 150 mg/ml Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Enjektör
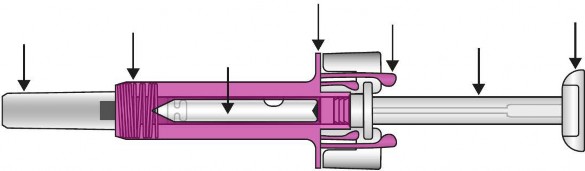
Parmak
İğne başlığı
Enjektör muhafazası
Görüntüleme penceresi Etiket ve son kullanma tarihi
kavrama noktası
Enjektör muhafazası kanatları
Piston
Piston başı
İlaç enjekte edildikten sonra, enjektör muhafazası etkinleşerek iğneyi örtecektir. Bu, kazayla iğne batma yaralanmalarına karşı koruma amaçlıdır.
Enjeksiyonunuz için ihtiyacınız olan diğer ürünler:

Alkollü bez.
Pamuk topu veya gazlı bez.
Kesici/delici atık toplama kabı.
Önemli güvenlik bilgisi
Dikkat: Enjektörü çocukların göremeyeceği ve erişemeyeceği yerlerde saklayınız.
Enjektörün iğne başlığı, bu maddeye duyarlı olan herhangi biri tarafından kullanılmaması gereken kuru kauçuk (lateks) içerebilir.
Bu ilacı kullanmaya hazır olana kadar kapalı kutuyu açmayınız.
Dış kutudaki mühür veya plastik tepsinin mührü kırılmışsa, kullanmanız güvenli olmayabileceğinden, bu ilacı kullanmayınız.
Şırınga sert bir yüzeye düşürülürse veya iğne kapağını çıkardıktan sonra düşürülürse kullanmayınız.
Enjektörü asla başkalarının kurcalayabileceği yerlerde bırakmayınız.
Enjektörü çalkalamayınız.
Kullanmadan önce enjektör muhafazası kanatlarına dokunmamaya dikkat ediniz. Kanatlara dokunulursa, enjektör muhafazası çok erken etkinleştirilebilir.
Enjeksiyonu uygulamadan hemen öncesine kadar iğne başlığını çıkarmayınız.
Enjektör tekrar kullanılamaz. Kullanılmış enjektörü kullanımdan hemen sonra kesici/delici aletler kabında atınız.
XOLAİR 150 mg/ml Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Enjektörün saklanması
Işığa karşı korumak için bu ilacı dış kutusunda saklayınız. Buzdolabında 2°C ile 8°C arasında muhafaza ediniz. DONDURMAYINIZ.
Enjeksiyon için hazırlanmadan önce enjektörü buzdolabından çıkarmayı ve oda sıcaklığına (25°C) ulaşmasını beklemeyi unutmayınız (yaklaşık 20 dakika sürer). Işıktan korumak için enjektörü kutusunda bırakınız. Enjektörün kullanımdan önce oda sıcaklığında (25°C) tutulma süresi 48 saati geçmemelidir.
Enjektörü, dış kutu ve enjektör etiketinde belirtilen son kullanma tarihinden sonra kullanmayınız. Süresi dolmuşsa, paketin tamamını eczaneye iade ediniz.
Enjeksiyon bölgesi
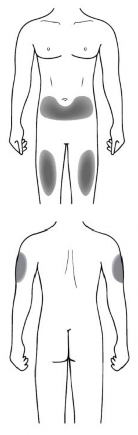
Enjeksiyon bölgesi, enjektörü vücutta kullanacağınız yerdir.
Tavsiye edilen bölge uylukların önüdür. Alt karnı da kullanabilirsiniz, ancak göbeğin (göbek deliği) etrafındaki 5 santimetre alanı kullanamazsınız.
Tam doz için birden fazla enjeksiyon yapmanız gerekiyorsa, her enjeksiyonda farklı bir enjeksiyon bölgesi seçiniz.
Cildin hassas, çürük, kırmızı veya sert olduğu bölgelere enjekte etmeyiniz. Yara izleri veya çatlakları olan alanlardan kaçınınız.
Enjektörü yatay tutarak etiketin üzerinde yazılı olan son kullanma tarihini kontrol etmek için görüntüleme penceresine bakınız. Not: Enjektör düzeneğinin iç kısmını, etiket görüntüleme penceresinde okunabilecek şekilde döndürmek mümkündür. Ürünün süresi dolmuşsa KULLANMAYINIZ. Süresi dolmuşsa, paketin tamamını eczaneye iade ediniz.
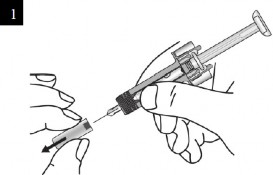
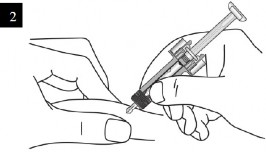
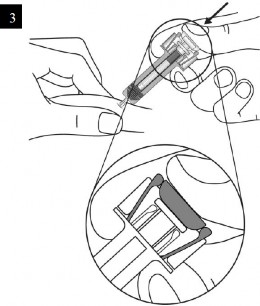
XOLAİR 150 mg/ml Enjeksiyonluk Çözelti İçeren Kullanıma Hazır Enjektör nasıl kullanılır?
İğne başlığını enjektörden dikkatlice çıkarınız. İğne başlığını atınız. İğnenin sonunda bir damla sıvı görebilirsiniz. Bu normaldir. |
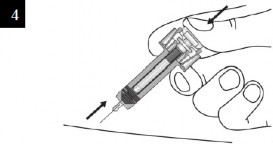
Enjeksiyon bölgesinde cildi parmaklarınız arasında yavaşça sıkıştırınız ve iğneyi gösterildiği gibi batırınız. İlacın tam olarak uygulanabildiğinden emin olmak için iğneyi sonuna kadar itiniz. |
Enjektörü gösterildiği gibi tutunuz. Piston başlığını tamamen enjektör muhafazası kanatları arasında olacak şekilde pistonu gidebildiği kadar yavaşça bastırınız. |
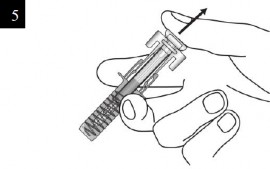
İğneyi enjeksiyon yerinden doğrudan ve dikkatlice çektiğiniz sırada pistonu tamamen basılı tutmaya devam ediniz. |
Pistonu yavaşça serbest bırakınız ve enjektör muhafazasının açıkta kalan iğneyi otomatik olarak örtmesine izin veriniz.
Enjeksiyon bölgesinde az miktarda kan olabilir. Enjeksiyon bölgesinin üzerine bir pamuk topu veya gazlı bez basabilir ve 30 saniye boyunca tutabilirsiniz. Enjeksiyon bölgesini ovalamayınız. Gerekirse enjeksiyon bölgesini küçük bir yapışkanlı bandajla kaplayabilirsiniz. |
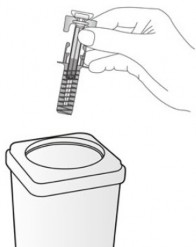
İmha talimatları |
Kullanılmış enjektörü derhal kesici/delici aletler kabı (kapatılabilir, delinmeye dayanıklı kap) içinde bertaraf ediniz. Sizin ve başkalarının güvenliği ve sağlığı için, iğneler ve kullanılmış enjektörler asla tekrar kullanılmamalıdır. Kullanılmayan herhangi bir tıbbi ürün veya atık malzeme yerel gerekliliklere uygun olarak imha edilmelidir. Herhangi bir ilacı atık su veya evsel atıklarla atmayınız. Artık kullanmadığınız ilaçları nasıl atacağınızı eczacınıza sorunuz. Bu önlemler çevrenin korunmasına yardımcı olacaktır. |
 HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur.
HIV ve Aids
HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan
Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A17416 |
| Satış Fiyatı | 6791.92 TL [ 7 Mar 2025 ] |
| Önceki Satış Fiyatı | 6791.92 TL [ 28 Feb 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504270204 |
| Etkin Madde | Omalizumab |
| ATC Kodu | R03DX05 |
| Birim Miktar | 150 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Solunum Sistemi > KORTİKOİDLER > Omalizumab |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |