XOLAIR 150 mg/ml enjeksiyonluk çözelti içeren kullanımahazır enjektör (1 adet) Farmakolojik Özellikler
{ Omalizumab }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstrüktif hava yolu hastalıklarında kullanılan diğer sistemik ilaçlar.
ATC Kodu: R03DX05.
Omalizumab, insanlardaki immünoglobülin E (IgE)'ye selektif olarak bağlanan, rekombinant DNA türevi, insan monoklonal antikorudur. Bu antikor; IgG1 kappa yapısındadır; ana iskeleti insan kökenli olup IgE'ye bağlanan komplementer-belirleyici bölgeleri murin ana antikorundan köken almaktadır.
Alerjik Astım ve Nazal polipli kronik rinosinuzit (NP'li KRS)
Etki mekanizması:
Omalizumab, IgE'ye bağlanır ve bu immünoglobülinin yüksek affiniteli IgE reseptörlerine (Fcï¥R1) bağlanmasını önleyerek, alerjik olaylar dizisini tetikleyecek serbest IgE miktarını azaltır. Atopik deneklerin omalizumabla tedavisi, bazofillerin yüzeyindeki Fcï¥R1 reseptörlerinin belirgin azalmasıyla sonuçlanmıştır. XOLAİR ile tedavi, düşük kan ve doku eozinofilleri ve innate (doğal), adaptive (edinilmiş) ve immün olmayan hücreler tarafından IL-4, IL-5 ve IL-13 dahil olmak üzere azalmış enflamatuvar mediyatörler ile kanıtlandığı üzere IgE aracılı enflamasyonu inhibe eder.
Farmakodinamik etki:
Alerjik astım
Tedavi öncesi değerler ile karşılaştırıldığında XOLAİR ile tedavi edilen hastalarda bir alerjen ile stimulasyonu takiben bazofillerden in vitro histamin salıverilmesi yaklaşık %90 azalmaktadır.
Astımlı hastalardaki klinik çalışmalarda serumdaki serbest IgE düzeyleri ilk dozdan sonra, doza bağlı olarak azalmış ve doz aralarında düşük değerlerde kalmıştır. XOLAİR tedavisinin durdurulmasından bir yıl sonra, IgE düzeyleri tedavi öncesindeki değerlere dönmüştür ve tıbbi ürünün vücuttan temizlenmesinden sonra IgE düzeylerinde rebound gözlenmemiştir.
Nazal polipli kronik rinosinuzit (NP'li KRS)
NP'li KRS hastalarında yapılan klinik çalışmalarda, XOLAİR tedavisi, alerjik astımı olan hastalarda gözlemlenenle benzer ölçüde, serumdaki serbest IgE düzeylerinde bir azalmaya (yaklaşık %95) ve serum total IgE düzeylerinde bir artışa yol açmıştır. Serbest IgE'ye göre daha yavaş eliminasyon hızına sahip omalizumab-IgE komplekslerinin oluşması nedeniyle serumdaki total IgE seviyeleri artmıştır.
Kronik İdiyopatik Ürtiker (KİÜ)
Etki mekanizması:
Omalizumab, IgE'ye bağlanır ve serbest IgE düzeylerini düşürür. Bunun sonucunda, hücreler üzerindeki IgE reseptörlerinin (Fcï¥R1) sayısı azalır. Bunun KİÜ semptomlarında bir iyileşme ile nasıl sonuçlandığı tam olarak anlaşılmamıştır.
Farmakodinamik etki:
KİÜ hastaları üzerinde yapılan klinik çalışmalarda, maksimum serbest IgE baskılanması ilk subkutan dozdan 3 gün sonra gözlenmiştir. 4 haftada bir kere tekrarlı doz uygulamasından sonra, doz öncesi serumdaki serbest IgE düzeyleri 12. ila 24. tedavi haftaları arasında sabit kalmıştır. XOLAİR tedavisinin bırakılmasından sonra, 16 haftalık tedavisiz takip dönemi boyunca tedavi öncesi düzeylere doğru serbest IgE düzeyleri artmıştır.
Klinik etkililik ve güvenlilik:
Alerjik Astım
Erişkinler ve ergenler (12 yaş ve üzeri):
XOLAİR'in etkililik ve güvenliliği, yüksek dozda inhale kortikosteroid ve uzun etkili beta2-agonisti kullanımına rağmen yetersiz astım kontrolü ve azalmış akciğer fonksiyonuna (FEV1 %40-80 öngörülen) sahip 12-79 yaşındaki 419 ağır alerjik astım hastasını içeren 28 haftalık çift kör plasebo kontrollü bir çalışmada (çalışma 1) gösterilmiştir. Seçilen hastalar önceki yılda yüksek dozda inhale kortikosteroid ve uzun etkili bir beta2-agonist ile kesintisiz tedaviye rağmen sistemik kortikosteroid tedavisi gerektiren çok sayıda astım alevlenmeleri yaşamış ya da ağır astım alevlenmesi nedeniyle hastaneye yatırılmış veya acil servise getirilmiştir. Subkutan XOLAİR veya plasebo
>1.000 mikrogram beklometazon dipropiyonat (veya eşdeğeri) artı uzun etkili bir beta2- agoniste ilave tedavi olarak uygulanmıştır. Oral kortikosteroid, teofilin ve lökotrien modifiye edici idame tedavilerine izin verilmiştir (sırasıyla hastaların %22, %27 ve
%35'i).
Sistemik kortikosteroidlerle tedavi gerektiren astım alevlenmelerinin oranı birincil sonlanım noktasıdır. Omalizumab astım alevlenmelerinin oranını %19 azaltmıştır (p = 0,153). XOLAİR lehine istatistiksel anlam (p<0,05) gösteren ilave değerlendirmeler ağır alevlenmeler (hastanın akciğer fonksiyonunun kendi en iyi değerinin %60 altına azaldığı ve sistemik kortikosteroid gerektiren) ve astımla ilişkili acil servis başvurularında (hastaneye yatırılma, acil servis ve planlı olmayan doktor vizitlerinden oluşur) azalmalar ve hekimin genel tedavi etkililiği değerlendirmesi, Astımla ilişkili Yaşam Kalitesi (AQL), astım semptomları ve akciğer fonksiyonunda iyileşmeleri içermiştir.
Bir alt grup analizinde, tedavi öncesi total IgE değeri ≥76 IU/ml olan hastaların XOLAİR'den klinik olarak anlamlı bir fayda elde etme olasılığının daha yüksek olduğu bulunmuştur. Çalışma 1'deki bu hastalarda XOLAİR astım alevlenmeleri oranını %40 azaltmıştır (p = 0,002). Ayrıca XOLAİR ağır astım programında toplam IgE ≥76 IU/ml popülasyonunda daha fazla hasta klinik olarak anlamlı yanıtlar elde etmiştir. Tablo 5'te çalışma 1 popülasyonunun bulguları yer almaktadır.
Tablo 5: Çalışma 1'in bulguları
| Tam çalışma 1 popülasyonu | |
| XOLAİR N=209 | Plasebo N=210 |
Astım alevlenmeleri |
|
|
28 haftalık periyot başına oran | 0,74 | 0,92 |
% azalma, oran için p-değeri | %19,4, p=0,153 | |
Ağır astım alevlenmeleri |
|
|
28 haftalık periyot başına oran | 0,24 | 0,48 |
% azalma, oran için p-değeri | %50,1, p=0,002 | |
Acil servis ziyaretleri |
|
|
28 haftalık periyot başına oran | 0,24 | 0,43 |
% azalma, oran için p-değeri | %43,9, p=0,038 | |
Hekimin genel değerlendirmesi |
|
|
%yanıt veren* | %60,5 | %42,8 |
p-değeri** | <0,001 | |
AQL iyileşmesi |
|
|
≥0,5 iyileşme görülen hasta yüzdesi | %60,8 | %47,8 |
p-değeri | 0,008 | |
*belirgin iyileşme veya tam kontrol
**genel değerlendirme dağılımı için p-değeri
Çalışma 2'de çalışma 1'deki popülasyonla eşleştirilmiş 312 ağır alerjik astım hastasından oluşan bir popülasyonda XOLAİR'in etkililik ve güvenliliği değerlendirilmiştir. Bu açık etiketli çalışmada XOLAİR ile tedavi tek başına güncel astım tedavisine kıyasla klinik olarak anlamlı astım alevlenmesi oranında %61 azalmaya yol açmıştır.
1.722 yetişkin ve ergende 28 ila 52 haftalık dört ilave büyük plasebo kontrollü destekleyici çalışmada (çalışma 3, 4, 5, 6) ağır persistan astımı olan hastalarda XOLAİR'in etkililik ve güvenliliği değerlendirilmiştir. Çoğu hasta yetersiz düzeyde kontrol edilmekle birlikte çalışma 1 veya 2'deki hastalardan daha az eşzamanlı astım tedavisi görmektedir. Çalışma 3-5'de birincil sonlanım noktası olarak alevlenme kullanılırken, çalışma 6'da başlıca inhale kortikosteroidden kurtulma değerlendirilmiştir.
Çalışma 3, 4 ve 5'de XOLAİR ile tedavi edilen hastalar astım alevlenmelerinde plaseboya kıyasla sırasıyla %37,5 (p=0,027), %40,3 (p<0,001) ve %57,6 (p<0,001) azalma sağlamıştır.
Çalışma 6'da plasebo grubuna (%45,8) kıyasla istatiksel anlamlı düzeyde (p<0,05) daha fazla sayıda XOLAİR kullanan ağır allerjik astım hastası (%60,3), astım kontrolünde bozulma olmaksızın flutikazon dozlarını ≤500 mikrogram/güne azaltabilmiştir.
Yaşam kalitesi skorları Juniper Astımla İlişkili Yaşam Kalitesi Anketi kullanılarak ölçülmüştür. Altı çalışmanın tümü için plasebo veya kontrol grubuna karşı XOLAİR hastaları için yaşam kalitesi skorlarında başlangıca göre istatistiksel olarak anlamlı bir iyileşme görülmüştür.
Hekimin genel tedavi etkililiği değerlendirmesi:
Hekimin genel değerlendirmesi tedaviden sorumlu hekim tarafından yürütülen kapsamlı bir astım kontrolü ölçümü olarak yukarıdaki çalışmaların beşinde yürütülmüştür. Hekim PEF (pik ekspiratuar akış), gündüz ve gece semptomları, kurtarma ilacı kullanımı, spirometri ve alevlenmeleri dikkate alabilmiştir. Beş çalışmanın tümünde plasebo hastalarına kıyasla XOLAİR ile tedavi edilen anlamlı olarak daha yüksek oranda hastanın
astımlarında belirgin bir iyileşme veya tam kontrol sağladıkları sonucuna varılmıştır.
6 - <12 yaş arası çocuklar
XOLAİR'in 6 - <12 yaş grubundaki güvenlilik ve etkililiği için primer destek randomize, çift kör, plasebo kontrollü, çok merkezli bir çalışmadan (çalışma 7) gelmektedir.
Çalışma 7, yüksek doz inhale kortikosteroidler (≥500 μg/gün flutikazon eşdeğeri) artı uzun etkili beta agonist ile tedavi edilmiş, mevcut endikasyonda tanımlanan belirli bir hasta alt grubunu (n=235) içeren plasebo kontrollü bir çalışmadır.
Klinik açıdan anlamlı bir alevlenme, araştırmacı tarafından klinik olarak değerlendirildiği üzere, astım semptomlarında, en az 3 gün süreyle başlangıç inhale kortikosteroid dozunun iki katına çıkarılması ve/veya en az 3 gün süreyle kurtarma sistemik (oral veya intravenöz) kortikosteroidlerle tedavi gerektiren kötüleşme olarak tanımlanmıştır.
Yüksek doz inhale kortikosteroid kullanan spesifik hasta alt grubunda, omalizumab grubunun, plasebo grubuna göre istatistiksel olarak anlamlı derecede daha düşük bir klinik açıdan anlamlı astım alevlenme oranına sahip olduğu görülmüştür. 24. haftada, tedavi grupları arasında oranlar açısından fark, omalizumab hastaları için plaseboya göre
%34'lük (oran oranı 0,662, p = 0,047) bir azalmayı temsil etmiştir. 28 haftalık ikinci çift kör tedavi döneminde, tedavi grupları arasında oranlar açısından fark, omalizumab hastaları için plaseboya göre %63'lük (oran oranı 0,37, p<0,001) bir düşüşü temsil etmiştir.
52 haftalık çift kör tedavi dönemi sırasında (24 haftalık sabit doz steroid fazı ve 28 haftalık steroid ayarlama fazını kapsar) tedavi grupları arasında oran farkı, omalizumab hastaları için alevlenmelerde %50 düzeyinde (oran oranı 0,504, p<0,001) rölatif bir azalmayı temsil etmiştir.
Omalizumab grubu, tedavi grupları arasındaki fark istatistiksel olarak anlamlı olmasa da, 52 haftalık tedavi süresinin sonunda beta-agonist kurtarma ilacı kullanımında plasebo grubuna göre daha yüksek düşüşler göstermiştir. Yüksek doz inhale kortikosteroidler ve uzun etkili beta agonistleri alan ağır hastalardan oluşan bir alt grupta 52 haftalık çift kör tedavi süresinin sonunda tedavi etkinliğinin genel değerlendirmesi için, plasebo grubuna kıyasla omalizumab grubunda 'mükemmel' tedavi etkinliğine sahip olarak değerlendirilen hastaların oranı daha yüksektir ve 'orta' veya 'kötü' tedavi etkinliğine sahip olanların oranı daha düşüktür; gruplar arasındaki fark istatistiksel olarak anlamlı (p<0,001) olmuştur; diğer yandan hastaların öznel Yaşam Kalitesi derecelendirmeleri açısından omalizumab ve plasebo grupları arasında fark yoktur.
Nazal polipli kronik rinosinüzit (NP'li KRS)
XOLAİR'in güvenliliği ve etkililiği, NP'li KRS'li hastalardaki iki randomize, çift kör, plasebo kontrollü çalışmada değerlendirilmiştir (Tablo 7). Hastalar her 2 veya 4 haftada bir subkutan olarak XOLAİR veya plasebo almıştır (bkz. Bölüm 4.2). Tüm hastalar, çalışma boyunca arka planda intranazal mometazon tedavisi almıştır. Çalışmalara dahil edilmek için önceki sino-nazal cerrahi veya önceden sistemik kortikosteroid kullanımı gerekli olmamıştır. Hastalar 24 hafta boyunca XOLAİR veya plasebo almış, bunu 4 haftalık bir takip dönemi izlemiştir. Alerjik komorbiditeler dahil olmak üzere demografik özellikler ve çalışma başlangıcındaki karakteristikler Tablo 6'da açıklanmaktadır.
Tablo 6 POLYP 1 ve 2 çalışmalarının demografik özellikleri ve çalışma başlangıcındaki karakteristikleri
Parametre | POLYP 1 N=138 | POLYP 2 N=127 |
Ortalama yaş (yıl) (SD) | 51 (13,2) | 50,1 (11,9) |
% Erkek | 63,8 | 65,4 |
Önceki yıl sistemik kortikosteroid kullanımı olan hastalar (%) | 18,8 | 26 |
Bilateral endoskopik nazal polip skoru (NPS): ortalama (SD), aralık 0-8 | 6,2 (1) | 6,3 (0,9) |
Nazal konjesyon skoru (NKS): ortalama (SD), aralık 0-3 | 2,4 (0,6) | 2,3 (0,7) |
Koku duyusu puanı: ortalama (SS), aralık 0-3 | 2,7 (0,7) | 2,7 (0,7) |
SNOT-22 toplam puanı: ortalama (SD) aralık 0-110 | 60,1 (17,7) | 59,5 (19,3) |
Kan eozinofilleri (hücre/µl): ortalama (SD) | 346,1 (284,1) | 334,6 (187,6) |
Total IgE IU/ml: ortalama (SD) | 160,9 (139,6) | 190,2 (200,5) |
Astım (%) | 53,6 | 60,6 |
Hafif (%) | 37,8 | 32,5 |
Orta (%) | 58,1 | 58,4 |
Ağır (%) | 4,1 | 9,1 |
Aspirin ile tetiklenen solunum hastalıkları (%) | 19,6 | 35,4 |
Alerjik rinit | 43,5 | 42,5 |
SD = standart sapma; SNOT-22 = Sino-Nazal Sonuç Testi 22 Anketi; IgE = İmmünoglobulin E; IU = uluslararası birimler. NPS, NKS ve SNOT-22 için daha yüksek puanlar, daha yüksek hastalık şiddetini gösterir.
Ortak birincil sonlanım noktaları, 24. haftada bilateral nazal polip skoru (NPS) ve ortalama günlük nazal konjesyon skoru (NKS) olmuştur. POLYP 1 ve 2 çalışmalarında, XOLAİR alan hastaların NPS'de 24. haftada başlangıca göre iyileşmeleri ve haftalık ortalama NKS'leri plasebo alan hastalara göre istatistiksel olarak anlamlı düzeyde daha fazla olmuştur. POLYP 1 ve 2 çalışmalarının sonuçları Tablo 7'de gösterilmektedir.
Tablo 7 POLYP 1, POLYP 2 ve birleştirilmiş (pooled) verilerden elde edilen klinik skorlarda 24. haftada başlangıca göre değişiklik
POLYP 1 |
POLYP 2 | POLYP 1 ve POLYP 2 çalışmalarının birleştirilmiş (pooled) sonuçları | ||||
| Plasebo | Xolair | Plasebo | Xolair | Plasebo | Xolair |
N | 66 | 72 | 65 | 62 | 131 | 134 |
Nazal polip skoru | ||||||
Başlangıçtaki ortalama | 6,32 | 6,19 | 6,09 | 6,44 | 6,21 | 6,31 |
24. haftada LS ortama değişimi | 0,06 | -1,08 | -0,31 | -0,9 | -0,13 | -0,99 |
Fark (%95) GA | -1,14 (-1,59, -0,69) | -0,59 (-1,05, -0,12) | -0,86 (-1,18, -0,54) | |||
p değeri |
<0,0001 |
0,014 |
<0,0001 | |||
7 günlük ortalama günlük nazal konjesyon skoru | ||||||
Başlangıçtaki ortalama | 2,46 | 2,4 | 2,29 | 2,26 | 2,38 | 2,34 |
24. haftada LS ortama değişimi | -0,35 | -0,89 | -0,2 | -0,7 | -0,28 | -0,8 |
Fark (%95) GA | -0,55 (-0,84, -0,25) | -0,5 (-0,8, -0,19) | -0,52 (-0,73, -0,31) | |||
p değeri |
0,0004 |
0,0017 |
<0,0001 | |||
TNSS | ||||||
Başlangıçtaki ortalama | 9,33 | 8,56 | 8,73 | 8,37 | 9,03 | 8,47 |
24. haftada LS ortama değişimi | -1,06 | -2,97 | -0,44 | -2,53 | -0,77 | -2,75 |
Fark (%95) | -1,91 (-2,85, -0,96) | -2,09 (-3, -1,18) | -1,98 (-2,63, -1,33) | |||
p değeri | 0,0001 | <0,0001 | <0,0001 | |||
SNOT-22 | ||||||
Başlangıçtaki ortalama | 60,26 | 59,82 | 59,8 | 59,21 | 60,03 | 59,54 |
24. haftada LS ortama değişimi | -8,58 | -24,7 | -6,55 | -21,59 | -7,73 | -23,1 |
Fark (%95) | -16,12 (-21,86, - 10,38) | -15,04 (-21,26, -8,82) | -15,36 (-19,57, - 11,16) | |||
p değeri | <0,0001 | <0,0001 | <0,0001 | |||
(MID = 8,9) |
|
|
| |||
UPSIT | ||||||
Başlangıçtaki ortalama | 13,56 | 12,78 | 13,27 | 12,87 | 13,41 | 12,82 |
24. haftada LS ortama değişimi | 0,63 | 4,44 | 0,44 | 4,31 | 0,54 | 4,38 |
Fark (%95) | 3,81 (1,38, 6,24) | 3,86 (1,57, 6,15) | 3,84 (2,17, 5,51) | |||
p değeri | 0,0024 | 0,0011 | <0,0001 | |||
LS = en küçük kare; GA = güven aralığı; TNSS = Toplam nazal semptom skoru; SNOT-22 = Sino-Nazal Sonuç Testi 22 Anketi; UPSIT = Pennsylvania Üniversitesi Koku Tanımlama Testi; MID = minimum önemli fark.
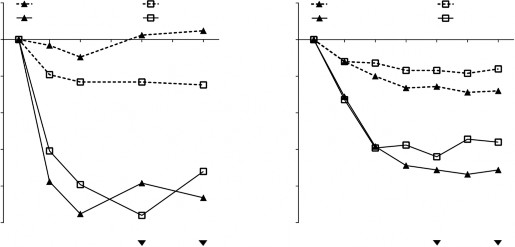
Şekil 1 POLYP 1 ve 2 çalışmalarında tedavi grubuna göre nazal konjesyon skorunda başlangıca göre ortalama değişim ve nazal polip skorunda başlangıca göre ortalama değişim
0.25
0.25
0.00 0.00
-0.25 -0.25
-0.50 -0.50
-0.75 -0.75
-1.00 -1.00
-1.25
-1.25
|
|
|
|
|
|
|
|
24 haftalık tedavi periyodu sırasında kurtarma tedavisinin önceden belirlenmiş bir birleştirilmiş (pooled) analizinde (ardışık 3 gün sistemik kortikosteroidler veya nazal polipektomi), XOLAİR'de kurtarma tedavisi gerektiren hastaların oranı plaseboya kıyasla daha düşük olmuştur (sırasıyla %2,3'e karşı %6,2). Plaseboya kıyasla XOLAİR'de kurtarma tedavisi almış olma olasılık oranı 0,38'dir (%95 GA: 0,10, 1,49). Her iki çalışmada da bildirilen hiçbir sino-nazal ameliyatı söz konusu olmamıştır.
POLYP 1 ve 2 çalışmalarına katılan NP'li KRS'li hastalarda XOLAİR'in uzun vadeli etkililiği ve güvenliliği, açık etiketli bir uzatma çalışmasında değerlendirilmiştir. Bu çalışmadan elde edilen etkililik verileri, 24. Haftada sağlanan klinik yararın 52. Haftaya kadar sürdüğünü göstermektedir. Güvenlilik verileri genel olarak omalizumabın bilinen güvenlilik profili ile tutarlıdır.
Kronik İdiyopatik Ürtiker (KİÜ)
Onaylanmış dozda HI antihistaminik tedavisine rağmen semptomatik kalan KİÜ görülen hastalarda XOLAİR'in etkililiği ve güvenliliği iki randomize, plasebo kontrollü faz III çalışmada (çalışma 1 ve 2) gösterilmiştir. Üçüncü bir çalışmada (çalışma 3) öncelikli olarak onaylanmış dozun dört katına kadar HI antihistaminikler ve H2 antihistamin ve/veya LTRA tedavisine rağmen semptomatik kalan KİÜ görülen hastalarda XOLAİR'in güvenliliği değerlendirilmiştir. Üç çalışmaya yaşları 12 ile 75 arasında olan 975 hasta (ortalama yaş 42,3; 39 hasta 12-17 yaş, 54 hasta ≥ 65 yaş; 259 erkek ve 716 kadın) dahil edilmiştir. Tüm hastalar, önceden en az 2 hafta boyunca bir antihistamin kullanmış olmasına rağmen randomizasyondan önceki 7 gün boyunca değerlendirildiğinde semptom kontrolünün yetersiz olması ile haftalık ürtiker aktivite skoru (UAS7, aralık 0-42) ≥ 16 ve haftalık kaşıntı şiddeti skorunun (UAS7'nin bir bileşenidir; 0-21 aralığı) ≥ 8 olması gerekmiştir
Çalışma 1 ve 2'de, hastaların haftalık ortalama kaşıntı şiddeti skoru başlangıçta 13,7 ile 14,5 arasında ve ortalama UAS7 skoru sırasıyla 29,5 ve 31,7 olmuştur. Güvenlilik çalışması 3'teki hastaların haftalık ortalama kaşıntı şiddeti skorunun 13,8 ve başlangıçta ortalama UAS7 skorunun 31,2 olduğu belirlenmiştir. Her üç çalışmada da hastalar çalışmaya dahil edilmeden önce KİÜ semptomları için ortalama 4 ila 6 ilaç (HI antihistaminikler dahil) aldıklarını bildirmişlerdir. Hastalar, çalışma 1 ve 2'de sırasıyla 24
ve 12 hafta boyunca 4 haftada bir subkutan enjeksiyon yoluyla 75 mg, 150 mg veya 300 mg dozunda XOLAİR veya plasebo ve çalışma 3'te 24 hafta boyunca her 4 haftada bir subkutan enjeksiyonla 300 mg veya plasebo almıştır. Tüm çalışmalarda 16 haftalık tedavisiz bir takip süresi yer almıştır.
Birincil sonlanım noktası, haftalık kaşıntı şiddeti skorunda başlangıç ile 12. hafta arasındaki değişimdir. Plasebo ile 3,63 ila 5,14'lük azalmaya kıyasla 300 mg dozunda omalizumab, haftalık kaşıntı şiddeti skorunu 8,55 ila 9,77 (p <0,0001) azaltmıştır (bkz. Tablo 8). UAS7 ≤ 6 (12. haftada) için yanıt veren oranlarında da 300 mg tedavi grupları için daha yüksek ve plasebo grupları için %11-19'a kıyasla %52-66 (p<0,0001) arasında bulunan istatistiksel olarak anlamlı sonuçlar gözlemlenmiş ve plasebo gruplarındaki hastaların %5-9'una kıyasla 300 mg ile tedavi edilen hastaların %34-44'ünde (p<0,0001) tam yanıt (UAS7=0) elde edilmiştir. 300 mg tedavi gruplarındaki hastalar, plasebo gruplarıyla (%88,1-89,2) karşılaştırıldığında, 4. haftadan 12. haftaya kadar en yüksek ortalama anjiyoödemsiz gün oranına (%91-96,1; p<0,001) ulaşmıştır. 300 mg tedavi grupları için toplam DLQI'de başlangıca göre 12. haftaya kadar ortalama değişim, plaseboya göre daha büyük olup (p<0,001) karşılık gelen plasebo grupları için 5,1-6,1 puana kıyasla 9,7-10,3 puan arasında değişen bir iyileşme göstermiştir.
Tablo 8 Haftalık kaşıntı şiddeti skorunda başlangıç ile 12. hafta arasındaki değişim, çalışma 1,2 ve 3 (mITT popülasyonu*)
|
Plasebo | Omalizumab 300 mg |
Çalışma 1 |
|
|
N | 80 | 81 |
Ortalama (SS) | -3,63 (5,22) | -9,4 (5,73) |
Plasebo karşısında LS ortalamalarında fark |
| -5,8 |
fark için %95 GA |
| -7,49, -4,1 |
Plasebo karşısında p değeri |
| <0,0001 |
Çalışma 2 |
|
|
N | 79 | 79 |
Ortalama (SS) | -5,14(5,58) | -9,77 (5,95) |
Plasebo karşısında LS ortalamalarında fark |
| -4,81 |
fark için %95 GA |
| -6,49, -3,13 |
Plasebo karşısında p değeri |
| <0,0001 |
Çalışma 3 |
|
|
N | 83 | 252 |
Ortalama (SS) | -4,01 (5,87) | -8,55 (6,01) |
Plasebo karşısında LS ortalamalarında fark |
| -4,52 |
fark için %95 GA |
| -5,97, -3,08 |
Plasebo karşısında p değeri |
| <0,0001 |
*Modifiye edilmiş tedavi amaçlı (mITT) popülasyon: randomize edilmiş ve en az bir doz çalışma ilacı alan tüm hastaları içermiştir.
Kayıp verileri hesaplamak için BOCF (İleriye Taşınan Başlangıçtaki Gözlem) kullanılmıştır.
1 LS ortalaması, bir ANCOVA modeli kullanılarak hesaplanmıştır. Katmanlar, başlangıç haftalık kaşıntı şiddeti skoru (<13'e karşı ≥ 13) ve başlangıç ağırlığıdır (<80 kg'a karşı ≥ 80 kg).
2 p-değeri ANCOVA t-testinden türetilmiştir.
Şekil 2'de, çalışma 1'de zaman içindeki ortalama haftalık kaşıntı şiddeti skoru gösterilmektedir. Ortalama haftalık kaşıntı şiddeti skorları, 24 haftalık tedavi periyodu boyunca sürdürülen ve 12. hafta civarında maksimum olan etki ile önemli ölçüde azalmıştır. Çalışma 3'te de sonuçlar benzerdir.
Her üç çalışmada da ortalama haftalık kaşıntı şiddeti skoru, 16 haftalık tedavisiz takip süresi boyunca, semptomların yeniden ortaya çıkmasıyla tutarlı olarak kademeli şekilde artmıştır. Takip süresinin sonundaki ortalama değerler, plasebo grubuna benzer ancak ilgili ortalama başlangıç değerlerinden daha düşük olmuştur.
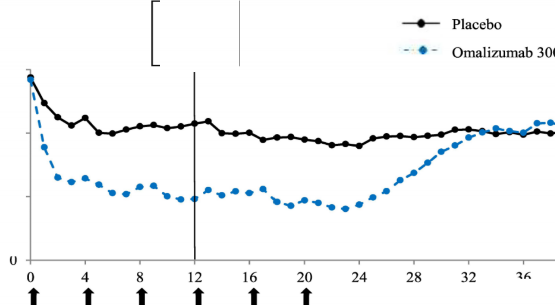
Hafta
Plasebo
Hafta 12 Birincil Sonlanım Noktası
Ortalama haftalık kaşıntı şiddeti skoru
Şekil 2 Zaman içinde haftalık ortalama kaşıntı şiddeti skoru, çalışma 1 (mITT popülasyonu)
Omalizumab veya plasebo uygulanmıştır
BOCF=ileriye taşınan başlangıçtaki gözlem; mITT=modifiye tedavi amaçlı popülasyon
24 haftalık tedaviden sonra etkililik
Tedavinin 24. haftasında gözlemlenen etkililik sonuçlarının boyutu, 12. haftada gözlemlenenlerle benzerdir:
300 mg için, 1. ve 3. çalışmalarda, haftalık kaşıntı şiddeti skorunda başlangıca göre ortalama düşüş sırasıyla 9,8 ve 8,6, UAS7 ≤ 6 olan hastaların oranı %61,7 ve %55,6 ve tam yanıt veren hastaların oranı (UAS7=0) %48,1 ve %42,5 olmuştur (plaseboya kıyasla tümü p<0,0001).
Hastaların omalizumab ile yeniden tedavisinde sınırlı klinik deneyim mevcuttur.
Adölesanlar (12 ila 17 yaş) hakkındaki klinik çalışma verileri, 11'i 300 mg doz alan toplam 39 hastayı içermiştir. 300 mg için sonuçlar 12. haftada 9 hasta ve 24. haftada 6 hasta için mevcuttur ve erişkin popülasyona kıyasla omalizumab tedavisine benzer bir yanıt büyüklüğü göstermektedir. Haftalık kaşıntı şiddeti skorunda başlangıca göre ortalama değişiklik 12. haftada 8,25 ve 24. haftada 8,95 azalma göstermiştir. Yanıt veren
oranları: UAS7=0 için 12. haftada %33 ve 24. haftada %67 ve UAS7<6 için 12. haftada
%56 ve 24. haftada %67'dir.
5.2. Farmakokinetik özellikler
Genel özelliklerOmalizumabın farmakokinetiği, alerjik astımı olan erişkin ve ergen hastalarda ve nazal polipli erişkin hastalarda çalışılmıştır. Omalizumabın genel farmakokinetik özellikleri bu hasta popülasyonlarında benzerdir.
Emilim:
Omalizumabın, subkutan uygulama sonrası, ortalama mutlak biyoyararlanım oranı
%62'dir. Astımlı erişkin ve ergen hastalarda tek bir subkutan dozun ardından omalizumab, yavaşça kana karışmış ve maksimum serum düzeylerine 6 ila 8 gün sonra ulaşmıştır. Çoğul omalizumab dozlarının ardından, sıfırıncı günle kararlı serum düzeylerinin elde edildiği 14. gün arasındaki serum konsantrasyonu-zaman eğrisinin altında kalan alan (EAA) değeri, ilk doz sonrası değerin 6 katı bulunmuştur.
Omalizumabın farmakokinetiği, 0,5 mg/kg'ın üzerindeki dozlarda doğrusaldır. KİÜ'lü hastalarda her 4 haftada bir 75 mg, 150 mg veya 300 mg dozlarını takiben, omalizumabın en düşük serum konsantrasyonları doz düzeyiyle orantılı olarak artmıştır.
XOLAİR'in likid veya liyofilize formülasyonlarının uygulanması benzer omalizumab serum konsantrasyon-zaman profillerine neden olmuştur.
Dağılım:
Omalizumab in vitro olarak, IgE ile sınırlı boyutta kompleksler oluşturur. In vitro ya da in vivo, presipitasyon gösteren ve molekül ağırlığı bir milyon Dalton'u aşan kompleksler gözlenmez. Popülasyon farmakokinetiğine dayalı olarak, omalizumab dağılımı alerjik astımı olan hastalar ile KİÜ hastalarında benzerdir. Astım hastalarında subkutan uygulamayı izleyen sanal dağılım hacmi, 78 ± 32 ml/kg olarak hesaplanmıştır.
Biyotransformasyon:
Karaciğer yoluyla metabolize edilir. IgG, retiküloendotelyal sistem (RES) ve endotel hücreleri tarafından parçalanır.
Eliminasyon:
Omalizumab klirensi, IgG klirensiprosesine uyar, ayrıca hedef ligandı olan IgE ile bağlanarak kompleks oluşturması da, omalizumabın eliminasyon yollarındandır. IgG'nin karaciğerdeki eliminasyonu retiküloendotelyal sistem ve endotel hücrelerinde parçalanmayı içerir. Değişikliğe uğramamış IgG safra ile de atılır. Omalizumabın astım hastalarındaki serum eliminasyon yarılanma ömrü ortalama 26 gün olmuş, günlük görünen klirensin ise ortalama 2,4 ± 1,1 ml/kg olduğu hesaplanmıştır. Vücut ağırlığının iki katına çıkması sanal klirensi yaklaşık ikiye katlamıştır. KİÜ hastalarında, popülasyon farmakokinetik simülasyonlarına dayalı olarak, kararlı durumda omalizumab serum eliminasyon yarı ömrü ortalama 24 gün ve 80 kg ağırlığındaki bir hasta için kararlı durumda görünür klirens 3 mL/kg/gün olmuştur.
Doğrusallık/Doğrusal Olmayan Durum:
Omalizumab, 0,5 mg/kg'ı aşan dozlarda lineer farmakokinetiğe sahiptir.
Hastalardaki karakteristik özellikler
Böbrek/Karaciğer yetmezliği:
Alerjik astım ya da kronik idiyopatik ürtikeri (KİÜ) olup, böbrek veya karaciğer yetmezliği görülen hastalarda elde edilmiş farmakokinetik veya farmakodinamik veriler mevcut değildir (bkz. Bölüm 4.2 ve Bölüm 4.4).
Pediyatrik popülasyon:
XOLAİR'in astımlı hastalarda 6, Nazal polipli kronik rinosinüzit(NP'li KRS)li hastalarda
18 ve KİÜ'sü olan hastalarda 12 yaşından daha küçük çocuklarda kullanılmasının güvenliliği ve etkililiği saptanmamıştır. Bu nedenle bu yaş grubundaki hastalarda XOLAİR'in kullanımı önerilmez.
Geriyatrik popülasyon:
XOLAİR'in 65 yaşın üzerindeki hastalarda kullanılması konusundaki tecrübeler sınırlıdır ama yaşlı hastalardaki dozun, gençlerdekinden farklı olması gerektiğine dair herhangi bir kanıt yoktur.
Yaş, Irk/Etnik köken, Cinsiyet, Vücut Kitle İndeksi:
Alerjik Astımlı ve Nazal polipli kronik rinosinüzitli (NP'li KRS) hastalar
XOLAİR'in popülasyon farmakokinetiği, demografik özelliklerin etkilerini değerlendirmek amacıyla analiz edilmiş ve eldeki bu sınırlı verilerin analizi; yaş (alerjik astımlı hastalar için 6-76 yaş; NP'li KRS'li hastalar için 18-75 yaş), ırk/etnik köken, cinsiyet veya vücut kitle indeksi için doz ayarlamasının gerekli olmadığını göstermektedir (bkz Bölüm 4.2).
KİÜ görülen hastalar
Demografik özelliklerin ve diğer faktörlerin omalizumab maruziyeti üzerindeki etkileri, popülasyon farmakokinetiğine dayalı olarak değerlendirilmiştir. Ek olarak, omalizumab konsantrasyonları ile klinik yanıtlar arasındaki ilişki analiz edilerek ortak değişken etkileri değerlendirilmiştir. Bu analizler, yaş (12 ila 75 yaş), ırk/etnisite, cinsiyet, vücut ağırlığı, vücut kitle indeksi, başlangıç IgE, anti-Fcï¥RI otoantikorları ya da H2 antihistaminikleri ya da lökotrien reseptör antagonistleri (LTRA'lar) ile eş zamanlı kullanım için doz ayarlamalarına gerek olmadığına işaret etmektedir.
5.3. Klinik öncesi güvenlilik verileri
Omalizumab, cynomolgus ve insan IgE'sine benzer afinite ile bağlandığından, omalizumabın güvenliliği cynomolgus maymununda incelenmiştir. Tekrarlanan subkutan veya intravenöz uygulamayı takiben bazı maymunlarda omalizumab antikorları saptanmıştır. Ancak, immün kompleks aracılığıyla gelişen hastalık veya komplemana bağımlı sitotoksite gibi belirgin bir toksisiteye rastlanmamıştır. Erişkin ve ergen cynomolgus maymunlarında mast hücresi degranülasyonuna bağlı sistemik anafilaksi reaksiyonu geliştiğine dair kanıt yoktur.
250 mg/kg'a kadar (önerilen doz tablosundaki mg/kg'a göre önerilen en yüksek klinik dozun en az 14 katı) kronik omalizumab uygulanması, insan-dışı primatlarda (hem erişkin hem de ergen hayvanlar) iyi tolere edilmiş ve yalnızca ergen hayvanlarda daha yüksek bir sensivite ile trombosit sayısının, doza ve yaşa bağımlı olarak azaldığı görülmüştür. Yetişkin cynomolgus maymunlarında başlangıca göre trombositlerde % 50'lik bir düşüş elde etmek için gereken serum konsantrasyonu beklenen maksimum klinik serum konsantrasyonlarından yaklaşık 4 ila 20-kat daha fazladır. Ayrıca, cynomolgus maymunundaki enjeksiyon yerinde, akut kanama ve inflamasyon gelişmiştir.
Omalizumab kullanılarak formal karsinojen etki çalışmaları yapılmamıştır.
Cynomolgus maymunlarında omalizumab kullanılarak üreme çalışmaları yapılmıştır. Bu çalışmalar sırasında subkutan olarak verilen 75 mg/kg'a varabilen (4 haftalık süre boyunca mg/kg olarak en yüksek klinik dozun en az 8 katına eşdeğer) dozlar organogenez döneminde kullanıldıklarında maternal toksisiteye, embriyotoksisiteye veya teratojen etkiye neden olmamış; gebeliğin geç döneminde, doğum sırasında veya emzirme döneminde kullanıldığında fetus ya da yenidoğanın gelişmesini olumsuz yönde etkilememiştir.
Omalizumab cynomolgus maymunlarında anne sütünde bulunur. Omalizumab'ın süt düzeyleri, maternal serum konsantrasyonunun % 0,15 idi.
Enjektörü inceleyiniz. Sıvı berrak ila hafif bulutlu olmalıdır. Rengi renksizden soluk kahverengimsi sarıya kadar değişebilir. Bir hava kabarcığı görebilirsiniz; bu normaldir. Enjektör kırılmışsa veya sıvı belirgin şekilde bulutlu veya belirgin kahverengi görünüyorsa ya da partikül içeriyorsa KULLANMAYINIZ. Tüm bu durumlarda, paketin tamamını eczaneye iade ediniz.
 Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir.
Kalp Krizi
Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
 Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir.
Sırt Ağrısı
Sırt ağrısı birden bire ortaya
çıkıp şiddetli (akut) olabilir veya zamanla gelişip daha uzun
süreli sorunlara (kronik) neden olabilir. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A17416 |
| Satış Fiyatı | 6791.92 TL [ 17 Mar 2025 ] |
| Önceki Satış Fiyatı | 6791.92 TL [ 7 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504270204 |
| Etkin Madde | Omalizumab |
| ATC Kodu | R03DX05 |
| Birim Miktar | 150 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 1 |
| Solunum Sistemi > KORTİKOİDLER > Omalizumab |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Astım Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 |
Grip, Soğuk Algınlığı ve Öksürük Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |