YAZZ 3 mg/0.02 mg film kaplı tablet Kısa Ürün Bilgisi
{ Drospirenon + Ethinyl Estradiol }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
YAZZ® 3 mg/0,02 mg film kaplı tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Her biri 3 mg drospirenon ve 0,02 mg etinilestradiol (betadeks klatrat olarak) içeren 24 adet hormon içeren film kaplı tablet ve bunları takip eden 4 adet hormon içermeyen beyaz film kaplı tablet.Yardımcı maddeler
Hormon içeren tabletler 48,18 mg laktoz monohidrat (sığır) içermektedir.Hormon içermeyen tabletler ise 23,205 mg laktoz monohidrat içermektedir. Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Film kaplı tablet.
Hormon içeren tabletler; yuvarlak, bikonveks, bir yüzünde düzgün altıgen içine “DS†işaretli açık pembe renkli tabletlerdir.
Hormon içermeyen tabletler; yuvarlak, bikonveks, bir yüzünde düzgün altıgen içine “DP†baskılı beyaz renkli tabletlerdir.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Gebeliği önleyici etkisinin yanısıra antimineralokortikoid ve antiandrojenik etkileri sayesinde, hormona bağlı su tutulması ve buna bağlı belirtiler gösteren kadınlarda,
4.2. Pozoloji ve uygulama şekli
Tabletler paketin üstünde gösterildiği sırayla, her gün yaklaşık aynı zamanda bir miktar su ile alınmalıdır. Tablet alımı süreklidir. Birbirini izleyen 28 gün boyunca hergün bir tablet alınır. Bir sonraki pakete önceki kutudaki son tablet alımının ertesi günü başlanır. Çekilme kanaması genellikle hormon içermeyen beyaz film kaplı tablet alımına başlanmasından 2-3 gün sonra başlar ve bir sonraki pakete başlandığında devam ediyor olabilir.
Kombine oral kontraseptiflerin (KOK) doğru şekilde alındıklarında yılda yaklaşık % 1 kadar başarısızlık oranı mevcuttur. Başarısızlık oranı tablet alımı unutulduğunda veya doğru alınmadığında artabilir.
Uygulama şekli:
Oral kullanım
YAZZ'a başlangıç:
Bir önceki ay hormonal kontraseptif kullanımı yoksa:
Tabletler normal siklusun ilk günü (kanamanın ilk günü) alınmaya başlanmalıdır. Tablete 2. ile 5. günler arasında başlanması da kabul edilebilir, ancak bu durumda tablet alınmaya başlanmasından itibaren yedi gün boyunca ilave olarak bir bariyer kontrasepsiyon yöntemi kullanılmalıdır.
Diğer bir kombine hormonal kontraseptiften (KOK, vajinal halkadan veya transdermal flaster) geçiş:
Kullanıcı tercihen, bir önceki KOK'un son tabletini (hormon içeren son tablet) aldığı günü izleyen günde YAZZ'a başlamalıdır. En geç, önceki KOK' un tabletsiz döneminin veya hormon içermeyen tablet döneminin ertesi gününde başlayabilir. Vajinal halka veya transdermal flaster kullanılıyorsa YAZZ alımına döngü paketindeki son halkanın ya da flasterin çıkartıldığı gün veya en geç yeni uygulamanın yapılması gereken gün başlanmalıdır.
Yalnız progesteron içeren bir yöntemden (minipil, enjeksiyon, implant) ya da progesteron salımlı rahim içi sistemden (RİS) geçiş:
Minipilden herhangi bir günde, (implant veya RİS'in çıkarıldığı gün, enjeksiyonda ise bir sonraki enjeksiyonun yapılması gereken gün) geçiş yapılabilir. Ancak tüm bu koşullarda tablet alımının ilk 7 günü ek bir bariyer yönteminin kullanılması önerilir.
İlk trimestr düşüğünden sonra:
Hemen başlanabilir. Bu durumda ek kontraseptif yöntemlere ihtiyaç duyulmaz.
Doğumdan ya da ikinci trimestr düşüğünden sonra:
(Emziren kadınlar için Bkz. Bölüm 4.6)
Kadınlar, tablet almaya doğumu veya ikinci trimester düşüğünü takip eden 21.-28. günleri arasında başlaması konusunda uyarılmalıdır. Eğer daha geç başlanacaksa tablet kullanımının ilk yedi gününde ek bir bariyer yöntemi önerilir. Ancak daha önce bir cinsel birleşme olduysa, oral kontraseptife başlamadan önce gebelik ekarte edilmeli ya da kullanıcı bir sonraki kanama dönemini beklemelidir.
Tablet alımı unutulduğunda:
Hormon içermeyen beyaz film kaplı tablet alımı unutulduğunda ek tedbire gerek yoktur, ancak hormon içermeyen beyaz film kaplı tablet alımının istem dışı uzamaması için unutulan tablet atılmalıdır. Aşağıdaki öneriler sadece hormon içeren açık pembe renkli film kaplı tabletlerin alınması unutulduğunda uygulanmalıdır:
Eğer kullanıcı aktif tabletini almakta 24 saatten daha az geç kalmışsa, kontraseptif koruyuculuk azalmaz. Hatırlanır hatırlanmaz tablet alınmalı ve bir sonraki tabletler de her zamanki gibi alınmaya devam edilmelidir. Eğer aktif tablet alımında 24 saatten daha fazla gecikme olmuşsa kontraseptif koruyuculuk azalmış olabilir. Bu durumda 2 basit kural uygulanır:
Aktif tablet alımına hiçbir zaman 7 günden fazla ara verilmez (önerilen hormon içermeyen tablet dönemi süresinin 4 gün olduğunu dikkate alınız).
4.3. Kontrendikasyonlar
KOK'lar aşağıdaki koşulların varlığında kullanılmamalıdır ve ilk kez KOKkullanımı sırasında bunlardan herhangi biri ortaya çıkacak olursa, tedavi hemen kesilmelidir.
VTE varlığı veya riski
Venöz tromboembolizm – mevcut VTE (antikoagülanlarla tedavide) veya öyküsü (örn. derin ven trombozu [DVT] veya pulmoner embolizm [PE])
4.4. Özel kullanım uyarıları ve önlemleri
Uyarılar
Dolaşım bozuklukları ile ilgili advers etkilerin ortaya çıkma riski özellikle 35 yaş üzeri ve sigara içen kadınlarda yüksektir.
Epidemiyolojik çalışmalar, drospirenon içeren kombine oral kontraseptifler (KOK) için VTE riskinin, levonorgesterol içeren KOK'lardan (ikinci jenerasyon olarak bilinen preparatlar) daha fazla olduğunu ve bu riskin desogestrel/gestoden içeren KOK'lar (üçüncü jenerasyon olarak bilinen preparatlar) ile benzer olabileceğini göstermiştir.
Aşağıda belirtilen durum veya risk faktörlerinden herhangi biri varsa, YAZZ'ın uygun olup olmadığı kadın ile tartışılmalıdır.
Bu durumlardan veya risk faktörlerinden herhangi birinin şiddetlenmesi veya ilk defa ortaya çıkması halinde, kadının YAZZ kullanımının sonlandırılmasının gerekli olup olmadığının belirlenmesi için doktoru ile iletişime geçmesi tavsiye edilmelidir.
Şüpheli veya onaylanmış VTE veya ATE durumunda, KHK kullanımı kesilmelidir. Antikoagülan tedaviye başlandığında, antikoagülan tedavinin (kumarin) teratojenisitesi nedeniyle, yeterli alternatif kontrasepsiyon başlatılmalıdır
Dolaşım bozuklukları
VTE riski
KHK kullanan kadınlarda, VTE riski kullanmayanlara göre artar. Levonorgestrel, norgestimat veya noretisteron içeren ürünler en düşük VTE riski ile ilişkilendirilmiştir. YAZZ gibi diğer ürünlerde ise bu risk iki katına kadar çıkabilir. En düşük VTE riskine sahip olduğu bilinenlerden farklı bir ürünün kullanılması kararı, ancak kadının mevcut risk faktörlerinin bu riski nasıl etkilediğini ve VTE riskinin bu ilacın kullanımının ilk yılında KHK'lerle ilişkili VTE riskinin en yüksek olduğunu anladığından emin olduktan sonra alınmalıdır. Ayrıca KHK kullanımına 4 hafta veya daha uzun süre ara verildikten sonra tekrar başlandığında riskin arttığını gösteren bazı kanıtlar vardır.
KHK kullanmayan ve gebe olmayan kadınlarda, 10.000 kişiden yaklaşık 2'si bir yıllık süre içinde VTE geliştirir. Bununla birlikte, herhangi bir kadında altta yatan risk faktörlerine bağlı olarak söz konusu risk çok daha yüksek olabilir (aşağı bakınız).
Drospirenon içeren KHK kullanan 10.000 kadından 9 ila 12'sinde bir yıl içinde VTE gelişeceği tahmin edilmektedir1; bu oran levonorgestrel içeren KHK kullanan kadınlarda 62
Düşük dozlu KHK'ler ile bir yıldaki VTE sayısı, gebelikte veya postpartum dönemindeki kadınlarda beklenen VTE sayısından düşüktür.
VTE, bu vakaların %1-2'sinde ölümcül olabilir.
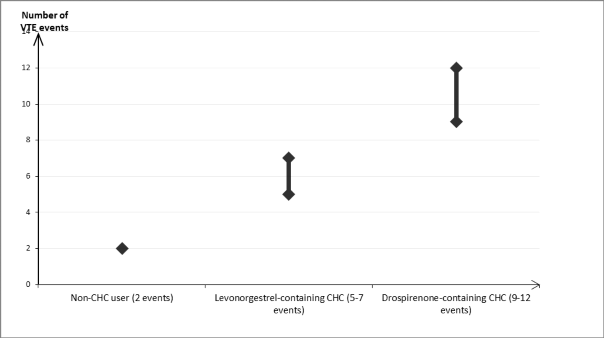
Levonorgestrel içeren KHK (5-7 vaka)
Drospirenon içeren KHK (9-12 vaka)
KHK kullanmayalar (2 vaka)
VTE vaka sayısı
Bir yıl içinde her 10.000 kadında görülen VTE vakası sayısı
Son derece nadir olarak, KHK kullanıcılarında diğer kan damarlarında (örn. hepatik, mesenterik, böbrek veya retinal toplardamarlar ve atardamarlar) tromboz meydana geldiği rapor edilmiştir.
VTE risk faktörleri
Venöz tromboembolik komplikasyon riski KHK kullanıcılarında özellikle çoklu risk faktörleri olduğunda, ilave risk faktörleri olan kadınlarda ciddi ölçüde artabilir (Bkz. Tablo: VTE Risk faktörleri).
Yüksek venöz tromboz riski oluşturan çoklu risk faktörleri mevcut olan kadında YAZZ kullanımı kontrendikedir (Bkz. Bölüm 4.3). Bir kadın birden fazla risk faktörüne sahipse risk artışı tüm faktörlerin ayrı ayrı toplamından fazla olabilir ve bu durumda toplam VTE riski dikkate alınmalıdır. Fayda ve risk dengesinin negatif olduğu düşünülüyorsa KHK reçete edilmemelidir (Bkz. Bölüm 4.3).
Tablo: VTE Risk faktörleri
Risk faktörü: | Açıklama |
Obezite (vücut kitle indeksi 30 kg/m'nin üstündeyse) | Vücut kitle indeksi yükseldiğinde risk ciddi ölçüde artar. Diğer risk faktörleri mevcutsa özellikle dikkate alınmalıdır. |
Uzun süreli hareketsizlik, majör cerrahi müdahale, bacaklara ve pelvise cerrahi müdahale, nörocerrahi, veya majör travma Not: 4 saatten fazla hava yolu seyahati dahil geçici hareketsizlik de özellikle diğer risk faktörleri olan kadınlarda VTE için bir risk faktörü olabilir. | Bu durumlarda ilacı kesmek (cerrahi müdahale durumunda en az 4 hafta) ve tamamen iyileştikten iki hafta sonrasına kadar devam etmemek önerilir. İstenmeyen gebeliği önlemek için başka bir kontrasepsiyon yöntemi kullanılmalıdır. Önceden YAZZ kesilmemişse, antitrombotik tedavi düşünülmelidir. |
Pozitif aile geçmişi (ebeveynlerden birinde ya da kardeşte erken yaşlarda (örn. 50 yaşından genç) VTE görülmüşse.) | Kalıtımsal bir eğilimden şüpheleniliyorsa, KHK kullanımından önce mutlaka bir uzmandan tavsiye alınmalıdır. |
VTE ile ilişkili diğer tıbbi durumlar | Kanser, sistemik lupus eritematoz, hemolitik üremik sendrom ve kronik inflamatuar bağırsak hastalıkları (Crohn hastalığı veya ülseratif kolit) ve orak hücre hastalığı. |
İlerleyen yaş | Özellikle 35 yaş üstü |
Variköz venlerin ve yüzeysel tromboflebitin venöz tromboembolideki olası rolü konusunda görüş birliği yoktur.
Gebelikte ve özellikle 6 haftalık puerperium periyodunda tromboemboli riskindeki artış dikkate alınmalıdır (Bkz. Bölüm 4.6).
VTE semptomları (DVT ve PE)
Semptomlar olması halinde, kadınlara acil tıbbi yardım almaları ve sağlık çalışanlarını KHK aldıkları konusunda bilgilendirmeleri tavsiye edilmelidir.
DVT semptomları aşağıdakileri kapsayabilir:
bacakta/ayakta tek taraflı ya da bacaktaki bir damar boyunca şişme;
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Not: Olası etkileşmeleri belirlemek amacıyla eşzamanlı kullanılacak ilacın prospektüsüne kullanma talimatına bakılmalıdır.
Diğer tıbbi ürünlerin YAZZ ile etkileşimleri:
Mikrozomal enzimleri indükleyen ilaçlar ile arasındaki etkileşimler seks hormonu klirensinde artışa neden olabilir, bu durum da ara kanamalara ve/veya kontraseptif başarısızlığa yol açabilirler.
Yönetilmesi
Birkaç günlük tedavinin ardından enzim indüksiyonu gözlemlenebilir. En fazla enzim indüksiyonu genellikle birkaç hafta içinde görülür. Enzim indüksiyonu, ilaç tedavisinin kesilmesinin ardından 4 hafta kadar sürebilir.
Kısa süreli tedavi
Bu ilaçlardan herhangi biri ile kısa süreli tedavi edilmekte olan kadınlar, KOK dışında geçici olarak bir bariyer yöntemi kullanmalı ya da başka bir kontrasepsiyon yöntemi seçmelidirler. İlaçlar ile birlikte kullanımları süresince ve tedavinin kesilmesini takiben 28 gün boyunca bariyer yöntemi kullanmalıdırlar. Bu eş zamanlı tedavi uygulanan ve bariyer yönteminin kullanıldığı dönem KOK kutusundaki hormon içeren açık pembe film kaplı tabletlerin bitiminden sonra da devam ediyorsa, bir sonraki YAZZ kutusuna hormon içermeyen beyaz film kaplı tabletleri almadan başlanmalıdır.
Uzun süreli tedavi
Karaciğer enzimini indükleyici etkin maddeler ile uzun süreli tedavi gören kadınlarda, başka bir güvenilir, hormonal olmayan kontrasepsiyon yöntemi önerilmektedir.
Literatürde aşağıdaki etkileşimler bildirilmiştir.
KOK klirensini artıran maddeler (enzimlerin uyarılmasıyla KOK etkililiğinin azalması), örn.: Fenitoin, bosentan, ritonavir, nevirapine, efavirenz, barbitüratlar, primidon, karbamazepin, rifampisin ve muhtemelen oksakarbazepin, topiramat, felbamat, griseofulvin ve sarı kantaron (St John's wort) içeren ürünler.
KOK klirensi üzerine değişken etkilere sahip maddeler;
KOK ile birlikte uygulandığında, HCV inhibitörleri ile olan kombinasyonlar dahil, birçok HIV proteaz inhibitörü ve nükleozid olmayan ters transkriptaz inhibitörleri kombinasyonu, plazma östrojen veya progesteron konsantrasyonlarını azaltabilmekte ya da artırabilmektedir. Bu değişikliklerin net etkisi, bazı olgularda klinik açıdan anlamlı olabilir.
Bu nedenle, HIV/HCV ilaç tedavisi ile eş zamanlı kullanım içinpotansiyel etkileşimleri tanımlamak ve bu konuya ilişkin herhangi bir tavsiye edinmek amacıyla kullanma talimatına bakılmalıdır. Herhangi bir süphe olması durumunda, proteaz inhibitörü ya da nükleozid olmayan ters transkriptaz inhibitörleri tedavisi durumunda kadın tarafından ilave bir önleyici kontraseptif metot kullanılmalıdır.
KOK klirensini azaltan maddeler (enzim inhibitörleri):
Enzim inhibitörleri ile potansiyel etkileşimlerin klinik anlamlılığı hala bilinmemektedir. Kuvvetli düzeyde CYP3A4 inhibitörleri ile eş zamanlı kullanım, östrojen veya progesteron veya her ikisinin de plazma konsantrasyonunu artırabilir.
Drospirenon (3 mg/gün) / etinilestradiol (betadeks klatrat olarak) (0,02 mg/gün) kombinasyonunun güçlü CYP3A4 inhibitörü ketakonazol ile 10 gün boyunca birlikte alımında drospirenonun ve etinilestradiolün EAA'sı (0-24 saat) sırasıyla 2,7 ve 1,4 kat artmıştır.
60 - 120 mg/gün etorikoksib dozlarının 0,035 mg etinilestradiol içeren KHK ile eş zamanlı olarak alındığı takdirde etinilestradiolün plazma konsantrasyonlarını sırasıyla 1,4 - 1,6 kat arttırdığı görüllmüştür.
YAZZ'ın diğer tıbbi ürünler üzerine etkisi:
KOK'lar diğer etkin maddelerin metabolizmaları ile etkileşebilmektedir. Buna bağlı olarak plazma ve doku konsantrasyonları artabilir (örn. siklosporin) veya azalabilir (örn. lamotrigin).
Omeprazol, simvastatin veya midazolam kullanan gönüllü kadınlarda yürütülen in vivo etkileşim çalışmasında elde edilen sonuçlara göre, drospirenonun 3 mg'lık dozlarda diğer ilaçların sitokrom P450 enzim aracılı metabolizmalarıyla klinik açıdan anlamlı bir etkileşim sergileme olasılığı bulunmamaktadır.
Klinik çalışmalar etinilestradiolun CYP1A2 substratlarının klirensini azalttığını ve plazma konsantrasyonlarının hafif (ör. teofilin) veya orta düzeyde (ör. tizanidin) artmasına neden olduğunu göstermektedir
Farmakodinamik etkileşimler
Ribavirin ile veya ribavirin olmadan, ombitasvir/paritaprevir/ritonavir ve dasabuvir veya glekaprevir/pibrentasvir içeren tıbbi ürünlerle eş zamanlı kullanım ALT yükselme riskini artırabilir (Bkz. Bölüm 4.3 ve 4.4).
Bu nedenle, YAZZ kullanıcıları, bu kombinasyon ilaç rejimiyle tedaviye başlamadan önce alternatif bir kontrasepsiyon yöntemine (örneğin, sadece progestajenle kontrasepsiyon veya hormonal olmayan yöntemler) geçmelidir. YAZZ, bu kombinasyon ilaç rejimi ile tedaviyi tamamladıktan 2 hafta sonra yeniden başlatılabilir.
Böbrek yetmezliği olmayan hastalarda, drospirenon ve ACE inhibitörlerinin ya da NSAID'lerin eş zamanlı kullanımında serum potasyumu üzerinde önemli bir etki görülmemiştir. Ancak, aldesteron antagonistleri ya da potasyum tutucu diüretikler ile YAZZ'ın eş zamanlı kullanımı çalışılmamıştır. Bu durumda, ilk tedavi döngüsü sırasında serum potasyumu test edilmelidir (Bkz. Bölüm 4.4).
Diğer etkileşmeler:
Laboratuvar testleri:
Kontraseptif steroidlerin kullanılması karaciğer, tiroid, adrenal ve renal fonksiyonlarınbiyokimyasal parametreleri, kortikosteroid bağlayıcı globulin gibi (taşıyıcı) proteinlerin plazma düzeyleri ve lipid/lipoprotein fraksiyonları, karbonhidrat metabolizması, koagülasyon ve fibrinoliz parametreleri gibi bazı laboratuvar testlerinin sonuçlarını etkileyebilir.
Değişiklikler genellikle normal laboratuvar düzeyleri içinde kalmaktadır. Drospirenon hafif derecedeki antimineralokortikoid etkinliğine bağlı olarak, plazma renin etkinliğinde ve plazma aldosteronunda bir artışa neden olur.
Özel popülasyonlara ilişkin ek bilgiler:
Pediyatrik popülasyon: YAZZ yalnızca menarştan sonra endikedir. Pediyatrik popülasyonda yapılmış etkileşim çalışması bulunmamaktadır.
4.6. Gebelik ve laktasyon
:Gebelik kategorisi X'dir.
Çocuk doğurma potansiyeli bulunan kadınlar / Doğum kontrolü (Kontrasepsiyon):
YAZZ bir oral kontraseptiftir.
Gebelik dönemi:
YAZZ film kaplı tabletlerin gebelikte kullanımı kontrendikedir. YAZZ kullanımı sırasında gebelik meydana gelmesi durumunda kullanım durdurulmalıdır. Ancak, yaygın epidemiyolojik çalışmalar ne gebeliğinden önce KOK kullanmış olan kadınların çocuklarında doğumsal kusur riskinde herhangi bir artışı ne de erken gebeliği süresince yanlışlıkla KOK kullanıldığında oluşan bir teratojenik etkiyi göstermemiştir.
Hayvanlar üzerinde yapılan çalışmalar, gebelik ve emzirme döneminde istenmeyen etkiler olduğunu göstermiştir (Bkz. Bölüm 5.3). Bu hayvan verilerine dayanarak, aktif bileşiklerin hormonal etkisine bağlı istenmeyen etkiler göz ardı edilemez. Bununla birlikte, gebelik sırasında KOK‘larla genel deneyim, insanlarda fiili bir istenmeyen etkiye yönelik kanıt ortaya koymamıştır.
YAZZ'ın gebelikte kullanımına ilişkin veriler, YAZZ'ın gebelik, fötus ya da yenidoğanın sağlığı üzerindeki olumsuz etkileri hakkında sonuçlara varılmasına izin veremeyecek kadar kısıtlıdır. Konu hakkında epidemiyolojik veri henüz mevcut değildir.
YAZZ kullanımına yeniden başlarken postpartum dönem sırasında artan VTE riski dikkate alınmalıdır (Bkz. Bölüm 4.2 ve Bölüm 4.4).
Laktasyon dönemi:
Laktasyon, anne sütünün miktarında azalmaya ve bileşiminde değişikliğe yol açabileceğinden, KOKlar tarafından etkilenebilir. Bu yüzden emziren anne bebeğini sütten kesinceye kadar KOK kullanımı genellikle önerilmemelidir. Kontraseptif steroidler ve metabolitleri küçük miktarlarda anne sütüne geçebilir. Bu miktar bebeği etkileyebilir.
Üreme yeteneği / Fertilite:
YAZZ, bir oral kontraseptiftir. Kullanıldığı sürece fertiliteyi engeller.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Araç ve makine kullanma becerileri üzerinde etkisi ile ilgili herhangi bir çalışma yapılmamıştır. KOK kullanımının araç ve makine kullanma becerileri üzerinde herhangi bir etkisi gözlenmemiştir.
4.8. İstenmeyen etkiler
KOK kullanıcılarında görülen ciddi istenmeyen etkiler için ayrıca Bkz. Bölüm 4.4. YAZZ kullanımı sırasında aşağıdaki advers reaksiyonlar bildirilmiştir:
Advers reaksiyonlar, aşağıda sistem-organ sınıfı (MedDRA) ve sıklık derecesine göre listelenmektedir. Sıklık dereceleri şu şekilde tanımlanmaktadır; çok yaygın (≥1/10), yaygın (≥1/100, <1/10), yaygın olmayan (≥1/1.000, <1/100), seyrek (≥1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (yalnızca pazarlama sonrası gözetimde tanınan ve sıklığın öngörülemediği ilave advers ilaç reaksiyonları).
Enfeksiyonlar ve enfestasyonlar
Seyrek: Kandidiyaz
Kan ve lenf sistemi hastalıkları
Seyrek: Anemi, trombositemi
Bağısıklık sistemi hastalıkları Seyrek: Alerjik reaksiyon Bilinmiyor: Aşırı duyarlılık
Endokrin hastalıkları
Seyrek: Endokrin bozukluk
Metabolizma ve beslenme hastalıkları
Seyrek: İştah artışı, anoreksi, hiperkalemi, hiponatremi
Psikiyatrik hastalıkları
Yaygın: Duygusal değişkenlik
Yaygın olmayan: Depresyon, gerginlik, somnolans Seyrek: Anorgazmi, uykusuzluk
Sinir sistemi hastalıkları
Yaygın: Baş ağrısı
Yaygın olmayan: Baş dönmesi, parestezi Seyrek: Vertigo, titreme
Göz hastalıkları
Seyrek: Konjuktivit, göz kuruluğu, göz bozukluğu
Kardiyak hastalıkları
Seyrek: Taşikardi
Vasküler hastalıkları
Yaygın olmayan: Migren, Varikoz ven, hipertansiyon
Seyrek: Flebit, vasküler bozukluk, venöz ve arteriyel tromboembolik olaylar**, epistaksis, senkop
Gastrointestinal hastalıkları
Yaygın: Bulantı
Yaygın olmayan: Karın ağrısı, kusma, dispepsi, şişkinlik, gastrit, diyare
Seyrek: Abdomende genişleme, gastrointestinal bozukluk, gastrointestinal doluluk, hiatus hernisi, oral kandidiyaz, kabızlık, ağız kuruluğu
Hepato-bilier hastalıkları
Seyrek: Biliyer ağrı, kolesistit
Deri ve deri altı doku hastalıkları
Yaygın olmayan: Akne, pruritus (kaşıntı), döküntü
Seyrek: Kloazma, egzema, alopesi, dermatit akneiform, deride kuruluk, eritema nodozum, hipertrikoz, deri bozukluğu, deride çizgilenme, kontak dermatit, fotosensitif dermatit, deri nodülü
Bilinmiyor: Eritema multiforme
Kas-iskelet bozukluklar, bağ doku ve kemik hastalıkları
Yaygın olmayan: Sırt ağrısı, ekstremitelerde ağrı, kas krampları
Üreme sistemi ve meme bozuklukları
Yaygın: Memelerde ağrı, metroraji*, amenore
Yaygın olmayan: Vajinal kandidiyaz, pelvik ağrı, memelerde büyüme, fibrokistik meme, uterin/genital kanama*, genital akıntı, ateş basması, vajinit, menstrüel bozukluk, dismenore, hipomenore, vajinal kuruluk, şüpheli papanicolaou smear, libido azalması
Seyrek: Disparöni, vulvovajinit, postkoital kanama, geri çekilme kanaması, memede kist, meme hiperplazisi, memede neoplazma, servikal polip, endometrial atrofi, over kisti, uterusda büyüme
Genel bozukluklar ve uygulama bölgesine iliskin hastalıklar
Yaygın olmayan: Asteni, terlemede artış, ödem (jeneralize ödem, periferik ödem, yüzde ödem)
Seyrek: Halsizlik
Araştırmalar
Yaygın olmayan: Vücut ağırlığında artış Seyrek: Vücut ağırlığında azalma
*Kanama düzensizlikleri genellikle tedavinin sürdürülmesiyle ortadan kalkmaktadır.
Seçilmiş advers reaksiyonların tanımlanması
KOK kullanan kadınlarda Özel kullanım uyarıları ve önlemleri bölümünde daha ayrıntılı olarak ele alınan aşağıdaki ciddi advers olaylar bildirilmiştir:
Venöz tromboembolik bozukluklar;
4.9. Doz aşımı ve tedavisi
YAZZ hormon içeren açık pembe film kaplı tabletlerin doz aşımı ile ilgili klinik deneyim yoktur. Preklinik çalışmalarda doz aşımına bağlı bildirilen ciddi yan etki yoktur. KOK'ların kullanımı sonucu elde edilen deneyimlere göre YAZZ film kaplı tabletlerin aktif tabletlerinin aşırı dozda kullanımında görülebilecek belirtiler, bulantı, kusma ve çekilme kanamasıdır. Çekilme kanaması, ilacı yanlışlıkla almaları halinde kız çocuklarında menarştan önce bile görülebilir. Antidotu yoktur ve tedavisi semptomatik olmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Östrojenler ve progestajenler, fiks kombinasyonlar ATC kodu: G03AA12
Yöntem başarısızlığına ilişkin Pearl İndeksi: 0,41 (üst iki yönlü %95 güven limiti: 0,85). Genel Pearl İndeksi (yöntem başarısızlığı + hasta başarısızlığı): 0,80 (üst iki yönlü %95 güven limiti: 1,30).
YAZZ'ın kontraseptif etkisi, çeşitli faktörlerin etkileşimine dayanır ve bunlardan en önemlisi ovülasyon inhibisyonu ve endometriyumda değişiklikler şeklinde görülür.
24 günlük bir rejim ve 21 günlük bir rejimde drospirenon 3 mg / etinilestradiol (betadeks klatrat olarak) 0,02 mg'ın karşılaştırıldığı 3 sikluslu ovülasyon inhibisyonu çalışmasında, 24 günlük rejim foliküler gelişimin daha fazla bastırılması ile ilişkilendirilmiştir. Tedavinin 3. siklusta kasıtlı olarak uygulanan dozlama hatalarının ardından, 21 günlük rejimdeki kadınların daha büyük bir kısmı 24 günlük rejimi alan kadınlara kıyasla kaçış ovülasyonları da dahil olmak üzere over aktivitesi göstermiştir. 24 günlük rejimi alan kadınların %91,8'inde tedavi sonrası siklusta over aktivitesi, tedavi öncesi seviyelerine dönmüştür.
YAZZ etinilestradiol ve progesteron drospirenon içeren kombine oral kontraseptiftir. Terapötik dozajda, drospirenon, antiandrojenik ve hafif antimineralokortikoid özellikler de gösterir. Östrojen, glukokortikoid ve antiglukortikoid aktivitesi yoktur. Bu da drospirenona, doğal hormon progesterona tıpatıp benzeyen bir farmakolojik profil sağlar.
YAZZ'ın hafif antimineralokortikoid özelliklerinin hafif bir antimineralokortikoid etkiye yol açtığı yönünde klinik çalışmalardan endikasyonlar mevcuttur.
YAZZ'ın orta derecede akne vulgarisli kadınlardaki etkililiği ve güvenliliğini değerlendirmek üzere iki çok merkezli, çift kör, randomize, plasebo kontrollü çalışma yapılmıştır.
Altı ay tedaviden sonra, plaseboya kıyasla, YAZZ enflamatuvar lezyonlarda %15,6 (%33,7'ye karşı %49,3), enflamatuvar olmayan lezyonlarda %18,5 (%22,1'e karşı %40,6) ve toplam lezyon sayılarında %16,5 (%28,1'e karşı %44,6) gibi istatistiksel olarak anlamlı derecede daha fazla azalma ortaya koymuştur. Buna ilaveten, %11,8 gibi daha yüksek oranda gönüllü (%6,8'e karşı %18,6), Araştırmacının Statik Global Değerlendirme (ISGA) ölçeğinde ‘net' veya ‘hemen hemen net' bir derecelendirme ortaya koymuştur.
5.2. Farmakokinetik özellikler
DrospirenonGenel özellikler
Emilim:
Oral olarak alınan drospirenon hızla ve hemen hemen tamamen emilir. Tek alımını takiben yaklaşık 1-2 saat sonra yaklaşık 38 ng/ml olan en yüksek etkin madde düzeyine ulaşılır. Biyoyararlılığı yaklaşık % 76-85'dir. Midenin boş olması ile karşılaştırıldığında gıda alımının drospirenonun biyoyararlılığı üzerine etkisi yoktur.
Dağılım:
Oral olarak alındıktan sonra serum drospirenon düzeyleri 31 saatlik bir terminal yarılanma ömrü ile azalır. Drospirenon serum albuminine bağlanır, SHBG'e (seks hormonu bağlayıcı globulin) ya da CBG'ye (kortikoid bağlayıcı globulin) bağlanmaz.
Toplam serum konsantrasyonun yalnızca % 3-5'i bağlanmamış halde bulunur. SHBG'nin etinilestradiole bağlı artışı drospirenonun serum protein bağlanmasını etkilemez. Drospirenon'un ortalama dağılım hacmi 3,7 ± 1,2 l/kg'dır.
Biyotransformasyon:
Oral olarak alınan drospirenon tam olarak metabolizasyona uğrar. Plazmada bulunan ana metabolitler drospirenonun lakton halkasının açılmasıyla oluşan asit formu ve indirgenmenin ve bunu takiben sülfatasyonun oluşturduğu 4,5-dihidro-drospirenon-3-sülfattır. Drospirenon, aynı zamanda CYP3A4 tarafından oksidatif metabolizmaya tabidir.
İn vitro olarak, drospirenon P450 sitokrom enzimleri CYP1A1, CYP2C9, CYP2C19 ve CYP3A4'ü zayıf ila orta düzeyde inhibe edebilir.
Eliminasyon:
Plazmadan klirens hızı yaklaşık 1,5 + 0,2 ml/dak/kg'dır. Drospirenonun sadece eser miktarı değişmemiş olarak atılır. Metabolitler feçes ve idrar ile 1,2 : 1,4 oranıyla atılır. Metabolitlerin idrar ve feçes ile atılım yarı ömürleri yaklaşık 40 saattir.
Doğrusallık/Doğrusal olmayan durum:
Drospirenon doğrusal farmakokinetik gösterir.
Kararlı durum koşulları:
Bir tedavi siklusu boyunca, yaklaşık 70 ng/ml'lik serumdaki drospirenonun maksimum kararlı durum konsantrasyonlarına yaklaşık 8 gün tedaviden sonra ulaşılır. Serum drospirenon seviyeleri, terminal yarılanma ömrü ve dozlama aralığı oranının sonucu olarak yaklaşık 3'lük bir faktör ile birikmiştir.
Hastalardaki karakteristik özellikler
Böbrek yetmezliği: Hafif düzeyde böbrek bozukluğu (kreatinin klirensi 50-80 ml/dak) olan kadınlar ile böbrek fonksiyonları normal olan (kreatinin klirensi>80 ml/dak) kadınların kararlı durum serum drospirenon düzeyleri karşılaştırılabilir sonuçlar vermiştir. Orta derecede böbrek bozukluğu (kreatinin klirensi 30-50 ml/dak) olan kadınların serum drospirenon düzeyleri böbrek fonksiyonu normal olan kadınlar ile karşılaştırıldığında %37 daha yüksek bulunmuştur. Drospirenon tedavisi tüm gruplar tarafından iyi tolere edilmiştir. Drospirenon tedavisi serum potasyum konsantrasyonu üzerine klinik olarak anlamlı bir etki göstermemiştir.
Karaciğer yetmezliği: Tek dozlu bir çalışmada, oral klirens (CL/F), karaciğer fonksiyonları normal olanlara kıyasla orta derecede karaciğer bozukluğu olan gönüllülerde yaklaşık %50 azalmıştır. Normal hepatik fonksiyona sahip gönüllülerle karşılaştırıldığında Orta derecede hepatik bozukluğu olan gönüllülerde gözlenen drospirenon klirensindeki azalma her iki grupta serum potasyum konsantrasyonlarında belirgin bir farklılık yaratmamıştır. Diabet varlığı ve spironolakton tedavisi (hastanın hiperkalemi eğilimini artıran iki durum) de serum potasyum
düzeylerini normal sınırın üzerine çıkarmamıştır. Sonuç olarak drospirenonun hafif ve orta derecede karaciğer bozukluğu olan hastalarda (Child-Pugh B) iyi tolere edildiği söylenebilir.
Etnik gruplar: Japon ve beyaz kadınlar arasındaki etnik farklılıkların drospirenon ve etinilestradiolün farmakokinetikleri üzerine klinik olarak anlamlı etkisi olmadığı görülmüştür.
Etinilestradiol Genel özellikler
Emilim:
Oral olarak alınan etinilestradiol hızla ve tamamen emilir. En yüksek serum konsantrasyonu olan yaklaşık 33 pg/ml'ye tek oral alımdan sonra 1-2 saat içerisinde ulaşılır. Karaciğerden ilk geçiş etkisi ve presistemik konjugasyon sonucu mutlak biyoyararlılığı yaklaşık % 60 kadardır. Etinilestradiol'ün gıda ile birlikte alınmasının incelendiği bireylerin % 25 kadarında biyoyararlanımının azaldığı gözlenmiştir.
Dağılım:
Etinilestradiol serumdan iki fazla yaklaşık 24 saatlik bir yarılanma ömrü ile elimine olur. Etinilestradiol serum albuminine yüksek oranda fakat non-spesifik olarak (yaklaşık % 98,5) bağlanır ve SHBG ve CBG'nin serum konsatrasyonlarındaki artışı inhibe eder. Dağılım hacmi yaklaşık 5 l/kg olarak bildirilmiştir.
Biyotransformasyon:
Etinilestradiol önemli bağırsak ve hepatik ilk geçiş metabolizmasına tabidir ve esas olarak aromatik hidroksilasyon ile metabolize olur. Etinilestradiol ve oksidatif metabolitler öncelikle glukronid veya sülfat ile konjuge olurlar. Etinilestradiolün metabolik klirens oranı yaklaşık 5 ml/dak/kg'dır.
İn vitro etinilestradiol hem CYP2C19, CYP1A1 ve CYP1A2'nin geri döndürülebilir inhibitörü, hem de CYP3A4/5, CYP2C8, ve CYP2J2'nin mekanizma temelli inhibitörüdür.
Eliminasyon:
Etinilestradiol değişmemiş olarak atılmaz. Yaklaşık 1 günlük yarılanma ömrü olan metabolitler halinde böbrek ve safradan 4:6 oranında atılır. Metabolit atılım yarılanma ömrü yaklaşık 1 gündür.
Doğrusallık/Doğrusal olmayan durum:
Etinilestradiol doğrusal farmakokinetik gösterir.
Kararlı durum koşulları:
Kararlı durum koşullarına tedavi siklusunun ikinci yarısında ulaşılır ve serum etinilestradiol seviyeleri yaklaşık 2,0 – 2,3 gibi bir faktörle çoğalır.
5.3. Klinik öncesi güvenlilik verileri
Laboratuvar hayvanlarında, drospirenon ve etinilestradiolün etkileri bilinen farmakolojik etkiyle ilişkili olanlarla sınırlıdır. Özellikle üreme toksisitesi çalışmaları, hayvanlarda türe özgü olarak değerlendirilen embriyotoksik ve fetotoksik etkiler ortaya çıkarmıştır. YAZZ kullanıcılarındaki maruziyetlerin üzerindeki maruziyetlerde, cinsi farklılaşma üzerindeki etkiler sıçan fetüslerinde gözlemlenirken, maymunlarda gözlemlenmemiştir. Çevresel risk değerlendirme çalışmaları, etinilestradiol ve drospirenonun su ortamı için risk teşkil etme potansiyeli olduğunu göstermiştir (Bkz. Bölüm 6.6).
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Etkin madde
Her biri 3 mg drospirenon ve 0,02 mg etinilestradiol (betadeks klatrat olarak) içeren 24 adet hormon içeren film kaplı tablet ve bunları takip eden 4 adet hormon içermeyen beyaz film kaplı tablet.Laktoz monohidrat (sığır) Mısır nişastası Magnezyum stearat Hidroksipropilmetil selüloz Talk
Titanyum dioksit Kırmızı demir oksit
Etkin madde
Her biri 3 mg drospirenon ve 0,02 mg etinilestradiol (betadeks klatrat olarak) içeren 24 adet hormon içeren film kaplı tablet ve bunları takip eden 4 adet hormon içermeyen beyaz film kaplı tablet.Laktoz monohidrat (sığır) Mikrokristalin selüloz Magnezyum stearat Hidroksipropilmetil selüloz Talk
Titanyum dioksit
6.2. Geçimsizlikler
Yoktur.
6.3. Raf ömrü
60 ay.
6.4. Saklamaya yönelik özel tedbirler
25ï‚°C altında oda sıcaklığında saklayınız.
6.5. Ambalajın niteliği ve içeriği
YAZZ, 24+4 tablet ve 3 x (24+4 tablet) şeklinde 84 film kaplı tablet içeren ambalajlarda bulunur.
PVC/Aluminyum blister'de etkin madde içeren 24 adet ve etkin madde içermeyen 4 adet film kaplı tablet.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller, “Tıbbi Atıkların Kontrolü Yönetmeliği†ve “Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliğiâ€ne uygun olarak imha edilmelidir.
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
 Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör.
Deri Kanseri
Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| DROSMAX | 8699828091394 | |
| DROSMIN | 8699828091349 | |
| DROSPERA | 8681026050297 | 364.81TL |
| JERASSI | 8699578092016 | 413.58TL |
| MINAYA | 8681026050051 | |
| Diğer Eşdeğer İlaçlar |
 |
Kolon, Rektum yada Bağırsak Kanseri Bağırsak kanseri kolon veya rektumda (arka geçit) herhangi bir bölgede ortaya çıkabilir.Kolorektal kanser erken safhalarda teşhis edilmesi halinde daha kolay ve daha başarılı bir şekilde tedavi edilir. |
 |
Lösemi Kan Kanseri Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 |
HIV ve Aids HIV, Human Immunodeficiency Virus’dür (İnsanlarda Bağışıklık Sistemini Bozan Virüsdür). Bu virüs AIDS hastalığına sebep olur. |
İLAÇ GENEL BİLGİLERİ
Bayer Türk Kimya San. Tic. Ltd. Şti.
| Satış Fiyatı | 1042.55 TL [ 27 Oct 2025 ] |
| Önceki Satış Fiyatı | 1042.55 TL [ 13 Oct 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699546094189 |
| Etkin Madde | Drospirenon + Ethinyl Estradiol |
| İthal ( ref. ülke : Ispanya ) ve Beşeri bir ilaçdır. |