YERVOY 200mg/40ml IV infüzyonluk çözelti konsantreSI içeren 1 flakon Kısa Ürün Bilgisi
{ Ipilimumab }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
YERVOY 200 mg/40 mL IV infüzyonluk çözelti konsantresi içeren flakon Steril
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
İpilimumab 5 mg/mL
40 mL'lik bir flakon 200 mg ipilimumab içerir.
İpilimumab rekombinant DNA teknolojisi ile Çin hamsteri over hücrelerinde üretilen tamamen insana özgü bir anti-CTLA-4 monoklonal antikordur (IgG1κ).
Yardımcı maddeler
Çözeltinin her mL'si 0.1 mmol sodyum, yani 2,30 mg sodyum içerir. Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
İnfüzyonluk çözelti konsantresi (steril konsantre)
Berrak ilâ hafif opalesan, renksiz ilâ açık sarı sıvıdır, içinde az miktarda partikül olabilir ve pH değeri 7 osmolaritesi ise 260-300 mOsm/kg'dır.
Eğer düzelmezse, düzelene kadar dozlar atlanır ve tedaviye kaldığı yerden devam edilir .
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Melanom
YERVOY, daha önce en az bir seri sistemik tedavi kullanmış ve sonrasında progresyon göstermiş rezeke edilemeyen relaps veya metastatik erişkin malign melanom hastalarının tedavisinde endikedir. YERVOY, nivolumab ile kombinasyon halinde, ECOG performans durumu 0-1 olan yetişkinlerde ileri evre (rezeke edilemeyen veya metastatik) melanom tedavisinde endikedir.
Renal Hücreli Karsinom (RHK)
YERVOY, nivolumab ile kombinasyon halinde IMDC risk kategorisi orta/kötü riskli, Karnofsky Performans Durumu 70 ve üzerinde olan ve 65 yaş ve altındaki ileri evre renal hücreli karsinomlu yetişkin hastaların birinci basamak tedavisinde endikedir (bkz. Bölüm 5.1).
Küçük Hücreli Dışı Akciğer Kanseri (KHDAK)
YERVOY, nivolumab ve 2 kür platin bazlı kemoterapi ile kombinasyon halinde, EGFR mutasyonu veya ALK translokasyonu bulunmayan metastatik küçük hücreli dışı akciğer kanserli ECOG Performans Skoru 0-1 olan yetişkin hastaların birinci basamak tedavisinde endikedir.
Malign Plevral Mezotelyoma (MPM)
YERVOY, nivolumab ile kombinasyon halinde, rezeke edilemeyen malign plevral mezotelyoması olan yetişkin hastaların birinci basamak tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Tedavi, kanser tedavisinde deneyimli uzman doktorlar tarafından başlatılmalı ve kontrol edilmelidir
Pozoloji/uygulama sıklığı ve süresi:
YERVOY Monoterapisi
Melanom
Yetişkinlerde
YERVOY'un önerilen indüksiyon rejimi 3 haftada bir 30 dakikalık bir sürede intravenöz yoldan uygulanan 3 mg/kg olmak üzere toplam 4 dozdur. Yeni lezyonların ortaya çıkmasına ya da var olan lezyonların büyümesine bakılmaksızın, hastalar tolere ettikleri sürece, bütün indüksiyon rejimini (4 doz) almalıdırlar. Tümörün verdiği yanıtı, ancak indüksiyon tedavisi tamamlandıktan sonra değerlendirmek gerekir.
Nivolumab ile kombinasyon halinde YERVOY
Melanom
Önerilen doz; ilk 4 doz boyunca her 3 haftada bir intravenöz yoldan uygulanan 1 mg/kg ipilimumab nivolumab ile kombinasyon halinde 3 mg/kg YERVOY şeklindedir. Tablo 1'de gösterildiği üzere, bunu her 2 haftada bir 240 mg veya her 4 haftada bir 480 mg dozunda intravenöz yoldan uygulanan nivolumab monoterapisi fazı takip eder. Monoterapi fazında, ilk nivolumab dozu aşağıda gösterilen şekillerde uygulanmalıdır;
Her iki haftada bir 240 mg uygulanıyor ise, nivolumab ve YERVOY kombinasyonunun son dozundan 3 hafta sonra; veya
Derece 1 ya da Derece 0'a gelmez veya başlangıç seviyesine geri dönmez ise YERVOY kesilir.
4.3. Kontrendikasyonlar
Etkin madde
4.4. Özel kullanım uyarıları ve önlemleri
İzlenebilirlik
Biyoteknolojik tıbbi ürünlerin izlenebilirliğini iyileştirmek için uygulanan ürünün ticari ismi ve seri numarası mutlaka hasta dosyasına kaydedilmelidir.
PD-L1 durumunun değerlendirilmesi
Tümörün PD-L1 durumunu değerlendirirken, iyi valide edilmiş ve güçlü bir metodolojinin kullanılması önemlidir.
Nivolumab ile kombinasyon halinde YERVOY
YERVOY, kombinasyon halinde uygulandığında, tedavinin başlangıcından önce nivolumabın Kısa Ürün Bilgisi'ne bakınız. Nivolumab tedavisi ile ilişkili uyarılar ve önlemler hakkında ayrıntılı bilgi almak için lütfen nivolumab KÜB'e bakınız. İmmünite ile ilişkili advers reaksiyonların birçoğu kortikosteroid tedavisinin başlatılması ve tedavi değişiklikleri dahil olmak üzere uygun yönetim adımları ile iyileşmiş ya da çözülmüştür (bkz. Bölüm 4.2). Monoterapi olarak uygulanan nivolumab ile karşılaştırıldığında nivolumabın, YERVOY ile kombinasyon şeklinde uygulanması durumunda immünite ile ilişkili advers reaksiyonlar daha yüksek sıklıklarda oluşmuştur.
Kombinasyon tedavisinde pulmoner emboli dahil olmak üzere kardiyak ve pulmoner advers olaylar da bildirilmiştir. Hastalar kardiyak ve pulmoner advers reaksiyonlar ayrıca tedavi öncesinde ve tedavi sırasında periyodik olarak elektrolit bozukluklarının ve dehidratasyonun göstergesi olan klinik bulgular, semptomlar ve laboratuvar anormallikleri için sürekli izlenmelidir. Nivolumab ile kombinasyon halinde YERVOY uygulaması yaşamı tehdit eden ya da tekrarlayan şiddetli kardiyak ve pulmoner advers reaksiyonların meydana gelmesi halinde kesilmelidir (bkz. Bölüm 4.2).
Nivolumab ile kombinasyon halinde YERVOY tedavisi sırasında veya tedaviden sonraki herhangi bir zamanda bir advers reaksiyon meydana gelebileceğinden, hastalar sürekli olarak (son dozu takiben en az 5 ay) izlenmelidir.
İmmünite ile ilişkili reaksiyonlar
YERVOY, etki mekanizmasına bağlı olabilen artmış veya aşırı immün aktivite sonucu ortaya çıkan enflamatuvar advers reaksiyonlar ile ilişkili bulunmuştur (immünite ile ilişkili advers reaksiyonlar). Ciddi veya yaşamı tehdit edici olabilen immünite ile ilişkili advers reaksiyonlar, gastrointestinal, karaciğer, deri, sinir, endokrin veya diğer organ sistemlerini içerebilmektedir. Çoğu immünite ile ilişkili advers reaksiyonlar indüksiyon döneminde görülmüş olsa bile, son YERVOY dozu uygulandıktan aylar sonra ortaya çıkanlar da bildirilmiştir. Farklı bir etiyoloji saptanmadıkça, diyare, artan dışkı sıklığı, kanlı dışkı, KCFT değerlerinde artış, deri döküntüsü ve endokrinopati, enflamatuvar ve YERVOY ile ilişkili olarak düşünülmelidir. Yaşamı tehdit eden komplikasyonları minimize etmek için erken teşhis ve uygun yönetim gereklidir.
İmmünite ile ilişkili ciddi advers reaksiyonların tedavisi için ilave immünosüpresif tedavi ile birlikte veya bu tedaviler olmaksızın yüksek dozda sistemik kortikosteroid gerekli olabilir. İmmünite ile ilişkili advers reaksiyonların yönetimi için monoterapi olarak ya da nivolumab ile kombinasyon halinde YERVOY'a özel kılavuz aşağıda yer almaktadır.
Şüpheli immünite ile ilişkili advers reaksiyonlar için, etiyolojiyi doğrulamak veya diğer nedenleri dışlamak için uygun değerlendirmeler yapılmalıdır. Advers reaksiyonun şiddetine dayanarak, YERVOY veya nivolumab ile kombinasyon halinde YERVOY tedavisine ara verilmeli ve kortikosteroidler uygulanmalıdır. Kombinasyon tedavisinin sonucu olarak meydana gelen bir advers reaksiyonu tedavi etmek üzere kortikosteroidlerle immünsüpresyon olması durumunda, iyileşme sonrasında en az 1 aylık süre içerisinde azaltılarak kesilmelidir. Dozun kısa sürede kesilmesi advers reaksiyonun kötüleşmesine veya tekrarlamasına yol açabilir. Kortikosteroid kullanımına rağmen kötüleşme görülen veya iyileşme görülmeyen hastalarda kortikosteroid dışında bir immünosüpresif tedavi eklenmelidir.
Hasta, immünosüpresif kortikosteroid dozlarını ya da diğer immünosüpresif tedavileri alırken nivolumab ile kombinasyon halinde YERVOY tedavisi sürdürülmemelidir. İmmünosüpresif tedavi alan hastalarda fırsatçı enfeksiyonların önlenmesi için profilaktik antibiyotikler kullanılmalıdır.
Herhangi bir şiddette immünite ile ilişkili advers reaksiyonun tekrarlaması veya yaşamı tehdit eden herhangi bir immünite ile ilişkili advers reaksiyon görülmesi durumunda nivolumab ile kombinasyon halinde YERVOY tedavisi kalıcı olarak kesilmelidir.
İmmünite ile ilişkili gastrointestinal reaksiyonlar
YERVOY monoterapisi
YERVOY immünite ile ilişkili ciddi gastrointestinal reaksiyonlar ile ilişkilendirilmiştir. Klinik çalışmalarda gastrointestinal perforasyon nedeni ile ölümler bildirilmiştir (bkz. Bölüm 4.8).
Bir Faz 3 ileri evre (rezeke edilemeyen veya metastatik) melanom çalışmasında (MDX010-20, bkz. Bölüm 5.1) 3 mg/kg dozunda YERVOY monoterapisi alan hastalarda şiddetli ya da fatal (Derece 3- 5) immünite ile ilişkili gastrointestinal reaksiyonlar, tedaviye başlandıktan sonra ortanca 8 haftada (aralık: 5 ilâ 13 hafta) görülmüştür. Protokolde belirtilen yönetim kılavuzlarıyla, vakaların büyük bir bölümünde (%90) düzelme (hafif [Derece 1] veya daha düşük şiddete veya başlangıçtaki şiddete gerileme olarak tanımlanır) görülmüş olup, olayın ortaya çıkması ile düzelmesi arasında geçen ortanca süre 4 haftadır (aralık: 0,6 ilâ 22 hafta). Hastalar immünite ile ilişkili kolit, diyare ya da
gastrointestinal perforasyonu akla getiren gastrointestinal belirti ve semptomlar açısından gözlenmelidir. Klinik durum diyare, bağırsak hareketlerinde artış, karın ağrısı veya ateşli ya da ateşsiz hematoşezi içerebilir. Klinik çalışmalarda immünite ile ilişkili kolit ülserasyon ile birlikte veya ülserasyon olmadan mukoza enflamasyonu ve lenfositik ve nötrofilik infiltrasyon ile ilişkilendirilmiştir. Pazarlama sonrası, kortikosteroidlere dirençli immünite ile ilişkili kolit hastalarında sitomegalovirüs (CMV) enfeksiyonu/reaktivasyonu olguları bildirilmiştir. Diyarenin ya da kolitin ortaya çıkması durumunda enfeksiyöz ya da farklı etiyolojilerinin dışlanması amacıyla dışkıda enfeksiyon araştırılmalıdır.
Diyare ile kolitin yönetim önerileri semptomların şiddetine göre belirlenir (NCI-CTCAE v4'e göre şiddet derecelendirme sınıflandırması). Hafif ilâ orta şiddette (Derece 1 ya da 2) diyaresi (günde 6 defaya kadar dışkılama) olan veya hafif ila orta şiddette kolitten şüphelenilen (ör, karın ağrısı veya dışkıda kan) hastalar YERVOY'a devam edebilirler. Semptomatik tedavi (ör, loperamid, sıvı replasmanı) ve yakın gözlem önerilir. Eğer hafif ilâ orta şiddetteki semptomlar tekrarlar veya 5-7 gün sürerse planlanan YERVOY dozuna ara verilmelidir ve kortikosteroid tedavisine (ör. günde bir defa 1 mg/kg oral prednison ya da eşdeğeri) başlanmalıdır. Derece 0-1 veya başlangıç düzeyine geri dönerse, YERVOY'a kalınan yerden devam edilebilir (bkz. Bölüm 4.2).
Ciddi (Derece 3 veya 4) diyare ya da kolitin geliştiği hastalarda YERVOY tamamen kesilmelidir (bkz. Bölüm 4.2) ve sistemik yüksek dozda intravenöz kortikosteroid tedavisine derhal başlanmalıdır (Klinik çalışmalarda 2 mg/kg/gün metilprednisolon kullanılmıştır). Diyare ve diğer semptomlar kontrol edildikten sonra, klinik değerlendirme doğrultusunda kortikosteroid yavaş yavaş azaltılmalıdır. Klinik çalışmalarda hızla azaltınca (<1 aylık sürelerde) bazı hastalarda diyare veya kolit nüksetmiştir. Hastalarda gastrointestinal perforasyon ya da peritonit belirtileri değerlendirilmelidir.
Klinik çalışmalarda elde edilen kortikosteroid-refrakter diyare ya da kolit tedavisi deneyimi sınırlıdır. Diğer nedenlerin dışarıda bırakılması durumunda (biyopside viral PCR ve diğer viral, bakteriyel ve parazitik etiyoloji ile değerlendirilen Sitomegalovirüs (CMV) enfeksiyonu/reaktivasyonu dahil) kortikosteroide dirençli immünite ile ilişkili kolitte kortikosteroid rejimine alternatif bir immünosüpresif ajan eklenmesi düşünülmelidir. Klinik çalışmalarda kontrendike olmadığı sürece 5 mg/kg'lık tek bir infliksimab dozu eklenmiştir. Gastrointestinal perforasyondan veya sepsisten şüpheleniliyorsa infliksimab kullanılmamalıdır (İnfliksimab Kısa Ürün Bilgisi'ne bakınız).
İmmünite ile ilişkili kolit
Nivolumab ile kombinasyon halinde YERVOY
Nivolumab ile kombinasyon halinde YERVOY ile şiddetli diyare ya da kolit gözlenmiştir (bkz. Bölüm 4.8). Hastalar diyare ya da karın ağrısı ve dışkıda mukus veya kan gibi ilave kolit semptomları için izlenmelidir. Enfeksiyöz ve hastalıkla ilişkili etiyolojiler dışlanmalıdır.
Derece 4 diyare ya da kolit için nivolumab ile kombinasyon halinde YERVOY kalıcı olarak kesilmeli ve 1 ila 2 mg/kg/gün metilprednizolon eşdeğer dozda kortikosteroid başlanmalıdır.
Nivolumab ile kombinasyon halinde YERVOY ile gözlenen Derece 3 diyare veya kolit, tedavinin kalıcı olarak kesilmesini ve 1 ila 2 mg/kg/gün metilprednizolon eşdeğer dozda kortikosteroidlerin başlatılmasını gerektirir.
Derece 2 diyare ya da kolit için nivolumab ile kombinasyon halinde YERVOY'a ara verilmelidir. Dirençli diyare veya kolit için, 0,5 ila 1 mg/kg/gün metilprednizolon eşdeğer dozda kortikosteroid ile yönetilmelidir. İyileşmeden sonra, kortikosteroid tedavisinin kademeli olarak kesilmesini takiben gerekirse nivolumab ile kombinasyon halinde YERVOY tedavisi yeniden başlatılabilir.
Kortikosteroid başlanmasına rağmen kötüleşme olursa veya iyileşme görülmezse kortikosteroid dozu 1 ila 2 mg/kg/gün metilprednizolon eşdeğerine yükseltilmeli ve nivolumab ile kombinasyon halinde YERVOY kalıcı olarak kesilmelidir.
İmmünite ile ilişkili pnömonit
Nivolumab ile kombinasyon halinde YERVOY
Nivolumab ile kombinasyon halinde YERVOY sırasında şiddetli pnömonit veya ölümcül vakalar dahil olmak üzere interstisyel akciğer hastalığı gözlenmiştir (bkz. Bölüm 4.8). Hastalar radyografik değişiklikler (ör., fokal buzlu cam opasiteleri ve yama tarzında filtratlar), dispne ve hipoksi gibi pnömonit işaretleri ve semptomları açısından izlenmelidir. Enfeksiyöz ve hastalıkla ilişkili etiyolojiler dışlanmalıdır.
Derece 3 veya 4 pnömonit için nivolumab ile kombinasyon halinde YERVOY kalıcı olarak kesilmeli ve 2 ila 4 mg/kg/gün metilprednizolon eşdeğer dozda kortikosteroide başlanmalıdır.
Derece 2 (semptomatik) pnömonit için nivolumab ile kombinasyon halinde YERVOY'a ara verilmeli ve 1 mg/kg/gün metilprednizolon eşdeğeri kortikosteroide başlanmalıdır. İyileşmeden sonra, kortikosteroidin kademeli olarak kesilmesini takiben YERVOY ile kombinasyon halinde nivolumab yeniden başlatılabilir. Kortikosteroide başlanmasına rağmen kötüleşme olursa veya iyileşme görülmezse kortikosteroid dozu 2 ila 4 mg/kg/gün metilprednizolon eşdeğerine yükseltilmeli ve nivolumab ile kombinasyon halinde YERVOY kalıcı olarak kesilmelidir.
İmmünite ile ilişkili hepatotoksisite
YERVOY monoterapisi
YERVOY ciddi immünite ile ilişkili hepatotoksisite ile ilişkilendirilmiştir. Klinik çalışmalarda ölümcül hepatik yetmezlik rapor edilmiştir (bkz. Bölüm 4.8).
MDX010-20'de 3 mg/kg YERVOY monoterapisi alan hastalarda orta ilâ ciddi şiddette ya da fatal (Derece 2-5) İmmünite ile ilişkili hepatotoksisite, tedaviye başlandıktan sonra 3 ilâ 9 hafta içinde ortaya çıkmıştır. Protokolde belirtilen yönetim kılavuzları ile, iyileşme süresi 0,7 ilâ 2 hafta arasında değişmiştir.
Erken laboratuvar değişiklikleri immünite ile ilişkili hepatitin göstergesi olabileceği için her YERVOY dozundan önce hepatik transaminaz ve bilirubin değerlendirilmelidir (bkz. Bölüm 4.2). Klinik semptom görülmeyen durumlarda KCFT yükselmeleri olabilir. Enfeksiyonlar, tümör progresyonu veya birlikte kullanılan ilaçlar dahil diğer hepatik yaralanma nedenlerini bertaraf etmek için AST ve ALT ya da total bilirubin artışları değerlendirilip düzelene kadar gözlemlenmelidir. İmmünite ile ilişkili hepatotoksisitesi olan hastaların karaciğer biyopsilerinde akut enflamasyon belirtilerine rastlanmıştır (nötrofiller, lenfositler ve makrofajlar).
Derece 2 transaminaz ya da total bilirubin yükselmesi olan hastalarda planlanan YERVOY dozuna ara verilmeli ve KCFT düzelene kadar gözlenmelidir. İyileşme olduktan sonra YERVOY'a devam edilebilir (bkz. Bölüm 4.2).
Derece 3 veya 4 transaminaz ya da total bilirubin yükselmesi görülen hastaların tedavileri tamamen kesilmelidir (bkz. Bölüm 4.2); bu hastalara sistemik yüksek doz intravenöz kortikosteroid tedavisine (ör. günde 2 mg/kg metilprednisolon ya da eşdeğeri) derhal başlanmalıdır. Bu hastalarda KCFT, normalleşene kadar gözlemlenmelidir. Semptomlar düzelip KCFT'de sürekli gelişme gözlenince veya KCFT başlangıç seviyesine dönünce klinik değerlendirmeye göre kortikosteroid yavaş yavaş
azaltılmaya başlanmalıdır. Azaltma en az 1 ay sürmelidir. Azaltma dönemindeki KCFT yükselmeleri kortikosteroid dozu arttırılıp azaltma yavaşlatılarak tedavi edilebilir.
KCFT yükselmeleri ciddi ve kortikosteroid tedavisine refrakter olan hastalarda kortikosteroid rejimine alternatif olarak bir immünosüpresif ajan ilavesi düşünülebilir. Klinik çalışmalarda, kortikosteroid tedavisine yanıt vermeyen veya kortikosteroid dozunun azaltıldığı dönemde kortikosteroid dozu arttırılarak düşürülemeyen KCFT yükselmeleri olan hastalarda mikofenolat mofetil kullanılmıştır (mikofenolat mofetilin Kısa Ürün Bilgisi'ne bakınız).
Nivolumab ile kombinasyon halinde YERVOY
Nivolumab ve YERVOY kombinasyonu ile ciddi hepatit gözlenmiştir (bkz. Bölüm 4.8). Hastalar transaminaz ve total bilirubin seviyelerinde yükselmeler gibi hepatit belirti ve semptomları açısından izlenmelidir. Enfeksiyöz ve hastalıkla ilgili etiyolojiler dışlanmalıdır.
Derece 3 ve 4 transaminaz ya da total bilirubin yükselmeleri için nivolumab ile YERVOY kombinasyonu kalıcı olarak kesilmeli, 1-2 mg/kg/gün metilprednizolon eşdeğer dozunda kortikosteroid başlanmalıdır.
Derece 2 transaminaz ya da total bilirubin yükselmeleri için nivolumab ile YERVOY kombinasyonuna ara verilmelidir. Laboratuvar değerlerinde inatçı yükselmeler 0,5-1 mg/kg/gün metilprednizolon eşdeğer dozunda kortikosteroidlerle yönetilmelidir. İyileşme sağlandığında kortikosteroidler azaltılarak kesildikten sonra gerekiyorsa nivolumab ile YERVOY kombinasyonu yeniden başlanabilir. Kortikosteroidlerin başlanmasına rağmen kötüleşme olursa ya da iyileşme olmazsa kortikosteroid dozu 1-2 mg/kg/gün metilprednizolon eşdeğer dozuna çıkartılmalı ve nivolumab ile YERVOY kombinasyonu kalıcı olarak kesilmelidir.
İmmünite ile ilişkili advers deri reaksiyonları
Önceki immün uyarıcı kanser tedavisi sırasında ağır ya da yaşamı tehdit eden advers deri reaksiyonları öyküsü olan hastalarda YERVOY veya nivolumab ile kombinasyon halinde YERVOY kullanımı düşünüldüğünde dikkatli olunmalıdır.
YERVOY monoterapisi
YERVOY immünite ile ilişkili olabilecek ciddi advers deri reaksiyonu ile ilişkilendirilmiştir. Bazılarında ölümcül sonuçlar görülen ender toksik epidermal nekroliz (TEN) vakaları (Stevens- Johnson Sendromu dahil) gözlenmiştir, Klinik çalışmalarda ve pazarlama sonrası kullanımda Eozinofili ve Sistemik Semptomların Eşlik Ettiği İlaç Reaksiyonları (DRESS) rapor edilmiştir (bkz. Bölüm 4.8).
DRESS şu özelliklerden bir veya daha fazlasıyla ilişkili eozinofilinin eşlik ettiği döküntüler olarak ortaya çıkar: ateş, lenfadenopati, yüzde ödem ve iç organ tutulumu (hepatik, renal, pulmoner). DRESS, tıbbi ürüne maruziyet ile hastalığın başlangıcı arasında uzun latent bir dönemle (iki ila sekiz hafta) karakterize olabilir.
YERVOY'un indüklediği kızarıklık ve kaşıntı çoğunlukla hafif veya orta şiddetteydi (Derece 1 ya da 2) ve semptomatik tedaviye cevap vermekteydi. MDX010-20'de 3 mg/kg YERVOY monoterapisi alan hastalarda orta ilâ ciddi şiddette veya fatal (Derece 2-5) advers deri reaksiyonlarının ortanca ortaya çıkış süresi tedaviye başlandıktan sonra 3 hafta (aralık: 0,9-16 hafta) olmuştur. Protokolde belirtilen yönetim rehberinde çoğu vaka (%87) düzelmiş, olayın ortaya çıkması ile düzelmesi arasında ortanca 5 hafta geçmiştir (aralık: 0,6 – 29 hafta).
YERVOY'un indüklediği kızarıklık ve kaşıntı şiddetine göre yönetilmelidir. Hafif ilâ orta şiddette (Derece 1 veya 2) kızarıklık görülen hastalar YERVOY'a devam edip semptomatik tedavi görebilirler
(ör. antihistaminikler). 1 ilâ 2 hafta süren ve lokal kortikosteroidler ile iyileşmeyen hafif ilâ orta şiddette kızarıklık veya kaşıntı vakalarında oral kortikosteroid tedavisi başlatılmalıdır (ör. günde bir kere 1 mg/kg prednison ya da eşdeğeri).
Ciddi (Derece 3) kızarıklık görülen hastalarda planlanan YERVOY dozuna ara verilmelidir. Eğer başlangıçtaki semptomlar hafif dereceye (Derece 1) gerilerse ya da ortadan tamamen kalkarsa YERVOY tedavisine devam edilebilir (bkz. Bölüm 4.2).
Çok ciddi (Derece 4) kızarıklık veya ciddi (Derece 3) kaşıntı görülen hastalarda YERVOY tamamen kesilmeli (bkz. Bölüm 4.2) ve derhal yüksek dozda sistemik intravenöz kortikosteroid tedavisi (ör. 2 mg/kg/gün dozunda metilprednisolon) başlatılmalıdır. Kızarıklık ya da kaşıntı kontrol altına alındıktan sonra, klinik değerlendirmeye göre kortikosteroidinin azaltılmasına başlanmalıdır. Azaltma süresi en az 1 ay olmalıdır.
Nivolumab ile kombinasyon halinde YERVOY
Nivolumab ile kombinasyon halinde YERVOY'da şiddetli döküntü gözlenmiştir (bkz. Bölüm 4.8). Nivolumab ile kombinasyon halinde YERVOY tedavisinde Derece 3 döküntü görülürse tedaviye ara verilmeli, Derece 4 döküntüde ise kesilmelidir. Şiddetli döküntü için, 1 ila 2 mg/kg/gün metilprednizolon eşdeğer dozda yüksek doz kortikosteroid ile yönetilmelidir.
Bazıları fatal sonuç gösteren seyrek SJS ve TEN olguları gözlenmiştir. SJS veya TEN belirtileri veya bulguları gelişirse, nivolumab ile kombinasyon halinde YERVOY tedavisi kesilmelidir ve hasta değerlendirme ve tedavi için uzman bir üniteye yönlendirilmelidir. Hastada nivolumab ile kombinasyon halinde YERVOY kullanımına bağlı SJS veya TEN gelişmişse, tedavinin kalıcı olarak kesilmesi önerilir (bkz. Bölüm 4.2).
İmmünite ile ilişkili nörolojik reaksiyonlar
YERVOY monoterapisi
YERVOY İmmünite ile ilişkili ciddi nörolojik advers reaksiyonlar ile ilişkilendirilmiştir. Klinik çalışmalarda fatal Guillain-Barré sendromu rapor edilmiştir. Myastenia gravis benzeri semptomlar da bildirilmiştir (bkz. Bölüm 4.8). Hastalar kas zayıflığından şikayet edebilir. Duyusal nöropati de olabilir.
4 günden fazla süren açıklanamayan motor nöropati, kas zayıflığı ya da duyusal nöropati değerlendirilmeli ve hastalığın progresyonu, enfeksiyonlar, metabolik sendromlar ve eşzamanlı ilaç tedavileri gibi enflamatuvar olmayan nedenler bertaraf edilmelidir. Muhtemelen YERVOY'a bağlı orta şiddette (Derece 2) nöropatisi olan hastalarda (duyusal ya da duyusal olmayan motor) planlanan doza ara verilmelidir. Eğer nörolojik semptomlar başlangıç seviyesine geri gelirse, hasta YERVOY'a devam edebilir (bkz. Bölüm 4.2).
YERVOY'a bağlı olduğundan şüphelenilen ciddi (Derece 3 ya da 4) duyusal nöropatisi olan hastalarda YERVOY kalıcı olarak kesilmelidir (bkz. Bölüm 4.2). Hastalar kurumun duyusal nöropatiye yönelik yönetim rehberleri doğrultusunda tedavi edilmeli ve derhal intravenöz kortikosteroidlere (ör. 2 mg/kg/gün metilprednisolon) başlanmalıdır.
Progresif motor nöropati bulguları immünite ile ilişkili olarak değerlendirilmeli ve buna göre yönetilmelidir. Nedeni ne olursa olsun şiddetli (Derece 3 ya da 4) motor nöropati geliştiren hastalarda YERVOY tamamen kesilmelidir (bkz. Bölüm 4.2).
İmmünite ile ilişkili nefrit ve renal fonksiyon bozukluğu
Nivolumab ile kombinasyon halinde YERVOY
Nivolumab ile kombinasyon halinde YERVOY ile şiddetli nefrit veya böbrek fonksiyon bozukluğu gözlenmiştir (bkz. Bölüm 4.8). Hastalar, nefrit ve böbrek fonksiyon bozukluğu belirti ve semptomları için izlenmelidir. Hastaların çoğunda herhangi bir semptom olmadan serum kreatininde artış gözlenmiştir. Hastalıkla ilişkili etiyolojiler dışlanmalıdır.
Derece 4 serum kreatinin artışları için nivolumab ile kombinasyon halinde YERVOY kalıcı olarak kesilmeli ve 1 ila 2 mg/kg/gün metilprednizolon eşdeğer dozunda kortikosteroidlere başlanmalıdır.
Derece 2 veya 3 serum kreatinin artışı için, nivolumab ile kombinasyon halinde YERVOY'a ara verilmeli ve 0,5 ila 1 mg/kg/gün metilprednizolon eşdeğer dozda kortikosteroidlere başlanmalıdır. İyileşmeden sonra, kortikosteroid dozunun kademeli olarak kesilmesini takiben nivolumab ile kombinasyon halinde YERVOY yeniden başlatılabilir. Kortikosteroide başlanmasına rağmen kötüleşme olursa veya iyileşme görülmezse kortikosteroid dozu 1 ila 2 mg/kg/gün metilprednizolon eşdeğerine yükseltilmeli ve nivolumab ile kombinasyon halinde YERVOY kalıcı olarak kesilmelidir.
İmmünite ile ilişkili endokrinopati
YERVOY monoterapisi
YERVOY endokrin sistem organlarında enflamasyona neden olabilir; hipofizit, hipopituitarizm, adrenal yetmezlik, hipotiroidizm, Tip 1 diyabetis mellitus ve diyabetik ketoasidoz (bkz. Bölüm 4.2 ve 4.8) görülebilir ve hastalar beyin metastazı ya da altta yatan hastalık gibi başka nedenlere benzeyen spesifik olmayan semptomlar gösterebilirler. En sık görülen klinik tablo baş ağrısı ve yorgunluktur. Semptomlar arasında görüş alanı bozuklukları, davranış değişiklikleri, elektrolit bozuklukları ve hipotansiyon da olabilir. Adrenal krizin hastanın semptomlarından biri olup olmadığı anlaşılmalıdır. YERVOY ile ilişkilendirilen endokrinopati ile klinik deneyim sınırlıdır.
MDX010-20'de 3 mg/kg dozunda YERVOY monoterapisi uygulanan hastalar için orta ilâ çok şiddetli (Derece 2-4) immünite ile ilişkili endokrinopatinin görülmesi tedaviye başlandıktan 7 ilâ yaklaşık 20 hafta sonrasında olmuştur. Klinik çalışmalarda gözlenen immünite ile ilişkili endokrinopati genellikle immünosüpresif ilaç tedavisi ve hormon replasman tedavisi ile kontrol edilmiştir.
Eğer, ciddi dehidratasyon, hipotansiyon veya şok gibi adrenal kriz bulguları varsa derhal mineralokortikoid aktivitesi olan intravenöz kortikosteroidlerin uygulanması önerilir ve hasta sepsis veya enfeksiyon açısından değerlendirilmelidir. Eğer adrenal yetmezlik bulguları varsa fakat hasta adrenal krizde değilse laboratuvar ve görüntüleme değerlendirmeleri dahil daha fazla araştırma yapmak gerekir. Kortikosteroid tedavisine başlamadan önce endokrin fonksiyonu değerlendirmek için laboratuvar sonuçlarına bakılabilir. Eğer pituiter görüntüleme ya da endokrin fonksiyon laboratuvar testleri anormalse, etkilenen bezin enflamasyonunu tedavi etmek amacıyla kısa bir süre için yüksek dozda kortikosteroid tedavisi (ör. 6 saatte bir 4 mg deksametason veya eşdeğeri) uygulanması ve planlanan YERVOY dozuna ara verilmesi önerilir (bkz. Bölüm 4.2). Kortikosteroid tedavisinin bezin fonksiyon bozukluğunu düzeltip düzeltmediği halen bilinmemektedir. Uygun hormon replasmanına da başlanmalıdır. Uzun süreli hormon replasman tedavisi gerekebilir.
Semptomatik diyabet için, YERVOY verilmemeli ve gerektiğinde insülin replasmanı başlatılmalıdır. Uygun insülin replasmanının kullanıldığından emin olmak için kan şekerinin izlenmesi devam etmelidir. Hayatı tehdit eden diyabet için YERVOY kalıcı olarak kesilmelidir.
Semptomlar veya laboratuvar anomalileri kontrol altına alınıp hastanın genel olarak iyiye gittiği kesinleşince, YERVOY tedavisi devam edebilir ve klinik değerlendirmeye göre kortikosteroid dozunun yavaş yavaş düşürülmesine başlanabilir. Doz düşürme, en az 1 aylık periyotlarla olmalıdır.
Nivolumab ile kombinasyon halinde YERVOY
Nivolumab ile kombinasyon halinde YERVOY tedavisi ile hipotiroidizm, hipertiroidizm, adrenal yetmezlik (sekonder adrenokortikal yetmezlik dahil), hipofizit (hipopitüitarizm dahil), diabetes mellitus ve diyabetik ketoasidoz dahil şiddetli endokrinopatiler gözlenmiştir (bkz. Bölüm 4.8).
Hastalar endokrinopatilerin klinik belirti ve semptomları, hiperglisemi ve tiroid fonksiyonundaki değişiklikler açısından dikkatli şekilde izlenmelidir (tedavinin başında, tedavi sırasında periyodik olarak ve klinik değerlendirmeye dayanarak gerekli olduğunda). Hastalarda yorgunluk, baş ağrısı, mental durum değişiklikleri, karın ağrısı, olağandışı bağırsak alışkanlıkları ve hipotansiyon veya beyin metastazları ya da altta yatan hastalık gibi diğer nedenlere benzeyen, spesifik olmayan semptomlar görülebilir. Alternatif etiyoloji belirlenene dek, endokrinopati belirti ve semptomlarının immünite ile ilişkili olduğu kabul edilmelidir.
Semptomatik hipotiroidizm için nivolumab ile kombinasyon halinde YERVOY'a ara verilmeli ve gerektiği şekilde tiroid hormon replasmanına başlanmalıdır. Semptomatik hipertiroidizm için nivolumab ile kombinasyon halinde YERVOY'a ara verilmeli ve gerektiği şekilde antitiroid ilaç tedavisine başlanmalıdır. Tiroidin akut enflamasyonundan şüpheleniliyorsa, 1 ila 2 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroidlere başlanmalıdır. İyileşmeden sonra, kortikosteroid dozunun kademeli olarak kesilmesini takiben gerekirse nivolumab ile kombinasyon halinde YERVOY'a yeniden başlatılabilir. Uygun hormon replasmanının kullanıldığından emin olmak için tiroid fonksiyonu sürekli şekilde izlenmelidir. Yaşamı tehdit eden hipertiroidizm veya hipotiroidizm durumunda nivolumab ile kombinasyon halinde YERVOY kalıcı olarak kesilmelidir.
Semptomatik Derece 2 adrenal yetmezlik için nivolumab ile kombinasyon halinde YERVOY'a ara verilmeli ve gerektiği şekilde fizyolojik kortikosteroid replasmanına başlanmalıdır. Ciddi (Derece 3) veya yaşamı tehdit eden (Derece 4) adrenal yetmezlik durumunda nivolumab ile kombinasyon halinde YERVOY kalıcı olarak kesilmelidir. Uygun kortikosteroid replasmanının kullanıldığından emin olmak için adrenal fonksiyon ve hormon düzeyleri sürekli şekilde izlenmelidir.
Semptomatik Derece 2 veya 3 hipofizit için nivolumab ile kombinasyon halinde YERVOY'a ara verilmeli ve gerektiği şekilde hormon replasmanına başlanmalıdır. Akut hipofiz bezi enflamasyonundan şüpheleniliyorsa, 1 ila 2 mg/kg/gün metilprednizolon eşdeğeri dozda kortikosteroidlere başlanmalıdır. İyileşmeden sonra, kortikosteroid dozunun kademeli olarak kesilmesini takiben gerekirse nivolumab ile kombinasyon halinde YERVOY yeniden başlatılabilir. Yaşamı tehdit eden (Derece 4) hipofizit durumunda nivolumab ile kombinasyon YERVOY kalıcı olarak kesilmelidir. Uygun hormon replasmanının kullanıldığından emin olmak için hipofiz fonksiyonu ve hormon düzeyleri sürekli şekilde izlenmelidir.
Semptomatik diyabet için nivolumab ile kombinasyon halinde YERVOY'a ara verilmeli ve gerektiği şekilde insülin replasmanına başlanmalıdır. Uygun insülin replasmanının kullanıldığından emin olmak için kan şekeri sürekli şekilde izlenmelidir. Yaşamı tehdit eden diyabet durumunda nivolumab ile kombinasyon halinde YERVOY kalıcı olarak kesilmelidir.
İnfüzyon reaksiyonu
Monoterapi olarak ya da nivolumab ile kombinasyon halinde YERVOY
YERVOY ya da nivolumab ile kombinasyon halinde YERVOY ile yapılan klinik çalışmalarda ciddi infüzyon reaksiyonları bildirilmiştir (bkz. Bölüm 4.8). Ciddi ya da yaşamı tehdit eden infüzyon
reaksiyonu durumunda YERVOY ya da nivolumab ile kombinasyon halinde YERVOY infüzyonu kesilmeli ve uygun tıbbi tedavi uygulanmalıdır. Hafif ya da orta şiddetteki infüzyon reaksiyonları gelişen hastalara yakın izlem ve infüzyon reaksiyonları profilaksisi için yerel tedavi rehberlerine göre verilen premedikasyon ile YERVOY ya da nivolumab ile kombinasyon halinde YERVOY verilebilir. İmmünite ile ilişkili diğer advers reaksiyonlar
YERVOY monoterapisi
MDX010-20'de 3 mg/kg YERVOY monoterapisi alan hastalarda immünite ile ilişkiliolduğundan şüphe edilen aşağıdaki advers reaksiyonlar da rapor edilmiştir: uveit, eozinofili, lipaz yükselmesi ve glomerulonefrit. MDX010-20'de bundan başka 3 mg/kg YERVOY + gp100 peptid aşısı ile tedavi edilen hastalarda iritis, hemolitik anemi, amilaz yükselmeleri, çoklu organ yetmezliği ve pnömonit de bildirilmiştir. Pazarlama sonrasında Vogt-Koyanagi-Harada sendromu vakaları ve seröz retina dekolmanı ve infektif olmayan sistit vakaları bildirilmiştir (bkz. Bölüm 4.8).
Ciddi (Derece 3 ya da 4) seyretmeleri halinde, bu reaksiyonlar derhal yüksek dozda sistemik kortikosteroid tedavisinin başlanmasını ve YERVOY'un kesilmesini gerektirebilir (bkz. Bölüm 4.2). YERVOY ilişkili uveit, iritis, seröz retina dekolmanı veya episklerit için topikal kortikosteroid göz damlalarının tıbben endike olduğu varsayılabilir. YERVOY ilişkili oküler enflamasyonları olan hastalarda geçici görme kaybı bildirilmiştir.
Pazarlama sonrası YERVOY ile tedavi edilen hastalarda solid organ nakli reddi bildirilmiştir. YERVOY tedavisi solid organ nakli alıcılarının ret riskini arttırabilir. Bu hastalarda YERVOY'la uygulanan tedavinin olası organ transplantasyonu sonrasında organ reddi riski karşısındaki faydası değerlendirilmelidir.
YERVOY monoterapisi ya da PD-1 veya PD-L1 inhibitörü ile kombinasyon halinde YERVOY YERVOY monoterapisi ve PD-1 veya PD-L1 inhibitörü (nivolumab dahil) ile kombinasyon halinde kullanılan YERVOY'la birlikte hemofagositik lenfohistiyositoz (HLH) gözlenmiştir. YERVOY, monoterapi olarak veya PD-1 veya PD-L1 inhibitörü ile kombinasyon halinde uygulanırken dikkatli olunmalıdır. HLH doğrulandığı takdirde YERVOY veya PD-1 veya PD-L1 inhibitörü ile kombinasyon halinde YERVOY uygulaması kesilmelidir ve HLH tedavisi başlatılmalıdır.
Nivolumab ile kombinasyon halinde YERVOY
Aşağıdaki immünite ile ilişkili advers reaksiyonlar çeşitli dozlarda ve tümör tiplerinde yapılan klinik çalışmalarda nivolumab ile kombinasyon halinde YERVOY ile tedavi edilen hastaların %1'inden azında bildirilmiştir: pankreatit, üveit, demiyelinizasyon, otoimmün nöropati (fasiyal ve abdusens sinir parezisi dahil), Guillain-Barré sendromu, myastenia gravis, miyastenik sendrom, aseptik menenjit, ensefalit, gastrit, sarkoidoz, duodenit, miyozit, miyokardit ve rabdomiyoliz. Pazarlama sonrasında Vogt-Koyanagi-Harada sendromu ve seröz retina dekolmanı vakaları bildirilmiştir (bkz. Bölüm 4.8). YERVOY ilişkili oküler enflamasyonları olan hastalarda geçici görme kaybı bildirilmiştir.
Şüpheli immünite ile ilişkili advers reaksiyonlar için etiyolojiyi doğrulamak veya diğer nedenleri dışlamak için uygun değerlendirmeler yapılmalıdır. Advers reaksiyonun şiddetine dayanarak nivolumab ile kombinasyon halinde YERVOY'a ara verilmeli ve kortikosteroidler uygulanmalıdır. İyileşmeden sonra, kortikosteroid dozunun kademeli olarak kesilmesini takiben nivolumab ile kombinasyon halinde YERVOY yeniden başlatılabilir. Herhangi bir şiddetli immünite ile ilişkili advers reaksiyonun tekrarlaması veya yaşamı tehdit eden herhangi bir immünite ile ilişkili reaksiyon görülmesi durumunda nivolumab ile kombinasyon halinde YERVOY kalıcı olarak kesilmelidir.
Nivolumab ile kombinasyon halinde YERVOY tedavisi ile bazıları ölümcül olan nadir miyotoksisite (miyozit, miyokardit ve rabdomiyoliz) vakaları bildirilmiştir. Hastada miyotoksisite belirtileri ve
semptomları geliştiği takdirde yakın takip uygulanmalıdır ve gecikmeden değerlendirme ve tedavi uygulanması için bir uzmana sevk edilmelidir. Miyotoksisitenin şiddetine bağlı olarak, nivolumab ile kombinasyon halinde YERVOY'a ara verilmeli veya kesilmelidir (bkz. Bölüm 4.2) ve uygun tedavi başlatılmalıdır.
Miyokardit tanısı için yüksek şüphe indeksi gereklidir. Kardiyak ya da kardiyo-pulmoner semptomları olan hastalar potansiyel miyokardit açısından değerlendirilmelidir. Miyokardit şüphesi varsa, derhal yüksek dozda steroidlere (1 ila 2 mg/kg/gün prednizon veya 1 ila 2 mg/kg/gün metilprednizolon) başlanmalı ve mevcut klinik rehberlere göre teşhis çalışması ile hızlı kardiyoloji konsültasyonu başlatılmalıdır. Miyokardit tanısı konduktan sonra nivolumab ile kombinasyon halindeki YERVOY'a ara verilmeli ya da kalıcı olarak kesilmelidir (bkz. Bölüm 4.2).
Hastalığa özgü önlemler
Melanom
Oküler melanom, primer Merkezi Sinir Sistemi (MSS) melanomu ve aktif beyin metastazları görülen hastalar MDX010-20 çalışmasına dahil edilmemiştir (bkz. Bölüm 5.1).
Oküler melanomu olan hastalar CA184-169 klinik çalışmasına dahil edilmemiştir. Bununla birlikte, beyin metastazları bulunan hastalar, metastatik beyin lezyonları ile ilişkili nörolojik semptomları yoksa ve YERVOY tedavisine başlanmasından önceki 10 gün içerisinde sistemik kortikosteroid tedavisine gerek duymamış ya da bu tedaviyi görmemişlerse bu çalışmaya dahil edilmişlerdir (bkz. Bölüm 5.1).
Oküler melanomu, aktif beyin metastazları olan ve daha önce YERVOY tedavisi görmüş olan hastalar pediyatrik çalışma CA184070'a dahil edilmemiştir (bkz. Bölüm 5.1).
Oküler melanomu, aktif beyin metastazları olan ve daha önce CTLA-4, PD-1, PD-L1 ya da CD137 hedefli ajanlarla tedavi görmüş olan hastalar pediyatrik çalışma CA184178'e dahil edilmemiştir (bkz. Bölüm 5.1).
Başlangıç performans skoru 2 ve 2'den büyük olan, aktif beyin metastazları veya otoimmün hastalığı bulunan hastalar ile çalışmaya giriş öncesinde sistemik immünosüpresanlar almakta olan hastalar nivolumab ile kombinasyon halinde YERVOY'un klinik çalışmalarından çıkarılmıştır. Oküler/uveal melanomu bulunan hastalar klinik melanom çalışmalarının dışında tutulmuştur. Veri bulunmadığında, nivolumab bu popülasyonlarda potansiyel fayda/risk değerlendirmesi bireysel olarak yapıldıktan sonra dikkatli kullanılmalıdır.
Nivolumab monoterapisine kıyasla, YERVOY'un nivolumab ile kombinasyonu için PFS'de bir artış, yalnızca tümör PD-L1 ekspresyonu düşük olan hastalarda tespit edilmiştir. Tümör PD-L1 ekspresyonu yüksek olan hastalarda (PD-L1 ≥%1) YERVOY ile nivolumab ve nivolumab monoterapisi arasında OS'deki iyileşme benzerdi. Kombinasyon tedavisine başlamadan önce doktorlara her bir hastayı ve tümör karakteristiklerini, gözlemlenen faydaları ve nivolumab monoterapisine kıyasla kombinasyonun toksisitesini dikkate alarak dikkatle değerlendirmeleri önerilir (bkz. Bölüm 4.8 ve 5.1).
Hastalıkları hızla ilerleyen melanom hastalarında nivolumab ile kombinasyon halinde YERVOY'un kullanımı.
Doktorlar, hastalığı hızla ilerleyen hastalarda tedaviye başlamadan önce nivolumab ile kombinasyon halindeki YERVOY etkisinin geciken başlangıcını değerlendirmelidir (bkz. Bölüm 5.1).
Renal Hücreli Karsinom
Nivolumab ile kombinasyon halinde YERVOY çalışmalarına eş zamanlı beyin metastazı ya da beyin metastazı öyküsü olan, aktif otoimmün hastalığı ya da sistemik immünosüpresyon tedavisi gerektiren medikal durumu olan hastalar dahil edilmemiştir (bkz. Bölüm 4.5 ve 5.1). Verilerin olmadığı durumlarda nivolumab ile kombinasyon halinde YERVOY, bu popülasyonlarda her hasta için bireysel olarak potansiyel risk-yararın dikkatli değerlendirilmesinden sonra dikkatle kullanılmalıdır.
Küçük Hücreli Dışı Akciğer Kanseri
KHDAK'nin birinci basamak tedavisi
Aktif otoimmün hastalığı, semptomatik interstisyel akciğer hastalığı, sistemik immünosupresyon gerektiren tıbbi koşulları, aktif (tedavi edilmemiş) beyin metastazı olan, lokal ileri hastalık için daha önce sistemik tedavi görmüş veya duyarlı EGFR mutasyonları veya ALK translokasyonları olan hastalar, KHDAK'nin birinci basamak tedavisini araştıran kılavuz çalışmalara dahil edilmemiştir (bkz. Bölüm 4.5 ve 5.1). Yaşlı hastalarda (≥75 yaş) sınırlı veri mevcuttur (bkz. Bölüm 5.1). Bu hastalarda, nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab, bireysel bazda potansiyel fayda/risk dikkatli bir şekilde değerlendirildikten sonra dikkatle kullanılmalıdır.
Malign plevral mezotelyoma
Primitif peritoneal, perikardiyal, testis veya tunika vajinalis mezotelyoması, interstisyel akciğer hastalığı, aktif otoimmün hastalığı, sistemik immünosupresyon gerektiren tıbbi koşulları ve beyin metastazı olan hastalar (cerrahi olarak rezeke edilmedikçe veya stereotaksik radyoterapi ile tedavi edilmedikçe ve tedaviye dahil edilmeden önceki 3 ay içinde herhangi bir gelişme olmadıkça) MPM'nin birinci basamak tedavisini araştıran kılavuz çalışmalara dahil edilmemiştir (bkz. bölüm 4.5 ve 5.1). Veri bulunmadığından, nivolumab ile kombinasyon halinde ipilimumab bu popülasyonlarda kişi bazında potansiyel yarar/risk değerlendirmesi yapılmasının ardından dikkatli şekilde kullanılmalıdır.
Otoimmün hastalığı olan hastalar
Aktif otoimmün hastalığı ya da organ nakli greft devamlılığı için sistemik immünosüpresif tedaviye ihtiyacı olanlar dahil olmak üzere geçmişte otoimmün hastalığı olan hastalar (vitiligo ve hipotiroidizm gibi yeterli derecede kontrol altında tutulan endokrin yetersizlikler dışında), klinik çalışmalarda değerlendirilmemiştir. YERVOY immün yanıtı sağlayan (bkz. Bölüm 5.1) bir T-hücresi potansiyalize edicisidir ve immünosüpresif tedaviye müdahale edebilir; sonuçta altta yatan hastalık alevlenebilir ya da greftin reddedilmesi riski artabilir. Daha sonraki immün aktivasyonunun yaşamı tehdit etme potansiyelinin bulunduğu şiddetli aktif otoimmün hastalığı olan hastalarda YERVOY'dan kaçınılmalıdır. YERVOY otoimmün hastalık geçmişi olan diğer hastalarda potansiyel risk yarar profili bireysel olarak dikkatlice ele alındıktan sonra dikkatli kullanılmalıdır.
Kontrollü sodyum diyetinde olan hastalar
Bu tıbbi ürün, DSÖ'nün bir yetişkin için önerdiği günlük maksimum 2 g sodyum alımının sırasıyla
%1,15'ine ve %4,60'ına eşdeğer gelen her 10 mL'lik flakonda 23 mg sodyum ve her 40 mL'lik flakonda 92 mg sodyum ihtiva eder. Bu durum, kontrollü sodyum diyetinde olan hastalar için göz önünde bulundurulmalıdır.
Vemurafenib ile eşzamanlı uygulama
Bir Faz 1 çalışmada, YERVOY (3 mg/kg) ve vemurafenibin (960 mg BID veya 720 mg BID) eş zamanlı kullanımı ile asemptomatik Derece 3 transaminaz (ALT/AST> 5 × ÜNL) ve bilirubin (total bilirubin>3 × ÜNL) artışları bildirilmiştir. Bu ön verilere dayanarak, YERVOY ve vemurafenibin eş zamanlı kullanımı tavsiye edilmez.
Vemurafenib ile sıralı uygulama
Faz 2 çalışmasında, BRAF mutasyonu olan metastatik melanomlu hastalarda vemurafenib ile sıralı tedavi ve ardından 10 mg/kg YERVOY tedavisi, tek başına YERVOY ile karşılaştırıldığında Derece 3+ deri advers reaksiyonlarında daha yüksek insidans göstermiştir. Vemurafenib sonrasında YERVOY uygulandığında dikkatli olunmalıdır.
Pediyatrik popülasyon
YERVOY 18 yaşından küçük çocuklarda kullanılmamalıdır.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
YERVOY, sitokrom P450 enzimleri (CYP) veya ilaçları metabolize eden diğer enzimlerce metabolize edilmeyen bir insan monoklonal antikorudur.
Daha önce tedavi almamış ileri evre melanom hastalarında tek başına ve kemoterapi (dakarbazin ya da paklitaksel/karboplatin) ile kombinasyon halindeYERVOY uygulanan yetişkinlerde bir ilaç etkileşim çalışması yapılmış ve CYP izoenzimleri (özellikle CYP1A2, CYP2E1, CYP2C8 ve CYP3A4) ile etkileşimi değerlendirilmiştir. YERVOY ve paklitaksel/karboplatin, dakarbazin veya onun metaboliti, 5-aminoimidazol-4-karboksamid (AIC) arasında klinik olarak ilgili hiçbir farmakokinetik ilaç-ilaç etkileşimi gözlenmemiştir.
Diğer etkileşim formları
Kortikosteroidler
YERVOY'un farmakodinamik aktivitesi ve etkililiği ile olası etkileşimi nedeniyle, YERVOY'a başlamadan önce; başlangıçta sistemik kortikosteroidlerin kullanımından kaçınılmalıdır. Yine de immünite ile ilişkili advers reaksiyonların tedavi edilmesi için YERVOY'a başlandıktan sonra sistemik kortikosteroidler veya diğer immünosüpresanlar kullanılabilir. YERVOY tedavisine başlandıktan sonra sistemik kortikosteroidlerin kullanımının YERVOY'un etkililiğini bozmadığı görülmektedir.
Antikoagülanlar
Antikoagülanların kullanımının gastrointestinal hemoraji riskini artırdığı bilinmektedir. Gastrointestinal hemoraji, YERVOY ile görülebilir bir advers reaksiyon olduğundan (bkz. Bölüm 4.8) eşzamanlı antikoagülan tedavisine ihtiyaç duyan hastalar yakından izlenmelidir.
Özel popülasyonlara ilişkin ek bilgiler:
Yaşlılarda, böbrek ve karaciğer yetmezliği olanlarda hiçbir ilaç etkileşim çalışması yapılmamıştır.
Pediyatrik Popülasyon:
Pediyatrik hastalar için klinik veri bulunmamaktadır.
4.6. Gebelik ve laktasyon
Gebelik kategorisi: C
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon):
Çocuk doğurma potansiyeli bulunan kadınlarda etkili kontraseptif metotlar kullanılmalıdır.
Gebelik dönemi
YERVOY'un gebe kadınlarda kullanımına ilişkin veri mevcut değildir. Hayvan üreme çalışmaları üreme toksisitesinin bulunduğunu göstermiştir (bkz. Bölüm 5.3). İnsan IgG1, plasenta bariyerini geçmektedir. Tedavinin gelişmekte olan fetusa yönelik potansiyel riski bilinmemektedir. Klinik yararı potansiyel riskinden fazla olmadığı sürece, YERVOY'un gebelik döneminde veya etkili bir doğum kontrol yöntemi kullanmayan çocuk doğurma potansiyeline sahip kadınlarda kullanılması önerilmemektedir.
Laktasyon dönemi
Hamilelik sırasında tedavi gören cynomolgus maymunlarında YERVOY sütte çok düşük seviyelerde görülmüştür. YERVOY'un insanlarda anne sütüne geçip geçmediği bilinmemektedir. IgG'lerin anne sütüne geçişi genellikle sınırlıdır ve IgG'ler düşük bir oral biyoyararlanıma sahiptir. İnfantlarda sistemik anlamlı bir maruziyet beklenilmemektedir ve emzirilen yeni doğan/infant üzerinde herhangi bir etki meydana gelmesi beklenmemektedir. Ancak emzirilen infantlarda advers reaksiyon potansiyelinden dolayı, çocuk için emzirmenin yararı ve kadın için YERVOY tedavisinin yararı göz önünde bulundurularak emzirmeye devam edilip edilmemesi veya YERVOY tedavisinin kesilip kesilmemesi konusunda karar verilmelidir.
Üreme yeteneği/Fertilite
YERVOY'un fertilite üzerindeki etkisini değerlendiren çalışmalar yapılmamıştır. Bu durumda YERVOY'un erkek ve dişi fertilitesi üzerindeki etkisi bilinmemektedir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
YERVOY'un araç ve makine kullanımı üzerine etkisi düşüktür.
Yorgunluk gibi potansiyel advers reaksiyonlara yol açabilmesi nedeniyle (bkz. Bölüm 4.8) hastalara YERVOY'un kendilerini ters bir şekilde etkilemediğinden emin olana dek araç ve makine kullanmaları konusunda dikkatli olmaları önerilmelidir.
4.8. İstenmeyen etkiler
YERVOY monoterapisi (bkz. Bölüm 4.2)
Güvenlilik profili özeti
YERVOY farklı dozlarda ve tümör tiplerinde kullanımının değerlendirildiği bir klinik programda yaklaşık 10.000 hastaya uygulanmıştır. Aksi belirtilmediği sürece, aşağıda belirtilen veriler, klinik melanom çalışmalarında 3 mg/kg'da YERVOY maruziyetini yansıtmaktadır. Faz 3 çalışmasında (MDX010-20. bkz. Bölüm 5.1) hastaların aldığı ortanca doz sayısı 4'tür (aralık 1-4).
YERVOY en çok immün aktivitedeki artış veya aşırı immün aktivite sonucu ortaya çıkan advers reaksiyonlar ile ilişkilendirilmiştir. Ciddi reaksiyonlar dahil bunların çoğu uygun medikal tedaviye başlandıktan ya da YERVOY kesildikten sonra düzelmiştir (immünite ile ilişkili advers reaksiyonların yönetimi ile ilgili bilgiler Bölüm 4.4'te bulunmaktadır).
MDX010-20'de 3 mg/kg YERVOY monotereapisi alan hastalarda en sık bildirilen advers reaksiyonlar (hastaların ≥ %10'u) diyare, kızarıklık, kaşıntı, yorgunluk, bulantı, kusma, iştah azalması ve karın ağrısıdır. Çoğunluğu hafif ilâ orta şiddette seyretmiştir (Derece 1 veya 2). Hastaların %10'unda advers reaksiyonlar nedeni ile YERVOY tedavisi kesilmiştir.
4.9. Doz aşımı ve tedavisi
YERVOY'un tolere edilen maksimum dozu belirlenmemiştir. Klinik çalışmalarda hastalar bariz bir toksik etki görülmeden 20 mg/kg'a kadar dozlar almıştır.
Doz aşımı olursa, hastalar advers reaksiyon bulguları ya da semptomları açısından yakından gözlenmeli ve uygun semptomatik tedavi başlatılmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
İ
5.1. Farmakodinamik özellikler
i
Farmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar, ATC kodu: L01FX04.
Etki mekanizması
Sitotoksik T-lenfosit antijeni (CTLA-4) T-hücresi aktivasyonunun önemli bir regülatörüdür. YERVOY, CTLA-4 yolağıyla indüklenen T hücresi inhibe edici sinyalleri bloke eden bir CTLA-4 immün kontrol noktası inhibitörüdür ve tümör hücrelerine karşı doğrudan bir T hücresi immün saldırısına geçmek için harekete geçen reaktif T efektör hücrelerin sayısını arttırmaktadır. CTLA-4 blokajı, düzenleyici T hücrelerinin işlevini de azaltabilir ve bu durum bir anti-tümör immün yanıtına katkıda bulunabilir. YERVOY tümör bölgesindeki düzenleyici T hücrelerini seçici olarak tüketebilir ve bu da tümör içi efektör T/düzenleyici T hücre oranının artmasına yol açarak tümör hücrelerinin ölümünü tetikleyebilir.
Farmakodinamik etkileri
YERVOY alan melanom hastalarında periferal kandaki mutlak lenfosit sayımı (ALC) indüksiyon dozu süreci boyunca artmıştır. Faz 2 çalışmalarda bu artış doza bağlıdır. MDX010-20'de (bkz. Bölüm 5.1), gp100 ile birlikte ya da tek başına uygulanan 3 mg/kg YERVOY, indüksiyon dozu sürecinde ALC'yi yükseltmiş, ancak araştırma amaçlı tek başına gp 100 peptid aşısı alan kontrol grubu hastalarında anlamlı bir ALC değişikliği görülmemiştir. Melanom hastalarının periferal kanında YERVOY tedavisinden sonra aktive HLA-DR+ CD4+ ve CD8+T hücrelerinin yüzdesinde ortalama bir artış gözlenmiştir: bu gözlemler etki mekanizması ile uyumludur. YERVOY tedavisinden sonra merkezî hafıza (CCR7+ CD45RA-) CD4+ ve CD8+ T hücrelerinin yüzdesinde ortalama bir yükselme ve efektör hafıza (CCR7- CD45RA-) CD8+ T hücrelerinin yüzdesinde ise daha az ancak anlamlı bir ortalama yükselme de gözlenmiştir.
Klinik etkililik ve güvenlilik
Nivolumab ile kombinasyon halinde YERVOY
YERVOY ile kombinasyon tedavisini takiben monoterapi olarak verilen nivolumab için doz önerileri ile ilişkili klinik etkililik ve güvenlilik hakkında daha fazla bilgi için lütfen nivolumab KÜB'üne bakınız.
Doz/maruziyet etkililik ve güvenlilik ilişkilerinin modellenmesine dayanarak, her 2 haftada bir 240 mg veya her 2 haftada bir 3 mg/kg nivolumab arasında etkililik ve güvenlilik açısından klinik olarak anlamlı bir fark bulunmamaktadır. Ek olarak, bu ilişkilere dayanarak, ileri evre melanom ve RHK'de 4 haftada bir 480 mg veya her 2 haftada bir 3 mg/kg nivolumab dozu arasında klinik olarak anlamlı bir fark görülmemiştir.
YERVOY monoterapisi ile Klinik Çalışmalar
Melanom
Daha önce tedavi edilmiş ve ileri evre (rezeke edilemeyen veya metastatik) melanom hastalarında önerilen 3 mg/kg YERVOY dozunda genel sağkalım (OS) avantajı bir Faz 3 çalışmada (MDX010- 20) kanıtlanmıştır. Oküler melanom, primer MSS melanomu, aktif beyin metastazları, insan immün yetmezlik virüsü (HIV), hepatit B ve hepatit C görülen hastalar, MDX010-20 klinik çalışmasına dahil edilmemiştir. Klinik çalışmaya ECOG (The Eastern Cooperative Oncology Group – Doğu Kooperatif Onkoloji Grubu) performans durumu >1 olan ve mukozal melanom görülen hastalar dahil edilmemiştir. Karaciğer metastazı görülmeyen ve başlangıçta AST değeri >2,5 x ÜNL olan hastalar, karaciğer metastazı görülen ve başlangıçta AST değeri >5 x ÜNL olan hastalar ve başlangıçta total bilirubin değeri ≥ 3 x ÜNL olan hastalar da çalışmaya dahil edilmemiştir.
Otoimmün hastalık geçmişi olan hastalar için bkz. Bölüm 4.4.
MDX010-20
Aşağıdakilerden birini ya da daha fazlasını içeren rejimler ile önceden tedavi görmüş olan ileri evre (rezeke edilemeyen veya metastatik) melanom hastalarının kaydolduğu çift kör, bir Faz 3 çalışmasıdır: IL-2, dekarbazin, temozolomid, fotemustin, veya karboplatin. Hastalar 3:1:1 oranında randomize edilmiş ve 3 mg/kg YERVOY + araştırma amaçlı gp 100 peptid aşısı (gp100), 3 mg/kg YERVOY monoterapisi ya da sadece gp100 almışlardır. Hastaların tamamı HLA-A2*0201 tipindedir; bu HLA tipi immün gp100 varlığını destekler. Hastalar, başlangıç BRAF mutasyon durumundan bağımsız olarak kaydedilmiştir. Hastalar, toleranslarına göre, 4 doz YERVOY'u 3 haftada bir almışlardır (indüksiyon tedavisi). İndüksiyon dönemi bitmeden tümör yüklerindeki artış belirgin olan hastalar performans durumlarının uygun olması şartıyla, tolere ettikleri sürece, indüksiyon tedavisine devam etmişlerdir. YERVOY'a verilen tümör yanıtı indüksiyon tedavisi tamamlandıktan sonra yaklaşık 12. haftada değerlendirilmiştir.
Tümörün ilk değerlendirmesinden >3 ay sonra, başlangıçtaki klinik yanıtın (PR veya CR) ardından veya stabil hastalık (SD) (modifiye DSÖ kriterlerine göre) ardından progresif hastalık (PD) geliştiren kişilere YERVOY ile ilave tedavi (tekrar tedavi) önerilmiştir. Primer sonlandırma kriteri gp100 grubuna karşı YERVOY + gp100 grubunda genel sağkalımdı (OS). Başlıca sekonder sonlandırma kriterleri YERVOY monoterapi grubuna karşı YERVOY+gp100 grubunda ve gp100 grubuna karşı YERVOY monoterapi grubunda OS idi.
Toplam 676 hasta randomize edilmiştir: 137'si YERVOY monoterapi grubuna, 403'ü YERVOY + gp100 grubuna, 136'sı da sadece gp100 grubuna. Büyük bir bölümü, indüksiyon sırasında 4 dozun hepsini de almıştır. Otuz iki hasta bir tekrar tedavi almıştır: bunların 8'i YERVOY monoterapi grubunda, 23'ü YERVOY + gp100 grubunda ve 1'i de gp100 grubundadır. Takip süresi 55 ay devam etmiştir. Başlangıç karakteristikleri gruplar arasında iyi dengelenmişti. Ortanca yaş 57'ydi. Hastaların çoğunluğunun (%71-73) M1c evresinde hastalığı vardı ve hastaların %37-40‘ının başlangıç laktat dehidrojenazı (LDH) yüksekti. Toplam 77 hastanın daha önce tedavi edilmiş beyin metastazı hikayesi vardı.
YERVOY içeren rejimler gp100 kontrol grubuna karşı istatistiksel olarak anlamlı bir OS avantajı elde etmiştir. OS karşılaştırmasında YERVOY monoterapisi ile gp100 arasındaki risk oranı (HR) 0,66 (%95 GA: 0,51, 0,87; p = 0,0026) olmuştur.
Alt grup analizinde, genel sağkalım (OS) yararının hasta alt gruplarının büyük bir kısmının içerisinde tutarlıydı (M [metastaz]-evre, önceki interlökin-2, başlangıçtaki LDH, yaş, cinsiyet ve önceki tedavi tipi ve sayısı). Ancak, 50 yaşın üzerindeki kadınlarda YERVOY tedavisinin OS yararını destekleyen veriler sınırlıdır. Alt grup analizi az sayıda hastayı içerdiğinden, bu verilerden kesin sonuçlar çıkartılamamaktadır.
1 ve 2 yıldaki ortanca ve tahmin edilen OS oranları Tablo 7'de verilmiştir.
Tablo 7: | MDX010-20'de Genel Sağkalım |
| |
| YERVOY 3 mg/kg n= 137 | gp 100 n= 136 | |
Ortanca Aylar (%95 GA) | 10 ay (8, 13,8) | 6 ay (5,5, 8,7) | |
1 yılda % OS | (%95 GA) | %46 (37, 54,1) | %25 (18,1, 32,9) |
2 yılda % OS | (%95 GA) | %24 (16, 31,5) | %14 (8, 20) |
3 mg/kg YERVOY monoterapi grubunda ortanca OS, sırasıyla SD olan hastalarda 22 ay ve PD olanlarda 8 ay olmuştur. Bu analiz yapılırken CR ya da PR geliştiren hastaların ortancalarına ulaşılmamıştı.
Tekrar tedavi gereken hastalar için BORR, YERVOY monoterapi grubunda %38 (3/8 hasta) ve gp100 grubunda %0 olmuştur. Hastalık kontrol oranı (DCR, CR+PR+SD olarak tanımlanır) sırasıyla %75 (6/8 hasta) ve %0 olmuştur. Bu analizlerde hasta sayısının sınırlı olmasından dolayı YERVOY'un tekrar tedavi etkisi tam olarak bilinmemektedir.
YERVOY tedavisini takiben sistemik kortikosteroid kullanılarak veya kullanılmadan klinik aktivite benzer şekilde gelişmiş veya korunmuştur.
CA184-169
Bir çift kör, Faz 3 çalışmaya daha önce tedavi görmüş ya da tedavi görmemiş rezeke edilemeyen Evre III ya da Evre IV melanom hastaları kaydolmuştur. Toplam 727 hasta, 4 doza kadar her 3 haftada bir 362'si YERVOY 3 mg/kg ve 365'i YERVOY 10 mg/kg alacak şekilde randomize edilmiştir. YERVOY 10 mg/kg grubunda ortanca OS (%95 GA) 16 ay (11,63, 17,84) ve YERVOY 3 mg/kg
grubunda ortanca OS (%95 GA) 12 aydı (9,86, 13,27). YERVOY 10 mg/kg ve 3 mg/kg grupları
arasında karşılaştırılan genel sağkalım HR = 0,84 (%95 GA: 0,70, 0,99; P-değeri = 0,04) göstermiştir. 10 mg/kg ve 3 mg/kg grupları arasında progresyonsuz sağkalımda (PFS) istatistiksel açıdan anlamlı fark gözlemlenmemiştir. (HR 0,89, %95 GA 0,76, 1,04 ve log-sıra testi P-değeri = 0,1548). BORR,
10 mg/kg ve 3 mg/kg gruplarında benzerdi. BORR, 10 mg/kg grubunda %15,3 (%95 GA: 11,8, 19,5)
ve 3 mg/kg grubunda %12,2 (%95 GA: 9, 16) idi. YERVOY 10 mg/kg, 3 mg/kg doz ile karşılaştırıldığında daha yüksek advers olay oranları ile ilişkilendirilmiştir. 10 mg/kg ve 3 mg/kg gruplarındaki ciddi advers reaksiyon sıklıkları %37% ve %18 olup, en yaygın 3 advers reaksiyon diyare (%10,7'ye %5,5), kolit (%8'e %3) ve hipofizitti (%4,4'e %1,9). 10 mg/kg ve 3 mg/kg gruplarında tedavinin kesilmesine neden olan advers olaylar sırasıyla hastaların %31'i ve %19'unda meydana gelmiş olup, 4 ve 2 hastada ölüme neden olan AO'lar meydana gelmiştir.
Önerilen 3 mg/kg dozunda, ortanca OS, genel popülasyona kıyasla 50 yaşındaki ve üstündeki kadınların alt grubunda benzerdi: (11,40 aya 11,53). Başlangıçta beyin metastazları olan alt gruptaki ortanca OS önerilen 3 mg/kg dozunda 5,67 aydı.
YERVOY monoterapisi ile diğer çalışmalar Melanom
CA184332 ve CA184338
Birleştirilmiş Faz 2 ve 3 klinik çalışmalarda daha önce kemoterapi görmemiş olan hastalarda (N=78: randomize edilen) ve iki retrospektif gözlem çalışmasındaki daha önce tedavi edilmemiş hastalarda (N=273 ve N=157) YERVOY 3 mg/kg monoterapisi ile elde edilen OS, genel olarak tutarlıdır. İki gözlem çalışmasında, hastaların %12,1 ve 33,1'inde ileri evre melanom teşhisi sırasında beyin metastazı mevcuttu. Ortanca OS ve tahmini 1 yıllık, 2 yıllık, 3 yıllık ve 4 yıllık sağkalım oranları Tablo 8'de sunulmaktadır. Birleştirilmiş Faz 2 ve 3 klinik çalışmalarda daha önce kemoterapi görmemiş olan hastalarda (N=78) tahmini 1 yıllık, 2 yıllık ve 3 yıllık sağkalım oranları, sırasıyla
%54,1 (%95 GA: 42,5 – 65,6), %31,6 (%95 GA: 20,7 – 42,9) ve %23,7 (%95 GA: 14,3 – 34,4) idi.
Tablo 8: Gözlem çalışmalarında genel sağkalım | ||
| CA184338 n= 273 | CA184332 n= 157 |
Ortanca OS (%95 GA) | 14 ay (12,8-18,7) | 10 ay (7-12,8) |
1.yılda % OS (%95 GA) | %59 (52,5-64,3) | %44 (35,5, 51,4) |
2.yılda % OS (%95 GA) | %39 (33,1-44,8) | %26 (18,9-33,3) |
3.yılda % OS (%95 GA) | %31 (25,5-36,7) | %22 (15,5-29,2) |
4.yılda % OS (%95 GA) | %26 (20,4-31,3) | %22 (15,5-29,2) |
CA184332 çalışmasında beyin metastazı olan hastalarda ortanca genel sağkalım 7 ay (%95 GA: 5,06 – 12,81) ve beyin metastazı olmayan hastalarda ortanca genel sağkalım 14,1 ay (%95 GA: 9,96- tahmin edilemiyor) bulunmuştur.
CA184338 çalışmasında beyin metastazı olan hastalarda ortanca genel sağkalım 6,3 ay (%95 GA: 3,2 – 12) ve beyin metastazı olmayan hastalarda ortanca genel sağkalım 17,7 ay (%95 GA: 13,6 – 12,1) bulunmuştur.
YERVOY (3mg/kg'da) tedavisinin uzun dönemli sağkalım yararı önceden tedavi görmüş ve hiç tedavi görmemiş ileri melanomlu hastalarda (N = 965) yapılan klinik çalışmalardan alınan OS verilerinin birleştirilmiş analiziyle gösterilmektedir. Kaplan-Meier OS eğrisi yaklaşık 3. yılda başlayan ve bazı hastalarda 10 yıla kadar uzayan bir platoyu ortaya koymuştur (OS oranı = %21 [%95 GA: 17-24]) (bkz. Şekil 1).
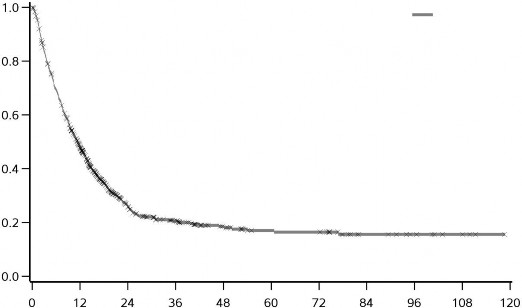
3.0
mg/kg
Genel Sağkalım (oran)
Şekil 1: Birleştirilmiş analizde YERVOY 3 mg/kg ile Genel Sağkalım
Süre (ay)
Risk altında olanlar | |||||||||||
3 mg/kg | 965 | 429 | 127 | 73 | 41 | 29 | 28 | 12 | 8 | 4 | 0 |
Nivolumab ile kombinasyon halinde YERVOY ile klinik çalışmalar Melanom
YERVOY monoterapisine karşı nivolumab ile kombinasyon halinde YERVOY veya nivolumab monoterapisi alınan randomize Faz 3 çalışma (CA209067)
İleri evre (rezeke edilemeyen veya metastatik) melanom tedavisi için YERVOY 3 mg/kg monoterapisine karşı 1 mg/kg nivolumab ile kombinasyon halindeki 3 mg/kg YERVOY'un ve 3 mg/kg nivolumabın güvenliliği ve etkililiği faz 3, randomize, çift kör çalışmada (CA209067) değerlendirilmiştir. Nivolumab içeren iki grup arasındaki farklılıklar tanımlayıcı şekilde değerlendirilmiştir. Çalışmaya rezeke edilemeyen Evre III ya da Evre IV melanomun doğrulandığı yetişkin hastalar dahil edilmiştir. Hastaların ECOG performans durumunun 0 ya da 1 olması gerekmiştir. Rezeke edilemeyen ya da metastatik melanom için daha önce sistemik kanser tedavisi görmemiş olan hastalar kaydolmuştur. Randomizasyondan en az 6 hafta önce tamamlanmış olması kaydıyla önceki adjuvan/neoadjuvan tedavisine izin verilmiştir. Aktif otoimmün hastalığı, oküler/üveal melonomu veya aktif beyin ya da leptomeningeal metastazları bulunan hastalar çalışmaya dahil edilmemiştir.
Toplam 945 hasta, nivolumab ile kombinasyon halinde YERVOY (n=314), nivolumab monoterapisi (n=316) veya YERVOY monoterapisi (n=315) alacak şekilde randomize edilmiştir. Kombinasyon kolundaki hastalar ilk 4 doz için her 3 haftada bir intravenöz yoldan 60 dakika boyunca 1 mg/kg nivolumab ve 90 dakika boyunca 3 mg/kg YERVOY ardından her 2 haftada bir 3 mg/kg nivolumab monoterapisi almıştır. Nivolumab monoterapisi kolundaki hastalar her 2 haftada bir 3 mg/kg nivolumab almıştır. Karşılaştırma ilacı kolundaki hastalar 4 doz için her 3 haftada bir intravenöz yoldan 3 mg/kg YERVOY ve nivolumab eşleşmeli plasebo ardından her 2 haftada bir plasebo almıştır. Randomizasyon, PD-L1 ekspresyonu (<%5'e ≥ %5 tümör hücresi membran ekspresyonu), BRAF durumu ve Amerika Kanser Komitesi (AJCC) Evreleme Sistemi uyarınca M evresine göre katmanlandırılmıştır. Tedavi, klinik yarar gözlendiği sürece veya tedavi hasta tarafından artık tolere edilmeyinceye kadar sürdürülmüştür. Tümör değerlendirmeleri randomizasyondan 12 hafta sonra ve
ardından ilk yıl için her 6 haftada bir ve daha sonra 12 haftada bir gerçekleştirilmiştir. Primer sonlanım noktaları progresyonsuz sağkalım ve OS idi. ORR ve yanıt süresi de değerlendirilmiştir.
Başlangıç karakteristikleri üç tedavi grubu arasında dengeliydi. Hastaların ortanca yaşı 61 olup (aralık: 18 ila 90 yaş) hastaların %65'i erkek ve %97'si beyazdı. ECOG performans durumu 0 (%73) veya 1 (%27) idi. Hastaların büyük çoğunluğunda AJCC Evre IV hastalık (%93) vardı; %58'inde çalışmaya giriş sırasında M1c hastalık vardı. Hastaların yüzde yirmi üçü daha önce adjuvan tedavisi görmüştü. Hastaların yüzde otuz ikisinde BRAF mutasyon pozitif melanom vardı; hastaların
%26,5'inde PD-L1 ≥ %5 tümör hücresi membran ekspresyonu vardı. Hastaların yüzde dördünde beyin metastazı öyküsü vardı ve hastaların %36'sında başlangıç LDH düzeyi çalışma başlangıcındaki ÜNL'ten yüksekti. Ölçülebilir tümör PD-L1 ekspresyonu olan hastalar arasında, hastaların dağılımı üç tedavi grubunda dengeliydi. Tümör PD-L1 ekspresyonu, PD-L1 IHC 28-8 pharmDx miktar tayini kullanılarak belirlenmiştir.
Birincil analizde (minimum takip 9 ay) ortanca PFS, nivolumab grubunda 6,9 ay iken YERVOY grubunda 2,9 aydı (HR = 0,57, %99,5 GA: 0,43, 0,76; p <0,0001). Ortanca PFS, YERVOY
grubundaki 2,9 aya kıyasla nivolumab grubuyla kombinasyon halinde YERVOY'da 11,5 aydı (HR = 0,42, %99,5 GA: 0,31, 0,57; p <0,0001).
Tanımlayıcı analizden PFS sonuçları (en az 90 ay takip süresi ile) Şekil 2'de (tamamı randomize edilmiş popülasyon), Şekil 3 (tümör PD-L1 %5 kesmede) ve Şekil 4'te (tümör PD-L1 %1 kesmede) gösterilmiştir.
Progresyonsuz sağkalım olasılığı
Şekil 2: Progresyonsuz Sağkalım (CA209067)
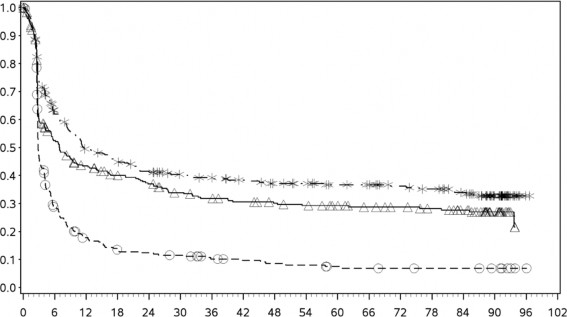
Progresyonsuz sağkalım (aylar)
Şekil 3: PD-L1 ekspresyonuna göre progresyonsuz sağkalım: %5 kesme (CA209067)
Progresyonsuz sağkalım olasılığı
PD-L1 ekspresyonu <%5
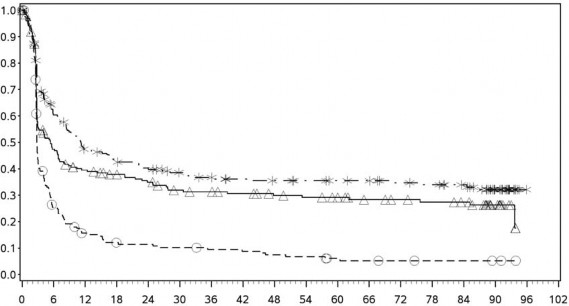
Progresyonsuz sağkalım (aylar)
Progresyonsuz sağkalım olasılığı
PD-L1 ekspresyonu ≥ %5
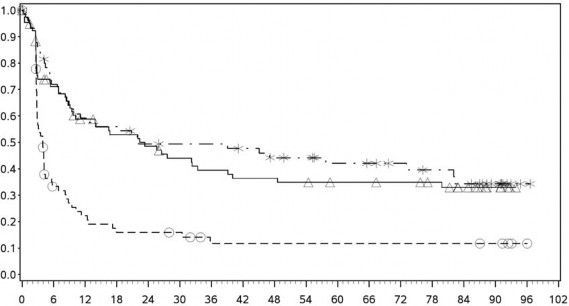
Progresyonsuz sağkalım (aylar)
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||
Şekil 4: PD-L1 ekspresyonuna göre progresyonsuz sağkalım: %1 kesme (CA209067)
PD-L1 ekspresyonu <%1
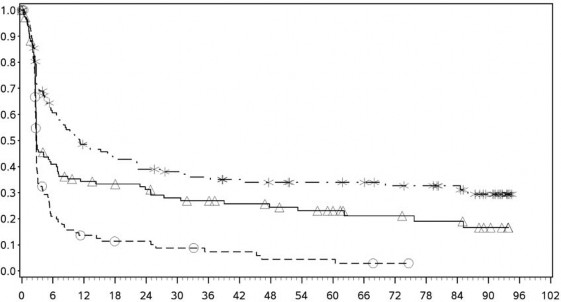
Progresyonsuz Sağkalım (Aylar)
|
| |||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
PD-L1 ekspresyonu %1
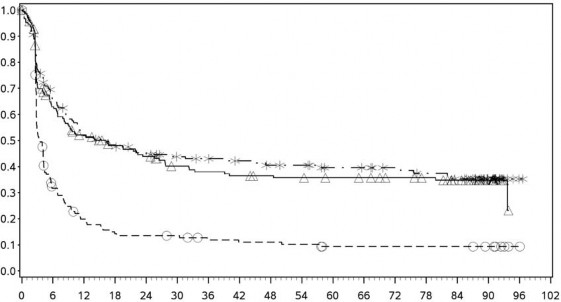
Progresyonsuz Sağkalım (Aylar)
Nihai OS analizi tüm hastalar için en az 28 aylık takip süresi olduğunda meydana gelmiştir. 28 ayda, YERVOY grubundaki 19,98 aya (HR=0,63, %98 GA: 0,48, 0,81; p-değeri: <0,0001) karşı nivolumab grubunda medyan OS'ye ulaşılmamıştır. YERVOY grubuyla (HR=0,55; %98 GA: 0,42, 0,72; p- değeri: <0,0001) kıyaslandığında nivolumab ile kombinasyon halindeki YERVOY grubunda medyan OS'ye ulaşılmamıştır.
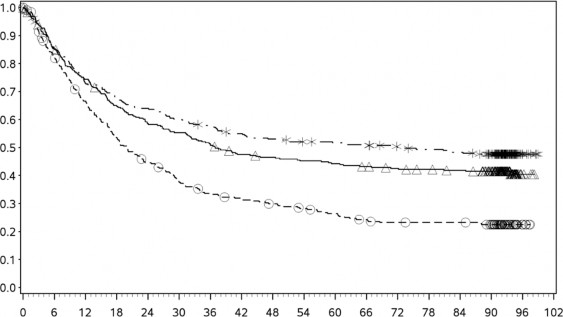
En az 90 aylık takip döneminde yapılan ek tanımlayıcı analizin OS sonuçları orijinal primer analizle tutarlı sonuçlar göstermektedir. Bu takip dönemi analizinin OS sonuçları Şekil 5 (tümü randomize), Şekil 6 ve Şekil 7'de (tümör PD-L1'de %5 ve %1 kesme) gösterilmektedir.
OS analizi alınan sonraki tedavileri de hesaplayacak şekilde ayarlanmamıştır. Sırasıyla kombinasyon, nivolumab monoterapisi ve YERVOY kollarındaki hastaların %36,0, %49,1 ve %66,3'ü daha sonra sistemik tedavi görmüştür. Sırasıyla kombinasyon, nivolumab monoterapisi ve YERVOY kollarındaki hastaların %19,1, %34,2 ve %48,3'ü daha sonra immünoterapi (anti-PD1 tedavisi, anti- CTLA-4 antikoru veya başka bir immünoterapi dahil) almıştır.
Şekil 5 Genel Sağkalım (CA209067) – Minimum 90 aylık takip
Şekil 6: PD-L1 ekspresyonuna göre genel sağkalım: %5 kesme (CA209067) – Minimum 90 aylık takip
PD-L1 ekspresyonu <%5
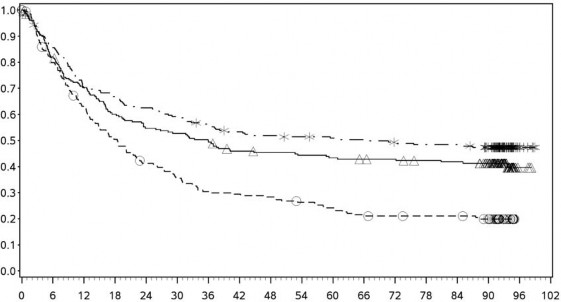
Genel Sağkalım Olasılığı
PD-L1 ekspresyonu ≥ %5
![]()
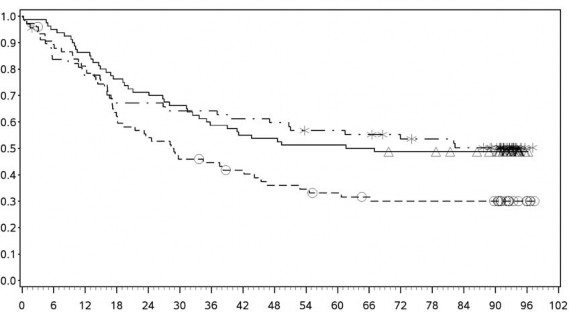
Şekil 7: PD-L1 ekspresyonuna göre genel sağkalım: %1 kesme (CA209067) – Minimum 90 aylık takip
PD-L1 ekspresyonu <%1
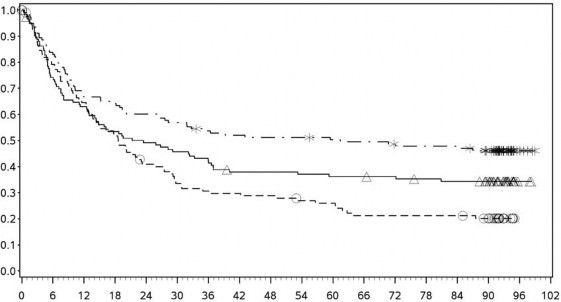
PD-L1 ekspresyonu ≥ %1
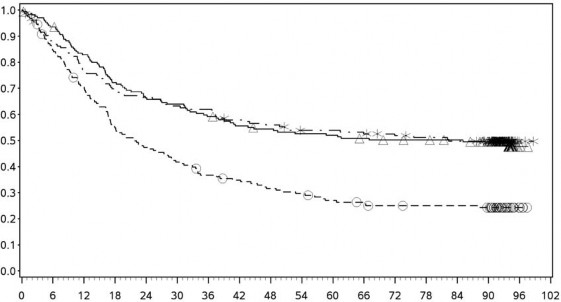
![]()
Objektif Yanıt Oranı (ORR) analizi için minimum takip süresi 90 aydı. Yanıtlar Tablo 9'da özetlenmiştir.
Tablo 9: Objektif yanıt (CA209067)
| nivolumab + YERVOY (n=314) | nivolumab (n=316) | YERVOY (n=315) |
Objektif yanıt | 183 (%58) | 142 (%45) | 60 (%19) |
(%95 GA) | (52,6, 63,8) | (39,4 50,6) | (14,9, 23,8) |
Risk oranı (YERVOY'a karşı) | 6,35 | 3,5 |
|
(%95 GA) | (4,38, 9,22) | (2,49 - 5,16) |
|
Tam yanıt (CR) | 71 (%23) | 59 (%19) | 19 (%6) |
Kısmi yanıt (PR) | 112 (%36) | 83 (%26) | 41 (%13) |
Stabil hastalık (SD) | 38 (%12) | 29 (%9) | 69 (%22) |
Yanıt süresi |
|
|
|
Ortanca (aralık), aylar | Belirlenemedi (69,1-Belirlenemedi) | 90,8 (45,7-Belirlenemedi) | 19,3 (8,8 – 47,4) |
Oran | %68 | %73 | %44 |
Oran | %58 | %63 | %30 |
Tümör PD-L1 ekspresyonuna göre ORR (%95 GA) | |||
<%5 | |||
≥%5 | |||
<%1 | |||
≥%1 | |||
Nivolumab içeren her iki kol, tek başına YERVOY ile kıyaslandığında anlamlı PFS ve OS faydası ile daha yüksek ORR sergilemiştir. 18 aylık takip süresinde gözlemlenen PFS sonuçları ile 28 aylık takipte ORR ve OS sonuçları başlangıç ECOG performans durumu, BRAF durumu, M evresi, yaş, beyin metastaz öyküsü ve başlangıç LDH düzeyi dahil hasta alt gruplarında tutarlı şekilde gösterilmiştir. Bu gözlem minimum 90 aylık takipte OS sonuçlarında korunmuştur.
28 aylık takip süresinden sonra advers reaksiyon nedeniyle kombinasyon tedavisi kesilen 131 hasta arasında ORR %71 olup (93/131), %20'si (26/131) tam yanıtı sağlamış ve ortanca OS'ye ulaşılamamıştır.
Nivolumab içeren her iki kol, PD-L1 ekspresyon seviyelerine bakılmaksızın YERVOY'dan daha yüksek objektif yanıt oranları sergilemiştir. ORR'ler, 90 aylık takip sonrasında tümör PD-L1 ekspresyon seviyeleri genelinde (Tablo 11) nivolumab monoterapisine göre nivolumab ve YERVOY
kombinasyonu için daha yüksek olup, tam yanıtın en iyi genel yanıtı iyileşen sağkalım oranıyla ilişkilendirilmiştir.
90 aylık takip sonrasında, tümör PD-L1 ekspresyon seviyesi ≥%5 olan hastalar için ortanca yanıt sürelerine kombinasyon kolunda 78,19 ay (aralık: 18,07 – Belirlenemedi), nivolumab monoterapisi kolunda 77,21 ay (aralık: 26,25 – Belirlenemedi) ve YERVOY kolunda 31,28 aydı (aralık: 6,08 – Belirlenemedi). Tümör PD-L1 ekspresyonu <%5'te, ortanca yanıt sürelerine kombinasyon kolunda ulaşılmamış (aralık: 61,93 – Belirlenemedi), nivolumab monoterapisi kolunda 90,84 (aralık: 50,43 – Belirlenemedi) ve YERVOY monoterapisi kolunda 19,25 aydı (aralık: 5,32 – 47,44).
Tümör yanıtı ile PFS ve OS'nin ilgili sonlanım noktalarını değerlendirirken PD-L1 ekspresyonu için net bir kesme değeri güvenli şekilde belirlenememektedir. Keşifsel çok değişkenli analizlere ait sonuçlar, sağkalım sonucuna katkıda bulunabilecek hasta ve tümör karakteristiklerini (ECOG performans durumu, M evresi, başlangıçtaki LDH, BRAF mutasyon durumu, PD-L1 durumu ve cinsiyet) tanımlamıştır.
BRAF durumuna göre etkililik:
90 aylık takip süresinden sonra, nivolumab ile kombinasyon halinde YERVOY koluna randomize edilen BRAF [V600] mutasyonu pozitif ve BRAF negatif tip hastalar için ortanca PFS sırasıyla 16,76 ay (%95 GA: 8,28-32) ve 11,17 ay (%95 GA: 7-19,32) iken, nivolumab monoterapisi kolundaki
hastalar için ortanca PFS sırasıyla 5,62 ay (%95 GA: 2,79- 9,46) ve 8,18 ay (%95 GA: 5,13-19,55) olmuştur. YERVOY monoterapisine randomize edilen BRAF [V600] mutasyonu pozitif ve BRAF negatif tip hastalarda ortanca PFS sırasıyla 3,09 ay (%95 GA: 2,79; 5,19) ve 2,83 aydı (%95 GA:
2,76; 3,06) olmuştur.
90 aylık takip süresinden sonra, nivolumab ile kombinasyon halinde YERVOY koluna randomize edilen BRAF [V600] mutasyonu pozitif ve BRAF negatif tip hastalar için ortanca ORR %67 (%95 GA: 57, 75,9; n = 103) ve %54 (%95 GA: 47,1, 60,9; n = 211) iken, nivolumab monoterapisi
kolundaki hastalar için ortanca ORR sırasıyla %37,87 (%95 GA: 28,2, 48,1; n = 98) ve %48,2 (%95 GA: 41.4, 55,0; n = 218) olmuştur. YERVOY monoterapisine randomize edilen BRAF [V600] mutasyonu pozitif ve BRAF negatif tip hastalarda ortanca ORR sırasıyla %23 (%95 CI: 15,2, 32,5; n
= 100) and %17,2 (%95 GA: 12,4, 22,9; n = 215).
90 aylık takip sonrasında, BRAF[V600] mutasyonu pozitif hastalarda, kombinasyon kolunda ortanca OS'ye ulaşılmamıştı ve nivolumab monoterapisi kolunda 45,5 aydı. YERVOY tedavi kolundaki BRAF[V600] mutasyonu pozitif hastalarda ortanca OS 24,6 aydı. BRAF negatif tip hastalarda ortanca OS kombinasyon kolunda 39,06 ay, nivolumab monoterapisi kolunda 34,37 ay ve YERVOY monoterapisi kolunda 18,5 aydı. YERVOY ile kombinasyon halinde nivolumaba karşı nivolumab monoterapisi için OS HR değerleri, BRAF[V600] mutasyonu pozitif hastalar için 0,66 (%95 GA: 0,44, 0,98) ve BRAF mutasyonu negatif hastalar için 0,95 (%95 GA: 0,74, 1,22) olarak belirlenmiştir.
Nivolumab ile kombinasyon halinde YERVOY ve YERVOY'un randomize faz 2 çalışması (CA209069) Çalışma CA209069, ileri evre (rezeke edilemeyen veya metastatik) melonomu olan, CA209067 çalışmasının ve BRAF-negatif tip melanomu olan hastalardaki (hastaların %77'si) primer analize benzer dahil etme kriterlerine sahip 142 hastada nivolumab ve YERVOY kombinasyonunu tek başına YERVOY ile karşılaştıran randomize, çift kör, Faz 2 çalışmasıydı. Araştırmacı tarafından değerlendirilen ORR kombinasyon kolunda %61 (%95 GA: 48,9, 72,4) iken YERVOY kolunda
%11'di (%95 GA: 3, 25,4). Tahmini 2 yıllık ve 3 yıllık OS oranları kombinasyon (n=73) için sırasıyla
68 (%95 GA: 56, 78) ve %61 (%95 GA: 49, 71) ve YERVOY (n = 37) için sırasıyla %53 (%95 GA:
36, 68) ve %44'tü (%95 GA: 28, 60).
Renal Hücreli Karsinom (RHK)
Nivolumab ile kombinasyon halinde YERVOY tedavisinin Sunitinib ile karşılaştırıldığı randomize faz 3 çalışma (CA209214)
İleri evre/metastatik RHK tedavisi için nivolumab 3 mg/kg ile kombinasyon halinde YERVOY 1 mg/kg'nin güvenliliği ve etkililiği faz 3, randomize, açık etiketli bir çalışmada (CA209214) değerlendirilmiştir. Çalışmaya, daha önce tedavi edilmemiş, berrak hücreli komponenti olan ileri evre veya metastatik renal hücreli karsinom hastaları (18 yaş ve üzeri) dahil edilmiştir. Primer etkililik popülasyonu, Uluslararası Metastatik RHK Veri Tabanı Konsorsiyumu (IMDC) kriterlerine göre 6 prognostik risk faktöründen en az 1 veya daha fazla olan orta/kötü riskli hastaları içermiştir (ilk renal hücreli karsinom teşhisi zamanından randomizasyona kadar bir yıldan az, Karnofsky performans durumu <%80, normal alt sınırdan daha düşük hemoglobin, 10 mg/dL'den daha yüksek düzeltilmiş kalsiyum, normal üst sınırdan daha yüksek trombosit sayımı ve normal üst sınırdan daha yüksek mutlak nötrofil sayımı). Hastalar bu çalışmaya tümör PD-L1 durumlarından bağımsız olarak dahil edilmiştir. Karnofsky performans durumunun <%70 olduğu ve herhangi bir geçmiş veya mevcut beyin metastazı olan, aktif otoimmün hastalığa sahip veya sistemik immünosüpresyon gerektiren tıbbi koşulları olan hastalar çalışmaya dahil edilmemiştir. Hastalar IMDC prognostik skoru ve bölgeye göre katmanlandırılmıştır.
Çalışmaya toplam 1096 hasta randomize edilmiş olup, bunlardan 847'si orta/kötü riskli RHK'ye sahipti ve 4 doza kadar her 3 haftada bir 60 dakika boyunca intravenöz yoldan uygulanan nivolumab ile kombinasyon halinde 30 dakika boyunca intravenöz yoldan uygulanan 1 mg/kg YERVOY (n=425) ve bunu takiben 2 haftada bir 3 mg/kg nivolumab monoterapisi almış veya her kürde 4 hafta boyunca oral yoldan günde 50 mg sunitinib (n=422) almış ve bunu 2 haftalık tedavisiz dönem izlemiştir. Tedaviye klinik yarar gözlendiği sürece veya hasta tedaviyi artık tolere edemeyene dek devam edilmiştir. İlk tümör değerlendirmesi randomizasyondan 12 hafta sonra yapılmış ve değerlendirmeler, ilk yıl için 6 haftada bir ve daha sonra progresyona veya tedavinin kesilmesine kadar, hangisi sonra meydana gelirse, her 12 haftada bir devam etmiştir. Araştırmacı tarafından değerlendirilen RECIST, versiyon 1.1'de tanımlı ilk progresyondan sonra tedaviye, araştırmacı tarafından belirlenen şekilde hastanın klinik yarar elde etmesi ve çalışma ilacını tolere etmesi durumunda izin verilmiştir. Primer sonlanım noktaları, orta/kötü riskli hastalarda Körlenmiş Bağımsız Merkezi İnceleme (BICR) ile belirlenen OS, ORR ve PFS idi.
Başlangıç karakteristikleri iki grup arasında genellikle dengeli olmuştur. Ortanca yaş 61 (aralık: 21- 85) olup, %38'i ≥ 65 yaşında ve %8'i ≥ 75 yaşındaydı. Hastaların çoğunluğu erkek (%73) ve beyazdı (%87) ve hastaların %31 ve %69'unda başlangıç KPS değeri sırasıyla %70 ila 80 ve %90 ila 100 olarak belirlenmiştir. İlk tanıdan randomizasyona kadar geçen ortanca süre hem nivolumab 3 mg/kg ile kombinasyon halindeki YERVOY 1 mg/kg hem de sunitinib gruplarında 0,4 yıldı. Ortanca tedavi süresi nivolumab ve YERVOY ile tedavi edilen hastalarda 7,9 ay (aralık: 1 gün-21,4 ay) ve sunitinib ile tedavi edilen hastalarda 7,8 ay (aralık: 1 gün-20,2 ay) olmuştur. Nivolumab ile YERVOY, hastaların %29'unda progresyondan sonra da devam etmiştir.
Orta/kötü riskli hastalardan elde edilen etkililik sonuçları Tablo 11'de (minimum 17,5 aylık takip ve minimum 60 aylık takiple primer analiz) ve Şekil 7'de (minimum 60 aylık takip) gösterilmektedir.
Minimum 60 aylık takiple yapılan tanımlayıcı analizden elde edilen OS sonuçları, orijinal primer analizden elde edilen sonuçlarla uyumlu idi.
Sağkalım Olasılığı
Şekil 8: Orta/kötü riskli hastalarda OS'ye ilişkin Kaplan-Meier eğrileri (CA209214) -Minimum 60 aylık takip
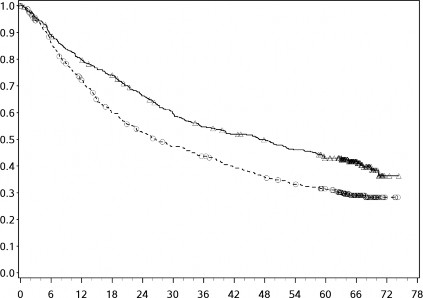
Genel Sağkalım (Ay)
![]()
Orta/kötü riskli hastalarda, tümör PD-L1 ekspresyonundan bağımsız olarak sunitinibe karşı nivolumab ile kombinasyon halinde YERVOY kolunda OS yararı gözlemlenmiştir. Tümör PD-L1 ekspresyonu ≥%1 olan hastalarda ortanca OS değerine nivolumab ile kombinasyon halinde YERVOY kolunda ulaşılamazken, sunitinib kolunda bu değer 19,61 ay olmuştur (HR = 0,52; %95 GA: 0,34, 0,78). Tümör PD-L1 ekspresyonu <%1 olan hastalar için, ortanca OS nivolumab ile kombinasyon halinde YERVOY kolunda 34,7 ay ve sunitinib kolunda 32,2 ay olmuştur (HR = 0,70; %95 GA: 0,54, 0,92).
CA209214 çalışmasında ayrıca IMDC kriterlerine göre iyi riskli 249 hasta nivolumab artı YERVOY (n=125) veya sunitinib (n=124) kollarına randomize edilmiştir. Bu hastalar primer etkililik popülasyonunun bir parçası olarak değerlendirilmemiştir. Sunitinibe kıyasla nivolumab artı YERVOY alan iyi riskli hastalarda OS için risk oranı 1,13 (%95 GA: 0,64, 1,99; p = 0,6710) idi.
Birinci basamak RHK'de sadece berrak olmayan hücre histolojisine sahip hastalarda nivolumab ile kombinasyon halinde YERVOY'un kullanımına ilişkin veri mevcut değildir.
Orta/kötü riskli hastalar için etkililik sonuçları Tablo 10'da gösterilmektedir.
Tablo 10: Orta/kötü riskli hastalarda etkililik sonuçları (CA209214)
nivolumab + ipilimumab (n = 425) | sunitinib (n = 422) | |
Primer analiz Minimum takip: 17,5 ay | ||
Genel sağkalım | ||
Olaylar | 140 (%33) | 188 (%45) |
Risk oranı | 0,63 | |
%99,8 GA | (0,44- 0,89) | |
P değeri | < 0,0001 | |
Medyan (%95 GA) | NE (28,2-NE) | 25,9 (22,1- NE) |
Oran (%95 GA) | ||
6. ayda | 89,5 (86,1- 92,1) | 86,2 (82,4- 89,1) |
12. ayda | 80,1 (75,9-83,6) | 72,1 (67,4-76,2) |
Progresyonsuz sağkalım | ||
Olaylar | 228 (%53,6) | 228 (%54) |
Risk oranı | 0,82 | |
%99,1 GA | (0,64-1,05) | |
P değeri | 0,0331 | |
Medyan (%95 GA) | 11,6 (8,71-15,51) | 8,4 (7,03-10,81) |
Doğrulanmış objektif yanıt (BICR) | 177 (%41,6) | 112 (%26,5) |
(%95 GA) | (36,9-46,5) | (22,4-31) |
ORR farkı (%95 GA) | 16 (9,8- 22,2) | |
P değeri | < 0,0001 | |
Tam yanıt (CR) | 40 (%9,4) | 5 (%1,2) |
Kısmi yanıt (PR) | 137 (%32,2) | 107 (%25,4) |
Stabil hastalık (SD) | 133 (%31,3) | 188 (%44,5) |
Medyan yanıt süresi | ||
Ay (aralık) | NE (1,4-25,5) | 18,17 (1,3-23,6) |
Yanıta kadar geçen medyan süre | ||
Ay (aralık) | 2,8 (0,9-11,3) | 3 (0,6-15) |
Güncellenmiş analiz* Minimum takip: 60 ay | ||
Genel sağkalım | ||
Olaylar | 242 (%57) | 282 (%67) |
Risk oranı | 0,68 | |
%95 GA | (0,58- 0,81) | |
Medyan (%95 GA) | 46,95 (35,35-57,43) | 26,64 (22,08- 33,54) |
Oran (%95 GA) | ||
24. ayda | 66,3 (61,5-70,6) | 52,4 (47,4-57,1) |
36. ayda | 54,6 (49,7-59,3) | 43,7 (38,7-48,5) |
48. ayda | 49,9 (44,9-54,6) | 35,8 (31,1-40,5) |
60. ayda | 43 (38,1-47,7) | 31,3 (26,8-35,9) |
Progresyonsuz sağkalım | ||
Olaylar | 245 (%57,6) | 253 (%60) |
Risk oranı | 0,73 | |
%95 GA | (0,61-0,87) | |
Medyan (%95 GA) | 11,6 (8,44-16,63) | 8,3 (7,03-10,41) |
Doğrulanmış objektif yanıt (BICR) | 179 (%42,1) | 113 (%26,8) |
(%95 GA) | (37,4-47) | (22,6-31,3) |
ORR farkı (%95 GA) | 16,2 (10- 22,5) | |
Tam yanıt (CR) | 48 (%11,3) | 9 (%2,1) |
Kısmi yanıt (PR) | 131 (%30,8) | 104 (%24,6) |
Stabil hastalık (SD) | 131 (%30,8) | 187 (%44,3) |
Medyan yanıt süresi | ||
Ay (aralık) | NE (50,89-NE) | 19,38 (15,38-25,10) |
Yanıta kadar geçen medyan süre | ||
Ay (aralık) | 2,8 (0,9-35) | 3,1 (0,6-23,6) |
NE = hesaplanamaz
*26 Şubat 2021 veri kesim tarihine dayalı tanımlayıcı analiz
Tüm hastalar minimum 24 ay takip edildiğinde güncellenmiş bir tanımlayıcı OS analizi yapılmıştır (bkz. Şekil 8). Bu analiz sırasında, kombinasyon kolunda 166/425 olay ve sunitinib kolunda 209/422 olay ile risk oranı 0,66 (%99,8 GA 0,48-0,91) idi. Orta/kötü riskli hastalarda, OS oranı tümör PD-L1 ekspresyonundan bağımsız şekilde sunitinib koluna kıyasla nivolumab ile kombinasyon halinde YERVOY için OS yararı gözlenmiştir. Tümör PD-L1 ekspresyonu ≥%1 olan hastalarda, nivolumab ile kombinasyon halinde YERVOY için medyan OS'ye erişilmemiş ve sunitinib için 19,61 ay olmuştur (HR=0,52; %95 GA: 0,34-0,78).
Tümör PD L1 ekpsresyonu <%1 olan hastalarda, medyan OS nivolumab ile kombinasyon halinde YERVOY için 34,7 ay iken sunitinib kolunda 32,2 ay olmuştur (HR=0,70; %95 GA: 0,54-0,92).
CA209214 çalışmasında ayrıca IMDC kriterlerine göre iyi riskli 249 hasta nivolumab artı YERVOY (n = 125) veya sunitinib (n = 124) kollarına randomize edilmiştir. Bu hastalar primer etkililik popülasyonunun bir parçası olarak değerlendirilmemiştir. 24 aylık takipte sunitinibe kıyasla nivolumab artı YERVOY alan iyi riskli hastalarda OS için risk oranı 1,13 (%95 GA: 0,64-1,99; p = 0,6710) idi. 60 aylık takipte OS için HR 0,94 idi (%95 GA: 0,65-1,37).
Birinci basamak RHK'de berrak hücreli olmayan histolojiye sahip hastalarda nivolumab ile kombinasyon halinde ipilimumabın kullanımına ilişkin veri mevcut değildir.
75 yaşında ve daha büyük hastalar CA209214'teki tüm orta/kötü riskli hastaların %8'ini temsil etmiştir ve nivolumab ile YERVOY kombinasyonu, minimum 17,5 aylık takiple bu alt grupta genel popülasyona kıyasla OS sonuçları sayısal olarak daha az etki göstermiştir (HR 0,97, %95 GA: 0,48, 1,95). Bu alt grubun küçük olmasından dolayı, bu verilerden kesin bir sonuç çıkarılamamaktadır.
Küçük hücreli dışı akciğer kanserinin birinci basamak tedavisi
4 kür platin bazlı kemoterapiye karşı ipilimumabın nivolumab ve 2 kür platin bazlı kemoterapi ile kombinasyonun araştırıldığı randomize faz 3 çalışma (CA2099LA)
3 haftada bir nivolumab 360 mg ve 2 kür platin bazlı kemoterapi ile kombinasyon halinde 6 haftada bir ipilimumab 1 mg/kg'ın güvenliliği ve etkililiği, bir faz 3, randomize, açık etiketli çalışmada (CA2099LA) değerlendirilmiştir. Çalışmaya histolojik olarak teyit edilmiş skuamöz olmayan veya skuamöz Evre IV veya rekürren KHDAK (7 Uluslararası Akciğer Kanseri Çalışmaları Derneğinin sınıflandırmasına göre), ECOG performans durumu 0 veya 1 olan ve daha önce hiçbir kanser tedavisi görmemiş (EGFR ve ALK inhibitörleri dahil) hastalar (18 yaş ve üzeri) dahil edilmiştir. Hastalar tümör PD-L1 durumlarına bakılmaksızın çalışmaya kaydedilmiştir.
EGFR mutasyonları veya ALK translokasyonları, aktif (tedavi edilmemiş) beyin metastazları, karsinomatöz menenjit, aktif otoimmün hastalık veya sistemik immünosüpresyon gerektiren tıbbi koşullara sahip hastalar çalışmaya dahil edilmemiştir. Tedavi edilen beyin metastazları olan hastalar, kayıttan en az 2 hafta önce nörolojik olarak başlangıç seviyesine dönmüşlerse ve kortikosteroidleri kesmişlerse veya günde <10 mg prednizon eşdeğeri olan stabil veya azalan bir doz alıyorsa çalışmaya alınmıştır. Randomizasyon histolojiye (skuamöze karşı skuamöz olmayan), tümör PD-L1 ekspresyon düzeyine (≥%1'e karşı <%1) ve cinsiyete (erkek ve kadın) göre basamaklandırılmıştır.
Toplam 719 hasta, nivolumab ve platin bazlı kemoterapi ile kombinasyon halinde ipilimumab (n= 361) veya platin bazlı kemoterapi (n= 358) alacak şekilde randomize edilmiştir. Nivolumab ve platin bazlı kemoterapi ile kombinasyon halinde ipilimumab kolundaki hastalar, her 3 haftada bir 30 dakika boyunca intravenöz yoldan uygulanan 360 mg nivolumab ve 2 kür için her 3 haftada bir uygulanan platin bazlı kemoterapi ile kombinasyon halinde 6 haftada bir 30 dakika boyunca intravenöz yoldan uygulanan 1 mg/kg ipilimumab almıştır. Kemoterapi kolundaki hastalara 4 kür boyunca her 3 haftada bir platin bazlı kemoterapi uygulanmıştır; skuamöz olmayan hastaların isteğe bağlı pemetrekset idame tedavisi almasına izin verilmiştir.
Platin bazlı kemoterapi skuamöz olmayan KHDAK için karboplatin (EAA 5 ya da 6) ve pemetrekset 500 mg/m ya da sisplatin 75 mg/m ve pemetrekset 500 mg/mm veya skuamöz KHDAK için karboplatin (EAA 6) ve paklitaksel 200 mg/m içermiştir.
Tedavi, hastalık progresyonuna, kabul edilemez toksisiteye veya 24 aya kadar devam etmiştir. Hasta klinik olarak stabilse ve araştırmacı tarafından klinik fayda sağladığı kabul edilirse, hastalığın ilerlemesinden sonra devam eden tedaviye izin verilmiştir. İpilimumab'a atfedilen bir advers olay nedeniyle kombinasyon tedavisini bırakan hastaların nivolumab monoterapisine devam etmelerine izin verilmiştir. Tümör değerlendirmeleri, çalışma tedavisinin ilk dozundan sonra ilk 12 ay boyunca 6 haftada bir, daha sonra hastalık progresyonuna veya çalışma tedavisi kesilene kadar her 12 haftada bir yapılmıştır.
CA2099LA başlangıç özellikleri genel olarak tüm tedavi gruplarında dengelenmişti. Medyan yaş 65 (aralık: 26-86) olup, %51'i ≥ 65 yaşında ve %10'u ≥ 75 yaşındaydı. Hastaların çoğunluğu beyaz (%89) ve erkekti (%70). Başlangıç ECOG performans durumu 0 (%31) veya 1 (%68) iken hastaların
%57'sinde PD-L1≥ %1 ve %37'sinde PD-L1 < %1 idi, % 31'inde skuamöz ve %69'unda skuamöz olmayan histoloji vardı, %17'sinde beyin metastazı vardı ve %86'sı daha önce/halen sigara içiyordu. Hiçbir hasta daha önce immünoterapi almamıştır.
CA2099LA çalışmasının primer etkililik sonuç ölçümü OS idi. İlave etkililik sonlanım noktaları, BICR ile belirlenen ORR, PFS ve yanıt süresi idi.
Çalışma, 351 olay gözlemlendiğinde önceden belirlenmiş ara analizde tek başına platin bazlı kemoterapiye kıyasla nivolumab ve platin bazlı kemoterapi ile kombinasyon halinde ipilimumab koluna randomize edilen hastalarda OS, PFS ve ORR'de istatistiksel olarak anlamlı bir yarar olduğunu göstermiştir (son analiz için planlanan olay sayısının %87'si). OS için minimum takip süresi 8,1 aydı.
Etkililik sonuçları Şekil 9'da (minimum 12,7 aylık takip ile güncellenmiş OS analizi) ve Tablo 12'de (minimum 8.1 aylık takip ile birincil analiz) gösterilmektedir. Tüm hastalar en az 12,5 ay takip edildikten sonra güncellenmiş bir etkililik analizi yapılmıştır (Bkz. Şekil 9). Bu analiz sırasında, OS için risk oranı 0,66 (%95 GA: 0,55-0,80) ve PFS için risk oranı 0,68 (%95 GA: 0,57-0,82) idi.
Şekil 9 OS'ye ilişkin Kaplan-Meier eğrileri (CA2099LA)
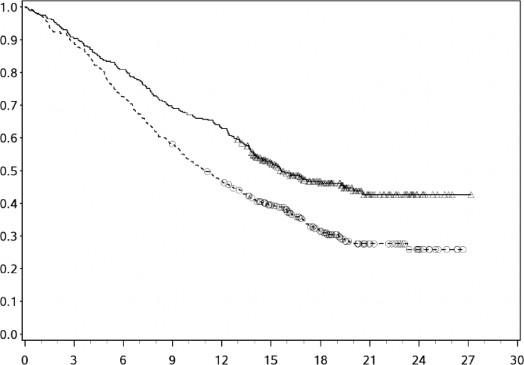
Sağkalım Olasılığı
Genel Sağkalım (Ay)
![]()
Tablo 11: Etkililik sonuçları (CA2099LA)
| nivolumab + ipilimumab + kemoterapi (n = 361) | kemoterapi (n = 358) |
Genel sağkalım | ||
Olaylar | 156 (%43,2) | 195 (%54,5) |
Risk oranı (%96.71 GA) | 0,69 (0,55-0,87) | |
Basamaklandırılmış log- sıralı p- değeri | 0,0006 | |
Medyan (ay) (%95 GA) | 14,1 (13,24-16,16) | 10,7 (9,46-12,45) |
6 ayda oran (%95 GA) | 80,9 (76,4-84,6) | 72,3 (67,4-76.7) |
Progresyonsuz sağkalım | ||
Olaylar | 232 (%64,3) | 249 (%69,6) |
Risk oranı (%97,48 GA) | 0,70 (0,57-0,86) | |
Basamaklandırılmış log-sıralı p-değeri | 0,0001 | |
Medyan (ay) (%95 GA) | 6,83 (5,55-7,66) | 4,96 (4,27-5,55) |
6 ayda oran (%95 GA) | 51,7 (46,2-56,8) | 35,9 (30,5-41,3) |
|
|
|
Genel yanıt oranı | 136 (%37,7) | 90 (%25,1) |
(%95 GA) | (32,7-42,9) | (20,7-30,0) |
Basamaklandırılmış CMH testi p-değeri | 0,0003 | |
Tam yanıt (CR) | 7 (%1,9) | 3 (%0,8) |
Kısmi yanıt (PR) | 129 (%35,7) | 87 (%24,3) |
|
|
|
Yanıt süresi | ||
Medyan (ay) (%95 GA) | 10,02 (8,21-3,01) | 5,09 (4,34-7,00) |
≥ 6 ay süre ile % | 74 | 41 |
Kombinasyon ve kemoterapi kollarındaki hastaların sırasıyla %28,8'i ve %41,1'i sistemik tedavi almıştır. Kombinasyon ve kemoterapi kollarındaki hastaların sırasıyla %3,9 ve %27,9'u daha sonra immünoterapi (anti-PD-1, anti-PD-L1 ve anti-CTLA4 dahil) almıştır.
CA2099LA çalışmasında, kemoterapiye göre bir tanımlayıcı alt grup analizinde, nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab ile tedavi edilen skuamöz histolojiye sahip hastalarda (HR [%95 GA] 0,65 [0,46-0,93], n = 227) ve skuamöz olmayan histolojiye sahip hastalarda (HR [%95 GA] 0,72 [0,55-0,93], n = 492) OS yararı gösterilmiştir.
Tablo 12'de, önceden tanımlanmış alt grup analizlerinde tümör PD-L1 ekspresyonuna göre OS, PFS ve ORR etkililik sonuçları özetlenmektedir.
Tablo 12: Tümör PD-L1 ekspresyonuna göre etkililik sonuçları (CA2099LA)
| nivolumab + ipilimuma b + kemotera pi |
kemoterapi | nivolumab + ipilimumab + kemotera pi |
kemoterapi | nivolumab + ipilimuma b + kemoterap i |
Kemoterapi | nivolumab + ipilimumab + kemoterap i |
kemoterapi |
| PD-L1 < %1 (n = 264) | PD-L1 ≥ %1 (n = 406) | PD- L1 ≥ 1% ile 49% (n = 233) | PD-L1 ≥ %50 (n = 173) | ||||
OS risk oranı (%95 GA) |
0,65 (0,46-0,92) |
0,67 (0,51-0,89) |
0,69 (0,48-0,98) |
0,64 (0,41-1,02) | ||||
PFS risk oranı (%95 GA) |
0,77 (0,57-1,03) |
0,67 (0,53-0,85) |
0,71 (0,52-0,97) |
0,59 (0,40-0,86) | ||||
ORR % | 31,1 | 20,9 | 41,9 | 27,6 | 37,8 | 24,5 | 48,7 | 30,9 |
CA2099LA çalışmasına ≥ 75 yaşında toplam 70 KHDAK hastası dahil edilmiştir (nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab kolundaki 37 hasta ve kemoterapi kolundaki 33 hasta). Bu çalışma alt grubunda kemoterapiye kıyasla nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab için OS'de 1,36 HR (%95 GA: 0,74-2,52) ve PFS'de 1,12 HR (%95 GA: 0,64- 1,96) gözlenmiştir. ORR, nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab kolunda
% 27 ve kemoterapi kolunda %15,2 idi. Yetmiş beş yaş ve üzeri hastaların %43'ü, nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab tedavisini bırakmıştır . Bu hasta popülasyonunda nivolumab ve kemoterapi ile kombinasyon halinde ipilimumabın etkililik ve güvenlilik verileri sınırlıdır.
Bir alt grup analizinde, daha önce hiç sigara içmemiş olan hastalarda kemoterapiye kıyasla nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab alan hastalarda azalan sağkalım yararı gözlenmiştir. Ancak düşük hasta sayısından dolayı bu verilerden kesin bir sonuç çıkarılamaz.
Malign plevral mezotelyoma
Kemoterapiye karşı nivolumab ile kombinasyon halinde ipilimumabın araştırıldığı randomize faz 3 çalışma (CA209743)
Her 2 haftada bir 3 mg/kg nivolumab ile kombinasyon halinde 6 haftada bir 1 mg/kg ipilimumabın güvenliliği ve etkililiği bir faz 3, randomize, açık etiketli çalışmada değerlendirilmiştir (CA209743). Çalışma, histolojik olarak teyit edilmiş ve daha önce tedavi edilmemiş epiteloid veya epiteloid olmayan histolojiye sahip malign plevral mezotelyoma bulunan, ECOG performans durumu 0 veya 1 olan ve ilk çalışma tedavisinden önceki 14 gün içinde palyatif radyoterapi uygulanmamış hastaları (18 yaş veya üzeri) içermiştir. Hastalar, tümör PD-L1 durumlarına bakılmaksızın çalışmaya kaydedilmiştir.
Primitif peritoneal, perikardiyal, testis veya tunika vajinalis mezotelyoması, interstisyel akciğer hastalığı, aktif otoimmün hastalığı, sistemik immünosüpresyon gerektiren tıbbi koşullar ve beyin metastazı olan hastalar (cerrahi olarak rezeke edilmedikçe veya stereotaksik radyoterapi ile tedavi edilmedikçe ve çalışmaya dahil edilmeden önceki 3 ay içinde herhangi bir gelişme olmadıkça)
çalışmaya dahil edilmemiştir. Randomizasyon, histolojiye (epitelioide karşı sarkomatoid veya karışık histoloji alt tipleri) ve cinsiyete (erkek ve kadın) göre basamaklandırılmıştır.
Toplam 605 hasta, nivolumab ile kombinasyon halinde ipilimumab (n = 303) veya kemoterapi (n = 302) almak üzere randomize edilmiştir. Nivolumab ile kombinasyon halinde ipilimumab kolundaki hastalar, 2 yıla kadar 2 haftada bir 30 dakika boyunca intravenöz yoldan uygulanan 3mg/kg nivolumab ile kombinasyon halinde 6 haftada bir 30 dakika boyunca intravenöz yoldan uygulanan 1 mg/kg ipilimumab almıştır. Kemoterapi kolundaki hastalar 6 küre kadar kemoterapi almıştır (her kür 21 gündü). Kemoterapi sisplatin 75 mg/m ve pemetrekset 500 mg/m veya karboplatin 5 EAA ve pemetrekset 500 mg/m terapilerini içermiştir.
Tedavi, hastalık progresyonuna, kabul edilemez toksisiteye veya 24 aya kadar devam etmiştir. Hasta klinik olarak stabilse ve araştırmacı tarafından klinik fayda sağladığı kabul edilirse, hastalığın ilerlemesinden sonra tedaviye izin verilmiştir. İpilimumaba atfedilen bir advers reaksiyon nedeniyle kombinasyon tedavisini bırakan hastaların nivolumab monoterapisine devam etmesine izin verilmiştir. Tümör değerlendirmeleri, çalışma tedavisinin ilk dozundan sonra ilk 12 ay boyunca 6 haftada bir, daha sonra hastalık progresyonuna veya çalışma tedavisi kesilene kadar her 12 haftada bir yapılmıştır.
CA209743 başlangıç özellikleri genel olarak tüm tedavi gruplarında dengeliydi. Medyan yaş 69 (aralık: 25-89) olup, hastaların %72'si ≥ 65 ve %26'sı ≥ 75 yaşındaydı. Hastaların çoğunluğu beyaz (%85) ve erkekti (%77). Başlangıç ECOG performans durumu 0 (%40) veya 1 (%60), hastaların %80'inde PD-L1 ≥ %1 ve hastaların %20'sinde PD-L1 < %1 idi, % 75'inde epiteloid ve
%25'inde epiteloid olmayan histoloji mevcuttu.
CA209743 primer etkililik sonuç ölçümü OS idi. Kilit ikincil etkililik sonlanım noktaları, plevral mezotelyoma için modifiye RECIST kriterleri kullanılarak BICR ile belirlenen PFS, ORR ve yanıt süresiydi. Bu ikincil sonlanım noktaları için tanımlayıcı analizler Tablo 14'de sunulmuştur.
Çalışma, 419 olay gözlemlendiğinde (nihai analiz için planlanan olay sayısının %89'u) önceden belirlenmiş ara analizde kemoterapiye kıyasla nivolumab ile kombinasyon halinde ipilimumab koluna randomize edilen hastalarda OS'de istatistiksel olarak anlamlı bir iyileşme göstermiştir. OS için minimum takip süresi 22 aydı.
Sağkalım Olasılığı
Şekil 10: OS'ye ilişkin Kaplan-Meier eğrileri (CA209743)
![]()
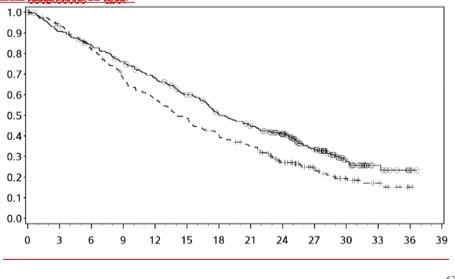
Genel sağkalım (ay)
Risk Altındaki Hasta Sayısı
Nivolumab + ipilimumab | ||||||||||||||
| 303 | 273 | 251 | 226 | 200 | 173 | 143 | 124 | 101 | 65 | 30 | 11 | 2 | 0 |
Kemoterapi | ||||||||||||||
| 302 | 268 | 233 | 190 | 162 | 136 | 113 | 95 | 62 | 38 | 20 | 11 | 1 | 0 |
--â—‹-- Nivolumab + ipilimumab (olaylar: 200/303), medyan ve %95 GA: 18,07 (16,82-21,45)
---+-- Kemoterapi (olaylar: 219/302), medyan ve %95 GA: 14,09 (12,45-16,23)
Tablo 13: Etkililik sonuçları (CA209743) | ||
| nivolumab + ipilimumab (n = 303) | kemoterapi (n = 302) |
Genel Sağkalım |
|
|
Olaylar | 200 (%66) | 219 (%73) |
Risk oranı (%96,6 GA) | 0,74 (0,60-0,91) |
|
Basamaklandırılmış log-sıralı p- değeri | 0,002 |
|
Medyan (ay) (%95 GA) | 18,1 (16,8-21,5) | 14,1 (12,5-16,2) |
24 ayda oran (%95 GA) | %41 (35,1-46,5) | %27 (21,9-32,4) |
Progresyonsuz sağkalım |
|
|
Olaylar | 218 (%72) | 209 (%69) |
Risk oranı (%95 GA) | 1,0 (0,82-1,21) |
|
Medyan (ay) (%95 GA) | 6,8 (5,6-7,4) | 7,2 (6,9-8,1) |
Genel yanıt oranı | %40 | %43 |
(%95 GA) | (34,1-45,4) | (37,1-48,5) |
Tam yanıt (CR) | %1,7 | 0 |
Kısmi yanıt (PR) | %38 | %43 |
Yanıt süresi |
|
|
Medyan (ay) (%95 GA) | 11 (8,1-16,5) | 6,7 (5,3-7,1) |
Kombinasyon ve kemoterapi kollarındaki hastaların sırasıyla %44,2 ve %40,7'si daha sonra sistemik tedavi almıştır. Kombinasyon ve kemoterapi kollarındaki hastaların sırasıyla %3,3 ve %20,2'si daha sonra immünoterapi (anti-PD-1, anti-PD-L1 ve anti - CTLA - 4 dahil) almıştır.
Tablo 14'de, önceden belirlenmiş alt grup analizlerinde histolojiye göre OS, PFS ve ORR etkililik sonuçları özetlenmektedir.
Tablo 14: Histolojiye göre etkililik sonuçları (CA209743) | ||||
| Epiteloid (n = 471) |
| Epiteloid olmayan (n = 134) |
|
| nivolumab + ipilimumab (n = 236) | kemoterapi (n = 235) | nivolumab + ipilimumab (n = 67) | kemoterapi (n = 67) |
Genel sağkalım |
|
|
|
|
Olaylar | 157 | 164 | 43 | 55 |
Risk oranı (%95 GA) | 0,85 (0,68- 1.06) |
| 0,46 (0,31-0,70) |
|
Medyan (ay) (%95 GA) | 18,73 (17,05-21,72) | 16,23 (14,09-19,15) | 16,89 (11,83-25,20) | 8,80 (7,62-11,76) |
24 ayda oran (%95 GA) | 41,2 (34,7-47,6) | 31,8 (25,7-38,1) | 39,5 (27,5-51,2) | 9,7 (3,8-18,9) |
Progresyonsuz sağkalım | ||||
Risk oranı (%95 GA) | 1,14 (0,92- 1,41) |
| 0,58 (0,38-0,90) |
|
Medyan (ay) (%95 GA) | 6,18 (5,49-7,03) | 7,66 (7,03-8,31) | 8,31 (3,84-11,01) | 5,59 (5,13-7,16) |
Genel yanıt oranı | %38,6 | %47,2 | %43,3 | %26,9 |
(%95 GA) | (32,3-45,1) | (40,7-53,8) | (31,2-56,0) | (16,8-39,1) |
Yanıt süresi | 8,44 | 6,83 | 24,02 | 4,21 |
Medyan (ay) (%95 GA) | (7,16-14,59) | (5,59-7,13) | (8,31-NA) | (2,79-7,03) |
Tablo 15'de, önceden belirlenmiş alt grup analizlerinde başlangıç tümör PD-L1 ekspresyonuna göre OS, PFS ve ORR etkililik sonuçları özetlenmektedir.
Tablo 15: Tümör PD-L1 ekspresyonuna göre etkililik sonuçları (CA209743) | ||||
| PD-L1 < %1 (n = 135) |
| PD-L1 ≥ %1 (n = 451) |
|
| ipilimumab + nivolumab (n = 57) | kemoterapi (n = 78) | ipilimumab + nivolumab (n = 232) | kemoterapi (n = 219) |
Genel sağkalım |
|
|
|
|
Olaylar | 40 | 58 | 150 | 157 |
Risk oranı | 0,94 |
| 0,69 |
|
(%95 GA) | (0,62-1,40) | (0,55-0,87) | ||
Medyan (ay) | 17,3 | 16,5 | 18,0 | 13,3 |
(%95 GA) | (10,1-24,3) | (13,4-20,5) | (16,8-21,5) | (11,6-15,4) |
24 ayda oran (%95 | 38,7 | 24,6 | 40,8 | 28,3 |
GA) | (25,9-51,3) | (15,5-35,0) | (34,3-47,2) | (22,1-34,7) |
Progresyonsuz sağkalım | ||||
Risk oranı | 1,79 |
| 0,81 |
|
(%95 GA) | (1,21-2,64) | (0,64-1,01) | ||
Medyan (ay) | 4,1 | 8,3 | 7,0 | 7,1 |
(%95 GA) | (2,7-5,6) | (7,0-11,1) | (5,8-8,5) | (6,2-7,6) |
Genel yanıt oranı | %21,1 | %38,5 | %43,5 | %44,3 |
(%95 GA) | (11,4-33,9) | (27,7-50,2) | (37,1-50,2) | (37,6-51,1) |
CA209743 çalışmasına 75 yaş ve üzeri toplam 157 MPM hastası kaydedilmiştir (nivolumab ile kombinasyon halinde ipilimumab kolunda 78 ve kemoterapi kolunda 79). Bu çalışma alt grubunda kemoterapiye kıyasla nivolumab ile kombinasyon halinde ipilimumab kolunda OS'de 1,02'lik risk oranı (% 95 GA: 0,70-1,48) gözlenmiştir. Nivolumab ile kombinasyon halinde ipilimumab alan tüm hastalara kıyasla 75 yaş ve üstü hastalarda daha yüksek ciddi advers reaksiyon ve advers reaksiyonlara bağlı olarak tedaviyi bırakma oranı görülmüştür (bkz. bölüm 4.8). Ancak, bu alt grup analizinin keşifsel doğası nedeniyle, kesin sonuçlara varılamaz.
5.2. Farmakokinetik özellikler
i Genel özelliklerEmilim:
YERVOY terapötik bir protein olup, sadece intravenöz bir infüzyon olarak melanomun tedavisi için uygulanır. Dolayısıyla, YERVOY için emilim ve biyoyararlanım değerlendirmesi geçerli değildir.
Dağılım:
Popülasyon farmakokinetik analizine dayanarak, YERVOY için aşağıdaki ortalama (yüzde varyasyon katsayısı) parametreler elde edilmiştir: kararlı durumdaki dağılım hacmi 7,47 L (%10,1) olmuştur. 3 mg/kg indüksiyon rejimi ile kararlı durumda elde edilen ortalama (yüzde varyasyon katsayısı) YERVOY C19,4 mikrogram/mL (%74,6) olmuştur.
Biyotransformasyon:
YERVOY'un insanlarda metabolizmasını ve metabolik yolaklarını değerlendirmek üzere klinik farmakoloji çalışmaları yapılmamıştır. Terapötik proteinlerin çoğu gibi, ipilimumab, karaciğer sitokromu P-450 (CYP) veya diğer metabolize edici enzimlerle metabolize olmaz ve inhibisyon ve indüksiyon bakımından CYP'ler veya diğer metabolize edici enzimler üzerinde herhangi bir etkiye sahip olma olasılığı yoktur. Dolayısıyla, YERVOY'un anlamlı metabolizma bazlı ilaç-ilaç etkileşimleri olması olasılığı yoktur.
YERVOY gibi monoklonal antikorlar, CYP'lerin veya taşıyıcıların aşağı regülasyonu ile CYP450 substratları olan ilaçların sistemik konsantrasyonlarındaki değişimler ve sitokinlerin salınımı yoluyla küçük moleküllerin farmakokinetiği ile etkileşime girebilir. CYP izozimleri (özellikle CYP2C8, CYP3A4, CYP1A2 ve CYP2E1) substratları (paklitaksel [175 mg/m] ve DTIC [850 mg/m]) ile potansiyel etkileşimi değerlendiren bir klinik çalışma (CA184078) yapılmıştır (bkz. Bölüm 4.5).
Eliminasyon:
Popülasyon farmakokinetik analizine dayanarak, YERVOY için aşağıdaki ortalama (yüzde varyasyon katsayısı) parametreler elde edilmiştir: sistemik CL 16,8mL/sa (%38,1) ve terminal yarılanma ömrü 15,4 gün (%34,4) olmuştur ve bunlar, insan monoklonal antikorlarının eliminasyonu ile uyumludur.
YERVOY CL'si, başlangıçta vücut ağırlığındaki artış ve laktat dehidrojenaz (LDH) arttıkça yükselmiştir; ancak, mg/kg bazında uygulama sonrasında, yükselmiş LDH veya vücut ağırlığı için doz ayarlaması gerekmez. CL yaş (aralık: 23-88 yaş), cinsiyet, eşzamanlı budesonid veya dakarbazin kullanımı, performans durumu, HLA-A2*0201 durumu, hafif karaciğer yetmezliği, böbrek yetmezliği, immünojenisite ve önceki anti-kanser tedavilerinden etkilenmemiştir.
Doğrusallık/ Doğrusal olmayan durum:
YERVOY'un farmakokinetiği 0,3 ilâ 10 mg/kg arasında değişen indüksiyon dozlarını alan 3 haftada bir 4 doz uygulanmış 785 ileri evre melanom hastasında araştırılmıştır. YERVOY'un C, Cve EAA incelenen doz aralığında doz ile orantılı bulunmuştur. Her 3 haftada bir tekrarlanan YERVOY dozlarında, klirens (CL) zamana göre değişmemiş olarak bulunmuş ve akümülasyon indeksi 1,5 kat veya daha düşük olmak üzere belirgin olarak minimal bir sistemik akümülasyon gözlenmiştir. Üçüncü doz ile YERVOY kararlı duruma ulaşmıştır.
Hastalardaki karakteristik özellikler
İleri evre melanomlu 497 hastada yapılan maruziyet-yanıt analizine göre, OS önceki sistemik anti kanser tedavilerinden bağımsızdı ve daha yüksek YERVOY Cminss plazma konsantrasyonları ile birlikte artmıştır.
Irk:
Beyaz ırka ait olmayan etnik gruplarda yeterli veri bulunmadığından ırkın etkisi incelenmemiştir.
Böbrek yetmezliği:
YERVOY'un böbrek yetmezliği olan hastalardaki farmakokinetiğinin değerlendirilmesi için hiçbir kontrollü çalışma yapılmamıştır.
Metastatik melanomlu hastalarla yapılan klinik çalışmalardan elde edilen verilerin popülasyon farmakokinetik analizinde, önceden mevcut hafif ve orta şiddetli böbrek yetmezliği, YERVOY CL'sini etkilememiştir. Önceden mevcut ciddi böbrek yetmezliği ile klinik ve farmakokinetik veriler sınırlıdır; doz ayarlamasının gerekli olup olmadığı belirlenememektedir.
Karaciğer yetmezliği:
Metastatik melanomlu hastalarla yapılan klinik çalışmalardan elde edilen verilerin popülasyon farmakokinetik analizinde, önceden mevcut hafif karaciğer yetmezliği, YERVOY CL'sini etkilememiştir. Önceden mevcut hafif karaciğer yetmezliği ile klinik ve farmakokinetik veriler sınırlıdır; doz ayarlamasının gerekli olup olmadığı belirlenememektedir. Klinik çalışmalarda önceden mevcut ciddi karaciğer yetmezliği olan hastalar tanımlanmamıştır.
Pediyatrik popülasyon:
Faz 4, 2 yetişkin çalışmasından (N=521) ve 2 pediyatrik çalışmadan (N=44) 565 hastadan elde edilen mevcut birleştirilmiş verileri kullanan bir popülasyon FK analizine göre, artan başlangıç vücut ağırlığı ile YERVOY'un CL'si artmıştır. Yaş (2-87 yaş) YERVOY'un CL'si üzerinde klinik olarak önemli bir etkiye sahip değildi. Tahmini geometrik ortalama CL, 12 yaşında ve daha büyük ila 18 yaşından küçük yaş arası adolesan hastalarda 8,72 mL/sa'dır. Adolesanlardaki maruziyet, aynı mg/kg dozunu alan yetişkinlerdeki maruziyetlerle karşılaştırılabilirdir. Yetişkinlerde ve pediyatrik popülasyondaki simülasyona göre, yetişkinlerde ve pediyatrik popülasyonda her 3 haftada bir önerilen 3 mg/kg dozunda karşılaştırılabilir maruziyet elde edilmiştir.
Farmakokinetik/farmakodinamik ilişkiler
Nivolumab ile kombinasyon halinde YERVOY: YERVOY 1 mg/kg, nivolumab 3 mg/kg ile kombinasyon halinde uygulandığında, YERVOY CL'si %1,5 azalmış ve nivolumab CL'si %1 artmış olup, klinik açıdan ilgili kabul edilmemiştir. YERVOY 3 mg/kg, nivolumab 1 mg/kg ile kombinasyon halinde uygulandığında, YERVOY CL'si %9 artmış ve nivolumab CL'si %29 artmış olup, klinik açıdan ilgili kabul edilmemiştir.
Nivolumab ile kombinasyon halinde uygulandığında, YERVOY CL'si anti-YERVOY antikorlarının varlığında %5,7 artmış ve nivolumab CL'si anti-nivolumab antikorlarının varlığında %20 artmıştır. Bu değişiklikler klinik olarak ilgili kabul edilmemiştir.
Nivolumab ve kemoterapi ile kombinasyon halinde YERVOY:
6 haftada bir YERVOY 1 mg/kg 3 haftada bir nivolumab 360 mg ve 2 kür kemoterapi ile kombinasyon halinde uygulandığında, ipilimumab CL değeri yaklaşık %22 artmış ve nivolumab CL değeri yaklaşık %10 düşmüş ve bu düşüş klinik olarak anlamlı kabul edilmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Maymunlarda yapılan intravenöz dozların tekrarlandığı toksikoloji çalışmalarında YERVOY genelde iyi tolere edilmiştir. İmmünite ile ilişkili advers reaksiyonlar nadiren (~3%) gözlemlenmiş ve kolit (tek bir ölüm vakası ile sonuçlanmıştır), dermatit ve infüzyon reaksiyonunu (muhtemelen yüksek enjeksiyon hızından kaynaklanan akut sitokin salımı nedeniyle) içermiştir. Bir çalışmada eşlik eden histopatolojik bulgular olmaksızın tiroid ve testislerin ağırlığında düşüş olduğu görülmüştür ve bu bulgunun klinik ilgisi bilinmemektedir.
YERVOY'un prenatal ve postnatal gelişimdeki etkileri sinomolgus maymunlarında yapılan bir çalışmada araştırılmıştır. Hamile maymunlar, doğuma kadar ilk trimesterde organogenezin başlangıcından itibaren 3 haftada bir, klinik 3 mg/kg YERVOY dozu ile ilişkili olanlara benzer veya onlardan yüksek maruziyet (EAA) düzeylerinde YERVOY almışlardır. Hamileliğin ilk iki trimesterı sırasında üreme üzerinde tedavi ilişkili hiçbir yan etki tespit edilmemiştir. Üçüncü trimesterdan başlayarak, her iki YERVOY grubundaki kürtaj, ölü doğum, prematüre doğum (ve bununla ilişkili olarak düşük doğum ağırlığı) ve bebek mortalitesi insidansı kontrol hayvanlarına göre daha yüksek
olmuştur; bu bulguların doza bağlı olduğu tespit edilmiştir. Ayrıca, ana rahminde YERVOY'a maruz kalan 2 bebeğin ürogenital sisteminde harici ve viseral gelişimsel anomaliler tespit edilmiştir. Bir dişi bebekte sol böbrekte ve üreterde tek taraflı böbrek agenezisi ve bir erkek bebekte imperforat üretra ve bununla ilişkili üriner obstrüksiyon ve subkütan skrotal ödem görülmüştür. Bu malformasyonların tedavi ile ilişkisi açık değildir.
YERVOY'un mutajenik ve karsinojenik potansiyelini değerlendirecek çalışma yapılmamıştır. Fertilite çalışmaları yapılmamıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Tris hidroklorür (2-amino-2-hidroksimetil-1,3-propanediol hidroklorür) Sodyum klorür
Mannitol (E421)
Pentetik asit (dietilenetriaminepentaasetik asit) Polisorbat 80
Sodyum hidroksit (pH ayarı için) Hidroklorik asit (pH ayarı için) Enjeksiyonluk su
6.2. Geçimsizlikler
Geçimlilik çalışmaları bulunmadığından bu tıbbi ürün diğer tıbbi ürünler ile karıştırılmamalıdır.
6.3. Raf ömrü
Açılmamış flakon: 36 ay Açıldıktan sonra:İnfüzyon solüsyonu: mikrobiyolojik bakış açısından, bir kere açıldıktan sonra, tıbbi ürünün infüzyonu
ya da dilüsyonu ve infüzyonu hemen yapılmalıdır. İnfüzyon solüsyonu (dilüe edilmiş ya da edilmemiş) açıldıktan sonra hemen kullanılmazsa 2°-8°C'de buzdolabında ya da 25'nin altındaki oda sıcaklığında 24 saate kadar saklanabilir.
6.4. Saklamaya yönelik özel tedbirler
2 -8°C arasında (buzdolabında) saklayınız. Dondurmayınız.
Işıktan korumak için orijinal ambalajında saklayınız.
Tıbbi ürünün ilk açılışından veya dilüe edilmesinden sonraki saklama şartları için bkz. Bölüm 6.3.
6.5. Ambalajın niteliği ve içeriği
Tıpalı (butil lastik kaplanmış) ve “flip off†mühürlü (alüminyum) bir flakonda (Tip I cam) 40 mL konsantre. 1'lik ambalaj.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Hazırlama aşaması, özellikle asepsi ile ilgili olarak iyi uygulamalara ilişkin kurallara uygun olarak eğitimli personel tarafından gerçekleştirilmelidir.
Dozun hesaplanması:
YERVOY monoterapisi veya nivolumab ile kombinasyon halinde YERVOY:
Hasta için reçete edilen doz mg/kg cinsinden verilir. Reçete edilen bu doza dayanılarak uygulanacak toplam doz hesaplanır. Hastaya tam doz uygulanabilmesi için birden fazla YERVOY konsantresi flakonu gerekli olabilir.
Her bir 10 mL'lik YERVOY konsantresi flakonu 50 mg ipilimumab, her bir 40 mL'lik flakon ise 200 mg ipilimumab içermektedir.
 Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür.
Lösemi Kan Kanseri
Lösemi, kan kanseridir ve vücudunun kan oluşturan dokularının hastalanması anlamına gelir. Birçok lösemi türü vardır; bazı lösemi türleri çocuklarda bazıları da yetişkinlerde sık görülür. |
 Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir.
Mide Kanseri
Mide kanseri genellikle mideyi tümüyle kaplayan ve mukus üretmekle görevli hücrelerde başlar. Bu kanser tipine adenokarsinom denir. |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Kalp Krizi Kalbe giden kan akışı durduğunda kalp krizi meydana gelir. |
İLAÇ GENEL BİLGİLERİ
Bristol-Myers Squibb İlaçları Inc.
| Geri Ödeme Kodu | A15633 |
| Satış Fiyatı | 214370.64 TL [ 8 Aug 2025 ] |
| Önceki Satış Fiyatı | 214370.64 TL [ 1 Aug 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kırmızı Reçeteli bir ilaçdır. |
| Barkodu | 8699726764109 |
| Etkin Madde | Ipilimumab |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |