YERVOY 50mg/10ml IV infüzyonluk çözelti konsantreSI içeren 1 flakon Farmakolojik Özellikler
{ Ipilimumab }
5. FARMAKOLOJİK ÖZELLİKLER
İ
5.1. Farmakodinamik özellikler
i
Farmakoterapötik grup: Antineoplastik ajanlar, monoklonal antikorlar, ATC kodu: L01FX04.
Etki mekanizması
Sitotoksik T-lenfosit antijeni (CTLA-4) T-hücresi aktivasyonunun önemli bir regülatörüdür. YERVOY, CTLA-4 yolağıyla indüklenen T hücresi inhibe edici sinyalleri bloke eden bir CTLA-4 immün kontrol noktası inhibitörüdür ve tümör hücrelerine karşı doğrudan bir T hücresi immün saldırısına geçmek için harekete geçen reaktif T efektör hücrelerin sayısını arttırmaktadır. CTLA-4 blokajı, düzenleyici T hücrelerinin işlevini de azaltabilir ve bu durum bir anti-tümör immün yanıtına katkıda bulunabilir. YERVOY tümör bölgesindeki düzenleyici T hücrelerini seçici olarak tüketebilir ve bu da tümör içi efektör T/düzenleyici T hücre oranının artmasına yol açarak tümör hücrelerinin ölümünü tetikleyebilir.
Farmakodinamik etkileri
YERVOY alan melanom hastalarında periferal kandaki mutlak lenfosit sayımı (ALC) indüksiyon dozu süreci boyunca artmıştır. Faz 2 çalışmalarda bu artış doza bağlıdır. MDX010-20'de (bkz. Bölüm 5.1), gp100 ile birlikte ya da tek başına uygulanan 3 mg/kg YERVOY, indüksiyon dozu sürecinde ALC'yi yükseltmiş, ancak araştırma amaçlı tek başına gp 100 peptid aşısı alan kontrol grubu hastalarında anlamlı bir ALC değişikliği görülmemiştir. Melanom hastalarının periferal kanında YERVOY tedavisinden sonra aktive HLA-DR+ CD4+ ve CD8+T hücrelerinin yüzdesinde ortalama bir artış gözlenmiştir: bu gözlemler etki mekanizması ile uyumludur. YERVOY tedavisinden sonra merkezî hafıza (CCR7+ CD45RA-) CD4+ ve CD8+ T hücrelerinin yüzdesinde ortalama bir yükselme ve efektör hafıza (CCR7- CD45RA-) CD8+ T hücrelerinin yüzdesinde ise daha az ancak anlamlı bir ortalama yükselme de gözlenmiştir.
Klinik etkililik ve güvenlilik
Nivolumab ile kombinasyon halinde YERVOY
YERVOY ile kombinasyon tedavisini takiben monoterapi olarak verilen nivolumab için doz önerileri ile ilişkili klinik etkililik ve güvenlilik hakkında daha fazla bilgi için lütfen nivolumab KÜB'üne bakınız.
Doz/maruziyet etkililik ve güvenlilik ilişkilerinin modellenmesine dayanarak, her 2 haftada bir 240 mg veya her 2 haftada bir 3 mg/kg nivolumab arasında etkililik ve güvenlilik açısından klinik olarak anlamlı bir fark bulunmamaktadır. Ek olarak, bu ilişkilere dayanarak, ileri evre melanom ve RHK'de 4 haftada bir 480 mg veya her 2 haftada bir 3 mg/kg nivolumab dozu arasında klinik olarak anlamlı bir fark görülmemiştir.
YERVOY monoterapisi ile Klinik Çalışmalar
Melanom
Daha önce tedavi edilmiş ve ileri evre (rezeke edilemeyen veya metastatik) melanom hastalarında önerilen 3 mg/kg YERVOY dozunda genel sağkalım (OS) avantajı bir Faz 3 çalışmada (MDX010- 20) kanıtlanmıştır. Oküler melanom, primer MSS melanomu, aktif beyin metastazları, insan immün yetmezlik virüsü (HIV), hepatit B ve hepatit C görülen hastalar, MDX010-20 klinik çalışmasına dahil edilmemiştir. Klinik çalışmaya ECOG (The Eastern Cooperative Oncology Group â Doğu Kooperatif Onkoloji Grubu) performans durumu >1 olan ve mukozal melanom görülen hastalar dahil edilmemiştir. Karaciğer metastazı görülmeyen ve başlangıçta AST değeri >2,5 x ÜNL olan hastalar, karaciğer metastazı görülen ve başlangıçta AST değeri >5 x ÜNL olan hastalar ve başlangıçta total bilirubin değeri ≥ 3 x ÜNL olan hastalar da çalışmaya dahil edilmemiştir.
Otoimmün hastalık geçmişi olan hastalar için bkz. Bölüm 4.4.
MDX010-20
Aşağıdakilerden birini ya da daha fazlasını içeren rejimler ile önceden tedavi görmüş olan ileri evre (rezeke edilemeyen veya metastatik) melanom hastalarının kaydolduğu çift kör, bir Faz 3 çalışmasıdır: IL-2, dekarbazin, temozolomid, fotemustin, veya karboplatin. Hastalar 3:1:1 oranında randomize edilmiş ve 3 mg/kg YERVOY + araştırma amaçlı gp 100 peptid aşısı (gp100), 3 mg/kg YERVOY monoterapisi ya da sadece gp100 almışlardır. Hastaların tamamı HLA-A2*0201 tipindedir; bu HLA tipi immün gp100 varlığını destekler. Hastalar, başlangıç BRAF mutasyon durumundan bağımsız olarak kaydedilmiştir. Hastalar, toleranslarına göre, 4 doz YERVOY'u 3 haftada bir almışlardır (indüksiyon tedavisi). İndüksiyon dönemi bitmeden tümör yüklerindeki artış belirgin olan hastalar performans durumlarının uygun olması şartıyla, tolere ettikleri sürece, indüksiyon tedavisine devam etmişlerdir. YERVOY'a verilen tümör yanıtı indüksiyon tedavisi tamamlandıktan sonra yaklaşık 12. haftada değerlendirilmiştir.
Tümörün ilk değerlendirmesinden >3 ay sonra, başlangıçtaki klinik yanıtın (PR veya CR) ardından veya stabil hastalık (SD) (modifiye DSÖ kriterlerine göre) ardından progresif hastalık (PD) geliştiren kişilere YERVOY ile ilave tedavi (tekrar tedavi) önerilmiştir. Primer sonlandırma kriteri gp100 grubuna karşı YERVOY + gp100 grubunda genel sağkalımdı (OS). Başlıca sekonder sonlandırma kriterleri YERVOY monoterapi grubuna karşı YERVOY+gp100 grubunda ve gp100 grubuna karşı YERVOY monoterapi grubunda OS idi.
Toplam 676 hasta randomize edilmiştir: 137'si YERVOY monoterapi grubuna, 403'ü YERVOY + gp100 grubuna, 136'sı da sadece gp100 grubuna. Büyük bir bölümü, indüksiyon sırasında 4 dozun hepsini de almıştır. Otuz iki hasta bir tekrar tedavi almıştır: bunların 8'i YERVOY monoterapi grubunda, 23'ü YERVOY + gp100 grubunda ve 1'i de gp100 grubundadır. Takip süresi 55 ay devam etmiştir. Başlangıç karakteristikleri gruplar arasında iyi dengelenmişti. Ortanca yaş 57'ydi. Hastaların çoğunluğunun (%71-73) M1c evresinde hastalığı vardı ve hastaların %37-40âının başlangıç laktat dehidrojenazı (LDH) yüksekti. Toplam 77 hastanın daha önce tedavi edilmiş beyin metastazı hikayesi vardı.
YERVOY içeren rejimler gp100 kontrol grubuna karşı istatistiksel olarak anlamlı bir OS avantajı elde etmiştir. OS karşılaştırmasında YERVOY monoterapisi ile gp100 arasındaki risk oranı (HR) 0,66 (%95 GA: 0,51, 0,87; p = 0,0026) olmuştur.
Alt grup analizinde, genel sağkalım (OS) yararının hasta alt gruplarının büyük bir kısmının içerisinde tutarlıydı (M [metastaz]-evre, önceki interlökin-2, başlangıçtaki LDH, yaş, cinsiyet ve önceki tedavi tipi ve sayısı). Ancak, 50 yaşın üzerindeki kadınlarda YERVOY tedavisinin OS yararını destekleyen
veriler sınırlıdır. Alt grup analizi az sayıda hastayı içerdiğinden, bu verilerden kesin sonuçlar çıkartılamamaktadır.
1 ve 2 yıldaki ortanca ve tahmin edilen OS oranları Tablo 7'de verilmiştir.
Tablo 7: | MDX010-20'de Genel Sağkalım |
| |
| YERVOY 3 mg/kg n= 137 | gp 100 n= 136 | |
Ortanca Aylar (%95 GA) | 10 ay (8, 13,8) | 6 ay (5,5, 8,7) | |
1 yılda % OS | (%95 GA) | %46 (37, 54,1) | %25 (18,1, 32,9) |
2 yılda % OS | (%95 GA) | %24 (16, 31,5) | %14 (8, 20) |
3 mg/kg YERVOY monoterapi grubunda ortanca OS, sırasıyla SD olan hastalarda 22 ay ve PD olanlarda 8 ay olmuştur. Bu analiz yapılırken CR ya da PR geliştiren hastaların ortancalarına ulaşılmamıştı.
Tekrar tedavi gereken hastalar için BORR, YERVOY monoterapi grubunda %38 (3/8 hasta) ve gp100 grubunda %0 olmuştur. Hastalık kontrol oranı (DCR, CR+PR+SD olarak tanımlanır) sırasıyla %75 (6/8 hasta) ve %0 olmuştur. Bu analizlerde hasta sayısının sınırlı olmasından dolayı YERVOY'un tekrar tedavi etkisi tam olarak bilinmemektedir.
YERVOY tedavisini takiben sistemik kortikosteroid kullanılarak veya kullanılmadan klinik aktivite benzer şekilde gelişmiş veya korunmuştur.
CA184-169
Bir çift kör, Faz 3 çalışmaya daha önce tedavi görmüş ya da tedavi görmemiş rezeke edilemeyen Evre III ya da Evre IV melanom hastaları kaydolmuştur. Toplam 727 hasta, 4 doza kadar her 3 haftada bir 362'si YERVOY 3 mg/kg ve 365'i YERVOY 10 mg/kg alacak şekilde randomize edilmiştir. YERVOY 10 mg/kg grubunda ortanca OS (%95 GA) 16 ay (11,63, 17,84) ve YERVOY 3 mg/kg
grubunda ortanca OS (%95 GA) 12 aydı (9,86, 13,27). YERVOY 10 mg/kg ve 3 mg/kg grupları
arasında karşılaştırılan genel sağkalım HR = 0,84 (%95 GA: 0,70, 0,99; P-değeri = 0,04) göstermiştir. 10 mg/kg ve 3 mg/kg grupları arasında progresyonsuz sağkalımda (PFS) istatistiksel açıdan anlamlı fark gözlemlenmemiştir. (HR 0,89, %95 GA 0,76, 1,04 ve log-sıra testi P-değeri = 0,1548). BORR,
10 mg/kg ve 3 mg/kg gruplarında benzerdi. BORR, 10 mg/kg grubunda %15,3 (%95 GA: 11,8, 19,5)
ve 3 mg/kg grubunda %12,2 (%95 GA: 9, 16) idi. YERVOY 10 mg/kg, 3 mg/kg doz ile karşılaştırıldığında daha yüksek advers olay oranları ile ilişkilendirilmiştir. 10 mg/kg ve 3 mg/kg gruplarındaki ciddi advers reaksiyon sıklıkları %37% ve %18 olup, en yaygın 3 advers reaksiyon diyare (%10,7'ye %5,5), kolit (%8'e %3) ve hipofizitti (%4,4'e %1,9). 10 mg/kg ve 3 mg/kg gruplarında tedavinin kesilmesine neden olan advers olaylar sırasıyla hastaların %31'i ve %19'unda meydana gelmiş olup, 4 ve 2 hastada ölüme neden olan AO'lar meydana gelmiştir.
Önerilen 3 mg/kg dozunda, ortanca OS, genel popülasyona kıyasla 50 yaşındaki ve üstündeki kadınların alt grubunda benzerdi: (11,40 aya 11,53). Başlangıçta beyin metastazları olan alt gruptaki ortanca OS önerilen 3 mg/kg dozunda 5,67 aydı.
YERVOY monoterapisi ile diğer çalışmalar Melanom
CA184332 ve CA184338
Birleştirilmiş Faz 2 ve 3 klinik çalışmalarda daha önce kemoterapi görmemiş olan hastalarda (N=78: randomize edilen) ve iki retrospektif gözlem çalışmasındaki daha önce tedavi edilmemiş hastalarda (N=273 ve N=157) YERVOY 3 mg/kg monoterapisi ile elde edilen OS, genel olarak tutarlıdır. İki gözlem çalışmasında, hastaların %12,1 ve 33,1'inde ileri evre melanom teşhisi sırasında beyin metastazı mevcuttu. Ortanca OS ve tahmini 1 yıllık, 2 yıllık, 3 yıllık ve 4 yıllık sağkalım oranları Tablo 8'de sunulmaktadır. Birleştirilmiş Faz 2 ve 3 klinik çalışmalarda daha önce kemoterapi görmemiş olan hastalarda (N=78) tahmini 1 yıllık, 2 yıllık ve 3 yıllık sağkalım oranları, sırasıyla
%54,1 (%95 GA: 42,5 â 65,6), %31,6 (%95 GA: 20,7 â 42,9) ve %23,7 (%95 GA: 14,3 â 34,4) idi.
Tablo 8: Gözlem çalışmalarında genel sağkalım | ||
| CA184338 n= 273 | CA184332 n= 157 |
Ortanca OS (%95 GA) | 14 ay (12,8-18,7) | 10 ay (7-12,8) |
1.yılda % OS (%95 GA) | %59 (52,5-64,3) | %44 (35,5, 51,4) |
2.yılda % OS (%95 GA) | %39 (33,1-44,8) | %26 (18,9-33,3) |
3.yılda % OS (%95 GA) | %31 (25,5-36,7) | %22 (15,5-29,2) |
4.yılda % OS (%95 GA) | %26 (20,4-31,3) | %22 (15,5-29,2) |
CA184332 çalışmasında beyin metastazı olan hastalarda ortanca genel sağkalım 7 ay (%95 GA: 5,06 â 12,81) ve beyin metastazı olmayan hastalarda ortanca genel sağkalım 14,1 ay (%95 GA: 9,96- tahmin edilemiyor) bulunmuştur.
CA184338 çalışmasında beyin metastazı olan hastalarda ortanca genel sağkalım 6,3 ay (%95 GA: 3,2 â 12) ve beyin metastazı olmayan hastalarda ortanca genel sağkalım 17,7 ay (%95 GA: 13,6 â 12,1) bulunmuştur.
YERVOY (3mg/kg'da) tedavisinin uzun dönemli sağkalım yararı önceden tedavi görmüş ve hiç tedavi görmemiş ileri melanomlu hastalarda (N = 965) yapılan klinik çalışmalardan alınan OS verilerinin birleştirilmiş analiziyle gösterilmektedir. Kaplan-Meier OS eğrisi yaklaşık 3. yılda başlayan ve bazı hastalarda 10 yıla kadar uzayan bir platoyu ortaya koymuştur (OS oranı = %21 [%95 GA: 17-24]) (bkz. Şekil 1).
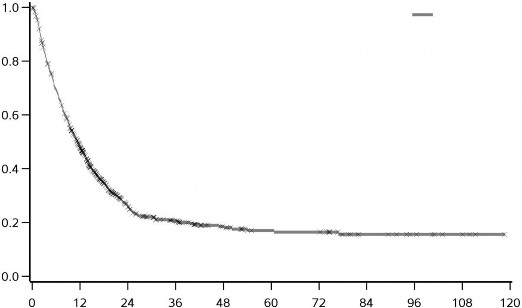
3.0
mg/kg
Genel Sağkalım (oran)
Şekil 1: Birleştirilmiş analizde YERVOY 3 mg/kg ile Genel Sağkalım
Süre (ay)
Risk altında olanlar | |||||||||||
3 mg/kg | 965 | 429 | 127 | 73 | 41 | 29 | 28 | 12 | 8 | 4 | 0 |
Nivolumab ile kombinasyon halinde YERVOY ile klinik çalışmalar Melanom
YERVOY monoterapisine karşı nivolumab ile kombinasyon halinde YERVOY veya nivolumab monoterapisi alınan randomize Faz 3 çalışma (CA209067)
İleri evre (rezeke edilemeyen veya metastatik) melanom tedavisi için YERVOY 3 mg/kg monoterapisine karşı 1 mg/kg nivolumab ile kombinasyon halindeki 3 mg/kg YERVOY'un ve 3 mg/kg nivolumabın güvenliliği ve etkililiği faz 3, randomize, çift kör çalışmada (CA209067) değerlendirilmiştir. Nivolumab içeren iki grup arasındaki farklılıklar tanımlayıcı şekilde değerlendirilmiştir. Çalışmaya rezeke edilemeyen Evre III ya da Evre IV melanomun doğrulandığı yetişkin hastalar dahil edilmiştir. Hastaların ECOG performans durumunun 0 ya da 1 olması gerekmiştir. Rezeke edilemeyen ya da metastatik melanom için daha önce sistemik kanser tedavisi görmemiş olan hastalar kaydolmuştur. Randomizasyondan en az 6 hafta önce tamamlanmış olması kaydıyla önceki adjuvan/neoadjuvan tedavisine izin verilmiştir. Aktif otoimmün hastalığı, oküler/üveal melonomu veya aktif beyin ya da leptomeningeal metastazları bulunan hastalar çalışmaya dahil edilmemiştir.
Toplam 945 hasta, nivolumab ile kombinasyon halinde YERVOY (n=314), nivolumab monoterapisi (n=316) veya YERVOY monoterapisi (n=315) alacak şekilde randomize edilmiştir. Kombinasyon kolundaki hastalar ilk 4 doz için her 3 haftada bir intravenöz yoldan 60 dakika boyunca 1 mg/kg nivolumab ve 90 dakika boyunca 3 mg/kg YERVOY ardından her 2 haftada bir 3 mg/kg nivolumab monoterapisi almıştır. Nivolumab monoterapisi kolundaki hastalar her 2 haftada bir 3 mg/kg nivolumab almıştır. Karşılaştırma ilacı kolundaki hastalar 4 doz için her 3 haftada bir intravenöz yoldan 3 mg/kg YERVOY ve nivolumab eşleşmeli plasebo ardından her 2 haftada bir plasebo almıştır. Randomizasyon, PD-L1 ekspresyonu (<%5'e ⥠%5 tümör hücresi membran ekspresyonu), BRAF durumu ve Amerika Kanser Komitesi (AJCC) Evreleme Sistemi uyarınca M evresine göre katmanlandırılmıştır. Tedavi, klinik yarar gözlendiği sürece veya tedavi hasta tarafından artık tolere edilmeyinceye kadar sürdürülmüştür. Tümör değerlendirmeleri randomizasyondan 12 hafta sonra ve
ardından ilk yıl için her 6 haftada bir ve daha sonra 12 haftada bir gerçekleştirilmiştir. Primer sonlanım noktaları progresyonsuz sağkalım ve OS idi. ORR ve yanıt süresi de değerlendirilmiştir.
Başlangıç karakteristikleri üç tedavi grubu arasında dengeliydi. Hastaların ortanca yaşı 61 olup (aralık: 18 ila 90 yaş) hastaların %65'i erkek ve %97'si beyazdı. ECOG performans durumu 0 (%73) veya 1 (%27) idi. Hastaların büyük çoğunluğunda AJCC Evre IV hastalık (%93) vardı; %58'inde çalışmaya giriş sırasında M1c hastalık vardı. Hastaların yüzde yirmi üçü daha önce adjuvan tedavisi görmüştü. Hastaların yüzde otuz ikisinde BRAF mutasyon pozitif melanom vardı; hastaların
%26,5'inde PD-L1 ⥠%5 tümör hücresi membran ekspresyonu vardı. Hastaların yüzde dördünde beyin metastazı öyküsü vardı ve hastaların %36'sında başlangıç LDH düzeyi çalışma başlangıcındaki ÜNL'ten yüksekti. Ölçülebilir tümör PD-L1 ekspresyonu olan hastalar arasında, hastaların dağılımı üç tedavi grubunda dengeliydi. Tümör PD-L1 ekspresyonu, PD-L1 IHC 28-8 pharmDx miktar tayini kullanılarak belirlenmiştir.
Birincil analizde (minimum takip 9 ay) ortanca PFS, nivolumab grubunda 6,9 ay iken YERVOY grubunda 2,9 aydı (HR = 0,57, %99,5 GA: 0,43, 0,76; p <0,0001). Ortanca PFS, YERVOY
grubundaki 2,9 aya kıyasla nivolumab grubuyla kombinasyon halinde YERVOY'da 11,5 aydı (HR = 0,42, %99,5 GA: 0,31, 0,57; p <0,0001).
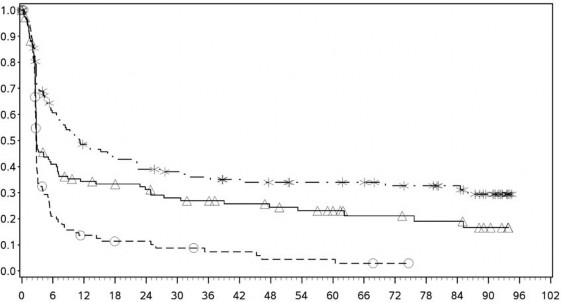
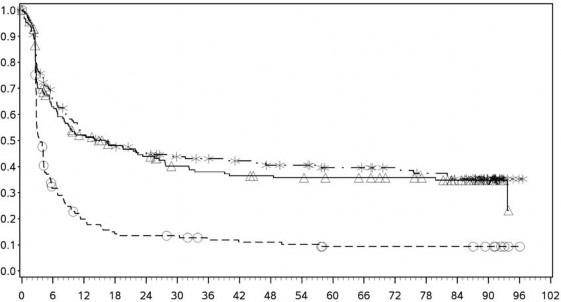
Tanımlayıcı analizden PFS sonuçları (en az 90 ay takip süresi ile) Şekil 2'de (tamamı randomize edilmiş popülasyon), Şekil 3 (tümör PD-L1 %5 kesmede) ve Şekil 4'te (tümör PD-L1 %1 kesmede) gösterilmiştir.
Progresyonsuz sağkalım olasılığı
Şekil 2: Progresyonsuz Sağkalım (CA209067)
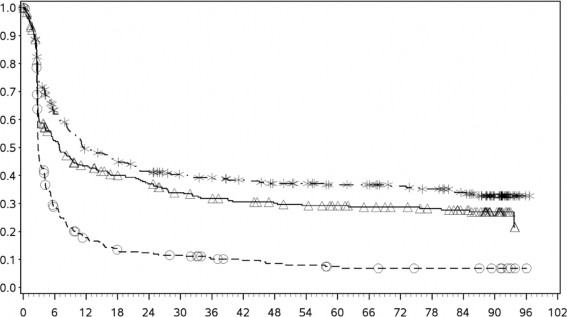
Progresyonsuz sağkalım (aylar)
Şekil 3: PD-L1 ekspresyonuna göre progresyonsuz sağkalım: %5 kesme (CA209067)
Progresyonsuz sağkalım olasılığı
PD-L1 ekspresyonu <%5
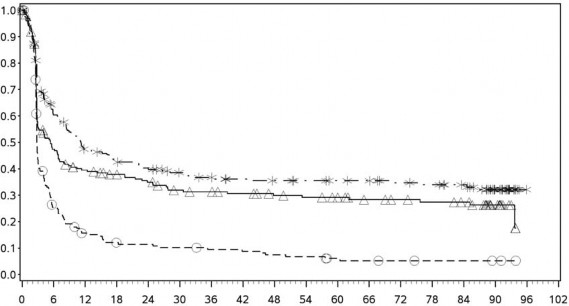
Progresyonsuz sağkalım (aylar)
Progresyonsuz sağkalım olasılığı
PD-L1 ekspresyonu ⥠%5
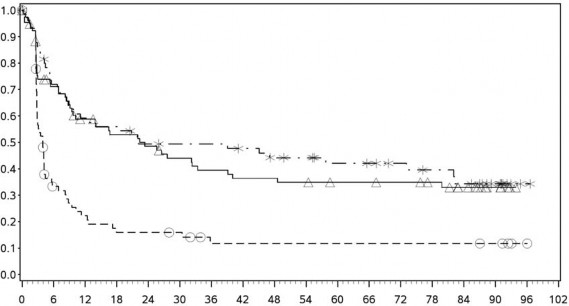
Progresyonsuz sağkalım (aylar)
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||
Şekil 4: PD-L1 ekspresyonuna göre progresyonsuz sağkalım: %1 kesme (CA209067)
PD-L1 ekspresyonu <%1
Progresyonsuz Sağkalım (Aylar)
|
| |||||||||||||||||
| ||||||||||||||||||
| ||||||||||||||||||
PD-L1 ekspresyonu %1
Progresyonsuz Sağkalım (Aylar)
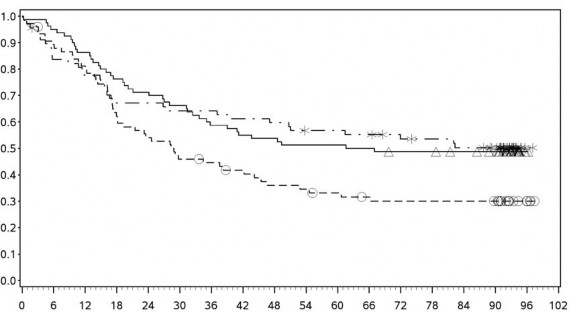
Nihai OS analizi tüm hastalar için en az 28 aylık takip süresi olduğunda meydana gelmiştir. 28 ayda, YERVOY grubundaki 19,98 aya (HR=0,63, %98 GA: 0,48, 0,81; p-değeri: <0,0001) karşı nivolumab grubunda medyan OS'ye ulaşılmamıştır. YERVOY grubuyla (HR=0,55; %98 GA: 0,42, 0,72; p- değeri: <0,0001) kıyaslandığında nivolumab ile kombinasyon halindeki YERVOY grubunda medyan OS'ye ulaşılmamıştır.
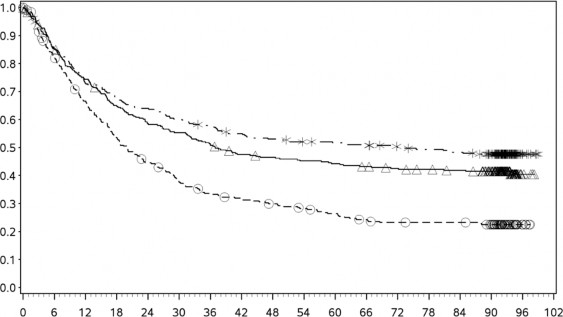
En az 90 aylık takip döneminde yapılan ek tanımlayıcı analizin OS sonuçları orijinal primer analizle tutarlı sonuçlar göstermektedir. Bu takip dönemi analizinin OS sonuçları Şekil 5 (tümü randomize), Şekil 6 ve Şekil 7'de (tümör PD-L1'de %5 ve %1 kesme) gösterilmektedir.
OS analizi alınan sonraki tedavileri de hesaplayacak şekilde ayarlanmamıştır. Sırasıyla kombinasyon, nivolumab monoterapisi ve YERVOY kollarındaki hastaların %36,0, %49,1 ve %66,3'ü daha sonra sistemik tedavi görmüştür. Sırasıyla kombinasyon, nivolumab monoterapisi ve YERVOY kollarındaki hastaların %19,1, %34,2 ve %48,3'ü daha sonra immünoterapi (anti-PD1 tedavisi, anti- CTLA-4 antikoru veya başka bir immünoterapi dahil) almıştır.
Şekil 5 Genel Sağkalım (CA209067) â Minimum 90 aylık takip
Şekil 6: PD-L1 ekspresyonuna göre genel sağkalım: %5 kesme (CA209067) â Minimum 90 aylık takip
PD-L1 ekspresyonu <%5
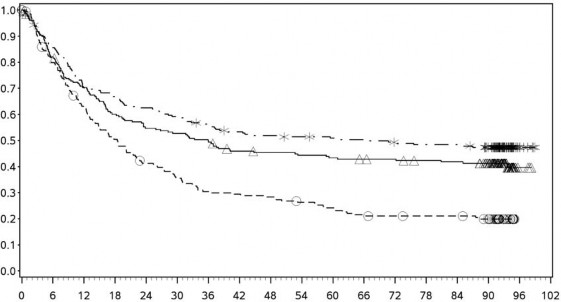
Genel Sağkalım Olasılığı
PD-L1 ekspresyonu ⥠%5
![]()
Şekil 7: PD-L1 ekspresyonuna göre genel sağkalım: %1 kesme (CA209067) â Minimum 90 aylık takip
PD-L1 ekspresyonu <%1
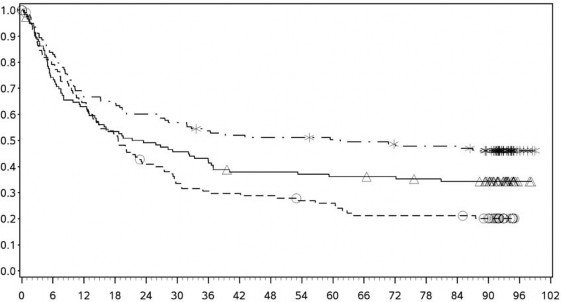
PD-L1 ekspresyonu ⥠%1
![]()
Objektif Yanıt Oranı (ORR) analizi için minimum takip süresi 90 aydı. Yanıtlar Tablo 9'da özetlenmiştir.
Tablo 9: Objektif yanıt (CA209067)
| nivolumab + YERVOY (n=314) | nivolumab (n=316) | YERVOY (n=315) |
Objektif yanıt | 183 (%58) | 142 (%45) | 60 (%19) |
(%95 GA) | (52,6, 63,8) | (39,4 50,6) | (14,9, 23,8) |
Risk oranı (YERVOY'a karşı) | 6,35 | 3,5 |
|
(%95 GA) | (4,38, 9,22) | (2,49 - 5,16) |
|
Tam yanıt (CR) | 71 (%23) | 59 (%19) | 19 (%6) |
Kısmi yanıt (PR) | 112 (%36) | 83 (%26) | 41 (%13) |
Stabil hastalık (SD) | 38 (%12) | 29 (%9) | 69 (%22) |
Yanıt süresi |
|
|
|
Ortanca (aralık), aylar | Belirlenemedi (69,1-Belirlenemedi) | 90,8 (45,7-Belirlenemedi) | 19,3 (8,8 â 47,4) |
Oran | %68 | %73 | %44 |
Oran | %58 | %63 | %30 |
Tümör PD-L1 ekspresyonuna göre ORR (%95 GA) | |||
<%5 | |||
â¥%5 | |||
<%1 | |||
â¥%1 | |||
Nivolumab içeren her iki kol, tek başına YERVOY ile kıyaslandığında anlamlı PFS ve OS faydası ile daha yüksek ORR sergilemiştir. 18 aylık takip süresinde gözlemlenen PFS sonuçları ile 28 aylık takipte ORR ve OS sonuçları başlangıç ECOG performans durumu, BRAF durumu, M evresi, yaş, beyin metastaz öyküsü ve başlangıç LDH düzeyi dahil hasta alt gruplarında tutarlı şekilde gösterilmiştir. Bu gözlem minimum 90 aylık takipte OS sonuçlarında korunmuştur.
28 aylık takip süresinden sonra advers reaksiyon nedeniyle kombinasyon tedavisi kesilen 131 hasta arasında ORR %71 olup (93/131), %20'si (26/131) tam yanıtı sağlamış ve ortanca OS'ye ulaşılamamıştır.
Nivolumab içeren her iki kol, PD-L1 ekspresyon seviyelerine bakılmaksızın YERVOY'dan daha yüksek objektif yanıt oranları sergilemiştir. ORR'ler, 90 aylık takip sonrasında tümör PD-L1 ekspresyon seviyeleri genelinde (Tablo 11) nivolumab monoterapisine göre nivolumab ve YERVOY
kombinasyonu için daha yüksek olup, tam yanıtın en iyi genel yanıtı iyileşen sağkalım oranıyla ilişkilendirilmiştir.
90 aylık takip sonrasında, tümör PD-L1 ekspresyon seviyesi â¥%5 olan hastalar için ortanca yanıt sürelerine kombinasyon kolunda 78,19 ay (aralık: 18,07 â Belirlenemedi), nivolumab monoterapisi kolunda 77,21 ay (aralık: 26,25 â Belirlenemedi) ve YERVOY kolunda 31,28 aydı (aralık: 6,08 â Belirlenemedi). Tümör PD-L1 ekspresyonu <%5'te, ortanca yanıt sürelerine kombinasyon kolunda ulaşılmamış (aralık: 61,93 â Belirlenemedi), nivolumab monoterapisi kolunda 90,84 (aralık: 50,43 â Belirlenemedi) ve YERVOY monoterapisi kolunda 19,25 aydı (aralık: 5,32 â 47,44).
Tümör yanıtı ile PFS ve OS'nin ilgili sonlanım noktalarını değerlendirirken PD-L1 ekspresyonu için net bir kesme değeri güvenli şekilde belirlenememektedir. Keşifsel çok değişkenli analizlere ait sonuçlar, sağkalım sonucuna katkıda bulunabilecek hasta ve tümör karakteristiklerini (ECOG performans durumu, M evresi, başlangıçtaki LDH, BRAF mutasyon durumu, PD-L1 durumu ve cinsiyet) tanımlamıştır.
BRAF durumuna göre etkililik:
90 aylık takip süresinden sonra, nivolumab ile kombinasyon halinde YERVOY koluna randomize edilen BRAF [V600] mutasyonu pozitif ve BRAF negatif tip hastalar için ortanca PFS sırasıyla 16,76 ay (%95 GA: 8,28-32) ve 11,17 ay (%95 GA: 7-19,32) iken, nivolumab monoterapisi kolundaki
hastalar için ortanca PFS sırasıyla 5,62 ay (%95 GA: 2,79- 9,46) ve 8,18 ay (%95 GA: 5,13-19,55) olmuştur. YERVOY monoterapisine randomize edilen BRAF [V600] mutasyonu pozitif ve BRAF negatif tip hastalarda ortanca PFS sırasıyla 3,09 ay (%95 GA: 2,79; 5,19) ve 2,83 aydı (%95 GA:
2,76; 3,06) olmuştur.
90 aylık takip süresinden sonra, nivolumab ile kombinasyon halinde YERVOY koluna randomize edilen BRAF [V600] mutasyonu pozitif ve BRAF negatif tip hastalar için ortanca ORR %67 (%95 GA: 57, 75,9; n = 103) ve %54 (%95 GA: 47,1, 60,9; n = 211) iken, nivolumab monoterapisi
kolundaki hastalar için ortanca ORR sırasıyla %37,87 (%95 GA: 28,2, 48,1; n = 98) ve %48,2 (%95 GA: 41.4, 55,0; n = 218) olmuştur. YERVOY monoterapisine randomize edilen BRAF [V600] mutasyonu pozitif ve BRAF negatif tip hastalarda ortanca ORR sırasıyla %23 (%95 CI: 15,2, 32,5; n
= 100) and %17,2 (%95 GA: 12,4, 22,9; n = 215).
90 aylık takip sonrasında, BRAF[V600] mutasyonu pozitif hastalarda, kombinasyon kolunda ortanca OS'ye ulaşılmamıştı ve nivolumab monoterapisi kolunda 45,5 aydı. YERVOY tedavi kolundaki BRAF[V600] mutasyonu pozitif hastalarda ortanca OS 24,6 aydı. BRAF negatif tip hastalarda ortanca OS kombinasyon kolunda 39,06 ay, nivolumab monoterapisi kolunda 34,37 ay ve YERVOY monoterapisi kolunda 18,5 aydı. YERVOY ile kombinasyon halinde nivolumaba karşı nivolumab monoterapisi için OS HR değerleri, BRAF[V600] mutasyonu pozitif hastalar için 0,66 (%95 GA: 0,44, 0,98) ve BRAF mutasyonu negatif hastalar için 0,95 (%95 GA: 0,74, 1,22) olarak belirlenmiştir.
Nivolumab ile kombinasyon halinde YERVOY ve YERVOY'un randomize faz 2 çalışması (CA209069) Çalışma CA209069, ileri evre (rezeke edilemeyen veya metastatik) melonomu olan, CA209067 çalışmasının ve BRAF-negatif tip melanomu olan hastalardaki (hastaların %77'si) primer analize benzer dahil etme kriterlerine sahip 142 hastada nivolumab ve YERVOY kombinasyonunu tek başına YERVOY ile karşılaştıran randomize, çift kör, Faz 2 çalışmasıydı. Araştırmacı tarafından değerlendirilen ORR kombinasyon kolunda %61 (%95 GA: 48,9, 72,4) iken YERVOY kolunda
%11'di (%95 GA: 3, 25,4). Tahmini 2 yıllık ve 3 yıllık OS oranları kombinasyon (n=73) için sırasıyla
%68 (%95 GA: 56, 78) ve %61 (%95 GA: 49, 71) ve YERVOY (n = 37) için sırasıyla %53 (%95
GA: 36, 68) ve %44'tü (%95 GA: 28, 60).
Renal Hücreli Karsinom (RHK)
Nivolumab ile kombinasyon halinde YERVOY tedavisinin Sunitinib ile karşılaştırıldığı randomize faz 3 çalışma (CA209214)
İleri evre/metastatik RHK tedavisi için nivolumab 3 mg/kg ile kombinasyon halinde YERVOY 1 mg/kg'nin güvenliliği ve etkililiği faz 3, randomize, açık etiketli bir çalışmada (CA209214) değerlendirilmiştir. Çalışmaya, daha önce tedavi edilmemiş, berrak hücreli komponenti olan ileri evre veya metastatik renal hücreli karsinom hastaları (18 yaş ve üzeri) dahil edilmiştir. Primer etkililik popülasyonu, Uluslararası Metastatik RHK Veri Tabanı Konsorsiyumu (IMDC) kriterlerine göre 6 prognostik risk faktöründen en az 1 veya daha fazla olan orta/kötü riskli hastaları içermiştir (ilk renal hücreli karsinom teşhisi zamanından randomizasyona kadar bir yıldan az, Karnofsky performans durumu <%80, normal alt sınırdan daha düşük hemoglobin, 10 mg/dL'den daha yüksek düzeltilmiş kalsiyum, normal üst sınırdan daha yüksek trombosit sayımı ve normal üst sınırdan daha yüksek mutlak nötrofil sayımı). Hastalar bu çalışmaya tümör PD-L1 durumlarından bağımsız olarak dahil edilmiştir. Karnofsky performans durumunun <%70 olduğu ve herhangi bir geçmiş veya mevcut beyin metastazı olan, aktif otoimmün hastalığa sahip veya sistemik immünosüpresyon gerektiren tıbbi koşulları olan hastalar çalışmaya dahil edilmemiştir. Hastalar IMDC prognostik skoru ve bölgeye göre katmanlandırılmıştır.
Çalışmaya toplam 1096 hasta randomize edilmiş olup, bunlardan 847'si orta/kötü riskli RHK'ye sahipti ve 4 doza kadar her 3 haftada bir 60 dakika boyunca intravenöz yoldan uygulanan nivolumab ile kombinasyon halinde 30 dakika boyunca intravenöz yoldan uygulanan 1 mg/kg YERVOY (n=425) ve bunu takiben 2 haftada bir 3 mg/kg nivolumab monoterapisi almış veya her kürde 4 hafta boyunca oral yoldan günde 50 mg sunitinib (n=422) almış ve bunu 2 haftalık tedavisiz dönem izlemiştir. Tedaviye klinik yarar gözlendiği sürece veya hasta tedaviyi artık tolere edemeyene dek devam edilmiştir. İlk tümör değerlendirmesi randomizasyondan 12 hafta sonra yapılmış ve değerlendirmeler, ilk yıl için 6 haftada bir ve daha sonra progresyona veya tedavinin kesilmesine kadar, hangisi sonra meydana gelirse, her 12 haftada bir devam etmiştir. Araştırmacı tarafından değerlendirilen RECIST, versiyon 1.1'de tanımlı ilk progresyondan sonra tedaviye, araştırmacı tarafından belirlenen şekilde hastanın klinik yarar elde etmesi ve çalışma ilacını tolere etmesi durumunda izin verilmiştir. Primer sonlanım noktaları, orta/kötü riskli hastalarda Körlenmiş Bağımsız Merkezi İnceleme (BICR) ile belirlenen OS, ORR ve PFS idi.
Başlangıç karakteristikleri iki grup arasında genellikle dengeli olmuştur. Ortanca yaş 61 (aralık: 21- 85) olup, %38'i ⥠65 yaşında ve %8'i ⥠75 yaşındaydı. Hastaların çoğunluğu erkek (%73) ve beyazdı (%87) ve hastaların %31 ve %69'unda başlangıç KPS değeri sırasıyla %70 ila 80 ve %90 ila 100 olarak belirlenmiştir. İlk tanıdan randomizasyona kadar geçen ortanca süre hem nivolumab 3 mg/kg ile kombinasyon halindeki YERVOY 1 mg/kg hem de sunitinib gruplarında 0,4 yıldı. Ortanca tedavi
süresi nivolumab ve YERVOY ile tedavi edilen hastalarda 7,9 ay (aralık: 1 gün-21,4 ay) ve sunitinib ile tedavi edilen hastalarda 7,8 ay (aralık: 1 gün-20,2 ay) olmuştur. Nivolumab ile YERVOY, hastaların %29'unda progresyondan sonra da devam etmiştir.
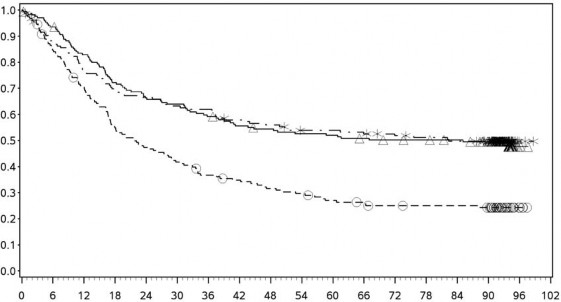
Orta/kötü riskli hastalardan elde edilen etkililik sonuçları Tablo 11'te (minimum 17,5 aylık takip ve minimum 60 aylık takiple primer analiz) ve Şekil 7'de (minimum 60 aylık takip) gösterilmektedir.
Minimum 60 aylık takiple yapılan tanımlayıcı analizden elde edilen OS sonuçları, orijinal primer analizden elde edilen sonuçlarla uyumlu idi.
Sağkalım Olasılığı
Şekil 8: Orta/kötü riskli hastalarda OS'ye ilişkin Kaplan-Meier eğrileri (CA209214) -Minimum 60 aylık takip
Genel Sağkalım (Ay)
![]()
Orta/kötü riskli hastalarda, tümör PD-L1 ekspresyonundan bağımsız olarak sunitinibe karşı nivolumab ile kombinasyon halinde YERVOY kolunda OS yararı gözlemlenmiştir. Tümör PD-L1 ekspresyonu â¥%1 olan hastalarda ortanca OS değerine nivolumab ile kombinasyon halinde YERVOY kolunda ulaşılamazken, sunitinib kolunda bu değer 19,61 ay olmuştur (HR = 0,52; %95 GA: 0,34, 0,78). Tümör PD-L1 ekspresyonu <%1 olan hastalar için, ortanca OS nivolumab ile kombinasyon halinde YERVOY kolunda 34,7 ay ve sunitinib kolunda 32,2 ay olmuştur (HR = 0,70; %95 GA: 0,54, 0,92).
CA209214 çalışmasında ayrıca IMDC kriterlerine göre iyi riskli 249 hasta nivolumab artı YERVOY (n=125) veya sunitinib (n=124) kollarına randomize edilmiştir. Bu hastalar primer etkililik popülasyonunun bir parçası olarak değerlendirilmemiştir. Sunitinibe kıyasla nivolumab artı YERVOY alan iyi riskli hastalarda OS için risk oranı 1,13 (%95 GA: 0,64, 1,99; p = 0,6710) idi.
Birinci basamak RHK'de sadece berrak olmayan hücre histolojisine sahip hastalarda nivolumab ile kombinasyon halinde YERVOY'un kullanımına ilişkin veri mevcut değildir.
Orta/kötü riskli hastalar için etkililik sonuçları Tablo 10'da gösterilmektedir.
Tablo 10: Orta/kötü riskli hastalarda etkililik sonuçları (CA209214)
nivolumab + ipilimumab (n = 425) | sunitinib (n = 422) | |
Primer analiz Minimum takip: 17,5 ay | ||
Genel sağkalım | ||
Olaylar | 140 (%33) | 188 (%45) |
Risk oranı | 0,63 | |
%99,8 GA | (0,44- 0,89) | |
P değeri | < 0,0001 | |
Medyan (%95 GA) | NE (28,2-NE) | 25,9 (22,1- NE) |
Oran (%95 GA) | ||
6. ayda | 89,5 (86,1- 92,1) | 86,2 (82,4- 89,1) |
12. ayda | 80,1 (75,9-83,6) | 72,1 (67,4-76,2) |
Progresyonsuz sağkalım | ||
Olaylar | 228 (%53,6) | 228 (%54) |
Risk oranı | 0,82 | |
%99,1 GA | (0,64-1,05) | |
P değeri | 0,0331 | |
Medyan (%95 GA) | 11,6 (8,71-15,51) | 8,4 (7,03-10,81) |
Doğrulanmış objektif yanıt (BICR) | 177 (%41,6) | 112 (%26,5) |
(%95 GA) | (36,9-46,5) | (22,4-31) |
ORR farkı (%95 GA) | 16 (9,8- 22,2) | |
P değeri | < 0,0001 | |
Tam yanıt (CR) | 40 (%9,4) | 5 (%1,2) |
Kısmi yanıt (PR) | 137 (%32,2) | 107 (%25,4) |
Stabil hastalık (SD) | 133 (%31,3) | 188 (%44,5) |
Medyan yanıt süresi | ||
Ay (aralık) | NE (1,4-25,5) | 18,17 (1,3-23,6) |
Yanıta kadar geçen medyan süre | ||
Ay (aralık) | 2,8 (0,9-11,3) | 3 (0,6-15) |
Güncellenmiş analiz* Minimum takip: 60 ay | ||
Genel sağkalım | ||
Olaylar | 242 (%57) | 282 (%67) |
Risk oranı | 0,68 | |
%95 GA | (0,58- 0,81) | |
Medyan (%95 GA) | 46,95 (35,35-57,43) | 26,64 (22,08- 33,54) |
Oran (%95 GA) | ||
24. ayda | 66,3 (61,5-70,6) | 52,4 (47,4-57,1) |
36. ayda | 54,6 (49,7-59,3) | 43,7 (38,7-48,5) |
48. ayda | 49,9 (44,9-54,6) | 35,8 (31,1-40,5) |
60. ayda | 43 (38,1-47,7) | 31,3 (26,8-35,9) |
Progresyonsuz sağkalım | ||
Olaylar | 245 (%57,6) | 253 (%60) |
Risk oranı | 0,73 | |
%95 GA | (0,61-0,87) | |
Medyan (%95 GA) | 11,6 (8,44-16,63) | 8,3 (7,03-10,41) |
Doğrulanmış objektif yanıt (BICR) | 179 (%42,1) | 113 (%26,8) |
(%95 GA) | (37,4-47) | (22,6-31,3) |
ORR farkı (%95 GA) | 16,2 (10- 22,5) | |
Tam yanıt (CR) | 48 (%11,3) | 9 (%2,1) |
Kısmi yanıt (PR) | 131 (%30,8) | 104 (%24,6) |
Stabil hastalık (SD) | 131 (%30,8) | 187 (%44,3) |
Medyan yanıt süresi | ||
Ay (aralık) | NE (50,89-NE) | 19,38 (15,38-25,10) |
Yanıta kadar geçen medyan süre | ||
Ay (aralık) | 2,8 (0,9-35) | 3,1 (0,6-23,6) |
NE = hesaplanamaz
*26 Şubat 2021 veri kesim tarihine dayalı tanımlayıcı analiz
Tüm hastalar minimum 24 ay takip edildiğinde güncellenmiş bir tanımlayıcı OS analizi yapılmıştır (bkz. Şekil 8). Bu analiz sırasında, kombinasyon kolunda 166/425 olay ve sunitinib kolunda 209/422 olay ile risk oranı 0,66 (%99,8 GA 0,48-0,91) idi. Orta/kötü riskli hastalarda, OS oranı tümör PD-L1 ekspresyonundan bağımsız şekilde sunitinib koluna kıyasla nivolumab ile kombinasyon halinde YERVOY için OS yararı gözlenmiştir. Tümör PD-L1 ekspresyonu â¥%1 olan hastalarda, nivolumab ile kombinasyon halinde YERVOY için medyan OS'ye erişilmemiş ve sunitinib için 19,61 ay olmuştur (HR=0,52; %95 GA: 0,34-0,78).
Tümör PD L1 ekpsresyonu <%1 olan hastalarda, medyan OS nivolumab ile kombinasyon halinde YERVOY için 34,7 ay iken sunitinib kolunda 32,2 ay olmuştur (HR=0,70; %95 GA: 0,54-0,92).
CA209214 çalışmasında ayrıca IMDC kriterlerine göre iyi riskli 249 hasta nivolumab artı YERVOY (n = 125) veya sunitinib (n = 124) kollarına randomize edilmiştir. Bu hastalar primer etkililik popülasyonunun bir parçası olarak değerlendirilmemiştir. 24 aylık takipte sunitinibe kıyasla nivolumab artı YERVOY alan iyi riskli hastalarda OS için risk oranı 1,13 (%95 GA: 0,64-1,99; p = 0,6710) idi. 60 aylık takipte OS için HR 0,94 idi (%95 GA: 0,65-1,37).
Birinci basamak RHK'de berrak hücreli olmayan histolojiye sahip hastalarda nivolumab ile kombinasyon halinde ipilimumabın kullanımına ilişkin veri mevcut değildir.
75 yaşında ve daha büyük hastalar CA209214'teki tüm orta/kötü riskli hastaların %8'ini temsil etmiştir ve nivolumab ile YERVOY kombinasyonu, minimum 17,5 aylık takiple bu alt grupta genel popülasyona kıyasla OS sonuçları sayısal olarak daha az etki göstermiştir (HR 0,97, %95 GA: 0,48, 1,95). Bu alt grubun küçük olmasından dolayı, bu verilerden kesin bir sonuç çıkarılamamaktadır.
Küçük hücreli dışı akciğer kanserinin birinci basamak tedavisi
4 kür platin bazlı kemoterapiye karşı ipilimumabın nivolumab ve 2 kür platin bazlı kemoterapi ile kombinasyonun araştırıldığı randomize faz 3 çalışma (CA2099LA)
3 haftada bir nivolumab 360 mg ve 2 kür platin bazlı kemoterapi ile kombinasyon halinde 6 haftada bir ipilimumab 1 mg/kg'ın güvenliliği ve etkililiği, bir faz 3, randomize, açık etiketli çalışmada (CA2099LA) değerlendirilmiştir. Çalışmaya histolojik olarak teyit edilmiş skuamöz olmayan veya skuamöz Evre IV veya rekürren KHDAK (7 Uluslararası Akciğer Kanseri Çalışmaları Derneğinin sınıflandırmasına göre), ECOG performans durumu 0 veya 1 olan ve daha önce hiçbir kanser tedavisi görmemiş (EGFR ve ALK inhibitörleri dahil) hastalar (18 yaş ve üzeri) dahil edilmiştir. Hastalar tümör PD-L1 durumlarına bakılmaksızın çalışmaya kaydedilmiştir.
EGFR mutasyonları veya ALK translokasyonları, aktif (tedavi edilmemiş) beyin metastazları, karsinomatöz menenjit, aktif otoimmün hastalık veya sistemik immünosüpresyon gerektiren tıbbi koşullara sahip hastalar çalışmaya dahil edilmemiştir. Tedavi edilen beyin metastazları olan hastalar, kayıttan en az 2 hafta önce nörolojik olarak başlangıç seviyesine dönmüşlerse ve kortikosteroidleri kesmişlerse veya günde < 10 mg prednizon eşdeğeri olan stabil veya azalan bir doz alıyorsa çalışmaya alınmıştır. Randomizasyon histolojiye (skuamöze karşı skuamöz olmayan), tümör PD-L1 ekspresyon düzeyine (⥠%1'e karşı < %1) ve cinsiyete (erkek ve kadın) göre basamaklandırılmıştır.
Toplam 719 hasta, nivolumab ve platin bazlı kemoterapi ile kombinasyon halinde ipilimumab (n= 361) veya platin bazlı kemoterapi (n= 358) alacak şekilde randomize edilmiştir. Nivolumab ve platin bazlı kemoterapi ile kombinasyon halinde ipilimumab kolundaki hastalar, her 3 haftada bir 30 dakika boyunca intravenöz yoldan uygulanan 360 mg nivolumab ve 2 kür için her 3 haftada bir uygulanan platin bazlı kemoterapi ile kombinasyon halinde 6 haftada bir 30 dakika boyunca intravenöz yoldan uygulanan 1 mg/kg ipilimumab almıştır. Kemoterapi kolundaki hastalara 4 kür boyunca her 3 haftada bir platin bazlı kemoterapi uygulanmıştır; skuamöz olmayan hastaların isteğe bağlı pemetrekset idame tedavisi almasına izin verilmiştir.
Platin bazlı kemoterapi skuamöz olmayan KHDAK için karboplatin (EAA 5 ya da 6) ve pemetrekset 500 mg/m ya da sisplatin 75 mg/m ve pemetrekset 500 mg/mm veya skuamöz KHDAK için karboplatin (EAA 6) ve paklitaksel 200 mg/m içermiştir.
Tedavi, hastalık progresyonuna, kabul edilemez toksisiteye veya 24 aya kadar devam etmiştir. Hasta klinik olarak stabilse ve araştırmacı tarafından klinik fayda sağladığı kabul edilirse, hastalığın ilerlemesinden sonra devam eden tedaviye izin verilmiştir. İpilimumab'a atfedilen bir advers olay nedeniyle kombinasyon tedavisini bırakan hastaların nivolumab monoterapisine devam etmelerine izin verilmiştir. Tümör değerlendirmeleri, çalışma tedavisinin ilk dozundan sonra ilk 12 ay boyunca 6 haftada bir, daha sonra hastalık progresyonuna veya çalışma tedavisi kesilene kadar her 12 haftada bir yapılmıştır.
CA2099LA başlangıç özellikleri genel olarak tüm tedavi gruplarında dengelenmişti. Medyan yaş 65 (aralık: 26-86) olup, %51'i ⥠65 yaşında ve %10'u ⥠75 yaşındaydı. Hastaların çoğunluğu beyaz (%89) ve erkekti (%70). Başlangıç ECOG performans durumu 0 (%31) veya 1 (%68) iken hastaların
%57'sinde PD-L1⥠%1 ve %37'sinde PD-L1 < %1 idi, % 31'inde skuamöz ve %69'unda skuamöz olmayan histoloji vardı, %17'sinde beyin metastazı vardı ve %86'sı daha önce/halen sigara içiyordu. Hiçbir hasta daha önce immünoterapi almamıştır.
CA2099LA çalışmasının primer etkililik sonuç ölçümü OS idi. İlave etkililik sonlanım noktaları, BICR ile belirlenen ORR, PFS ve yanıt süresi idi.
Çalışma, 351 olay gözlemlendiğinde önceden belirlenmiş ara analizde tek başına platin bazlı kemoterapiye kıyasla nivolumab ve platin bazlı kemoterapi ile kombinasyon halinde ipilimumab koluna randomize edilen hastalarda OS, PFS ve ORR'de istatistiksel olarak anlamlı bir yarar olduğunu göstermiştir (son analiz için planlanan olay sayısının %87'si). OS için minimum takip süresi 8,1 aydı.
Etkililik sonuçları Şekil 9'da (minimum 12,7 aylık takip ile güncellenmiş OS analizi) ve Tablo 12'de (minimum 8.1 aylık takip ile birincil analiz) gösterilmektedir. Tüm hastalar en az 12,5 ay takip edildikten sonra güncellenmiş bir etkililik analizi yapılmıştır (Bkz. Şekil 9). Bu analiz sırasında, OS için risk oranı 0,66 (%95 GA: 0,55-0,80) ve PFS için risk oranı 0,68 (%95 GA: 0,57-0,82) idi.
Sağkalım Olasılığı
Şekil 9 OS'ye ilişkin Kaplan-Meier eğrileri (CA2099LA)
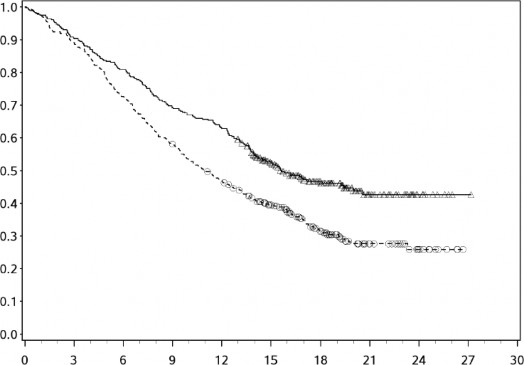
Genel Sağkalım (Ay)
![]()
Tablo 11: Etkililik sonuçları (CA2099LA)
| nivolumab + ipilimumab + kemoterapi (n = 361) | kemoterapi (n = 358) |
Genel sağkalım | ||
Olaylar | 156 (%43,2) | 195 (%54,5) |
Risk oranı (%96.71 GA) | 0,69 (0,55-0,87) | |
Basamaklandırılmış log- sıralı p- değeri | 0,0006 | |
Medyan (ay) (%95 GA) | 14,1 (13,24-16,16) | 10,7 (9,46-12,45) |
6 ayda oran (%95 GA) | 80,9 (76,4-84,6) | 72,3 (67,4-76.7) |
Progresyonsuz sağkalım | ||
Olaylar | 232 (%64,3) | 249 (%69,6) |
Risk oranı (%97,48 GA) | 0,70 (0,57-0,86) | |
Basamaklandırılmış log-sıralı p-değeri | 0,0001 | |
Medyan (ay) (%95 GA) | 6,83 (5,55-7,66) | 4,96 (4,27-5,55) |
6 ayda oran (%95 GA) | 51,7 (46,2-56,8) | 35,9 (30,5-41,3) |
|
|
|
Genel yanıt oranı | 136 (%37,7) | 90 (%25,1) |
(%95 GA) | (32,7-42,9) | (20,7-30,0) |
Basamaklandırılmış CMH testi p-değeri | 0,0003 | |
Tam yanıt (CR) | 7 (%1,9) | 3 (%0,8) |
Kısmi yanıt (PR) | 129 (%35,7) | 87 (%24,3) |
|
|
|
Yanıt süresi | ||
Medyan (ay) (%95 GA) | 10,02 (8,21-3,01) | 5,09 (4,34-7,00) |
⥠6 ay süre ile % | 74 | 41 |
Kombinasyon ve kemoterapi kollarındaki hastaların sırasıyla %28,8'i ve %41,1'i sistemik tedavi almıştır. Kombinasyon ve kemoterapi kollarındaki hastaların sırasıyla %3,9 ve %27,9'u daha sonra immünoterapi (anti-PD-1, anti-PD-L1 ve anti-CTLA4 dahil) almıştır.
CA2099LA çalışmasında, kemoterapiye göre bir tanımlayıcı alt grup analizinde, nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab ile tedavi edilen skuamöz histolojiye sahip hastalarda (HR [%95 GA] 0,65 [0,46-0,93], n = 227) ve skuamöz olmayan histolojiye sahip hastalarda (HR [%95 GA] 0,72 [0,55-0,93], n = 492) OS yararı gösterilmiştir.
Tablo 12'de, önceden tanımlanmış alt grup analizlerinde tümör PD-L1 ekspresyonuna göre OS, PFS ve ORR etkililik sonuçları özetlenmektedir.
Tablo 12: Tümör PD-L1 ekspresyonuna göre etkililik sonuçları (CA2099LA)
| nivolumab + ipilimuma b + kemotera pi |
kemoterapi | nivolumab + ipilimumab + kemotera pi |
kemoterapi | nivolumab + ipilimuma b + kemoterap i |
Kemoterapi | nivolumab + ipilimumab + kemoterap i |
kemoterapi |
| PD-L1 < %1 (n = 264) | PD-L1 ⥠%1 (n = 406) | PD- L1 ⥠1% ile 49% (n = 233) | PD-L1 ⥠%50 (n = 173) | ||||
OS risk oranı (%95 GA) |
0,65 (0,46-0,92) |
0,67 (0,51-0,89) |
0,69 (0,48-0,98) |
0,64 (0,41-1,02) | ||||
PFS risk oranı (%95 GA) |
0,77 (0,57-1,03) |
0,67 (0,53-0,85) |
0,71 (0,52-0,97) |
0,59 (0,40-0,86) | ||||
ORR % | 31,1 | 20,9 | 41,9 | 27,6 | 37,8 | 24,5 | 48,7 | 30,9 |
CA2099LA çalışmasına ⥠75 yaşında toplam 70 KHDAK hastası dahil edilmiştir (nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab kolundaki 37 hasta ve kemoterapi kolundaki 33 hasta). Bu çalışma alt grubunda kemoterapiye kıyasla nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab için OS'de 1,36 HR (%95 GA: 0,74-2,52) ve PFS'de 1,12 HR (%95 GA: 0,64- 1,96) gözlenmiştir. ORR, nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab kolunda
% 27 ve kemoterapi kolunda %15,2 idi. Yetmiş beş yaş ve üzeri hastaların %43'ü, nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab tedavisini bırakmıştır. Bu hasta popülasyonunda nivolumab ve kemoterapi ile kombinasyon halinde ipilimumabın etkililik ve güvenlilik verileri sınırlıdır.
Bir alt grup analizinde, daha önce hiç sigara içmemiş olan hastalarda kemoterapiye kıyasla nivolumab ve kemoterapi ile kombinasyon halinde ipilimumab alan hastalarda azalan sağkalım yararı gözlenmiştir. Ancak düşük hasta sayısından dolayı bu verilerden kesin bir sonuç çıkarılamaz.
Malign plevral mezotelyoma
Kemoterapiye karşı nivolumab ile kombinasyon halinde ipilimumabın araştırıldığı randomize faz 3 çalışma (CA209743)
Her 2 haftada bir 3 mg/kg nivolumab ile kombinasyon halinde 6 haftada bir 1 mg/kg ipilimumabın güvenliliği ve etkililiği bir faz 3, randomize, açık etiketli çalışmada değerlendirilmiştir (CA209743). Çalışma, histolojik olarak teyit edilmiş ve daha önce tedavi edilmemiş epiteloid veya epiteloid olmayan histolojiye sahip malign plevral mezotelyoma bulunan, ECOG performans durumu 0 veya 1 olan ve ilk çalışma tedavisinden önceki 14 gün içinde palyatif radyoterapi uygulanmamış hastaları (18 yaş veya üzeri) içermiştir. Hastalar, tümör PD-L1 durumlarına bakılmaksızın çalışmaya kaydedilmiştir.
Primitif peritoneal, perikardiyal, testis veya tunika vajinalis mezotelyoması, interstisyel akciğer hastalığı, aktif otoimmün hastalığı, sistemik immünosüpresyon gerektiren tıbbi koşullar ve beyin metastazı olan hastalar (cerrahi olarak rezeke edilmedikçe veya stereotaksik radyoterapi ile tedavi edilmedikçe ve çalışmaya dahil edilmeden önceki 3 ay içinde herhangi bir gelişme olmadıkça)
çalışmaya dahil edilmemiştir. Randomizasyon, histolojiye (epitelioide karşı sarkomatoid veya karışık histoloji alt tipleri) ve cinsiyete (erkek ve kadın) göre basamaklandırılmıştır.
Toplam 605 hasta, nivolumab ile kombinasyon halinde ipilimumab (n = 303) veya kemoterapi (n = 302) almak üzere randomize edilmiştir. Nivolumab ile kombinasyon halinde ipilimumab kolundaki hastalar, 2 yıla kadar 2 haftada bir 30 dakika boyunca intravenöz yoldan uygulanan 3mg/kg nivolumab ile kombinasyon halinde 6 haftada bir 30 dakika boyunca intravenöz yoldan uygulanan 1 mg/kg ipilimumab almıştır. Kemoterapi kolundaki hastalar 6 küre kadar kemoterapi almıştır (her kür 21 gündü). Kemoterapi sisplatin 75 mg/m ve pemetrekset 500 mg/m veya karboplatin 5 EAA ve pemetrekset 500 mg/m terapilerini içermiştir.
Tedavi, hastalık progresyonuna, kabul edilemez toksisiteye veya 24 aya kadar devam etmiştir. Hasta klinik olarak stabilse ve araştırmacı tarafından klinik fayda sağladığı kabul edilirse, hastalığın ilerlemesinden sonra tedaviye izin verilmiştir. İpilimumaba atfedilen bir advers reaksiyon nedeniyle kombinasyon tedavisini bırakan hastaların nivolumab monoterapisine devam etmesine izin verilmiştir. Tümör değerlendirmeleri, çalışma tedavisinin ilk dozundan sonra ilk 12 ay boyunca 6 haftada bir, daha sonra hastalık progresyonuna veya çalışma tedavisi kesilene kadar her 12 haftada bir yapılmıştır.
CA209743 başlangıç özellikleri genel olarak tüm tedavi gruplarında dengeliydi. Medyan yaş 69 (aralık: 25-89) olup, hastaların %72'si ⥠65 ve %26'sı ⥠75 yaşındaydı. Hastaların çoğunluğu beyaz (%85) ve erkekti (%77). Başlangıç ECOG performans durumu 0 (%40) veya 1 (%60), hastaların %80'inde PD-L1 ⥠%1 ve hastaların %20'sinde PD-L1 < %1 idi, % 75'inde epiteloid ve
%25'inde epiteloid olmayan histoloji mevcuttu.
CA209743 primer etkililik sonuç ölçümü OS idi. Kilit ikincil etkililik sonlanım noktaları, plevral mezotelyoma için modifiye RECIST kriterleri kullanılarak BICR ile belirlenen PFS, ORR ve yanıt süresiydi. Bu ikincil sonlanım noktaları için tanımlayıcı analizler Tablo 14'de sunulmuştur.
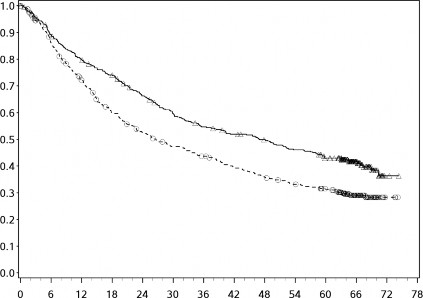
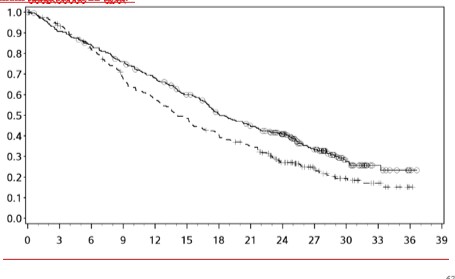
Çalışma, 419 olay gözlemlendiğinde (nihai analiz için planlanan olay sayısının %89'u) önceden belirlenmiş ara analizde kemoterapiye kıyasla nivolumab ile kombinasyon halinde ipilimumab koluna randomize edilen hastalarda OS'de istatistiksel olarak anlamlı bir iyileşme göstermiştir. OS için minimum takip süresi 22 aydı.
Sağkalım Olasılığı
Şekil 10: OS'ye ilişkin Kaplan-Meier eğrileri (CA209743)
![]()
Genel sağkalım (ay)
Risk Altındaki Hasta Sayısı
Nivolumab + ipilimumab | ||||||||||||||
| 303 | 273 | 251 | 226 | 200 | 173 | 143 | 124 | 101 | 65 | 30 | 11 | 2 | 0 |
Kemoterapi | ||||||||||||||
| 302 | 268 | 233 | 190 | 162 | 136 | 113 | 95 | 62 | 38 | 20 | 11 | 1 | 0 |
--â-- Nivolumab + ipilimumab (olaylar: 200/303), medyan ve %95 GA: 18,07 (16,82-21,45)
---+-- Kemoterapi (olaylar: 219/302), medyan ve %95 GA: 14,09 (12,45-16,23)
Tablo 13: Etkililik sonuçları (CA209743) | ||
| nivolumab + ipilimumab (n = 303) | kemoterapi (n = 302) |
Genel Sağkalım |
|
|
Olaylar | 200 (%66) | 219 (%73) |
Risk oranı (%96,6 GA) | 0,74 (0,60-0,91) |
|
Basamaklandırılmış log-sıralı p- değeri | 0,002 |
|
Medyan (ay) (%95 GA) | 18,1 (16,8-21,5) | 14,1 (12,5-16,2) |
24 ayda oran (%95 GA) | %41 (35,1-46,5) | %27 (21,9-32,4) |
Progresyonsuz sağkalım |
|
|
Olaylar | 218 (%72) | 209 (%69) |
Risk oranı (%95 GA) | 1,0 (0,82-1,21) |
|
Medyan (ay) (%95 GA) | 6,8 (5,6-7,4) | 7,2 (6,9-8,1) |
Genel yanıt oranı | %40 | %43 |
(%95 GA) | (34,1-45,4) | (37,1-48,5) |
Tam yanıt (CR) | %1,7 | 0 |
Kısmi yanıt (PR) | %38 | %43 |
Yanıt süresi |
|
|
Medyan (ay) (%95 GA) | 11 (8,1-16,5) | 6,7 (5,3-7,1) |
Kombinasyon ve kemoterapi kollarındaki hastaların sırasıyla %44,2 ve %40,7'si daha sonra sistemik tedavi almıştır. Kombinasyon ve kemoterapi kollarındaki hastaların sırasıyla %3,3 ve %20,2'si daha sonra immünoterapi (anti-PD-1, anti-PD-L1 ve anti - CTLA - 4 dahil) almıştır.
Tablo 14'de, önceden belirlenmiş alt grup analizlerinde histolojiye göre OS, PFS ve ORR etkililik sonuçları özetlenmektedir.
Tablo 14: Histolojiye göre etkililik sonuçları (CA209743) | ||||
| Epiteloid (n = 471) |
| Epiteloid olmayan (n = 134) |
|
| nivolumab + ipilimumab (n = 236) | kemoterapi (n = 235) | nivolumab + ipilimumab (n = 67) | kemoterapi (n = 67) |
Genel sağkalım |
|
|
|
|
Olaylar | 157 | 164 | 43 | 55 |
Risk oranı (%95 GA) | 0,85 (0,68- 1.06) |
| 0,46 (0,31-0,70) |
|
Medyan (ay) (%95 GA) | 18,73 (17,05-21,72) | 16,23 (14,09-19,15) | 16,89 (11,83-25,20) | 8,80 (7,62-11,76) |
24 ayda oran (%95 GA) | 41,2 (34,7-47,6) | 31,8 (25,7-38,1) | 39,5 (27,5-51,2) | 9,7 (3,8-18,9) |
Progresyonsuz sağkalım | ||||
Risk oranı (%95 GA) | 1,14 (0,92- 1,41) |
| 0,58 (0,38-0,90) |
|
Medyan (ay) (%95 GA) | 6,18 (5,49-7,03) | 7,66 (7,03-8,31) | 8,31 (3,84-11,01) | 5,59 (5,13-7,16) |
Genel yanıt oranı | %38,6 | %47,2 | %43,3 | %26,9 |
(%95 GA) | (32,3-45,1) | (40,7-53,8) | (31,2-56,0) | (16,8-39,1) |
Yanıt süresi | 8,44 | 6,83 | 24,02 | 4,21 |
Medyan (ay) (%95 GA) | (7,16-14,59) | (5,59-7,13) | (8,31-NA) | (2,79-7,03) |
Tablo 15'de, önceden belirlenmiş alt grup analizlerinde başlangıç tümör PD-L1 ekspresyonuna göre OS, PFS ve ORR etkililik sonuçları özetlenmektedir.
Tablo 15: Tümör PD-L1 ekspresyonuna göre etkililik sonuçları (CA209743) | ||||
| PD-L1 < %1 (n = 135) |
| PD-L1 ⥠%1 (n = 451) |
|
| ipilimumab + nivolumab (n = 57) | kemoterapi (n = 78) | ipilimumab + nivolumab (n = 232) | kemoterapi (n = 219) |
Genel sağkalım |
|
|
|
|
Olaylar | 40 | 58 | 150 | 157 |
Risk oranı (%95 GA) | 0,94 (0,62-1,40) |
| 0,69 (0,55-0,87) |
|
Medyan (ay) (%95 GA) | 17,3 (10,1-24,3) | 16,5 (13,4-20,5) | 18,0 (16,8-21,5) | 13,3 (11,6-15,4) |
24 ayda oran (%95 GA) | 38,7 (25,9-51,3) | 24,6 (15,5-35,0) | 40,8 (34,3-47,2) | 28,3 (22,1-34,7) |
Progresyonsuz sağkalım | ||||
Risk oranı (%95 GA) | 1,79 (1,21-2,64) |
| 0,81 (0,64-1,01) |
|
Medyan (ay) (%95 GA) | 4,1 (2,7-5,6) | 8,3 (7,0-11,1) | 7,0 (5,8-8,5) | 7,1 (6,2-7,6) |
Genel yanıt oranı | %21,1 | %38,5 | %43,5 | %44,3 |
(%95 GA) | (11,4-33,9) | (27,7-50,2) | (37,1-50,2) | (37,6-51,1) |
CA209743 çalışmasına 75 yaş ve üzeri toplam 157 MPM hastası kaydedilmiştir (nivolumab ile kombinasyon halinde ipilimumab kolunda 78 ve kemoterapi kolunda 79). Bu çalışma alt grubunda kemoterapiye kıyasla nivolumab ile kombinasyon halinde ipilimumab kolunda OS'de 1,02'lik risk oranı (% 95 GA: 0,70-1,48) gözlenmiştir. Nivolumab ile kombinasyon halinde ipilimumab alan tüm hastalara kıyasla 75 yaş ve üstü hastalarda daha yüksek ciddi advers reaksiyon ve advers reaksiyonlara bağlı olarak tedaviyi bırakma oranı görülmüştür (bkz. bölüm 4.8). Ancak, bu alt grup analizinin keşifsel doğası nedeniyle, kesin sonuçlara varılamaz.
5.2. Farmakokinetik özellikler
i Genel özelliklerEmilim:
YERVOY terapötik bir protein olup, sadece intravenöz bir infüzyon olarak melanomun tedavisi için uygulanır. Dolayısıyla, YERVOY için emilim ve biyoyararlanım değerlendirmesi geçerli değildir.
Dağılım:
Popülasyon farmakokinetik analizine dayanarak, YERVOY için aşağıdaki ortalama (yüzde varyasyon katsayısı) parametreler elde edilmiştir: kararlı durumdaki dağılım hacmi 7,47 L (%10,1) olmuştur. 3 mg/kg indüksiyon rejimi ile kararlı durumda elde edilen ortalama (yüzde varyasyon katsayısı) YERVOY C19,4 mikrogram/mL (%74,6) olmuştur.
Biyotransformasyon:
YERVOY'un insanlarda metabolizmasını ve metabolik yolaklarını değerlendirmek üzere klinik farmakoloji çalışmaları yapılmamıştır. Terapötik proteinlerin çoğu gibi, ipilimumab, karaciğer sitokromu P-450 (CYP) veya diğer metabolize edici enzimlerle metabolize olmaz ve inhibisyon ve indüksiyon bakımından CYP'ler veya diğer metabolize edici enzimler üzerinde herhangi bir etkiye sahip olma olasılığı yoktur. Dolayısıyla, YERVOY'un anlamlı metabolizma bazlı ilaç-ilaç etkileşimleri olması olasılığı yoktur.
YERVOY gibi monoklonal antikorlar, CYP'lerin veya taşıyıcıların aşağı regülasyonu ile CYP450 substratları olan ilaçların sistemik konsantrasyonlarındaki değişimler ve sitokinlerin salınımı yoluyla küçük moleküllerin farmakokinetiği ile etkileşime girebilir. CYP izozimleri (özellikle CYP2C8, CYP3A4, CYP1A2 ve CYP2E1) substratları (paklitaksel [175 mg/m] ve DTIC [850 mg/m]) ile potansiyel etkileşimi değerlendiren bir klinik çalışma (CA184078) yapılmıştır (bkz. Bölüm 4.5).
Eliminasyon:
Popülasyon farmakokinetik analizine dayanarak, YERVOY için aşağıdaki ortalama (yüzde varyasyon katsayısı) parametreler elde edilmiştir: sistemik CL 16,8mL/sa (%38,1) ve terminal yarılanma ömrü 15,4 gün (%34,4) olmuştur ve bunlar, insan monoklonal antikorlarının eliminasyonu ile uyumludur.
YERVOY CL'si, başlangıçta vücut ağırlığındaki artış ve laktat dehidrojenaz (LDH) arttıkça yükselmiştir; ancak, mg/kg bazında uygulama sonrasında, yükselmiş LDH veya vücut ağırlığı için doz ayarlaması gerekmez. CL yaş (aralık: 23-88 yaş), cinsiyet, eşzamanlı budesonid veya dakarbazin kullanımı, performans durumu, HLA-A2*0201 durumu, hafif karaciğer yetmezliği, böbrek yetmezliği, immünojenisite ve önceki anti-kanser tedavilerinden etkilenmemiştir.
Doğrusallık/ Doğrusal olmayan durum:
YERVOY'un farmakokinetiği 0,3 ilâ 10 mg/kg arasında değişen indüksiyon dozlarını alan 3 haftada bir 4 doz uygulanmış 785 ileri evre melanom hastasında araştırılmıştır. YERVOY'un C, Cve EAA incelenen doz aralığında doz ile orantılı bulunmuştur. Her 3 haftada bir tekrarlanan YERVOY dozlarında, klirens (CL) zamana göre değişmemiş olarak bulunmuş ve akümülasyon indeksi 1,5 kat veya daha düşük olmak üzere belirgin olarak minimal bir sistemik akümülasyon gözlenmiştir. Üçüncü doz ile YERVOY kararlı duruma ulaşmıştır.
Hastalardaki karakteristik özellikler
İleri evre melanomlu 497 hastada yapılan maruziyet-yanıt analizine göre, OS önceki sistemik anti kanser tedavilerinden bağımsızdı ve daha yüksek YERVOY Cminss plazma konsantrasyonları ile birlikte artmıştır.
Irk:
Beyaz ırka ait olmayan etnik gruplarda yeterli veri bulunmadığından ırkın etkisi incelenmemiştir.
Böbrek yetmezliği:
YERVOY'un böbrek yetmezliği olan hastalardaki farmakokinetiğinin değerlendirilmesi için hiçbir kontrollü çalışma yapılmamıştır.
Metastatik melanomlu hastalarla yapılan klinik çalışmalardan elde edilen verilerin popülasyon farmakokinetik analizinde, önceden mevcut hafif ve orta şiddetli böbrek yetmezliği, YERVOY CL'sini etkilememiştir. Önceden mevcut ciddi böbrek yetmezliği ile klinik ve farmakokinetik veriler sınırlıdır; doz ayarlamasının gerekli olup olmadığı belirlenememektedir.
Karaciğer yetmezliği:
Metastatik melanomlu hastalarla yapılan klinik çalışmalardan elde edilen verilerin popülasyon farmakokinetik analizinde, önceden mevcut hafif karaciğer yetmezliği, YERVOY CL'sini etkilememiştir. Önceden mevcut hafif karaciğer yetmezliği ile klinik ve farmakokinetik veriler sınırlıdır; doz ayarlamasının gerekli olup olmadığı belirlenememektedir. Klinik çalışmalarda önceden mevcut ciddi karaciğer yetmezliği olan hastalar tanımlanmamıştır.
Pediyatrik popülasyon:
Faz 4, 2 yetişkin çalışmasından (N=521) ve 2 pediyatrik çalışmadan (N=44) 565 hastadan elde edilen mevcut birleştirilmiş verileri kullanan bir popülasyon FK analizine göre, artan başlangıç vücut ağırlığı ile YERVOY'un CL'si artmıştır. Yaş (2-87 yaş) YERVOY'un CL'si üzerinde klinik olarak önemli bir etkiye sahip değildi. Tahmini geometrik ortalama CL, 12 yaşında ve daha büyük ila 18 yaşından küçük yaş arası adolesan hastalarda 8,72 mL/sa'dır. Adolesanlardaki maruziyet, aynı mg/kg dozunu alan yetişkinlerdeki maruziyetlerle karşılaştırılabilirdir. Yetişkinlerde ve pediyatrik popülasyondaki simülasyona göre, yetişkinlerde ve pediyatrik popülasyonda her 3 haftada bir önerilen 3 mg/kg dozunda karşılaştırılabilir maruziyet elde edilmiştir.
Farmakokinetik/farmakodinamik ilişkiler
Nivolumab ile kombinasyon halinde YERVOY: YERVOY 1 mg/kg, nivolumab 3 mg/kg ile kombinasyon halinde uygulandığında, YERVOY CL'si %1,5 azalmış ve nivolumab CL'si %1 artmış olup, klinik açıdan ilgili kabul edilmemiştir. YERVOY 3 mg/kg, nivolumab 1 mg/kg ile kombinasyon halinde uygulandığında, YERVOY CL'si %9 artmış ve nivolumab CL'si %29 artmış olup, klinik açıdan ilgili kabul edilmemiştir.
Nivolumab ile kombinasyon halinde uygulandığında, YERVOY CL'si anti-YERVOY antikorlarının varlığında %5,7 artmış ve nivolumab CL'si anti-nivolumab antikorlarının varlığında %20 artmıştır. Bu değişiklikler klinik olarak ilgili kabul edilmemiştir.
Nivolumab ve kemoterapi ile kombinasyon halinde YERVOY:
6 haftada bir YERVOY 1 mg/kg 3 haftada bir nivolumab 360 mg ve 2 kür kemoterapi ile kombinasyon halinde uygulandığında, ipilimumab CL değeri yaklaşık %22 artmış ve nivolumab CL değeri yaklaşık %10 düşmüş ve bu düşüş klinik olarak anlamlı kabul edilmemiştir.
5.3. Klinik öncesi güvenlilik verileri
Maymunlarda yapılan intravenöz dozların tekrarlandığı toksikoloji çalışmalarında YERVOY genelde iyi tolere edilmiştir. immünite ile ilişkili advers reaksiyonlar nadiren (~3%) gözlemlenmiş ve kolit (tek bir ölüm vakası ile sonuçlanmıştır), dermatit ve infüzyon reaksiyonunu (muhtemelen yüksek enjeksiyon hızından kaynaklanan akut sitokin salımı nedeniyle) içermiştir. Bir çalışmada eşlik eden histopatolojik bulgular olmaksızın tiroid ve testislerin ağırlığında düşüş olduğu görülmüştür ve bu bulgunun klinik ilgisi bilinmemektedir.
YERVOY'un prenatal ve postnatal gelişimdeki etkileri sinomolgus maymunlarında yapılan bir çalışmada araştırılmıştır. Hamile maymunlar, doğuma kadar ilk trimesterde organogenezin başlangıcından itibaren 3 haftada bir, klinik 3 mg/kg YERVOY dozu ile ilişkili olanlara benzer veya onlardan yüksek maruziyet (EAA) düzeylerinde YERVOY almışlardır. Hamileliğin ilk iki trimesterı sırasında üreme üzerinde tedavi ilişkili hiçbir yan etki tespit edilmemiştir. Üçüncü trimesterdan başlayarak, her iki YERVOY grubundaki kürtaj, ölü doğum, prematüre doğum (ve bununla ilişkili olarak düşük doğum ağırlığı) ve bebek mortalitesi insidansı kontrol hayvanlarına göre daha yüksek
olmuştur; bu bulguların doza bağlı olduğu tespit edilmiştir. Ayrıca, ana rahminde YERVOY'a maruz kalan 2 bebeğin ürogenital sisteminde harici ve viseral gelişimsel anomaliler tespit edilmiştir. Bir dişi bebekte sol böbrekte ve üreterde tek taraflı böbrek agenezisi ve bir erkek bebekte imperforat üretra ve bununla ilişkili üriner obstrüksiyon ve subkütan skrotal ödem görülmüştür. Bu malformasyonların tedavi ile ilişkisi açık değildir.
YERVOY'un mutajenik ve karsinojenik potansiyelini değerlendirecek çalışma yapılmamıştır. Fertilite çalışmaları yapılmamıştır.
 Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır. |
 Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir.
Pankreas Kanseri
Pankreas karnın alt kısmında yatay şekilde bulunan bir organdır. Sindirime yardımcı olan enzimleri ve kan şekerini yönetmeye yardımcı olan hormonları vücuda dağıtmakla görevlidir. |
İLAÇ GENEL BİLGİLERİ
Bristol-Myers Squibb İlaçları Inc.
| Geri Ödeme Kodu | A15634 |
| Satış Fiyatı | 77792.05 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 77792.05 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699726764505 |
| Etkin Madde | Ipilimumab |
| ATC Kodu | L01XC11 |
| Birim Miktar | 50 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 10 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları > Ipilimumab |
| İthal ( ref. ülke : Almanya ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Deri Kanseri Deri kanseri çok rastlanan bir hastalıktır. Üç ana türü bulunur ;genelde kemirici ülser olarak bilinen bazal hücreli karsinom, yassı hücreli karsinom ve kötü huylu tümör. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |
 |
Ruh ve Akıl Sağlığımızı Geliştirmek İyi akıl ve ruh sağlığı sahip olmaktan ziyade, yaptığınız şeylerdir. Akıl ve ruhsal olarak sağlıklı olmak için kendinize değer vermeli ve kendinizi kabul etmelisiniz. |