YULAREB 100 mg film kaplı tablet (42 tablet) Farmakolojik Özellikler
{ Abemasiklib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Antineoplastik ajanlar, Protein kinaz inhibitörleri, ATC kodu: L01EF03
Etki mekanizması
Abemasiklib, siklin bağımlı kinaz 4 ve 6'nın (CDK4 ve CDK6) potent ve seçici bir inhibitörü olup, enzimatik testlerde en çok Siklin D1/CDK4'e karşı aktif olduğu bulunmuştur. Abemasiklib retinoblastom proteininin (Rb) fosforilasyonunu önleyerek hücre döngüsünün G1'den hücre bölünmesi S fazına ilerlemesini bloke eder ve böylece tümör büyümesinin baskılanmasını sağlar. Östrojen reseptörü pozitif meme kanseri hücre soylarında abemasiklib ile sağlanan uzun süreli hedef inhibisyonu Rb fosforilasyonunun geri dönüşünü önleyerek hücre yaşlanmasına ve apoptoza yol açmıştır. İn vitro, Rb-negatif ve Rb-depleted kanser hücre serileri, genellikle abemasiklibe karşı daha az hassastır. Meme kanseri ksenogreft modellerinde, klinik açıdan anlamlı konsantrasyonlarda tek başına veya anti-östrojenlerle kombinasyon halinde kesintisiz olarak her gün dozlama yapılarak uygulanan abemasiklib tümör boyutunda küçülme sağlamıştır.
Farmakodinamik etkiler
G1 restriksiyon noktasından önce hücre döngüsü inhibisyonuyla sonuçlanan Rb fosforilasyonu ve topoizomeraz II alfa inhibisyonundan anlaşıldığı üzere, abemasiklib kanser hastalarında CDK4 ve CDK6'yı inhibe eder.
Kardiyak elektrofizyoloji
Abemasiklibin QTcF aralığı üzerindeki etkisi 144 ileri evre kanser hastasında değerlendirilmiştir. Terapötik dozlama programının ardından gözlemlenen ortalama maksimum kararlı durum abemasiklib konsantrasyonunda QTcF aralığında büyük bir değişiklik (>20 ms) saptanmamıştır.
Sağlıklı bireylerde günde iki kez 200 mg dozuna benzer maruziyet düzeylerinde yapılan maruziyet-yanıt analizinde, abemasiklibin QTcF aralığını klinik açıdan anlamlı derecede uzatmadığı belirlenmiştir.
Klinik etkililik ve güvenlilik
Erken evre meme kanseri
Randomize Faz 3 Çalışma monarchE: Endokrin tedavi ile kombinasyon halinde abemasiklib
Adjuvan endokrin tedavi ile kombinasyon halinde abemasiklib'in etkililiği ve güvenliği, HR pozitif, HER2 negatif, nod pozitif, nüks riski yüksek erken evre meme kanseri olan kadın ve erkeklerde, randomize, açık etiketli, iki kohortlu bir faz 3 çalışma olan monarchE çalışmasında değerlendirilmiştir. Yüksek nüks riski, şu klinik ve patolojik özelliklerle tanımlanmıştır: ≥ 4 pALN (pozitif aksiller lenf düğümleri) veya 1-3 pALN ve takip eden kriterlerden en az biri: tümör boyutu ≥5 cm veya histolojik grade 3 veya yüksek Ki-67 indeksi (≥%20).
Toplam 5637 hasta, 2 yıl günde iki kez abemasiklib 150 mg artı doktor seçimi standart endokrin tedavi veya tek başına standart endokrin tedavi alacak şekilde 1:1 oranında randomize edilmiştir. Randomizasyon, önceki kemoterapi, menopoz durumu ve bölgeye göre gerçekleştirilmiştir. Erkekler postmenopozal olarak sınıflandırılmıştır. Hastalar definitif lokorejyonal tedaviyi (neoadjuvan veya adjuvan kemoterapi olsun veya olmasın) tamamlamıştır. Hastalar, önceki herhangi bir kemoterapi veya radyoterapinin akut yan etkilerinden kurtulmuş olmalıdır. Randomizasyondan önce, kemoterapiden sonra 21 gün ve radyoterapiden sonra 14 günlük bir arınma periyodu gerekli olmuştur. Randomizasyondan önce hastaların 12 haftaya kadar adjuvan endokrin tedavisi almalarına izin verilmiştir. Standart endokrin tedavisi olarak fulvestrant ile adjuvan tedaviye izin verilmemiştir. Doğu Kooperatifi Onkoloji Grubu (Eastern Cooperative Oncology Group - ECOG) Performans Durumu 0 veya 1 olan hastalar dahil edilmiştir. VTE öyküsü olan hastalar çalışmaya dahil edilmemiştir. Çalışma tedavi periyodunun bitiminden sonra, her iki tedavi kolunda hastalar, kümülatif en az 5 yıl ve tıbbi olarak uygunsa 10 yıla kadar adjuvan endokrin tedavisi almaya devam etmiştir.
LHRH agonistleri, erkekler ve premenopozal ve perimenopozal kadınlar için klinik olarak endike olduğunda verilmiştir.
Randomize popülasyon, sadece yüksek risk klinik ve patolojik özelliklerine göre çalışmaya alınan 5120 (%91) hastayı ve 1-3 pALN ve yüksek Ki-67 indeksine dayalı olarak çalışmaya alınan 517 (%9) hastayı içermektedir.
Hasta demografikleri ve başlangıçtaki tümör özellikleri tedavi kolları arasında dengelidir. Çalışmaya alınan hastaların medyan yaşı yaklaşık 51'dir (aralık, 22-89 yıl); hastaların %15'i 65 yaş veya üzeri, %99'u kadın, %71'i beyaz ırk, %24'ü asyalı ve %5'i diğerdir. Hastaların %44'ü premenopozal veya perimenopozaldır. Hastaların çoğu öncesinde kemoterapi (%37 neoadjuvan, %62 adjuvan) ve radyoterapi (%95) almıştır. Hastaların aldığı başlangıç endokrin tedavi letrozol (%38), tamoksifen (%31), anastrozol (%22) veya eksemestanı (%8) içermektedir. Hastaların %60'ında 4 veya daha fazla pozitif lenf nodu, %38'inde GRADE 3 tümör ve %22'sinde ameliyatta patolojik tümör boyutu ≥5 cm ve %44'ü tedavisi amaçlanan popülasyonda (ITT) yüksek Ki-67 indeksine sahiptir.
Birincil sonlanım noktası randomizasyondan itibaren; ipsilateral invaziv meme tümörü nüksü, bölgesel invaziv meme kanseri nüksü, uzak nüks, kontralateral invaziv meme kanseri, primeri meme olmayan ikinci bir invazif kanserin ilk oluşumuna kadar geçen süre veya herhangi bir
nedene bağlanabilecek ölüm olarak tanımlanan İnvazif Hastalıksız Sağkalım (Invasive Disease- Free Survival - IDFS)'dır. Anahtar ikincil sonlanım noktası, randomizasyondan ilk uzak nüks oluşumuna veya herhangi bir nedene atfedilebilen ölüme kadar geçen süre olarak tanımlanan Uzak Nükssüz Sağkalım (Distant Relapse Free Survival - DRFS)'dır.
Çalışmanın birincil amacına, önceden planlanmış interim analizde (veri kesim tarihi 16 Mart 2020), medyan 15,5 aylık takip süresiyle ulaşılmıştır.
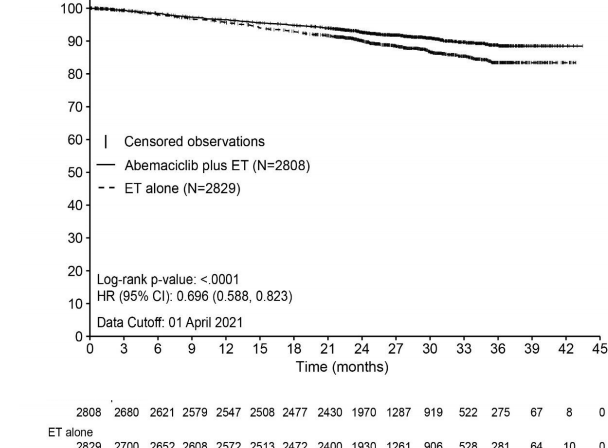
Abemasiklib artı endokrin tedavi alan hastalarda tek başına endokrin tedavi alanlara kıyasla IDFS'de istatistiksel olarak anlamlı bir iyileşme gözlenmiştir (HR = 0,747, %95 CI [0,598, 0,932], p = 0,0096).Daha ileri bir analizde (01 Nisan 2021 veri kesim tarihli), hastaların %90ı 2 yıllık çalışma tedavi süresinden uzaktır ve medyan takip süresi 27,1 aydır.
Etkililik sonuçları Tablo 9 ve Şekil 1'de özetlenmiştir.
Tablo 9. monarchE: Etkililik verilerinin özeti (Tedavisi amaçlanan popülasyon)
| Abemasiklib artı endokrin tedavi N = 2808 | Yalnızca endokrin tedavi N = 2829 |
İnvazif Hastalıksız Sağkalım (IDFS) |
|
|
Olay görülen hasta sayısı (n, %) | 232 (8,3) | 333 (11,8) |
Tehlike oranı (%95 CI) ve p değeri | 0,696 (0,588, 0,823), p < 0,0001 | |
24. ayda IDFS (%, %95 CI) | 92,7 (91,6, 93,6) | 90,0 (88,8, 91,1) |
36. ayda IDFS (%, %95 CI) | 88,8 (87,0, 90,3) | 83,4 (81,3, 85,3) |
Uzak Nükssüz Sağkalım (Distant Relapse Free Survival - DRFS) |
|
|
Olay görülen hasta sayısı (n, %) | 191 (6,8) | 278 (9,8) |
Tehlike oranı (%95 CI) | 0,687 (0,571, 0,826) | |
24. ayda DRFS (%, %95 CI) | 94,1 (93,2, 95,0) | 91,6 (90,5, 92,6) |
36. ayda DRFS (%, %95 CI) | 90,3 (88,6, 91,8) | 86,1 (84,2, 87,9) |
Kısaltma: CI = Güven aralığı Veri kesim tarihi 01 Nisan 2021
Zaman (ay)
Log-sıra p-değeri: <.0001
HR (%95 CI): 0,696 (0,588, 0,823)
Veri kesim: 01 Nisan 2021
Sansürlenmiş gözlemler Abemasiklib artı ET (N=2808) Yalnızca ET (N=2829)
İnvazif Hastalıksız Sağkalım (%)
Şekil 1. monarchE: IDFS'ye ilişkin Kaplan-Meier grafiği (Araştırmacı değerlendirmesi, tedavisi amaçlanan popülasyon)
Kısaltmalar: CI = güven aralığı; ET = endokrin tedavi; HR = tehlike oranı; IDFS = invazif hastalıksız sağkalım; N = popülasyondaki hasta sayısı
Veri kesim tarihi 01 Nisan 2021
Coğrafi bölge, menopoz durumu ve önceki kemoterapi ile tanımlanan hasta alt gruplarında fayda gözlemlenmiştir.İleri evre veya metastatik meme kanseri
Randomize Faz 3 Çalışma MONARCH 3: Aromataz inhibitörleriyle kombinasyon halinde abemasiklib
Bir aromataz inhibitörü (anastrozol veya letrozol) ile kombinasyon halinde abemasiklib'in etkililiği ve güvenliliği, bu hastalık koşullarında önceden sistemik tedavi uygulanmamış HR pozitif, HER2 negatif, lokal olarak ilerlemiş veya metastatik meme kanseri olan kadınların yer aldığı randomize, çift kör, plasebo kontrollü bir faz 3 çalışma olan MONARCH 3 çalışmasında değerlendirilmiştir. Hastalar, günde iki kez 150 mg abemasiklib artı aynı programa göre plasebo artı nonsteroid aromataz inhibitörüne karşı önerilen dozda günlük olarak uygulanan nonsteroid aromataz inhibitörü almak üzere 2:1 oranında randomize edilmiştir. Primer sonlanım noktası RECIST 1.1 uyarınca araştırmacı tarafından değerlendirilen progresyonsuz sağkalım (PFS), temel sekonder etkililik sonlanım noktaları ise objektif yanıt oranı (ORR), klinik yarar oranı (KYO) ve genel sağkalım (GS) olarak belirlenmiştir.
Çalışmaya alınan hastaların medyan yaşı 63 (aralık: 32-88) olarak kaydedilmiştir. Neo(adjuvan) koşullarda hastaların yaklaşık %39'u kemoterapi ve %44'ü antihormonal tedavi almıştır. Önceden (neo) adjuvan endokrin tedavi alan hastalar, bu tedaviyi çalışma randomizasyonundan en az 12 ay önce tamamlamış olmalıdır. Hastaların büyük bölümünde (%96) başlangıçta metastatik hastalık tespit edilmiştir. Hastaların yaklaşık %22'sinde yalnızca kemikte hastalık gözlenirken, %53'ünde viseral metastazlar belirlenmiştir.
Çalışma, PFS'nin iyileştirilmesi olarak belirlenen primer sonlanım noktasını karşılamıştır. Primer etkililik bulguları Tablo 10 ve Şekil 2'de özetlenmektedir.
Tablo 10. MONARCH 3: Etkililik verilerinin özeti (Araştırmacı değerlendirmesi, tedavisi amaçlanan popülasyon)
| Abemasiklib artı aromataz inhibitörü | Plasebo artı aromataz inhibitörü |
Progresyonsuz sağkalım | N=328 | N=165 |
Araştırmacı değerlendirmesi, olay sayısı (%) | 138 (42,1) | 108 (65,5) |
Medyan [ay] (%95 CI) | 28,18 (23,51; NR) | 14,76 (11,24; 19,20) |
PFS'deki fark (ay) | NR | |
Tehlike oranı (%95 CI) ve p değeri | 0,540 (0,418; 0,698); p <0,000002 | |
Bağımsız radyografik inceleme, olay sayısı (%) | 91 (27,7) | 73 (44,2) |
Medyan [ay] (%95 CI) | NR (NR; NR) | 19,36 (16,37; 27,91) |
Tehlike oranı (%95 CI) ve p değeri | 0,465 (0,339; 0,636); p < 0,000001 | |
Objektif yanıt oranı[%] (%95 CI) | 49,7 (44,3; 55,1) | 37,0 (29,6; 44,3) |
Yanıt süresi [ay] (%95 CI) | 27,39 (25,74; NR) | 17,46 (11,21; 22,19) |
Ölçülebilir hastalığı olan hastalarda objektif yanıt |
N=267 |
N=132 |
Objektif yanıt oranı [%] (%95 CI) | 61,0 (55,2 â 66.9) | 45,5 (37,0 ; 53,9) |
Tam yanıt, (%) | 3,4 | 0 |
Kısmi yanıt, (%) | 57,7 | 45.5 |
Klinik yarar oranı(ölçülebilir hastalık) [%] (%95 CI) | 79,0 (74,1; 83,9) | 69,7 (61,9; 77,5) |
Şekil 2. MONARCH 3: Progresyonsuz sağkalıma ilişkin Kaplan-Meier grafiği (Araştırmacı değerlendirmesi, tedavisi amaçlanan popülasyon)
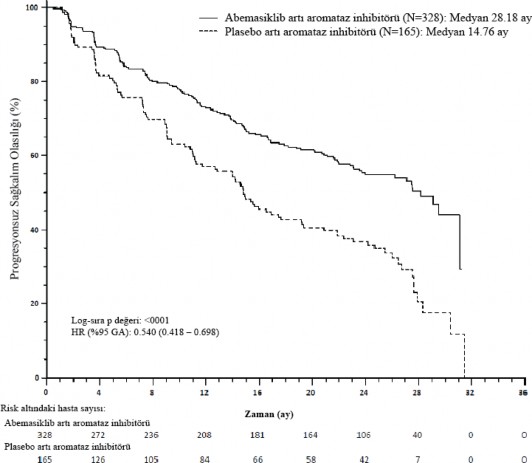
Progresyonsuz sağkalım (PFS) abemasiklib artı aromataz inhibitörü (Aİ) kolunda anlamlı ölçüde uzamıştır (HR 0,540 [%95 GA, 0,418, 0,698]); medyan PFS abemasiklib artı Aİ kolunda 28,18 ay, plasebo artı Aİ kolunda 14,76 ay olarak belirlenmiştir. Bu bulgular, abemasiklib artı aromataz inhibitörü ile tedavi edilen hastalarda hastalık progresyonu veya ölüm riskinde %46 oranında klinik açıdan anlamlı bir azalmaya karşılık gelmektedir.
Son PFS analizi sırasında genel sağkalım verileri olgunlaşmamıştır (iki kolda 93 olay gözlemlenmiştir). HR 1,057 (%95 GA: 0,683, 1,633), p=0,8017 olarak bildirilmiştir.
Önceden belirlenmiş bir dizi alt grup PFS analizi göstermiştir ki, yaş (<65 veya ≥65 yıl), hastalık bölgesi, hastalık durumu (de novo metastatik veya rekürren metastatik ya da lokal olarak ilerlemiş rekürren), ölçülebilir hastalığın varlığı, progesteron reseptörü durumu dahil olmak üzere hasta alt grupları arasında ve temel ECOG performans durumu parametrelerinde sonuçlar tutarlıdır. Hastalık progresyonu veya ölüm riskinde azalma viseral hastalık bulunan hastalar (HR 0,567 [%95 GA: 0,407, 0,789], medyan PFS 21,6 ay ve 14,0 ay), yalnızca kemikte
hastalık bulunan hastalar (HR 0,565, [%95 GA: 0,306, 1,044]) ve ölçülebilir hastalık bulunan
hastalarda (HR 0,517, [%95 GA: 0,392, 0,681]) gözlenmiştir.
İlk genel sağkalım (OS) interim analizinde, her iki kolda 197 olay gözlemlenmiştir ve HR, 0,786 (%95 CI: 0,589, 1,049) olarak bildirilmiştir.
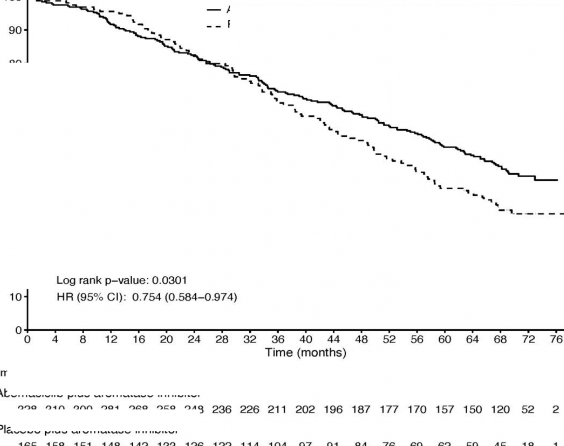
İkinci OS interim analizinde, her iki kolda 255 olay gözlemlenmiştir. Medyan OS, abemasiklib artı Aİ kolunda 67,1 ay ve plasebo artı Aİ kolunda 54,5 aydır. 0,754 (%95 GA: 0,584, 0,974) olarak gözlemlenen HR, istatistiksel anlamlılığa ulaşmadığından (Şekil 3), çalışma genel sağkalımı tam olarak karakterize etmeye devam etmektedir.
Zaman (ay)
Log sıra p-değeri: 0,0301
HR (%95 GA): 0,754 (0,584 â 0,974)
Genel Sağkalım Olasılığı (%)
Şekil 3. MONARCH 3: Genel sağkalıma ilişkin Kaplan-Meier grafiği (Tedavisi amaçlanan popülasyon)
Randomize Faz 3 Çalışma MONARCH 2: Fulvestrant ile kombinasyon halinde abemasiklib
Fulvestrant ile kombinasyon halinde abemasiklib'in etkililiği ve güvenliliği HR pozitif, HER2 negatif, lokal olarak ilerlemiş veya metastatik meme kanseri olan kadınların yer aldığı randomize, çift kör, plasebo kontrollü bir faz 3 çalışma olan MONARCH 2 çalışmasında değerlendirilmiştir. Hastalar, günde iki kez 150 mg abemasiklib artı ilk dozdan iki hafta sonra uygulanan ek 500 mg dozla birlikte bir aylık aralıklarla 500 mg fulvestrant ve plasebo artı aynı programa göre tek başına fulvestrant almak üzere 2:1 oranında randomize edilmiştir. Primer sonlanım noktası RECIST 1.1 uyarınca araştırmacı tarafından değerlendirilen PFS, temel sekonder etkililik sonlanım noktaları ise objektif yanıt oranı (ORR), klinik yarar oranı (KYO) ve genel sağkalım (GS) olarak belirlenmiştir.
Çalışmaya alınan hastaların medyan yaşı 60 (aralık: 32-91) olarak kaydedilmiştir. Her tedavi kolunda hastaların büyük bölümü beyaz ırktandır ve daha önce metastatik hastalık için
kemoterapi almamıştır. GnRH agonisti ile overi baskılanan hastaların %17'si pre/perimenopozal dönemdedir. Hastaların yaklaşık %56'ında viseral Hastaların yaklaşık % 25'i primer endokrin direncine sahiptir (adjuvan endokrin tedavinin ilk 2 yılında endokrin terapisinde ilerleme veya metastatik meme kanseri için ilk sıradaki endokrin tedavinin ilk 6 ayında) ve çoğunluğunda endokrin direnci daha sonra gelişmiştir. Hastaların %59'u (neo) adjuvan basamakta ve %38'i metastatik basamakta en son endokrin tedaviyi almıştır.
Çalışma, PFS'de primer sonlanım noktasını karşılamıştır. Primer etkililik bulguları Tablo 11 ve Şekil 4'te özetlenmektedir.
Tablo 11. MONARCH 2: Etkililik verilerinin özeti (Araştırmacı değerlendirmesi, tedavisi amaçlanan popülasyon)
| Abemasiklib artı fulvestrant | Plasebo artı fulvestrant |
Progresyonsuz sağkalım | N=446 | N=223 |
Araştırmacı değerlendirmesi, olay sayısı (%) | 222 (49,8) | 157 (70,4) |
Medyan [ay] (%95 CI) | 16,4 (14,4; 19,3) | 9,3 (7,4; 12,7) |
Tehlike oranı (%95 CI) ve p değeri | 0,553 (0,449; 0,681), p=0,0000001 | |
Bağımsız radyografik inceleme, olay sayısı (%) | 164 (36,8) | 124 (55,6) |
Medyan [ay] (%95 CI) | 22,4 (18,3; NR) | 10,2 (5,8; 14,0) |
Tehlike oranı (%95 CI) ve p değeri | 0,460 (0,363; 0,584); p <0,000001 | |
Objektif yanıt oranı [%] (%95 CI) | 35,2 (30,8; 39,6) | 16,1 (11,3; 21,0) |
Yanıt süresi [ay] (%95 CI) | NR (18,05; NR) | 25,6 (11,9; 25,6) |
Ölçülebilir hastalığı olan hastalarda objektif yanıt |
N=318 |
N=164 |
Objektif yanıt oranı [%] (%95 CI) | 48,1 (42,6; 53,6) | 21,3 (15,1; 27,6) |
Tam yanıt, (%) | 3,5 | 0 |
Kısmi yanıt, (%) | 44,7 | 21,3 |
Klinik yarar oranı (ölçülebilir hastalık) [%] (%95 CI) | 73,3 (68,4; 78,1) | 51,8 (44,2; 59,5) |
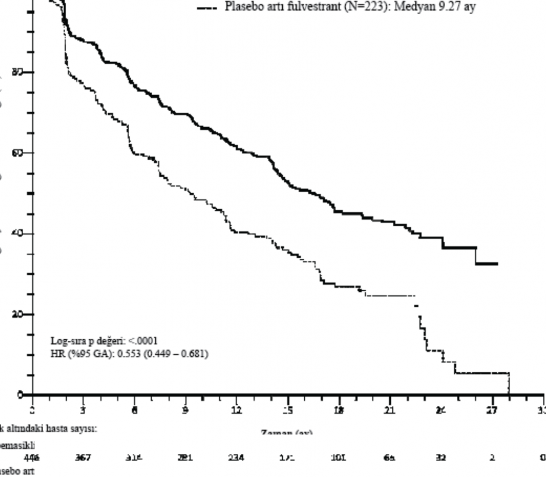
Şekil 4. MONARCH 2: Progresyonsuz sağkalıma ilişkin Kaplan-Meier grafiği (Araştırmacı değerlendirmesi, tedavisi amaçlanan popülasyon)
|
|
|
|
|
|
|
|
|
|
|
Medyan PFS abemasiklib artı fulvestrant kolunda anlamlı ölçüde uzamış (HR 0,553 [%95 GA 0,449, 0,681]) ve abemasiklib artı fulvestrant kolunda medyan PFS 16,4 ay, plasebo artı fulvestrant 9,3 ay olarak belirlenmiştir. Bu bulgular, abemasiklib artı fulvestrant ile tedavi edilen hastalarda hastalık progresyonu veya ölüm riskinde klinik açıdan anlamlı olan %44,7 azalmaya ve medyan PFS'de 7,2 aylık artışa karşılık gelmektedir. Abemasiklib artı fulvestrant sağlıkla ilgili yaşam kalitesinde klinik açıdan anlamlı veya önemli bir zarara yol açmadan progresyonsuz sağkalımı uzatmıştır.
Önceden belirlenmiş bir dizi alt grup PFS analiziyapılmıştır, yaş (<65 veya ≥65 yıl), ırk, coğrafi bölge, hastalık bölgesi, endokrin tedavi direnci, ölçülebilir hastalık varlığı, progesteron reseptörü durumu ve menopozal durum dahil olmak üzere hasta alt grupları arasında tutarlı sonuçlar göstermiştir. Hastalık progresyonu veya ölüm riskinde azalma viseral hastalık bulunan hastalar (HR 0,481 [%95 GA: 0,369, 0,627], medyan PFS 6,5 aya karşılık 14,7 ay ), yalnızca
kemikte hastalık bulunan hastalar (HR 0,543, [%95 GA: 0,355, 0,833]) ve ölçülebilir hastalık
bulunan hastalarda (HR 0,523, [%95 GA: 0,412, 0,644]) gözlemlenmiştir. Tehlike oranı,
pre/perimenopozal dönemdeki hastalarda 0,415 (%95 GA: 0,246, 0,698), progesteron reseptörü
negatif hastalarda ise 0,509 [%95 GA: 0,325, 0,797]) olarak belirlenmiştir.
PFS, lokal olarak ilerlemiş veya metastatik hastalığı olan ve önceden endokrin tedavi almayan alt popülasyonda da tutarlıdır.
ITT popülasyonundaki genel sağkalım (OS) analizi, plasebo artı fulvestrant alanlara kıyasla abemasiklib artı fulvestrant alan hastalarda istatistiksel olarak anlamlı bir iyileşme göstermiştir. Genel sağkalım sonuçları Tablo 12 ve Şekil 5'te özetlenmiştir.
Tablo 12. MONARCH 2: Genel sağkalım verilerinin özeti (Tedavisi amaçlanan popülasyon)
| Abemasiklib artı fulvestrant | Plasebo artı fulvestrant |
Genel sağkalım | N = 446 | N = 223 |
Olayların sayısı (n, %) | 211 (47,3) | 127 (57,0) |
Medyan OS [ay] (95 % CI) | 46,7 (39,2, 52,2) | 37,3 (34,4, 43,2) |
Tehlike oranı (95 %CI) | 0,757 (0,606, 0,945) | |
p değeri | 0,0137 | |
N = hasta sayısı; CI = güven aralığı; OS = genel sağkalım
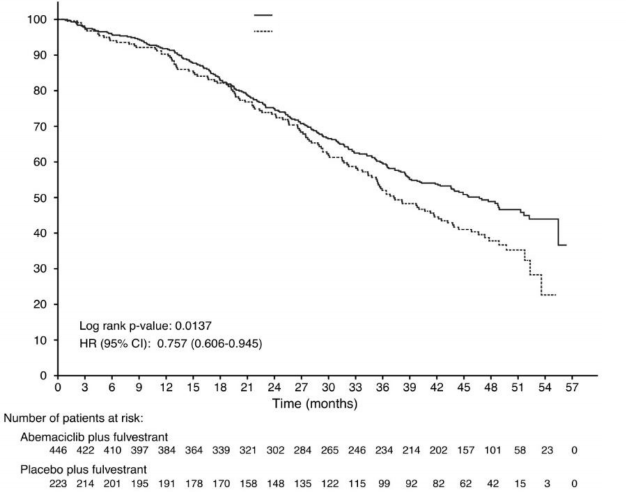
Abemasiklib artı fulvestrant (N=446): Medyan 46,72 ay Plasebo artı fulvestrant (N=223): Medyan 37,25 ay
Plasebo artı fulvestrant
Zaman (ay)
Risk altındaki hasta sayısı: Abemasiklib artı fulvestrant
Log-sıra p değeri: 0,0137
HR (%95 GA): 0,757 (0,606-0,945)
Genel Sağkalım Olasılığı (%)
Şekil 5. MONARCH 2: Genel sağkalıma ilişkin Kaplan-Meier eğrisi (Tedavisi amaçlanan popülasyon)
Sınıflandırma faktörlerine göre OS analizleri, viseral hastalığı olan hastalarda OS HR'nin 0,675 (%95 GA: 0,511, 0,891) ve primer endokrin direnci olan hastalarda 0,686 (%95 GA: 0,451,
1,043) olduğunu göstermiştir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Abemasiklib, Tdeğeri 8 saat ve ortalama mutlak biyoyararlanımı yaklaşık %45 olan yavaş emilimli bir ilaçtır. 50-200 mg terapötik doz aralığında, plazma maruziyeti (EAA) ve Cdeğerindeki artış dozla yaklaşık olarak orantılıdır. Tekrarlanan günde iki kez dozlamadan sonra kararlı duruma 5 gün içinde ulaşılırken, abemasiklibin Cve EAA'ya göre sırasıyla 3,7 (%58 CV) ve 5,8 (%65 CV) geometrik ortalama birikim oranıyla biriktiği belirlenmiştir. Yüksek yağ içerikli öğün abemasiklib ve aktif metabolitlerinin kombine EAA değerini %9, Cdeğerini
%26 artırmıştır. Bu değişiklikler klinik açıdan anlamlı bulunmamıştır. Dolayısıyla, abemasiklib aç veya tok karnına alınabilir.
Dağılım:
Abemasiklib insanlarda plazma proteinlerine yüksek oranda bağlanır (ortalama bağlı fraksiyon yaklaşık %96-98). Yaklaşık 750 L (%69 CV) olarak belirlenen geometrik ortalama sistemik dağılım hacmi abemasiklibin dokulara dağıldığını göstermektedir.
Abemasiklib ve aktif metabolitlerinin beyin-omurilik sıvısındaki konsantrasyonları bağlanmamış plazma konsantrasyonlarına benzerdir.
Biyotransformasyon:
Abemasiklibin temel klerens yolu hepatik metabolizmadır. Abemasiklib, ağırlıklı olarak sitokrom P450 (CYP) 3A4 tarafından çeşitli metabolitlere metabolize edilir. Primer biyotransformasyon, ana ilacın % 77'si olan bir EAA ile sirküle olan bir metabolite hidroksilasyondur. Ek olarak, N-desetil ve N-desetilhidroksi metabolitleri, ana ilacın % 39 ve
% 15'i olan EAA'larda sirküle olmaktadır. Bu sirküle olan metabolitler, abemasiklibe benzer bir potansiyele sahiptir.
Eliminasyon:
Abemasiklibin geometrik ortalama hepatik klerensi (CL) 21,8 L/sa. (%39,8 CV) olarak hesaplanırken, hastalardaki ortalama plazma eliminasyon yarılanma ömrü 24,8 saat (%52,1 CV) olarak belirlenmiştir. [C]-abemasiklibin tek oral dozundan sonra dozun yaklaşık %81'i feçes ve %3,4'ü idrar ile atılır. Feçeste elimine edilen dozun büyük kısmı metabolitlerdir.
Doğrusallık/doğrusal olmayan durum: Veri bulunmamaktadır.
Hastalardaki karekteristik özellikler
Özel popülasyonlar:
Yaş, cinsiyet ve vücut ağırlığı:
Kanser hastalarına ilişkin popülasyon farmakokinetiği analizinde (135 erkek, 859 kadın; yaş aralığı 24-91 yaş, vücut ağırlığı aralığı 36-175 kg) yaş, cinsiyet ve vücut ağırlığının abemasiklib maruziyeti üzerinde etki göstermediği saptanmıştır.
Karaciğer yetmezliği:
Abemasiklib karaciğerde metabolize edilir. Hafif (Child Pugh A) ve orta derece (Child Pugh B) karaciğer yetmezliğinin abemasiklib maruziyeti üzerinde etkisi olmadığı belirlenmiştir. Şiddetli karaciğer yetmezliği (Child Pugh C) bulunan hastalarda bağlanmamış abemasiklib artı aktif metabolitleri sırasıyla 2,1 kat ve 2,4 kat artmıştır. Abemasiklibin yarı ömrü 24 saatten 55 saate yükselmiştir (Bkz. Bölüm 4.2).
Böbrek yetmezliği:
Abemasiklib ve metabolitlerinin renal klerensi minör düzeydedir. Hafif ve orta derece böbrek yetmezliğinin abemasiklib maruziyeti üzerinde etkisi olmadığı belirlenmiştir. Şiddetli böbrek yetmezliği, son dönem böbrek hastalığı olan veya diyaliz uygulanan hastalarla ilgili veri yoktur.
5.3. Klinik öncesi güvenlilik verileri
İnsanlarla potansiyel olarak ilgili olan primer hedef organ bulguları, 13 haftaya kadar sürdürülen çalışmalarda fare, sıçan ve köpeklerde görülen gastrointestinal kanal, hematolenfopoetik organlar ve erkek üreme sisteminde görülmüştür. Gözlerdeki ve kalp kapakçıklarındaki etkiler, klinik olarak ilişkili maruziyet seviyelerinde yalnızca kemirgenlerde meydana gelmiştir. Akciğer ve iskelet kası üzerindeki etkiler, yalnızca kemirgenlerde insan maruziyet seviyelerinden en az 2 kat daha yüksek maruziyet seviyelerinde ve böbreklerdeki etkiler, yalnızca kemirgenlerde insan maruziyet seviyelerinden en az 6 kat daha yüksek maruziyet seviyelerinde meydana gelmiştir. 28 günlük iyileşme süresinin sonunda, erkek üreme sistemindeki etkiler istisnası dışında tüm hedef organ bulgularında tam veya kısmi iyileşme gözlenmiştir.
Genotoksisite
Abemasiklib bakteriyel ters mutasyon (Ames) testinde mutajenik, insan periferik kan lenfositlerindeki in vitro kromozomal aberasyon testinde klastojenik ve in vivo sıçan kemik iliği mikronükleus testinde klastojenik bulunmamıştır.
Karsinojenisite
Abemasiklib, sıçanlarda ve farelerde yapılan 2 yıllık çalışmalarda kanserojenisite açısından değerlendirilmiştir. Erkek sıçanlarda abemasiklibin günlük oral uygulaması, insan klinik maruziyetinin yaklaşık 1,5 katı maruziyetlerde benign testiküler interstisyel hücre adenomları ile sonuçlanmıştır. İlave olarak, insan klinik maruziyetinin yaklaşık 0,1 katı maruziyetlerde interstisyel hücre hiperplazisi gözlemlenmiştir. Bu etkilerin insanlardaki yansıması bilinmemektedir. Farelerde veya dişi sıçanlarda abemasiklib uygulamasına bağlı neoplastik bulguya rastlanmamıştır.
Fertilite bozukluğu
Abemasiklib, üreme potansiyeli olan erkeklerde fertilite bozukluğuna neden olabilir. 3 aya kadar tekrarlanan doz toksisite çalışmalarında abemasiklib ile ilişkili bulgular, testis, epididimis, prostat ve seminal veziküldeki azalmış organ ağırlıkları, intratubüler hücresel debris, hipospermi, tübüler dilatasyon, atrofi ve dejenerasyon/nekrozu içermektedir. Bu etkiler, sıçanlarda ve köpeklerde insan klinik maruziyetinin sırasıyla yaklaşık 2 ve 0,02 katı maruziyetlerde meydana gelmiştir. Bir sıçan erkek fertilite çalışmasında, abemasiklibin üreme performansı üzerinde herhangi bir etkisi olmamıştır.
Bir sıçan dişi fertilite ve erken embriyonik gelişim çalışmasında ve tekrarlanan doz toksisite çalışmalarında, abemasiklibin üreme performansı üzerinde herhangi bir etkisi olmamıştır veya dişilerde fertilitenin bozulma riskinin göstergesi olan, dişi üreme sistemi üzerinde herhangi bir önemli etkisi olmamıştır.
Gelişim toksisitesi
Abemasiklib, insanlar için önerilen doza benzer maternal maruziyetlerde teratojenik bulunmuş ve fetus ağırlığında azalmaya neden olmuştur.
 İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar.
İnme
İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama
ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına
yol açar. |
 Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir.
Mesane Kanseri
Mesane kanseri her zaman mukozada başlar. Erken safhalarda bu tabakada sınırlı kalır ve
hücre içindeki karsinom olarak nitelendirilir. |
İLAÇ GENEL BİLGİLERİ
Lilly İlaç Ticaret Ltd.Şti.
| Satış Fiyatı | 42820.01 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 42820.01 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Kısıtlanmış Beyaz Reçeteli bir ilaçdır. |
| Barkodu | 8699673098289 |
| Etkin Madde | Abemasiklib |
| ATC Kodu | L01EF03 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 42 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Fransa ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Aşırı Alkol Kullanımı, Alkolizm Alkol bağımlılığı, alkol kullanımı ve alkol sorunları arasındaki farkı açıklamak güçtür. Örneğin, geçmişte alkol kullanmış olan bir kimsenin mutlaka alkol bağımlısı olması gerekmez. |
 |
Dış Gebelik Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
 |
Yüksek Tansiyon Hipertansiyon sürekli anormal derecede yüksek olan kan basıncıdır. Tansiyon atardamarlarınızdaki kanın basıncıdır. |