ZEJULA 100 mg sert kapsül Farmakolojik Özellikler
{ Niraparib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer antineoplastik ajanlar, Poli (ADP-riboz) polimeraz (PARP) inhibitörleri
ATC kodu: L01XK02
Etki mekanizması ve farmakodinamik etkiler
Niraparib, DNA onarımında rol oynayan poli(ADP-riboz) polimeraz (PARP) enzimleri PARP- 1 ve PARP-2'nin bir inhibitörüdür. İn vitro çalışmalarda, niraparible indüklenen sitotoksisiteye PARP enzimatik aktivitesinin inhibisyonu ve DNA hasarı, apoptoz ve hücre ölümü ile sonuçlanan PARP-DNA komplekslerinin oluşumunda artışın dahil olabileceği gösterilmiştir. Meme kanseri (BRCA) 1 ve 2 tümör baskılayıcı genlerinde eksiklik olan veya olmayan tümör
hücre hatlarında artan niraparib kaynaklı sitotoksisite gözlenmiştir. Farelerde büyütülen ortotopik yüksek dereceli seröz over kanseri hasta kaynaklı ksenograft tümörlerinde (PDX) niraparibin; BRCA 1 ve 2 mutantlarında, homolog rekombinasyon (HR) eksikliği olan BRCA vahşi tipte ve tespit edilebilir HR eksikliği olmayan BRCA vahşi tip tümörlerde tümör büyümesini azalttığı görülmüştür.
Klinik etkililik ve güvenlilik
Birinci basamak over kanseri idame tedavisi
PRIMA, Faz 3 çift kör, plasebo kontrollü bir çalışmadır ve birinci basamak platin temelli kemoterapiye tam veya kısmi yanıt veren hastalar (n=733) 2:1 oranında ZEJULA veya eşleştirilmiş plaseboya randomize edilmiştir. PRIMA, 475 hastada (317'si niraparib koluna, 158'i plasebo koluna randomize edilmiştir) devam eden 28 günlük döngülerde günde tek doz 300 mg başlangıç dozuyla başlatılmıştır. PRIMA'nın başlangıç dozu Protokolün 2. Değişikliği ile değiştirilmiştir. Bu noktadan sonra, bazal vücut ağırlığı ≥77 kg ve bazal trombosit sayımı ≥ 150.000/µL olan hastalara günlük ZEJULA 300 mg (3×100 mg kapsül) (n=34) veya plasebo (3 kapsül) (n=21) tedavisi uygulanırken, bazal vücut ağırlığı <77 kg ve bazal trombosit sayımı < 150.000/µL olan hastalara günlük ZEJULA 200 mg (2×100 mg kapsül) (n=122) veya plasebo (2 kapsül) (n=61) tedavisi uygulanmıştır.
Hastalar birinci basamak platin temelli kemoterapi yanı sıra ameliyat oldu ise, ameliyatın tamamlanmasından sonra randomize edilmiştir. Gönüllüler kemoterapinin son döngüsünün ilk gününden sonraki 12 hafta içinde randomize edilmiştir. Gönüllülere ≥6 ve ≤9 platin temelli tedavi döngüsü uygulanmıştır. Tümör hacminin azaltıldığı ara ameliyatlardan sonra, gönüllülere ≥2 postoperatif platin temelli tedavi döngüsü uygulanmıştır. Kemoterapiyle birlikte bevasizumab verilen ama idame tedavisi olarak bevasizumab alamayan hastalar çalışma dışında tutulmamıştır. Hastalar ZEJULA dahil olmak üzere geçmiş PARP inhibitörü (PARPi) tedavisi görmemiş olmalıdır. Neoadjuvan kemoterapi ve sonrasında tümör hacminin azaltıldığı ara ameliyat geçiren hastalarda görünür rezidüel hastalık olabilir veya rezidüel hastalık olmayabilir. Hastalığı 3. evrede olan ve tümör hacminin azaltıldığı primer ameliyattan sonra tam sitoredüksiyon uygulanan (yani görünür rezidüel hastalığı olmayan) hastalar çalışmanın dışında bırakılmıştır. Randomizasyon, birinci basamak platin rejimi sırasında verdiği en iyi yanıt (tam yanıt ya da kısmi yanıt), neoadjuvan kemoterapi (NAKT) (Evet ya da Hayır) ve homolog rekombinasyon eksikliği (HR eksikliği) durumuna [pozitif (HR eksikliği) ya da negatif (HR eksikliği yok) veya belirlenememiş] göre tabakalaştırılmıştır. HR eksikliği testi, ilk tanı tarihinde alınan tümör dokusunda yapılan HR eksikliği testi kullanılarak yapılmıştır. CA-125 düzeyleri hastanın birinci basamak tedavisi sırasında normal aralıkta (veya >% 90 CA- 125 düşüşü) olmalı ve en az 7 gün boyunca stabil devam etmelidir.
Hastalar 1. döngü/1. günde (C1/D1), devamlı 28 günlük döngülerde günde tek doz uygulanan ZEJULA 200 veya 300 mg veya karşılık gelen plasebo ile tedaviyle başlamıştır. Her bir döngüde klinik ziyaretleri gerçekleştirilmiştir (4 hafta ±3 gün).
Birincil sonlanım noktası, RECIST'e (versiyon 1.1) kör bağımsız merkezi inceleme (BICR) ile belirlenen progresyonsuz (ilerlemesiz) sağkalımdır (PFS). Genel sağkalım (OS) anahtar ikincil hedeftir. PFS testi, ilki HR eksikliği olan popülasyonda ve sonra genel popülasyonda olmak üzere hiyerarşik olarak yapılmıştır: Medyan yaş 62'dir ve ZEJULA'ya randomize edilen hastalarda 32 ila 85 yaş aralığında, plaseboyla randomize edilen hastalarda 33 ila 88 yaş aralığındadır. Tüm hastaların % 89'u beyazdır. ZEJULA ile randomize edilen hastaların % 69'u, plaseboyla tedavi edilen hastaların % 71'inin çalışmanın başlangıcındaki ECOG skoru 0'dır. Genel popülasyonda, hastaların % 65'inde 3. evre hastalık, % 35'inde 4. evre hastalık vardır. Genel popülasyonda, çoğu hastanın (≥% 80) primer tümör bölgesi overdir; çoğu hastada (>% 90) seröz histolojiye sahip tümör vardır. Hastaların % 67'si neoadjuvan kemoterapi NAKT
almıştır. Hastaların % 69'u birinci basamak platin temelli kemoterapiye tam yanıt vermiştir. Niraparib verilen toplam 6 hasta over kanseri için önceden bevasizumab tedavisi görmüştür.
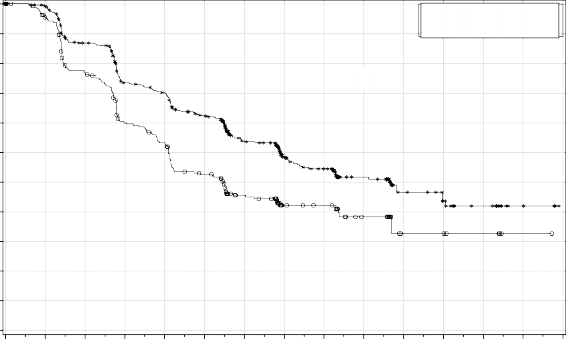
PRIMA çalışmasında, HR (Homolog Rekombinasyonu) eksikliği (HR eksikliği) olan ve genel popülasyonda plaseboyla karşılaştırıldığında ZEJULA'ya randomize edilen hastalarda PFS'de istatistiksel açıdan anlamlı iyileşme görülmüştür (Tablo 5, Şekil 1 ve 2).
İkincil etkililik sonlanım noktaları arasında, ilk izleyen tedaviden sonra PFS (PFS2) ve OS bulunmaktadır (Tablo 5).
Tablo 5: Etkililik sonuçları - PRIMA (BICR belirlemesine göre)
| HR eksikliği olan popülasyon | Genel popülasyon | ||
ZEJULA (N=247) | plasebo (N=126) | ZEJULA (N=487) | plasebo (N=246) | |
Medyan PFS (% 95 GA) | 21,9 (19,3; NE) | 10,4 (8,1; 12,1) | 13,8 (11,5; 14,9) | 8,2 (7,3; 8,5) |
Tehlike oranı (% 95 GA) | 0,43 (0,31; 0,59) |
| 0,62 (0,5; 0,76) |
|
p değeri | <0,0001 |
| <0,0001 |
|
| ||||
PFS2 Tehlike oranı (% 95 GA) | 0,84 (0,485; 1,453) |
| 0,81 (0,577; 1,139) |
|
| ||||
OS* Tehlike oranı (% 95 GA) | 0,61 (0,265; 1,388) |
| 0,7 (0,44; 1,11) |
|
PFS = progresyonsuz sağkalım; GA = güven aralığı; NE = değerlendirilemez; OS = genel
sağkalım; PFS2 = sonraki ilk tedaviden sonra progresyonsuz sağkalım.
* Primer PFS analizi sırasında, genel popülasyonda ZEJULA alan hastaların %84'ünde, plasebo alan hastaların % 77'sinde randomizasyondan iki yıl sonra tahmini sağkalım.
PFS2 ve OS verileri henüz olgunlaşmamıştır.
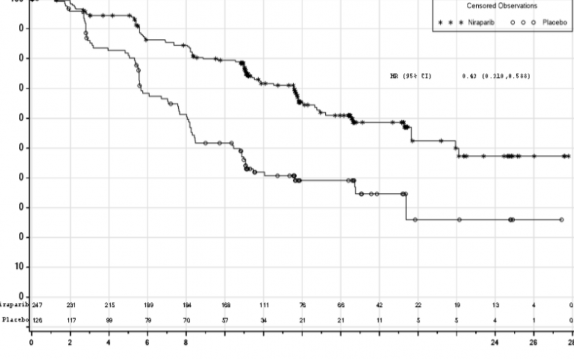
Şekil 1: HR eksikliği olan tümörlere sahip hastalarda progresyonsuz sağkalım - PRIMA (ITT popülasyonu, N=373)
Şekil 2: Genel popülasyonda progresyonsuz sağkalım – PRIMA (ITT popülasyonu, N=733)
![]()
![]()
Alt grup analizleri
Homolog Rekombinasyon (HR) eksikliği olan popülasyonda, BRCA (+) over kanserli hastalardan oluşan alt grupta 0,4 tehlike oranı (% 95 GA 0,27; 0,62) gözlenmiştir (N=223). HR eksikliği BRCA (-) hastalardan oluşan alt grupta (N=150), 0,5 tehlike oranı (%95 GA 0,31; 0,83) gözlenmiştir. HR eksikliği olmayan popülasyonda (N=249); 0,68 tehlike oranı (% 95 GA 0,49; 0,94) gözlenmiştir.
Bazal vücut ağırlığı veya trombosit sayımına göre 200 veya 300 mg ZEJULA uygulanan hastaların keşifsel alt grup analizlerinde, benzer etkililik gözlenmiştir (araştırmacının değerlendirdiği PFS) ve tehlike oranı HR eksikliği olan popülasyonda 0,54 (% 95 GA 0,33; 0,91) ve genel popülasyonda 0,68'dir (% 95 GA 0,49; 0,94). HR eksikliği olmayan alt grupta, 200 mg dozunun tedavi etkisinin 300 mg dozuyla karşılaştırıldığında daha düşük olduğu görülmüştür.
Platine duyarlı rekürren (tekrarlayan) over kanseri idame tedavisi
İdame tedavisi olarak niraparib güvenliliği ve etkililiği, nükseden ağırlıklı olarak yüksek derecede seröz epitelyal over, fallop tüpü veya birincil periton kanseri hastası olan ve altı aydan uzun süre sondan önceki platin temelli tedavilerine kadar tam yanıt (CR) veya kısmi yanıt (PR) tanımlarına göre platin duyarlı hastalarda gerçekleştirilen Faz 3 randomize, çift kör, plasebo kontrollü uluslararası bir çalışmada (NOVA) incelenmiştir. Hastaların niraparib tedavisine uygun olması için son platin temelli kemoterapinin tamamlanmasından sonra yanıt vermesi (CR veya PR) gerekmektedir. Son platin tedavisinden sonra CA 125 seviyeleri normal (veya CA 125'te başlangıca göre > %90 azalma) olmalı ve en az 7 gün boyunca stabil kalmalıdır. Hastalar daha önce ZEJULA dahil olmak üzere hiçbir PARPi tedavisi almamış olmalıdır. Uygun hastalar germline BRCA (gBRCA) mutasyon testinin sonucuna göre iki kohorttan birine atanmıştır. Her kohort içinde, hastalar 2:1 oranında niraparib ve plaseboya randomize edilmiştir. Hastalar randomizasyondan önce gBRCA analizi için alınan kan numunelerine göre gBRCA mutasyonlu kohortuna atanmıştır. Tümör BRCA (tBRCA) mutasyonu ve HR eksikliği testleri, ilk tanı konduğu tarihte veya tekrar gerçekleşme tarihinde alınan tümör dokusu üzerinde yapılan HR eksikliği testi kullanılarak gerçekleştirilmiştir.
Tüm kohortlardaki randomizasyon, çalışmaya katılmadan önceki platin tedavisinden sonra ilerlemeye kadar geçen zamana (6 ila <12 ay ve ≥12 ay); sondan önceki veya son platin rejimiyle birlikte bevasizumab kullanılmadığına ve en yakın geçmişteki platin rejimi sırasındaki en iyi yanıta (tam yanıt ve kısmi yanıt) göre tabakalaştırılmıştır.
Döngü 1/1.gündeki (C1/D1) hastalar , 28 günlük sürekli döngüler halinde günde tek doz uygulanan niraparib 300 mg veya eşleştirilmiş plasebo ile tedaviye başlamıştır. Her döngüde klinik ziyaretleri yapılmıştır (4 hafta ± 3 gün).
NOVA çalışmasında, 1. döngüde hastaların % 48'inin dozuna ara verilmiştir. Hastaların yaklaşık % 47'si 2. döngüde daha düşük bir dozla tekrar başlamıştır.
NOVA çalışmasında niraparible tedavi edilen hastalarda en yaygın olarak kullanılan doz 200 mg'dır.
Progresyonsuz sağkalım (PFS), RECIST 1'e (Solid Tümörlerde Yanıt Değerlendirme, versiyon 1.1) veya klinik belirtiler ve semptomlara ve CA-125 artışına göre belirlenmiştir. PFS, (kemoterapi rejiminin tamamlanmasından 8 haftaya kadar sonraki) randomizasyon tarihinden hastalık ilerlemesi veya ölüme kadar ölçülmüştür.
PFS için primer etkililik analizi, körleştirilmiş merkezi bağımsız değerlendirmeyle belirlenmiştir ve gBRCA mutasyonlu kohort ve gBRCA mutasyonsuz kohort için ayrıca ileriye dönük şekilde tanımlanmış ve değerlendirilmiştir. Genel sağkalım (OS) analizleri, ikincil sonuç ölçütleridir.
İkincil etkililik sonlanım noktaları arasında, kemoterapisiz ara (CFI), izleyen ilk tedaviye kadar geçen süre (TFST), izleyen ilk tedaviden sonra geçen süre (PFS2)ve OS'bulunmaktadır.
gBRCA mutasyonlu (n=203) ve gBRCA mutasyonsuz kohortlarda (n=350) niraparib ve plasebo kolları arasında demografik, bazal hastalık karakteristikleri ve geçmiş tedavi öyküsü genellikle dengelidir. Medyan yaşlar tüm tedaviler ve kohortlarda 57 ila 63 aralığındadır. Tüm kohortlarda çoğu hastadaki (>% 80) birincil tümör bölgesi overlerdir; çoğu hastada (>% 84) seröz histolojiye sahip tümörler vardır. Her iki kohorttaki her iki tedavi kolunda bulunan hastaların yüksek bir oranı daha önce 3 veya daha fazla kemoterapi basamağı almıştır; bunlara gBRCA mutasyonlu ve gBRCA mutasyonsuz kohortlardaki niraparib hastalarının sırasıyla %49'u ve
%34'ü dahildir. Çoğu hasta 18 ila 64 yaşındadır (% 78), beyazdır (% 86) ve ECOG performans skoru 0'dır (% 68).
gBRCA mutasyonlu kohortta, tedavi döngüsünün medyan sayısı niraparib kolunda plasebo koluna göre daha yüksektir (sırasıyla 14 ve 7 döngü). Niraparib grubunda plasebo grubuyla karşılaştırıldığında daha fazla sayıda hasta (sırasıyla % 54,4 ve % 16,9) 12 aydan uzun süre tedaviye devam etmiştir.
Genel gBRCA mutasyonsuz kohortta, tedavi döngüsünün medyan sayısı niraparib kolunda plasebo koluna göre daha yüksektir (sırasıyla 8 ve 5 döngü). Niraparib grubunda plasebo grubuyla karşılaştırıldığında daha fazla sayıda hasta (sırasıyla % 34,2 ve % 21,1) 12 aydan uzun süre tedaviye devam etmiştir.
Çalışma gBRCA mutasyonlu kohortta ve gBRCA mutasyonsuz kohortta plaseboyla karşılaştırıldığında niraparib idame tedavisi için PFS'de istatistiksel açıdan anlamlı iyileşme olan esas amacına ulaşmıştır. Tablo 6 ve Şekil 3'te, primer etkililik popülasyonlarında PFS birincil sonlanım noktası için sonuçlar görülmektedir (gBRCA mutasyonlu kohort ve genel gBRCA mutasyonsuz kohort).
Tablo 6: NOVA çalışmasındaki birincil nesnel sonuçların özeti
| gBRCA mutasyonlu kohort | gBRCA mutasyonsuz kohort | ||
| Niraparib (N=138) | plasebo (N=65) | niraparib (N=234) | plasebo (N=116) |
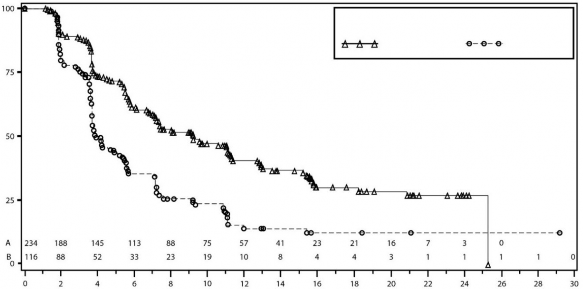
PFS medyan (% 95 GA*) | 21 (12,9; NR) | 5,5 (3,8; 7,2) | 9,3 (7,2; 11,2) | 3,9 (3,7; 5,5) |
P değeri | <0,0001 | <0,0001 | ||
Tehlike oranı (TO) (Niraparib:plasebo) (% 95 GA*) | 0,27 (0,173; 0,41) | 0,45 (0,338; 0,607) | ||
PFS = progresyonsuz sağkalım;GA = güven aralığı; NE = değerlendirilemez
Estimated Survival Function
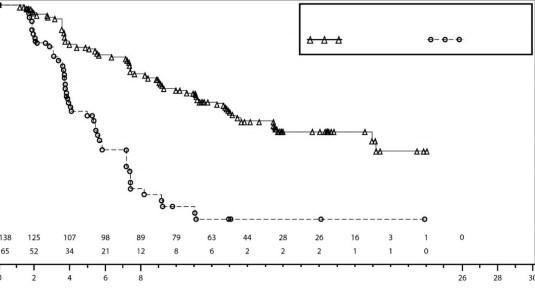
Time since Randomization (Months)
![]()
Şekil 3: IRC değerlendirmesine göre gBRCA mutasyonlu kohortta progresyonsuz sağkalım için Kaplan-Meier grafiği – NOVA (ITT popülasyonu, n=203)
Şekil 4: IRC değerlendirmesine göre gBRCA mutasyonsuz kohortta progresyonsuz sağkalım için Kaplan-Meier grafiği – NOVA (ITT popülasyonu, n=350)
NOVA'da ikincil etkililik sonlanım noktaları
Son analizde, gBRCAmut kohortunda medyan PFS2, niraparib ile tedavi edilen hastalarda 29,9 ay iken, plasebo alan hastalarda 22,7 aydır (HR = 0,70; % 95 GA: 0,50, 0,97). gBRCAmut olmayan kohorttaki medyan PFS2, niraparib ile tedavi edilen hastalarda 19,5 ay iken, plasebo alan hastalarda 16,1 aydır (HR = 0,80; %95 GA: 0,63, 1,02).
Genel sağkalımın son analizinde, gBRCAmut kohortunda (n = 203) medyan OS, niraparib ile tedavi edilen hastalarda 40,9 ay, plasebo alan hastalarda ise 38,1 ay (HR = 0,85; %95 GA: 0,61, 1,20) olduğu görülmüştür. gBRCAmut kohortu için kohort olgunluğu %76'dır. gBRCAmut olmayan kohortta (n = 350) medyan OS, niraparib ile tedavi edilen hastalarda 31.0 ay, plasebo alan hastalarda ise 34.8 ay (HR = 1.06; %95 GA: 0.81, 1.37) olduğu görülmüştür. gBRCAmut olmayan kohort için kohort olgunluğu %79'dur.
Doğrulanmış anket yöntemleriyle (FOSI ve EQ-5D) elde edilen hasta beyanlı sonuç (PRO) verileri, niraparible tedavi edilen hastaların yaşam kalitesiyle ilişkilendirilen ölçümlerde plasebodan farklı olmadığını göstermiştir.
Pediyatrik popülasyon
Avrupa İlaç Kurumu (EMA), ZEJULA ile over karsinomda (rabdomiyosarkoma ve germ hücreli tümörler hariç) pediyatrik popülasyon tüm alt gruplarında çalışma sunma yükümlülüğü konusunda muafiyet getirmiştir.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Açlık koşullarında tek doz 300 mg niraparib uygulandıktan sonra, niraparib plazmada 30 dakika içinde ölçülebilir düzeydedir ve niraparib için ortalama pik plazma konsantrasyonuna (C) yaklaşık 3 saatte ulaşılmıştır [804 ng/mL (% VK: % 50,2]. Günde bir kez 30 mg ila 400 mg aralığında çoklu oral niraparib dozlarından sonra, niraparib birikimi yaklaşık 2 ila 3 kattır.
Niraparib dozu 30 mg'dan 400 mg'a arttırıldığında niraparibe sistemik maruziyetler (Cve EAA) dozla orantılı şekilde artmıştır. Niraparibin mutlak biyoyararlanımı yaklaşık % 73'tür ve ilk geçiş etkisinin minimal olduğuna işaret etmektedir. Niraparibin popülasyon farmakokinetik analizinde, biyoyararlanım açısından bireyler arası değişkenliğin değişim katsayısı (VK) % 31'dir.
300 mg niraparib uygulamasından sonra, eşzamanlı yüksek yağlı öğün tüketilmesi niraparibin farmakokinetiğini anlamlı düzeyde etkilememiştir.
Tablet ve kapsül formülasyonlarının biyoeşdeğer olduğu gösterilmiştir. Açlık koşulları altında kitle tümörü olan 108 hastada bir 300 mg tablet veya üç 100 mg niraparib kapsülünün uygulanmasını takiben, tablet için Cmaks, EAAve EAAiçin kapsüllere kıyasla geometrik ortalama oranlarının %90 güven aralıkları biyoeşdeğerlik limitlerinde olmuştur (0,80 ve 1,25).
Dağılım:
Niraparib insan plazmasında proteinlere orta düzeyde (% 83), esas olarak serum albüminle
bağlanmaktadır. Niraparibin popülasyon farmakokinetik analizinde, kanser hastalarında (VK
% 116) görülen dağılım hacmi (V/F) 1,331 L'dir (70 kg hasta ağırlığına göre) ve niraparibin
dokulara yaygın olarak dağıldığına işaret etmektedir.
Biyotransformasyon:
Niraparib ağırlıklı olarak karboksilesterazlar (CE) tarafından metabolize edilir ve majör inaktif metabolit olan M1 oluşur. Bir kütle denkliği çalışmasında, M1 ve M10 (sonradan oluşturulan M1 glukuronidleri) dolaşımdaki majör metabolitlerdir.
Eliminasyon:
Tek oral 300 mg niraparib dozundan sonra, niraparibin ortalama terminal yarı ömrü (t) 48 ila 51 saattir (yaklaşık 2 gün). Popülasyon farmakokinetik analizinde, niraparibin görünür toplam klirensi (CL/F) kanser hastalarında 16,5 L/h'dir (VK % 23,4).
Niraparib esas olarak hepatobiliyer ve renal yollardan elimine edilmektedir. Tek 300 mg [C]- niraparib dozu uygulandıktan sonra, dozun ortalama % 86,2'si (aralık % 71 ila % 91) 21 günlük bir sürede idrar ve dışkıda geri kazanılmıştır. İdrardaki radyoaktivite geri kazanımı dozun % 47,5'i (aralık % 33,4 ila % 60,2) ve dışkıda % 38,8'idir (aralık: % 28,3 ila % 47). 6 günlük bir sürede toplanan havuzlanmış numunelerde, dozun % 40'ı idrarda ağırlıklı şekilde metabolit olarak, dozun % 31,6'sı dışkıda esas olarak değişmemiş niraparib olarak geri kazanılmıştır.
Hastalardaki karakteristik özellikler Böbrek yetmezliği
Popülasyon farmakokinetik analizinde, hafif (kreatinin klirensi 60-90 mL/dk.) ve orta dereceli (30-60 ml/dk.) böbrek yetmezliği olan hastalarda, böbrek işlevi normal (hafif yetmezlikte % 7- 17 daha yüksek maruziyet ve orta dereceli yetmezlikte % 17-38 daha yüksek maruziyet) olan bireylerle karşılaştırıldığında niraparib klirensi hafifçe düşmüştür. Maruziyet farkının doz ayarlaması gerektirdiği düşünülmemektedir. Klinik çalışmalarda önceden şiddetli böbrek yetmezliği veya son dönem böbrek hastalığı olan ve hemodiyaliz gören hiçbir hasta belirlenmemiştir (bkz. Bölüm 4.2).
Karaciğer yetmezliği
Hastalarda yapılan klinik çalışmalarda elde edilen verilerin popülasyon farmakokinetik analizinde, önceden var olan hafif dereceli karaciğer yetmezliği (n=155) niraparibin klirensini etkilememiştir. Karaciğer yetmezliğinin derecesini sınıflandırmak için NCI-ODWG kriterlerini kullanan, kanser hastalarına yönelik bir klinik çalışmada, tek seferde 300 mg'lık dozun uygulanmasını takiben, orta dereceli karaciğer yetmezliği olan hastalarda (n=8) niraparib EAA, normal karaciğer fonksiyonuna sahip hastaların (n=9) 1,56 (%90 GA: 1,06 ila 2,30) katı olmuştur. Orta derecede karaciğer yetmezliği olan hastalarda niraparib doz ayarlaması önerilmektedir (bkz. Bölüm 4.2). Orta derecede karaciğer yetmezliğinin niraparib Cveya niraparib protein bağlanması üzerinde bir etkisi olmamıştır. Niraparibin farmakokinetiği şiddetli karaciğer yetmezliği olan hastalarda değerlendirilmemiştir (bkz. Bölüm 4.2 ve 4.4).
Kilo, yaş ve ırk
Popülasyon farmakokinetik analizinde kilo artışının niraparibin dağılım hacmini arttırdığı görülmüştür. Ağırlığın niraparib klirensi veya genel maruziyet üzerinde hiçbir etkisi görülmemiştir. Farmakokinetik açıdan vücut ağırlığına göre doz ayarlaması gerekmemektedir.
Popülasyon farmakokinetik analizinde yaş artışının niraparib klirensini azalttığı görülmüştür. 91 yaşındaki bir hastadaki ortalama maruziyetin, 30 yaşındaki bir hastadan % 23 daha yüksek olacağı öngörülmüştür. Yaşın etkisinin doz ayarlaması gerektirdiği düşünülmemektedir.
Irkın niraparibin farmakokinetiği üzerindeki etkisiyle ilgili bir sonuca varmak için, ırklarda yeterli veri bulunmamaktadır.
Pediyatrik popülasyon
Niraparibin pediyatrik hastalardaki farmakokinetiğini incelemek için henüz çalışma yapılmamıştır.
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi
İn vitro ortamda, niraparib insan maruziyet düzeylerinin altındaki konsantrasyonlarda dopamin taşıyıcısı DAT'ı inhibisyona uğratmıştır. Farelerde, tek doz niraparib, korteksteki hücre içi dopamin ve metabolit düzeylerini arttırmıştır. Farelerde yapılan iki tek doz çalışmasından birinde lokomotor aktivitede düşüş görülmüştür. Bu bulguların klinik önemi bilinmemektedir. Beklenen terapötik maruziyet düzeylerine benzer veya bunların altında olması beklenen tahmini MSS Merkezi Sinir Sistemi (MSS) maruziyeti düzeylerinde sıçanlar ve köpeklerde yapılan yinelenen dozlu toksisite çalışmalarında davranışsal ve/veya nörolojik parametreler üzerinde hiçbir etki gözlemlenmemiştir.
Yinelenen doz toksisitesi
Klinik olarak görülen maruziyet düzeylerinde sıçanlar ve köpeklerde spermatojenezde düşüş gözlenmiştir ve dozun kesilmesini izleyen 4 hafta büyük oranda geri dönüşlüdür.
Genotoksisite
Niraparib bakteriyel ters mutasyon tayininde (Ames) mutajenik değildir ama in vitro memeli kromozom aberasyon analizinde ve in vivo sıçan kemik iliği mikronükleus tayininde klastojeniktir. Bu klastojenite, niraparibin esas farmakolojisinden kaynaklanan genomik instabiliteyle tutarlıdır ve insanlarda genotoksisite potansiyeli olduğuna işaret etmektedir.
Üreme toksikolojisi
Niraparible üreme ve gelişim toksisitesi çalışması yapılmamıştır. Karsinojenisite
Niraparible karsinojenisite çalışması yapılmamıştır.
 Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır.
Astım
Astımlı kişilerin akciğerlerindeki hava boruları (bronşlar) hassastır. Bu kişiler belirli tetikleyici faktörlere maruz kaldıklarında, hava boruları nefes almalarını güçleştirecek şekilde daralır. |
 Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur.
Dış Gebelik
Dış gebelik, her 100 gebelikten birini etkileyen, sık görülen ve ölüme sebep
olabilecek bir durumdur. Bu, döllenen yumurta, rahimin dışına yerleşirse, oluşan
bir durumdur. Gebelik ilerledikçe, ağrıya ve kanamalara sebep olur. |
İLAÇ GENEL BİLGİLERİ
Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
| Satış Fiyatı | 100457.98 TL [ 18 Apr 2025 ] |
| Önceki Satış Fiyatı | 100457.98 TL [ 14 Apr 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699522154210 |
| Etkin Madde | Niraparib |
| ATC Kodu | L01XK02 |
| Birim Miktar | 100 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 56 |
| Antineoplastik ve İmmünomodülatör Ajanlar > Diğer Kanser İlaçları |
| İthal ( ref. ülke : Yunanistan ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
İnme İnme, beynin hasar görmesinin sonucudur. Bu hasar, beynin bir kısmındaki ya bir kanama ya da akut kan eksikliği nedeniyle o kısmın geçici ya da kalıcı olarak işlevini yapamamasına yol açar. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Belsoğukluğu, Chlamydia ve Frengi Belsoğukluğu, bakterilerin sebep olduğu bir enfeksiyondur. Cinsel ilişki yoluyla bulaşır ve dölyatağı boynunda, idrar yollarında, anüste, makatta ve boğazda enfeksyona sebep olabilir. |