ZESTAT 15 mg / ml oral solüsyon Kısa Ürün Bilgisi
{ Mirtazapin }
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
ZESTAT 15 mg/ml oral çözelti
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde
Mirtazapin 15 mg/ml
Yardımcı maddeler
Sıvı maltitol 600.00 mg/ml Sodyum benzoat 1.2 mg/ml
Sodyum sakarin 1.2 mg/ml
Yardımcı maddeler için 6.1'e bakınız.
3. FARMASÖTİK FORMU
Oral çözelti.
Berrak, renksiz çözelti.
Hekimin reçetede belirttiği ml miktarı kadar piston çekilerek ilaç enjektörün içine
doldurulmalıdır. Sonra enjektör şişeden çıkarılmalıdır.
4. KLİNİK ÖZELLİKLER
4.1. Terapötik endikasyonlar
Major depresif bozukluk ataklarının tedavisinde endikedir.
4.2. Pozoloji ve uygulama şekli
Yetişkinler:
Etkili günlük doz genelde 15 mg (1 ml) ve 45 mg (3 ml) arasındadır; başlangıç dozu 15 mg (1 ml) ya da 30 mg (2 ml)'dır. Mirtazapin genel olarak tedaviden 1-2 hafta sonra etkisini göstermeye başlar. Yeterli dozdaki tedavi, 2-4 hafta içinde olumlu yanıta yol açmalıdır. Yeterli yanıt alınamadığı durumlarda, doz en yüksek doza kadar artırılabilir. Daha sonraki 2-4 haftada yanıt alınamaz ise tedavi kesilmelidir.
Depresyonlu hastalar, semptomların tamamen ortadan kalktığından emin olabilmek için en az
6 ay olmak üzere yeterli bir dönem boyunca tedavi edilmelidir.
Çekilme semptomlarına yol açmamak için mirtazapin tedavisine yavaş yavaş son verilmesi önerilmektedir (bakınız bölüm 4.4).
Uygulama şekli:
Mirtazapin 20â40 saatlik bir eliminasyon yarılanma ömrüne sahiptir ve dolayısıyla günde tek seferlik uygulama için uygundur. Tercihen yatmadan önce tek seferlik gece dozu olarak tatbik edilmelidir. ZESTAT gün içerisinde bölünmüş dozlar şeklinde de alınabilir (sabah bir sefer ve akşam bir sefer). Eğer bölünmüş olarak alınan dozlar eşit değil ise yüksek doz gece alınmalıdır.
Solüsyon, bir bardak su içinde ağızdan alınır. İlaç tercihen gece yatmadan önce kullanılmalıdır. Sabah ve gece olmak üzere ikiye bölünmüş dozlar olarak da kullanılabilir. Bu durumda gece dozu daha yüksek olmalıdır.
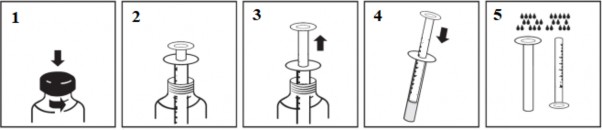
Kapak aşağı doğru bastırılırken aynı zamanda saat yönünün tersine çevrilmelidir. İlk olarak kapağa takılmış kilit kırılacaktır; daha sonra bastırılan ve çevrilen kapak açılacaktır. Bu işlem dönen kapağın en üstünde, sembolik talimatlar halinde verilmiştir.
Piston itilerek ilaç bir bardak suya eklenmelidir ve karışımın tamamı bir seferde
içilmelidir.
4.3. Kontrendikasyonlar
Etkin madde
Monoamin oksidaz (MAO) inhibitörleriyle mirtazapinin birlikte kullanımı (bakınız bölüm
4.5).
4.4. Özel kullanım uyarıları ve önlemleri
Antidepresan ilaçların çocuklar ve 24 yaşına kadar olan gençlerdeki kullanımlarının intihar düşüncesi ya da davranışlarını artırma olasılığı bulunmaktadır. Bu nedenle özellikle tedavinin başlangıcı ve ilk aylarında, ilaç dozunun artırılma/azaltılma ya da kesilme dönemlerinde hastanın gösterebileceği huzursuzluk, aşırı hareketlilik gibi beklenmedik davranış değişiklikleri ya da intihar olasılığı gibi nedenlerle hastanın gerek ailesi gerekse tedavi edicilerle yakinen izlenmesi gereklidir.
Mirtazapin, 18 yaş üstündeki hastalarda görülen majör depresif bozukluğun tedavisinde
endikedir.
Pediyatrik popülasyon:
ZESTAT, çocukların ve 18 yaş altındaki ergenlerin tedavisinde kullanılmamalıdır. Klinik çalışmalarda, antidepresanlarla tedavi edilen çocuk ve ergenlerde plasebo ile tedavi edilenlerle kıyaslandığında, intihar ile ilgili davranışlar (intihar girişimi ve intihar düşünceleri) ve düşmanca davranışlar (saldırganlık, asilik ve öfke) daha sık gözlenmiştir. Eğer klinik gereksinime dayalı tedavi kararı alınırsa, hasta intihar semptomlarının ortaya çıkması açısından yakından izlenmelidir. Ayrıca çocuk ve ergenlerde büyüme, olgunlaşma, bilişsel ve davranış gelişimi ile ilgili uzun süreli güvenlilik verisi eksiktir.
İntihar/ intihar düşünceleri veya klinik olarak kötüleşme:
Depresyon, intihar etme düşüncesinde artış, kendine zarar verme ve intihar (intihar ile ilişkili olaylar) riskiyle ilişkilidir. Bu risk önemli ölçüde remisyon meydana gelene kadar devam eder. İyileşme, tedavinin ilk haftaları ya da sonrasında meydana gelemeyebileceği için, hastalar böyle bir iyileşme olana kadar yakın olarak takip edilmelidir. Genel klinik tecrübeye göre intihar etme riski iyileşmenin ilk evrelerinde artabilir.
İntihar bağlantılı bir olay öyküsü olan hastalar veya tedavinin başlamasından önce önemli derecede intihar düşüncesi olan hastaların, intihar düşünceleri veya intihara kalkışma riskinin yüksek olduğu bilinmektedir. Bu hastaların tedavi süresince dikkatlice izlenmeleri gerekmektedir. Psikiyatrik rahatsızlıkları olan yetişkin hastalarda, antidepresanlarla plasebo- kontrollü klinik deneylerin meta-analizi, 25 yaşın altındaki hastalarda plasebo kullanımıyla kıyaslandığında, intihar davranışı riskinin daha da artmış olduğunu göstermiştir.
Hastaların ve özellikle yüksek risk altında olanların yakından izlenmesine, özellikle antidepresan tedavisinin ilk başlarında ve doz değişikliklerinde devam edilmelidir. Hastalar (ve hastaların bakıcıları), herhangi bir klinik kötüleşme, intiharla ilgili bir davranış ya da düşünce ve daha önce davranışta görülmeyen değişikliklerin gözlenmesi konusunda her an tetikte olmalı ve bu semptomların herhangi birisi fark edilirse hemen medikal yardım istenmelidir.
İntihar olasılığına bağlı olarak, özellikle tedavinin başlangıcında, hastayı iyi takip ederek hastadaki doz aşımı riskini azaltabilmek için sadece az miktarda ZESTAT film kaplı tablet verilmelidir.
Kemik iliği depresyonu:
ZESTAT tedavisi sırasında, genelde granülositopeni ya da agranülositoz şeklinde kendini gösteren kemik iliği depresyonu bildirilmiştir. ZESTAT ile yapılan klinik çalışmalar sırasında nadir de olsa geri dönüşlü agranülositoz bildirilmiştir. Pazarlama sonrası periyotta, ZESTAT
ile çoğu geri dönüşlü olmak üzere çok nadir fakat bazıları ölümcül olmak üzere agranülositoz olgusu bildirilmiştir. Ölüm ile sonlanan olguların tümünde hastalar 65 yaş üzerindedir. Hekim, ateş, boğaz ağrısı, stomatit veya diğer enfeksiyon belirtilerine karşı dikkatli olmalı, benzer septomlar görüldüğünde tedavi kesilmeli ve kan testleri yapılmalıdır.
Sarılık:
Sarılık görüldüğünde tedavi kesilmelidir.
İzlemeye gerek duyulan durumlar:
Düzenli ve yakın izlemle birlikte doz ayarlamasının hastalarda dikkatli yapılması gereken
durumlar:
Epilepsi ve organik beyin sendromu: Klinik deneyimler, diğer antidepresanlar ile olduğu gibi, mirtazapin ile tedavi edilen hastalarda da epileptik nöbetlerin nadir olduğunu gösterse de ZESTAT nöbet öyküsü olan hastalarda dikkatlice uygulanmalıdır. Tedavi, nöbet gelişen hastalarda veya nöbet sıklığında artışa neden olduğunda kesilmelidir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Farmakodinamik etkileşimler
Mirtazapin MAO inhibitörleri ile eşzamanlı olarak ya da MAO inhibitör tedavisi kesilmesinden sonraki iki hafta içinde verilmemelidir. Mirtazapinle tedavi edilen hastalar MAO inhibitörleriyle tedavi edilmeden önce aradan yaklaşık iki hafta geçmelidir (bkz bölüm 4.3).
Ayrıca, selektif serotonin geri-alım inhibitörlerinde (SSRI) olduğu gibi diğer serotonerjik etkin maddelerin (L-triptofan, triptanlar, tramadol, linezolid, metilen mavisi, SSRI, venlafaksin, lityum ve St. John'sWort â Hypericum perforatum, sarı kantaron â preparatları) birlikte kullanılması, serotonin ile ilişkili etkilerin insidansını yükseltebilir (serotonin sendromu: bkz bölüm 4.4).
4.6. Gebelik ve laktasyon
Gebelik kategorisi C'dir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon) Mirtazapinin gebe kadınlarda kullanımına ilişkin yeterli kontrollü çalışma mevcut değildir. Doktorlar, çocuk doğurma potansiyeli bulunan kadınları etkili bir doğum kontrol yöntemi kullanmaları konusunda yönlendirmelidir.
Gebelik dönemi
Mirtazapinin gebe kadınlarda kullanılmasına ilişkin sınırlı veriler, artmış konjenital malformasyon riski göstermemektedir. Hayvanlarda yapılan çalışmalar, klinik olarak anlamlı hiçbir teratojen etki göstermemiştir, ancak gelişimsel toksisite gözlenmiştir (bakınız bölüm 5.3). Gebe kadınlara reçete edilirken dikkatli olmak gerekmektedir. Eğer ZESTAT doğuma veya doğumdan kısa bir süre öncesine kadar kullanılırsa, yenidoğanın, olası kesilme etkileri göz önünde bulundurularak doğumdan sonra izlenmesi önerilir.
Epidemiyolojik veriler gebelikte, özellikle gebeliğin son zamanlarında, selektif serotonin geri- alım inhibitörleri (SSRI) kullanımının yenidoğanda persistan pulmoner hipertansiyonu (PPHN) riskini arttırabileceğini göstermektedir. PPHN ve mirtazapin kullanımı arasındaki ilişkiyi gösteren çalışmalar yapılmamış olmasına rağmen, etkilenen mekanizmadaki (serotonin konsantrasyonlarında artış) potansiyel risk göz ardı edilemez.
ZESTAT 15 mg/ml oral çözelti gerekli olmadıkça gebelik döneminde kullanılmamalıdır.
Laktasyon dönemi
Hayvan çalışmalarında ve insanlardaki sınırlı veriler, mirtazapinin anne sütüne çok az miktarlarda geçtiğini göstermiştir. Bebeğin emzirerek beslenmesi/beslenmemesi veya ZESTAT tedavisine devam edilmesi/edilmemesi kararı, anne sütünün bebeğe faydası ve ZESTAT tedavisinin anneye faydaları hesaba katılarak verilmelidir.
Üreme yeteneği / Fertilite
Mirtazapinin üreme yeteneği/fertilite üzerine yapılmış herhangi bir çalışma verisi yoktur.
4.7. Araç ve makine kullanımı üzerindeki etkiler
Mirtazapin araç ve makine kullanma yeteneğini hafif veya orta derecede etkilemektedir. Mirtazapin, konsantrasyonu ve uyanıklığı bozabilir (özellikle tedavinin başlangıç evresinde). Hastalar, motorlu araç veya hareketli makinelerin kullanımı gibi dikkat ve iyi konsantrasyon gerektiren potansiyel tehlikeli işlerden kaçınmalıdır.
4.8. İstenmeyen etkiler
Depresyondaki hastalarda hastalığın kendisi ile ilişkili birçok semptom ortaya çıkar. Bu nedenle bazen bu semptomların hastalığın kendisine mi ait olduğu yoksa ZESTAT tedavisinin sonucu olarak mı geliştiğinin ayrıştırılması güçtür.
Somnolans, sedasyon, ağız kuruması, kilo artışı, iştah artışı, sersemlik ve yorgunluk, plasebo- kontrollü, randomize çalışmalarda, mirtazapin ile tedavi edilen hastaların %5'inden fazlasında meydana gelen, en sık bildirilen advers olaylardır (aşağıya bakınız).
Hastalarda yapılan tüm plasebo-kontrollü, randomize çalışmalar (majör depresif bozukluk dışındaki endikasyonlarda yapılanlar dahil) mirtazapinin advers reaksiyonları bakımından değerlendirilmiştir. Meta-analizde, planlanan tedavi süresi en fazla 12 hafta olan ve günde 60 miligrama varan mirtazapin dozları verilen 1501 hastayla (134 kişi-yılı) plasebo verilen 850 hastanın (79 kişi-yılı) yer aldığı 20 çalışma ele alınmıştır. Bu çalışmaların uzatma dönemleri, plasebo tedavisiyle karşılaştırılabilirliğin devam ettirilmesi amacıyla alınmamıştır.
Klinik çalışmalardaki mirtazapin tedavisi sırasında, plaseboya kıyasla istatistiksel olarak anlam taşıyacak şekilde daha fazla görülen advers olaylarla, bizzat hastalar tarafından bildirilen advers olayların kategorize edilmiş insidanslarını göstermektedir. Spontan bildirimlerden advers reaksiyonların sıklığı, bu olayların klinik araştırmalarda bildirim oranına dayanır. Plasebo-kontrollü, randomize çalışmalarda olmayan vakaların spontan bildirimlerinden mirtazapin ile advers reaksiyon sıklığı âbilinmiyor' olarak sınıflandırılmıştır.
Mirtazapin kullanıcılarında bildirilmiş olan advers ilaç reaksiyonlarının listesi, aşağıda verilmektedir.
Sıklıklar şu şekilde tanımlanmıştır:
Çok yaygın (≥ 1/10), yaygın (⥠1/100 ila < 1/10), yaygın olmayan (⥠1/1.000 ila <1/100), seyrek (⥠1/10.000 ila <1/1.000), çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor).
Kan ve lenf sistemi hastalıkları
Bilinmiyor: Kemik iliği depresyonu (granülositopeni, agranülositoz, aplastik anemi
trombositopeni), eozinofili
Endokrin hastalıkları
Bilinmiyor: Uygun olmayan antidiüretik hormon salınımı
Metabolizma ve beslenme hastalıkları Çok yaygın: Kilo artışı, iştah artışı Bilinmiyor: Hiponatremi
Psikiyatrik hastalıklar
Yaygın: Anormal rüyalar, konfüzyon, anksiyete, uykusuzluk
Yaygın olmayan: Kabuslar, mani, ajitasyon, halüsinasyonlar, psikomotor huzursuzluk (akatizi, hiperkineziyi içermektedir)
Seyrek: Saldırganlık
Bilinmiyor: İntihar düşüncesi, intihar davranışı
Sinir sistemi hastalıkları
Çok yaygın: Somnolans, sedasyon, başağrısı Yaygın: Letarji, sersemlik, tremor
Yaygın olmayan: Parestezi, huzursuz bacak, senkop
Seyrek: Myoklonus
Bilinmiyor: Konvülsiyonlar (travmalar), serotonin sendromu, oral parestezi, dizartri
Vasküler hastalıklar
Yaygın: Ortostatik hipotansiyon Yaygın olmayan: Hipotansiyon
Gastrointestinal hastalıklar
Çok yaygın: Ağız kuruluğu
Yaygın: Bulantı, diyare, kusma, konstipasyon
Yaygın olmayan: Oral hipoestezi
Seyrek: Pankreatit
Bilinmiyor: Ağızda ödem, tükürük salgısında artış
Hepato-bilier hastalıklar
Seyrek: Serum trans aminazlarında yükselme
Deri ve deri altı doku hastalıkları
Yaygın: Ekzantem
Bilinmiyor: Stevens-Johnson sendromu, bülloz dermatit, eritema multiforme, toksik
epidermal nekroliz
Kas-iskelet bozuklukları, bağ doku ve kemik hastalıkları
Yaygın: Artralji, miyalji, sırt ağrısı
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygın: Periferik ödem1, yorgunluk
Bilinmiyor: Genel ödem, lokal ödem, uyurgezerlik
sonuçlanmaz, ancak antidepresan etkinliğini riske atabilir.
Klinik çalışmalar sırasındaki laboratuvar değerlendirmelerinde, transaminazlarda ve gamma- glutamiltransferazda geçici artışlar gözlenmiştir (ancak bunlara eşlik eden advers olaylar mirtazapin tedavisi sırasında, plaseboya eşlik edenlerden istatistik anlam taşıyacak şekilde daha sık görülmemiştir).
Pediyatrik popülasyon:
Çocuklarda yapılan klinik çalışmalarda yaygın olarak kilo kaybı, kurdeşen ve hipertrigliseridemi (aynı zamanda bakınız bölüm 5.1) gibi advers olaylar gözlemlenmiştir.
Şüpheli advers reaksiyonların raporlanması
Ruhsatlandırma sonrası şüpheli ilaç advers reaksiyonların raporlanması büyük önem taşımaktadır. Raporlama yapılması, ilacın yarar/risk dengesinin sürekli olarak izlenmesine olanak sağlar. Sağlık mesleği mensuplarının herhangi bir şüpheli advers reaksiyonu Türkiye Farmakovijilans Merkezi (TÜFAM)'ne bildirmeleri gerekmektedir (www.titck.gov.tr; e-posta:tufam@titck.gov.tr; tel:0 800 314 00 08; faks: 0 312 218 35 99).
4.9. Doz aşımı ve tedavisi
Yalnızca mirtazapin doz aşımına ilişkin deneyim, semptomların genellikle hafif olduğunu göstermektedir. Merkezi sinir sistemi depresyonu ile birlikte oryantasyon bozukluğu ve uzamış sedasyon, beraberinde taşikardi ve hiper ya da hipotansiyon bildirilmiştir. Bununla birlikte, özellikle karışık doz aşımlarında ve tedavi edici dozdan çok yüksek dozlarda daha ciddi (ölümü de içeren) sonuçlarla karşılaşma olasılığı vardır. Bu vakalarda QT uzaması ve Torsades de Pointes de bildirilmiştir.
Doz aşımı olgularında yaşamsal işlevler için uygun semptomatik ve destekleyici tedavi uygulanmalıdır. EKG monitörizasyonu yapılmalıdır. Aktif kömür veya gastrik lavaj da düşünülmelidir.
Pediyatrik hastalarda doz aşımı durumunda yukarıda yetişkinler için anlatılan uygun tedbirler alınmalıdır.
Sonra enjektör su ile yıkanarak temizlenmelidir. İlaç şişesinin kapağı kapatılmalıdır.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Diğer antidepresanlar ATC Kodu: N06AX11
Mirtazapin, merkezi noradrenerjik ve serotonerjik nörotransmiter iletimini artıran, merkezi etkili bir presinaptik α2 antagonistidir. Serotonerjik nörotransmisyon artışı, özellikle 5-HT1 reseptörleri aracılığıyla gerçekleşir çünkü mirtazapin hem 5-HT2 hem de 5-HT3 reseptörlerini bloke eder. Mirtazapinin her iki enantiomerinin de antidepresif etkiye katkıda bulunduğu kabul edilmektedir; S(+) enantiomeri α2 ve 5-HT2 reseptörlerini, R(-) enantiomeri 5-HT3 reseptörlerini bloke eder.
Histamin H1-antagonistik etkisi mirtazapinin sedatif etkisi ile ilişkilidir. Mirtazapinin antikolinerjik etkisi pratik olarak yoktur ve tedavi edici dozlarda kardiyovasküler sistem üzerinde yalnızca sınırlı etkisi (örn: ortostatik hipotansiyon) vardır.
Pediyatrik popülasyon:
Yaşları 7 â 18 arasında değişen ve majör depresif bozukluğu olan çocuklarda (n=259) esnek doz kullanılarak yapılan ve ilk 4 hafta boyunca 15-45 mg mirtazapin, sonraki 4 hafta boyunca 15, 30 veya 45 mg mirtazapin verilen; çift-kör, plasebo-kontrollü, randomize iki çalışmada, mirtazapinle plasebo arasında primer ve tüm sekonder sonlanım noktaları bakımından istatistiksel anlama sahip hiçbir fark ortaya konulamamıştır. Plasebo verilen çocukların
%5.7'sine karşılık mirtazapin verilen çocukların %48.8'inde istatistiksel anlama sahip (%7 veya daha fazla) kilo artışı gözlenmiştir. Mirtazapin grubunda kurdeşen (%6.8'e karşılık
%11.8) ve hipertrigliseridemi de (%0'a karşılık %2.9), plasebo grubundakinden daha fazla
görülmüştür.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Mirtazapin ağızdan alındıktan sonra etkin madde mirtazapin, hızla ve iyi biçimde emilir
(biyoyararlanımı ~ %50). Gıda alımının mirtazapinin farmakokinetiği üzerinde etkisi yoktur.
Dağılım:
Plazma doruk konsantrasyonuna yaklaşık 1 saat sonra ulaşılır. Mirtazapinin plazma proteinlerine bağlanma oranı yaklaşık %85'tir.
Biyotransformasyon:
Mirtazapin yaygın biçimde metabolize olur ve birkaç günde idrar ve feçes ile atılır. Temel biyotransformasyon yolları demetilasyon ve oksidasyondur. Ardından konjugasyon gelmektedir. İnsan karaciğer mikrozomlarından elde edilen in vitro verilere göre, mirtazapinin 8-hidroksi metabolitinin oluşumunda sitokrom P450 enzimlerinden CYP2D6 ve CYP1A2, N- demetil ve N-oksit metabolitlerinin oluşumunda CYP3A4 enzimi görev almaktadır. Demetil metaboliti farmakolojik olarak aktif olup, ana bileşik ile aynı farmakokinetik özelliklere sahiptir.
Mirtazapinin klerensi böbrek ya da karaciğer yetmezliğinde azalabilir.
Eliminasyon:
Ortalama eliminasyon yarılanma ömrü 20-40 saattir; 65 saate dek süren daha uzun yarılanma ömrü değerleri nadiren bildirilmiştir ve genç erkeklerde daha kısa yarılanma ömrü izlenmektedir. Eliminasyon yarılanma ömrü günde tek doz kullanıma uygundur. Kararlı kan konsantrasyonuna 3-4 gün sonra ulaşılır ve bundan sonra birikim olmamaktadır.
Doğrusallık/doğrusal olmayan durum:
Mirtazapinin farmakokinetiği önerilen doz aralığında doğrusaldır.
5.3. Klinik öncesi güvenlilik verileri
Klinik öncesi veriler, geleneksel güvenlilik farmakolojisi, tekrarlanan doz toksisitesi, karsinojenisite veya genotoksisite çalışmalarının sonuçları temel alındığında insanlar için özel bir tehlike ortaya çıkarmamıştır. Sıçan ve tavşanlarda üreme toksisitesi çalışmalarında, herhangi bir teratojenik etki gözlenmemiştir. Sıçanlarda, insandaki maksimal terapötik maruziyetin iki katı sistemik maruziyete implantasyon-sonrası fötus kaybında artış, yavruların doğum ağırlığında azalma ve laktasyonun ilk üç günü sırasında hayatta kalan yavru sayısında azalma eşlik etmiştir.
Mirtazapin, bir dizi gen mutasyonu ve kromozomal ve DNA hasarı testlerinde genotoksisite göstermemiştir. Sıçan karsinojenite çalışmasında bulunan tiroid bezi tümörleri ve fare karsinojenite çalışmasında bulunan hepatosellüler neoplazmanın, hepatik enzim indükleyicilerinin yüksek dozları ile uzun süreli tedavi ile ilişkili, türe özgü ve nongenotoksik yanıtlar olduğu düşünülmüştür.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
L-metionin Sodyum benzoat Sodyum sakarin
Sitrik asit monohidrat Gliserol
Sıvı maltitol Portakal aroması Mandalina aroması Saf su
6.2. Geçimsizlikler
Oral çözelti su dışındaki sıvılarla karıştırılmamalıdır.
6.3. Raf ömrü
36 ay.
6.4. Saklamaya yönelik özel tedbirler
25°C altındaki oda sıcaklığında saklanmalıdır.
6.5. Ambalajın niteliği ve içeriği
Ambalaj, 66 ml çözelti (15 mg/ml) içeren bir kahverengi (tip III) cam şişe ve bir oral enjektör içerir.
ZESTAT şişesinin, çocukların açamayacağı özellikte, döndürülerek açılan bir kapağı vardır. Kapak tersine döndürülerek kapağın mühürü kırılır.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller âTıbbi Atıkların Kontrolü Yönetmeliğiâ ve âAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmelikleriâne uygun olarak imha edilmelidir.
 Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur?
Depresyonu Anlamak
Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel
olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış.
Parkinson Hastalığı
Hastalık ilk kez 1817 de İngiliz doktor James Parkinson tarafından tanımlanmış ve Dr. Parkinson hastalığı “sallayıcı felç” olarak kaleme almış. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| MIRTARON | 8699502092051 | 133.70TL |
| MOLREM | 8697933020711 | |
| REDEPRA | 8699541095013 | 133.70TL |
| REMERON | 8699636091166 | 109.42TL |
| VELORIN | 8699517091582 | |
| Diğer Eşdeğer İlaçlar |
 |
Depresyonu Anlamak Depresyon farklı kişileri farklı biçimlerde etkiler. Duygusal veya fiziksel olmak üzere geniş alanda belirtilere sebep olabilir.Depresyona neler sebep olur? |
 |
Diyabet Hastalığı Diyabet, insülin hormonu ile ilgili problemlerden kaynaklanan bir hastalıktır. |
 |
Travma Sonrası Bunalımı Travmatik bir olay, günlük olağan olayların dışında olan ve kişiyi derinden rahatsız eden bir olaydır.Birçok olay böyle bir etki gösterebilir. |
İLAÇ GENEL BİLGİLERİ
Abdi İbrahim İlaç Sanayi ve Ticaret A.Ş.
| Geri Ödeme Kodu | A11492 |
| Satış Fiyatı | 412.09 TL [ 17 Dec 2024 ] |
| Önceki Satış Fiyatı | 412.09 TL [ 2 Dec 2024 ] |
| Original / Jenerik | Jenerik İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699514650041 |
| Etkin Madde | Mirtazapin |
| ATC Kodu | N06AX11 |
| Birim Miktar | 15 |
| Birim Cinsi | MG/ML |
| Ambalaj Miktarı | 66 |
| Sinir Sistemi > Antidepresanlar > Mirtazapin |
| Yerli ve Beşeri bir ilaçdır. |