ZYKADIA 150 mg 150 kapsül Farmakolojik Özellikler
{ Seritinib }
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grubu: Protein kinaz inhibitörleri, anaplastik lenfoma kinaz (ALK)
inhibitörleri
ATC kodu: L01ED02
Etki mekanizması
Seritinib oral yolla yüksek selektiviteye sahip ve güçlü bir ALK inhibitörüdür. Seritinib, ALK otofosforilasyonunu, aşağı yönde sinyalleme yapan proteinlerin ALK'nin aracılık ettiği fosforilasyonunu ve ALK'ye bağımlı kanser hücrelerinin proliferasyonunu hem in vitro hem de in vivo koşullarda inhibe eder.
ALK translokasyonu, ortaya çıkacak füzyon proteinini ve KHDAK'da buna bağlı anormal ALK sinyallemesini belirler. KHDAK olgularının çoğunda EML4, ALK'nin translokasyon partneridir; bu, ALK'nin EML4'ün N-terminal kısmına kaynaşık protein kinaz kısmını içeren EML4-ALK füzyon proteinini ortaya çıkarır. Bir KHDAK hücre dizisinde (H2228) seritinibin EML4-ALK kinaz aktivitesine karşı etkili olduğunu, bunun da in vitro koşullarda hücre proliferasyonunu inhibe ettiği ve fare ve sıçanda H2228 türevi ksenogreftlerde tümör regresyonu ile sonuçlandığı gösterilmiştir.
Klinik etkililik ve güvenlilik
Önceden tedavi edilmemiş ALK pozitif, ilerlemiş KHDAK – randomize faz 3 Çalışma A2301 (ASCEND-4)
İlerlemiş ALK pozitif KHDAK'lı ve önceden neo adjuvan veya adjuvan tedavi dışında sistemik anti-kanser tedavisi (ALK inhibitörü dahil) görmemiş olan hastaların tedavisinde ZYKADIA'nın etkililiği ve güvenliliği bir global, çok merkezli, randomize, açık etiketli faz 3 çalışma A2301'de gösterilmiştir.
Toplam 376 hasta 1:1 oranında (Dünya Sağlık Örgütü (WHO) performans durumuna, önceden adjuvan/neoadjuvan kemoterapi görme durumuna ve taramada beyin metastazlarının olup olmamasına göre gruplandırılmıştır) seritinib (günlük 750 mg, aç karnına) veya kemoterapi (araştırıcının tercihine göre pemetreksed [500 mg/m] + sisplatin [75 mg/m] veya karboplatin [EAA 5 - 6] 21 günde bir) alacak şekilde randomize edilmiştir. Progresif hastalık meydana gelmeksizin 4 kemoterapi kürünü (indüksiyon) tamamlayan hastalara 21 günde bir tek ajan idame tedavisi olarak pemetreksed (500 mg/m) verilmiştir. 189 hasta seritinibe, 187 hasta ise kemoterapiye randomize edilmiştir.
Medyan yaş 54'tür (22 - 81 yaş aralığında); hastaların %78,5'i 65 yaşından küçüktür. Hastaların toplam %57,4'ü kadındır. Çalışma popülasyonunun%53,7'si beyaz, %42'si asyalı, %1,6'sı siyah, %2,6'sı diğer ırklardandır. Hastaların çoğunda adenokarsinom mevcuttur (%96,5) ve hiç sigara içmemişlerdir ya da sigarayı bırakmışlardır (%92). Doğu İşbirliği Onkoloji Grubu (ECOG) performans durumu hastaların %37'si, %56,4'ü ve %6,4'ünde sırasıyla 0, 1, 2'dir ve hastaların %32,2'sinde başlangıçta beyinde metastaz vardır. Başlangıçta beyin metastazı olan hastaların %59,5'i önceden beyin için radyoterapi görmemiştir. Semptomatik merkezi sinir sistemi (MSS) metastazları olan ve nörolojik olarak stabil olmayan ya da MSS semptomlarının yönetimi için taramadan önceki 2 hafta içinde steroid dozlarının artırılması gereken hastalar çalışmaya dahil edilmemiştir.
Araştırıcının fikrine göre klinik yararın devam ediyor olması halinde, hastaların ilk başlangıç sonrasında da atanan çalışma tedavisine devam etmelerine izin verilmiştir. Kemoterapi koluna randomize edilen hastaların, körlenmiş bağımsız inceleme komitesi (BIRC) tarafından
doğrulanan, RECIST tarafından tanımlanmış hastalık progresyonu yaşamaları halinde seritinibe çapraz geçiş yapmalarına izin verilmiştir. Kemoterapi kolunda tedaviyi bırakan 145 hastadan 105'i (%72,4) daha sonra birinci antineoplastik tedavi olarak ALK inhibitörü almıştır. Bu hastalardan 81'i seritinib almıştır.
Medyan izlem süresi 19,7 aydır (randomizasyondan veri kesme tarihine kadar).
Çalışma, BIRC'ye göre progresyonsuz sağkalımda (PFS) istatistiksel olarak anlamlı iyileşme sağlandığını göstererek birincil hedefine ulaşmıştır (bkz. Tablo 3 ve Şekil 1). Seritinibin PFS yararı, araştırıcı değerlendirmesine göre ve yaş, cinsiyet, ırk, sigara kullanım durumu, ECOG performans durumu ve hastalık yükü dahil olmak üzere çeşitli alt gruplarda tutarlıdır.
Genel sağkalım verileri (OS) nihai OS analizi için gereken olayların yaklaşık %42,3'ünü temsil eden 107 ölüm olgusu ile henüz olgun değildir.
Çalışma A2301'den elde edilen etkililik verileri Tablo 3'te verilmiş ve PFS ve OS için Kaplan- Meier eğrileri ise sırasıyla Şekil 1 ve Şekil 2'de gösterilmiştir.
Tablo 3 ASCEND-4 (Çalışma A2301) – Önceden tedavi edilmemiş, ALK-pozitif, ilerlemiş KHDAK'lı hastalarda etkililik sonuçları
| Seritinib | Kemoterapi |
| (N=189) | (N=187) |
Progresyonsuz sağkalım (BIRC'e göre) |
|
|
Olay sayısı, n (%) | 89 (47,1) | 113 (60,4) |
Medyan, ay (%95 GA) | 16,6 (12,6; 27,2) | 8,1 (5,8; 11,1) |
HR (%95 GA) | 0,55 (0,42; 0,73) | |
p-değeri | <0,001 | |
Genel sağkalım |
|
|
Olay sayısı, n (%) | 48 (25,4) 59 (31,6) | |
Medyan, ay (%95 GA) | NE (29,3; NE) 26,2 (22,8; NE) | |
24 ayda OS oranı (%95 GA) | 70,6 (62,2; 77,5) 58,2 (47,6; 67,5) | |
HR (%95 GA) | 0,73 (0,50; 1,08) | |
p-değeri | 0,056 | |
Tümör yanıtı (BIRC'e göre) Genel yanıt oranı (%95 GA) |
%72,5 (65,5; 78,7) |
%26,7 (20,5; 33,7) |
Yanıt süresi (BIRC'e göre) |
|
|
Yanıt veren hasta sayısı | 137 | 50 |
Medyan, ay (%95 GA) | 23,9 (16,6; NE) | 11,1 (7,8; 16,4) |
18 ayda olaysızlık oranı, % (%95 GA) | 59 (49,3; 67,4) | 30,4 (14,1; 48,6) |
HR=risk oranı; GA=güven aralığı; BIRC=Körlenmiş Bağımsız İnceleme Komitesi;
NE=hesaplanamaz
![]()
Şekil 1 ASCEND-4 (Çalışma A2301) –BIRC değerlendirmesine göre progresyonsuz
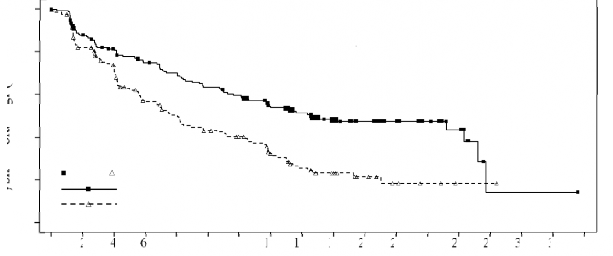
100
80
60
40
20
0
0 2
8 10 12 4 6 8 0 2 24 6 8 0 2 34
sağkalım için Kaplan-Meier eğrileri
6
4
2
2
1
1
1
3
3
2
2
Olaysızlık olasılığı (%)
Zaman (Ay)
Halen risk altındaki hasta sayısı
Şekil 2 ASCEND-4 (Çalışma A2301)- Tedavi koluna göre genel sağkalım için Kaplan-Meier grafiği
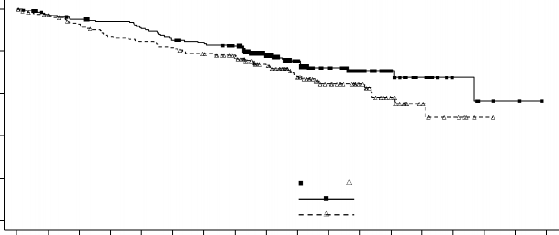
100
Olaysızlık olasılığı (%)
80
60
4
20
1
0
![]()
0 2 4 6 8
0 12
14 16 18
20 22 24 26 28
30 2 34
3
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Zaman (Ay)
Halen risk altında olan hastaların sayısı
Hasta tarafından bildirilen anketler (Akciğer kanseri semptom ölçeği [LCSS], EORTC-QLQ- C30 [C30], EORTC QLQ-LC13 [LC13] ve EQ-5D-5L) çalışma süresinde, zaman noktalarının çoğunda, tüm anketler için seritinib ve kemoterapi kollarında hastaların %80'i veya daha fazlası tarafından doldurulmuştur.
Seritinib, önceden belirtilen akciğer kanserine özgü öksürük, ağrı ve dispne semptomlarında kötüleşmeye kadar olan zamanı anlamlı şekilde uzatmıştır (kompozit sonlanım noktası LCSS:HR=0,61; %95 GA:0,41; 0,90; kötüleşmeye kadar olan medyan süre [TTD] seritinib kolunda NE [%95 GA:20,9; NE] iken, kemoterapi kolunda 18,4 aydır [13,9; NE]; LC13:HR=0,48; %95 GA:0,34; 0,69; medyan TTD seritinib kolunda 23,6 ay iken [%95
GA:20,7; NE] kemoterapi kolunda 12,6 aydır [%95 GA:8,9; 14,9].
Seritinib alan hastalarda kemoterapi alanlara kıyasla genel olarak yaşam kalitesi ve genel sağlık durumu ölçütlerinde anlamlı iyileşmeler gösterilmiştir (LCSS [p<0,001], QLQ-C30, [p<0,001] ve EQ-5D-5L indeksi [p<0,001]).
A2301 çalışmasında, başlangıçta ölçülebilir beyin metastazları olan ve başlangıç sonrası en az bir radyolojik beyin değerlendirmesi yapılmış olan 44 hasta (seritinib kolundan 22 hasta ve kemoterapi kolundan 22 hasta) değiştirilmiş RECIST 1.1'e göre (beyinde 5 adede kadar lezyon) BIRC nöro-radyolog hekim tarafından intrakraniyal yanıt açısından değerlendirilmiştir. İntrakraniyal ORR (OIRR) kemoterapi koluna kıyasla (%27,3; %95 GA 10,7; 50,2) seritinible
daha yüksektir (%72,7; %95 GA:49,8; 89,3).
RECIST 1.1'in kullanıldığı BIRC'e göre medyan PFS, beyin metastazları olan ve olmayan hasta alt gruplarında kemoterapi koluna kıyasla seritinib kolunda daha uzundur. Beyin metastazları olan hastalarda medyan PFS seritinib kolunda 10,7 ay (%95 GA:8,1; 16,4), kemoterapi kolunda ise 6,7 ay (%95 GA:4,1; 10,6) olup; HR=0,7'dir (%95 GA:0,44; 1,12). Beyin metastazları olmayan hastalarda medyan PFS seritinib kolunda 26,3 ay (%95 GA: 15,4; 27,7), kemoterapi kolunda ise 8,3 ay (%95 GA:6; 13,7) olup; HR=0,48'dir (%95 GA:0,33;
0,69).
Önceden tedavi edilmiş ALK pozitif, ilerlemiş KHDAK – randomize faz 3 Çalışma A2303 (ASCEND-5)
Önceden krizotinible tedavi edilmiş olan ALK Pozitif, ilerlemiş KHDAK'lı hastaların tedavisinde ZYKADIA'nın etkililiği ve güvenliliği bir global, çok merkezli, randomize, açık etiketli faz 3 çalışma A2303'te gösterilmiştir.
İlerlemiş ALK pozitif KHDAK'lı ve önceden krizotinib ve kemoterapiyle tedavi görmüş (platin bazlı çift kemoterapi dahil bir veya iki rejim) toplam 231 hasta analize dahil edilmiştir. 115 hasta ZYKADIA tedavisine ve 116 hasta kemoterapiye randomize edilmiştir (pemetreksed veya dosetaksel). 73 hasta dosetaksel ve 40 hasta pemetreksed almıştır. Seritinib kolunda 115 hasta günde bir kez aç karnına 750 mg ile tedavi edilmiştir. Medyan yaş 54'tür (28 - 84 yaş aralığında) ve hastaların %77,1'i 65 yaşından küçüktür. Hastaların toplam %55,8'i kadındır. Çalışma popülasyonunun %64,5'i beyaz, %29,4'ü asyalı, %0,4'ü siyah ve %2,6'sı diğer ırklardandır. Hastaların çoğunda adenokarsinom (%97) vardır ve hiç sigara kullanmamış veya sigarayı bırakmışlardır (%96,1). Doğu İşbirliği Onkoloji Grubu (ECOG) performans durumu hastaların %46,3'ü, %47,6'sı ve %6,1'inde sırasıyla 0, 1, 2'dir ve hastaların %58'sinde başlangıçta beyinde metastaz vardır. Tüm hastalar önceden krizotinible tedavi edilmiştir. Bir hasta dışındaki tüm hastalar ilerlemiş hastalık için kemoterapi almıştır (platin bazlı çiftli kemoterapi dahil); seritinib kolundaki hastaların %11,3'ü ve kemoterapi kolundaki hastaların
%12,1'i ilerlemiş hastalık için önceden iki kemoterapi rejimi almıştır.
Araştırıcının fikrine göre klinik yararın devam ediyor olması halinde, hastaların ilk başlangıç sonrasında da atanan çalışma tedavisine devam etmelerine izin verilmiştir. Kemoterapi koluna
randomize edilen hastaların, BIRC tarafından doğrulanmış, RECIST tanımına göre hastalık progresyonu yaşamaları halinde ZYKADIA'ya çapraz geçiş yapmalarına izin verilmiştir.
Medyan izlem süresi 16,5 aydır (randomizasyondan veri kesme tarihine kadar).
Çalışma, kemoterapi koluna kıyasla seritinib kolunda %51 olarak hesaplanan risk azalması ile, BIRC'e göre PFS'de istatistiksel olarak anlamlı iyileşme olduğunu göstererek birincil hedefine ulaşmıştır (bkz. Tablo 4 ve Şekil 3). ZYKADIA'nın PFS yararı yaş, cinsiyet, ırk, sigara kullanım durumu, ECOG performans durumu ve başlangıçta beyin metastazlarının varlığı ya da önceden krizotinibe yanıt verilmesi dahil olmak üzere çeşitli alt gruplar arasında tutarlıdır. PFS yararı, bölgesel araştırıcı değerlendirmesi ve ORR ve DCR analizi ile de desteklenmektedir.
OS verileri seritinib kolunda 48 (%41,7) ve kemoterapi kolunda 50 olayla (%43,1) olgun değildir; bu olaylar nihai OS analizinde gereken olay sayısının yaklaşık %50'sine karşılık gelmektedir. Buna ek olarak, kemoterapi kolundaki 81 hasta (%69,8) çalışma tedavisinin kesilmesinin ardından ilk antineoplastik tedavi olarak ZYKADIA almıştır.
Çalışma A2303'ten elde edilen etkililik verileri Tablo 4'te verilmiş ve PFS ve OS için Kaplan- Meier eğrileri ise sırasıyla Şekil 3 ve Şekil 4'de gösterilmiştir.
![]()
Tablo 4 ASCEND-5 (Çalışma A2303) – Önceden tedavi edilmiş, ALK-pozitif, metastatik/ilerlemiş KHDAK'lı hastalarda etkililik sonuçları
Seritinib
(N=115)
Kemoterapi (N=116)
İzlem süresi Medyan (ay) (min-maks) | 16,5 (2,8 – 30,9) |
Progresyonsuz sağkalım (BIRC'e göre) | |
Olay sayısı, n (%) | 83 (%72,2) 89 (%76,7) |
Medyan, ay (%95 GA) | 5,4 (4,1; 6,9) 1,6 (1,4; 2,8) |
HR (%95 GA) | 0,49 (0,36; 0,67) |
p-değeri | <0,001 |
Genel sağkalım |
|
Olay sayısı, n (%) | 48 (%41,7) 50 (%43,1) |
Medyan, ay (%95 GA) | 18,1 (13,4; 23,9) 20,1 (11,9; 25,1) |
HR (%95 GA) | 1 (0,67; 1,49) |
p-değeri | 0,496 |
Tümör yanıtları (BIRC'e göre)
Objektif Yanıt Oranı (%95 GA) %39,1 (30,2; 48,7) %6,9 (3; 13,1)
Yanıt süresi Yanıt veren hasta sayısı |
45 |
8 |
Medyan, ay (%95 GA) | 6,9 (5,4; 8,9) | 8,3 (3,5; NE) |
9 ayda olaysızlık olasılığı (%95 GA) | tahmini, %31,5 (%16,7; %47,3) | %45,7 (%6,9; %79,5) |
HR=risk oranı; GA =güven aralığı; BIRC=Körlenmiş Bağımsız İnceleme Komitesi;
NE=hesaplanamaz
ayarlanmamıştır.
![]()
Şekil 3 ASCEND-5 (Çalışma A2303) –BIRC değerlendirmesine göre progresyonsuz
sağkalım için Kaplan-Meier grafiği
Olaysızlık olasılığı (%)

![]()
![]()
Zaman (Ay)
Halen risk altındaki hasta sayısı
|
|
|
|
|
|
|
|
|
|
|
|
|
Şekil 4 ASCEND-5 (Çalışma A2303) –Tedavi koluna göre genel sağkalımın Kaplan- Meier grafiği


Olaysızlık olasılığı (%)
Halen risk altındaki hasta sayısı
EORTC QLQ C30/LC13, LCSS ve EQ-5D-5L kullanılarak hasta tarafından bildirilen sonuç anketleri toplanmıştır. Çalışma süresince zaman noktalarının çoğunda seritinib ve kemoterapi kollarındaki hastaların %75'i veya daha fazlası LCSS anketlerini doldurmuştur. Kemoterapiye kıyasla ZYKADIA için akciğer kanserine özgü semptomların çoğunda anlamlı iyileşmeler bildirilmiştir (altı LCSS skorundan dördü ve 12 QLQ-LC13 semptom skorundan 10'u). Seritinib, kansere özgü semptomlar olan öksürük, ağrı ve dispne için kötüleşmeye kadar olan süreyi anlamlı şekilde uzatmıştır (kompozit sonlanım noktası LCSS:HR=0,40; 95% GA:0,25; 0,65; Kötüleşmeye kadar olan medyan zaman [TTD] seritinib kolunda 18 aya kıyasla [%95 GA:13,4; NE] kemoterapi kolunda 4,4 ay [%95 GA:1,6; 8,6]; LC13:HR=0,34; %95 GA:0,22;
0,52; medyan TTD seritinib kolunda 11,1 aya kıyasla [%95 GA:7,1; 14,2] kemoterapi kolunda 2,1 ay [%95 GA:1; 5,6]). EQ-5D anketinde kemoterapiye kıyasla ZYKADIA ile genel sağlık durumunda anlamlı iyileşme gözlenmiştir.
A2303 çalışmasında, başlangıçta beyin metastazları olan 133 hasta (seritinib kolundan 66 hasta ve kemoterapi kolundan 67 hasta) değiştirilmiş RECIST 1.1'e göre (beyinde 5 adede kadar lezyon) BIRC nöro-radyolog hekim tarafından intrakraniyal yanıt açısından değerlendirilmiştir. Başlangıçta beyinde ölçülebilir hastalığı olan ve başlangıç sonrası en az bir değerlendirme yapılan hastalarda genel intrakraniyal yanıt oranı (OIRR) kemoterapi koluna kıyasla (%5; %95 GA:0,1; 24,9) seritinib kolunda (%35,3; %95 GA:14,2; 61,7) daha yüksektir. RECIST 1.1'in kullanıldığı BIRC'e göre medyan PFS, beyin metastazları olan ve olmayan hasta alt gruplarında kemoterapi koluna kıyasla seritinib kolunda daha uzundur. Beyin metastazları olan hastalarda
medyan PFS seritinib kolunda 4,4 ay (%95 GA:3,4; 6,2), kemoterapi kolunda ise 1,5 aydır (%95 GA:1,3; 1,8); HR=0,54'tür (%95 GA:0,36; 0,8). Beyin metastazları olmayan hastalarda medyan PFS seritinib kolunda 8,3 ay (%95 GA:4,1; 14), kemoterapi kolunda ise 2,8 aydır (%95 GA:1,4;
4,1); HR=0,41 (%95 GA:0,24; 0,69).
Doz optimizasyon Çalışması A2112 (ASCEND-8)
Yemek ile birlikte alınan ZYKADIA 450 mg'ın etkililiği, çok merkezli, açık etiketli bir doz optimizasyon çalışması olan A2112'de (ASCEND-8) değerlendirilmiştir. ALK-pozitif lokal ileri veya metastatik KHDAK'li daha önce tedavi edilmemiş toplam 147 hasta, günde bir kez yemek ile birlikte ZYKADIA 450 mg (N=73) veya günde bir kez aç karnına ZYKADIA 750 mg'a (N=74) randomize edilmiştir. Kritik ikincil etkililik sonlanım noktalarından birisi, BIRC tarafından değerlendirildiği şekilde, RECIST 1.1'e göre ORR olarak belirlenmiştir.
ALK-pozitif lokal ileri evre veya metastatik KHDAK'lı daha önce tedavi görmemiş hastaların, yemek ile 450 mg (N=73) ve aç karnına 750 mg (N=74) olan iki kol arasındaki popülasyon özellikleri şu şekildedir: sırasıyla yaş ortalaması 54,3 ve 51,3, 65 yaşından küçükler (%78,1 ve %83,8), kadın (%56,2 ve %47,3), beyaz (%49,3 ve %54,1), asyalı (%39,7 ve %35,1), daha önce hiç sigara içmemiş veya daha önce sigara kullanmış ve bırakmış (%90,4 ve %95,9), WHO PS 0 veya 1 (%91,7 ve %91,9), adenokarsinom histolojisi (%98,6 ve %93,2)
ve beyine metastaz (%32,9 ve %28,4).
ASCEND-8'in etkililik sonuçları aşağıdaki Tablo 5'te özetlenmiştir.
Tablo 5 ASCEND-8 (Çalışma A2112) – Daha önce tedavi edilmemiş, BIRC'ye göre
ALK-pozitif lokal ileri veya metastatik KHDAK'li hastalarda etkililik sonuçları
Etkililik Parametresi | Seritinib 450 mg yemek ile | Seritinib 750 mg aç |
| birlikte (N=73) | karnına (N=74) |
Genel Yanıt Oranı (ORR: | 57 (78,1) | 56 (75,7) |
CR+PR), n (%) (95% GA) | (66,9; 86,9) | (64,3; 84,9) |
GA: Güven Aralığı
Tam Yanıt (CR), Kısmı Yanıt (PR), ilk yanıt kriterleri sağlandıktan en az 4 hafta sonra, tekrar
değerlendirmeleri ile doğrulanmıştır
RECIST 1.1'e göre BIRC değerlendirmesine dayalı olarak belirlenmiş genel yanıt oranı
![]()
Tek kollu X2101 ve A2201 çalışmaları
Önceden bir ALK inhibitörü ile tedavi edilen ALK-pozitif KHDAK hastalarının tedavisinde ZYKADIA'nın kullanımı 2 global, çok merkezli, açık etiketli, tek kollu faz 1/2 çalışmada incelenmiştir (Çalışma X2101 ve Çalışma A2201).
Çalışma X2101'de, toplam 246 ALK-pozitif KHDAK hastası günde bir kez aç karnına 750 mg ZYKADIA dozunda tedavi edilmiştir: bunlardan 163'ü önceden bir ALK inhibitörü ile tedavi görmüştür ve 83'ü daha önce hiç ALK inhibitörü kullanmamıştır.
Çalışmada 750 mg dozunda tedavi edilen 163 ALK-pozitif KHDAK hastasının medyan yaşı 52'dir (aralık: 24 ile 80 yaş); hastaların %86,5'i 65 yaşın altında ve %54'ü kadındır. Hastaların büyük kısmı beyaz (%63,3) ve asyalı (%28,8) hastalardır. %93,3'ünde adenokarsinom vardır ve %96,9'u ya hiç sigara kullanmamışlardır ya da sigarayı bırakmışlardır. Tüm hastalar bu çalışmaya alınmadan önce en az bir rejim ile, %84'ü önceden iki veya daha fazla rejim ile tedavi edilmiştir.
A2201 çalışması, önceden 1-3 kür sitotoksik kemoterapi alan, ardından krizotinib ile tedavi edilen ve sonrasında krizotinib tedavisinde progrese olan 140 hastadan oluşmaktadır. Medyan yaş 51'dir (aralık: 29 ile 80 yaş); hastaların %87,1'i 65 yaşın altında ve %50'si kadındır.
Hastaların büyük kısmı beyaz (%60) ve asyalıdır (%37,9). Hastaların %92,1'inde adenokarsinom vardır.
İki çalışmanın başlıca etkililik verileri Tablo 6'da özetlenmektedir. Çalışma A2201 için genel sağkalım (GS) final verileri aşağıda gösterilmektedir. Çalışma X2101'in analiz edildiği tarihte ise GS verileri henüz olgunlaşmamıştır.
Tablo 6 ALK-pozitif ilerlemiş KHDAK – Çalışma X2101 ve A2201'in etkililik
sonuçlarının özeti
| Çalışma X2101 seritinib 750 mg | Çalışma A2201 seritinib 750 mg |
| N=163 | N=140 |
Takip süresi | 10,2 | 14,1 |
Medyan (ay) (min - maks) | (0,1 – 24,1) | (0,1 – 35,5) |
Genel yanıt oranı Araştırıcı (%95 GA) |
%56,4 (48,5; 64,2) |
%40,7 (32,5; 49,3) |
BIRC (%95 GA) | %46 (38,2; 54) | %35,7 (27,8; 44,2) |
Yanıt süresi * Araştırıcı (ay, %95 GA) |
8,3 (6,8; 9,7) |
10,6 (7,4; 14,7) |
BIRC (ay, %95 GA) | 8,8 (6; 13,1) | 12,9 (9,3; 18,4) |
Progresyonsuz sağkalım Araştırıcı (ay, %95 GA) |
6,9 (5,6; 8,7) |
5,8 (5,4; 7,6) |
BIRC (ay, %95 GA) | 7 (5,7; 8,7) | 7,4 (5,6; 10,9) |
Genel sağkalım (ay, %95 GA) | 16,7 (14,8; NE) | 15,6 (13,6; 24,2) |
NE = hesaplanabilir değil
Çalışma X2101: Yanıtlar RECIST 1.0 kullanılarak değerlendirilmiştir Çalışma A2201: Yanıtlar RECIST 1.1 kullanılarak değerlendirilmiştir
* Sadece doğrulanmış CR, PR'li hastaları içerir
![]()
Çalışma X2101 ve A2201'de beyin metastazları sırasıyla hastaların %60,1 ve %71,4'ünde görülmüştür. Başlangıçta beyin metastazları olan hastaların ORR, DOR ve PFS değerleri (BIRC değerlendirmesine göre), bu çalışmaların genel popülasyonu için bildirilenle tutarlı olmuştur.
Adenokarsinom dışı histoloji:
Adenokarsinom dışı histolojiye sahip ALK-pozitif KHDAK hastalarında sınırlı bilgi mevcuttur.
Geriyatrik hastalar:
Yaşlı hastalarda sınırlı etkililik verileri mevcuttur. 85 yaşın üzerindeki hastalarda etkililik verisi
bulunmamaktadır.
5.2. Farmakokinetik özellikler
Genel özelliklerEmilim:
Seritinibin pik plazma düzeylerine (C) hastalarda oral uygulamayı takiben yaklaşık 4 ile 6 saatte ulaşılmaktadır. Feçesteki metabolit yüzdelerine dayalı olarak oral emilimin ≥%25 olduğu hesaplanmıştır. Seritinibin mutlak biyoyararlanımı henüz saptanmamıştır.
Yiyecek ile birlikte seritinibe sistemik maruziyet artmaktadır. Seritinib EAAdeğerleri, sağlıklı bireylerde, ilacın aç karnına alındığı durumla karşılaştırıldığında, tek bir 500 mg
seritinib dozunun düşük yağlı bir öğünle (yaklaşık 330 kilokalori ve 9 gram yağ içeren) ve yüksek yağlı bir öğünle (yaklaşık 1000 kilokalori ve 58 gram yağ içeren) uygulandığı durumda yaklaşık %58 ve %73 daha yüksek olmuştur (Cyaklaşık %43 ve %41 daha yüksek).
Yemek ile birlikte günlük ZYKADIA 450 mg veya 600 mg (yaklaşık 100 ila 500 kilokalori ve 1,5 ila 15 gram yağ) ile aç karnına günlük 750 mg (ilk ruhsatlandırılmış besin ve doz koşulları) karşılaştıran bir doz optimizasyon çalışması olan A2112'de (ASCEND-8), aç karnına uygulama kolu 750 mg (N=31) ile karşılaştırıldığında yemek ile birlikte uygulanan 450 mg (N=36) kolunda seritinibin sistemik kararlı durum maruziyetinde klinik olarak anlamlı bir fark belirlenmemiştir; sadece kararlı durum EAA'da (%90 GA) %4 (-%13, %24) ve C'ta (% 90 GA) %3 (-%14, %22) gibi küçük artışlar olmuştur. Buna karşılık, aç karnına uygulamanın yapıldığı 750 mg kolu ile karşılaştırıldığında yemek ile birlikte uygulanan 600 mg (N=30) kolunda kararlı durum EAA (%90 GA) ve C(%90 GA) sırasıyla %24 (%3, %49) ve %25 (%4, %49) artmıştır. Önerilen maksimum ZYKADIA dozu, yemek ile birlikte günde bir kez oral yoldan 450 mg'dır (bkz. Bölüm 4.2).
Hastalarda tek oral seritinib uygulamasından sonra Cve EAAdeğerleri ile ifade edilen plazma seritinib maruziyeti, 50 ile 750 mg doz aralığında aç karnına alındığında dozla oransal olarak artmıştır. Tek doz verilerinin aksine, tekrarlı günlük dozlardan sonra doz öncesi konsantrasyonun (C) doz-oransaldan daha yüksek oranda arttığı görülmüştür.
Dağılım:
Seritinibin in vitro şartlarda insan plazma proteinlerine bağlanma oranı, 50 ng/ml ile 10.000 ng/ml aralığında konsantrasyondan bağımsız şekilde yaklaşık %97'dir. Seritinib ayrıca plazmaya kıyasla kırmızı kan hücrelerine biraz daha tercihli dağılıma sahip olup ortalama in vitro kan-plazma oranı 1,35'dir. İn vitro veriler seritinibin P-glikoprotein (P-gp) substratı olduğunu fakat meme kanseri direnç proteini (BCRP) veya çoklu direnç proteini 2'nin (MRP2) substratı olmadığını düşündürmektedir. Seritinibin in vitro koşullarda görünür pasif geçirgenliğinin düşük olduğu belirlenmiştir.
Sıçanda seritinib sağlam kan beyin bariyerini geçer ve beyin-kan maruziyeti (EAA) oranı yaklaşık %15'tir. İnsanda beyin-kan maruziyet oranı ile ilgili veri bulunmamaktadır.
Biyotransformasyon:
İn vitro çalışmalar, CYP3A'nın seritinibin metabolik klirensinde görev alan başlıca enzim
olduğunu göstermiştir.
Aç karnına 750 mg düzeyinde tek oral radyoaktif seritinib uygulamasından sonra seritinib insan plazmasında dolaşımdaki ana bileşen olmuştur. Plazmada dolaşan toplam 11 metabolit bulunmuştur; bunların düzeyleri düşük olup radyoaktivite EAA değerine ortalama katkıları her bir metabolit için ≤%2,3'tür. Sağlıklı gönüllülerde tanımlanan başlıca biyotransformasyon yolakları mono-oksijenasyon, O-dealkilasyon ve N-formilasyonu içermektedir. Birincil biyotransformasyon ürünlerini içeren ikincil biyotransformasyon yolakları arasında glukuronidasyon ve dehidrojenasyon yer almıştır. O-dealkile seritinibe bir tiol grubunun eklendiği de gözlenmiştir.
Eliminasyon:
Seritinibin aç karnına tek oral dozlarından sonra hastalarda seritinibin geometrik ortalama görünür plazma terminal yarı ömrü (T) 400 ile 750 mg doz aralığında 31 ile 41 saat arasında olmuştur. Seritinibin günlük oral doz uygulamaları sonucunda kararlı duruma yaklaşık 15 günde ulaşılır ve bundan sonra stabil seyreder; 3 hafta süreyle günlük doz uygulamalarından sonra geometrik ortalama birikme oranı 6,2'dir. Seritinibin geometrik ortalama görünür klirensi (CL/F), 750 mg tek oral dozuna (88,5 litre/saat) kıyasla günde bir kez 750 mg oral doz
uygulamasından sonra kararlı durumda daha düşük olarak (33,2 litre/saat) seritinibin zaman içinde doğrusal olmayan farmakokinetik özellikler sergilediğini düşündürmüştür.
Seritinib ve metabolitlerinin birincil atılım yolu feçes iledir. Feçeste tespit edilen değişmemiş seritinib oral dozun ortalama %68'ini oluşturur. Uygulanan oral dozun sadece %1,3'ü idrarda tespit edilir.
Hastalardaki karakteristik özellikler
Karaciğer yetmezliği olan hastalar: Karaciğer bozukluğunun seritinibin tek doz farmakokinetiği üzerindeki etkisi (aç karnına 750 mg) hafif (Child-Pugh sınıf A; N=8), orta derecede (Child- Pugh sınıf B; N=7) ya da şiddetli (Child-Pugh C sınıfı; N=7) karaciğer yetmezliği olan hastalarda ve normal karaciğer fonksiyonuna sahip 8 sağlıklı bireyde değerlendirilmiştir. Normal hepatik fonksiyona sahip olan bireylere kıyasla, hafif ve orta şiddette karaciğer yetmezliği olan kişilerde, seritinibin geometrik ortalama EAAdeğeri (bağlanmamış EAA), sırasıyla %18 (%35) ve %2 (%22) yükselmiştir.
Seritinibin geometrik ortalama EAA(bağlanmamış EAA) değeri, normal karaciğer fonksiyonuna sahip olan bireylere göre şiddetli karaciğer yetmezliği olan kişilerde %66 (%108) artmıştır (bkz. Bölüm 4.2). Karaciğer bozukluğu olan hastalarda kararlı koşullar altında çalışılmış özel bir farmakokinetik çalışma gerçekleştirilmemiştir.
Böbrek yetmezliği olan hastalar: Böbrek bozukluğu olan hastalarda özel bir farmakokinetik çalışma gerçekleştirilmemiştir. Eldeki verilere dayanılarak, seritinibin böbrek yoluyla eliminasyonu göz ardı edilebilir düzeydedir (tek oral uygulanan dozun %1,3'ü).
Hafif böbrek bozukluğu olan 345 hasta (Kreatinin klirensi 60 ile <90 mL/dk), orta dereceli böbrek bozukluğu (CLcr 30 ile <60 mL/dk) olan 82 hasta ve normal renal fonksiyonu olan 546 hastanın (≥90 mL/dk) popülasyon farmakokinetik analizine dayalı olarak, seritinib maruziyetleri hafif ve orta dereceli böbrek bozukluğu olan hastalarda ve normal renal fonksiyonu olan hastalarda benzer olup bu da hafif ile orta dereceli böbrek bozukluğu olan hastalarda herhangi bir doz ayarlamasının gerekli olmadığını düşündürmektedir. Şiddetli böbrek bozukluğu (CLcr <30 mL/dk) olan hastalar ZYKADIA klinik çalışmalarına dahil edilmemiştir (bkz. Bölüm 4.2).
Yaş, cinsiyet ve ırk etkisi: Popülasyon farmakokinetiği analizleri yaş, cinsiyet ve ırkın, seritinib maruziyeti üzerinde anlamlı bir etkisinin olmadığını göstermiştir.
Kardiyak elektrofizyoloji: Seritinibin QT aralığında uzatma potansiyeli, ZYKADIA ile gerçekleştirilen yedi klinik çalışmada değerlendirilmiştir. Aç karnına günde bir kez 750 mg ZYKADIA ile tedavi edilmiş 925 hastada seritinibin QT aralığı üzerindeki etkisini değerlendirmek üzere tek dozdan sonra ve kararlı durumda seri EKG'ler çekilmiştir. EKG verilerinin kategorik uç değerler analizi 12 hastada (%1,3) yeni QTc >500 milisaniye durumu göstermiştir. Başlangıca göre > 60 milisaniye QTc uzaması olan 58 hasta (%6,3) belirlenmiştir. Çalışma A2301'den gelen ortalama kararlı durum konsantrasyonlarında QTc verilerinin merkezi eğilim analizi iki yönlü %90 güven aralığının üst sınırının aç karnına ZYKADIA 750 mg dozunda 15,3 milisaniye olduğunu göstermiştir. Bir farmakokinetik analiz, seritinibin QTc değerinde konsantrasyona bağlı artışlara neden olduğunu öne sürmüştür (bkz. Bölüm 4.4).
5.3. Klinik öncesi güvenlilik verileri
Güvenlilik farmakolojisi çalışmaları, seritinibin solunum ve santral sinir sistemlerinin hayati işlevlerine müdahale etmesinin olası olmadığına işaret etmektedir. İn vitro veriler seritinibin hERG potasyum kanalı üzerindeki inhibitör etkisinin IC50 değerinin 0,4 mikromol olduğunu göstermektedir. Maymunlarla gerçekleştirilen bir in vivo telemetri çalışmasında en yüksek seritinib dozu alındıktan sonra 4 hayvanın 1'inde düşük dereceli QT uzaması olduğunu
göstermiştir. 4 veya 13 hafta süreyle seritinib dozlarını takiben maymunlarda yürütülen EKG çalışmaları QT uzaması ya da anormal EKG'ler göstermemiştir.
TK6 hücrelerindeki mikronükleus testi pozitif sonuç vermiştir. Seritinib ile gerçekleştirilen diğer in vitro ve in vivo genotoksisite çalışmalarında herhangi bir mutajenisite ve klastojenisite belirtisi gözlenmemiştir. Dolayısıyla, insanda genotoksik risk beklenmemektedir.
Seritinib ile karsinojenisite çalışmaları gerçekleştirilmemiştir.
Gebe sıçanlar ve tavşanlar ile gerçekleştirilen üreme toksikolojisi çalışmaları (yani embriyo- fetal gelişim çalışmaları) organojenez sırasındaki seritinib doz uygulaması sonrasında fetotoksisite veya teratojenisiteye işaret etmemiştir ancak maternal plazma maruziyeti, önerilen insan dozu ile gözlenenden düşük bulunmuştur. Seritinibin fertilite üzerindeki potansiyel etkilerine yönelik resmi klinik dışı çalışmalar gerçekleştirilmemiştir.
Sıçan ve maymunda seritinib uygulaması ile ilişkili başlıca toksisite, periferik kanda nötrofil sayısında artışın eşlik ettiği ekstrahepatik safra yollarının enflamasyonu olmuştur. Ekstrahepatik safra yollarının karma hücre/nötrofilik enflamasyonu daha yüksek dozlarda pankreasa ve/veya duodenuma yayılmıştır. Gastrointestinal toksisite iki türde de gözlemlenmiş olup beden ağırlığında azalma, yem tüketiminde azalma, kusma (maymun), ishal ve yüksek dozlarda erozyon, mukoza enflamasyonu ve duodenal kriptlerde ve alt mukoza tabakasında köpüksü makrofajları içeren histopatolojik lezyonlar ile karakterizedir. Ayrıca, insan için önerilen en yüksek doz düzeylerinde iki türde de karaciğer etkilenmiştir ve bu durum az sayıda hayvanda karaciğer transaminazlarda minimal artışları ve intrahepatik safra epitelinde boşluk oluşumunu içermektedir. Sıçanların akciğerlerinde alveolar köpüksü makrofajlar (doğrulanmış fosfolipidozis) görülürken aynı etki maymunlarda görülmemiştir ve sıçanların ve maymunların lenf bezlerinde makrofaj kümeleşmeleri bulunmuştur. Hedef organ etkileri, kısmi ile tam arası düzelme göstermiştir.
Gerek sıçanda (mikroskobik korelasyon olmaksızın tiroit uyarıcı hormonda ve triiodotironin/ tiroksin T3/T4 konsantrasyonlarında hafif artışlar) gerekse maymunda (4 haftalık çalışmalarda erkeklerde koloid deplesyonu ve 13 haftalık çalışmada bir maymunda yüksek dozda yaygın foliküler hücre hiperplazisi ve tiroit uyarıcı hormonda artış) tiroit üzerinde etkiler gözlenmiştir. Bu klinik dışı etkiler hafif dereceli, değişken ve tutarsız olduğundan, hayvanlarda seritinib ile tiroit bezi değişiklikleri arasındaki ilişki net değildir.
 Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır.
Ağız Kanseri
Ağız kanserinin en yaygın türleri, dudak, dil, dişetidir. Nadiren
yanak içi veya damak bölgelerini de içine alır. |
 Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır.
Grip, Soğuk Algınlığı ve Öksürük
Grip ve soğuk algınlığı (nezle) semptomları arasındaki farkı bilmek önemlidir. Soğuk algınlığı gripten daha hafif belirtiler gösteren bir solunum yolu hastalığıdır. |
İLAÇ GENEL BİLGİLERİ
Novartis Sağlık,Gıda ve Tarım Ürünleri San. Tic. A.Ş.
| Geri Ödeme Kodu | A16808 |
| Satış Fiyatı | 110539.17 TL [ 24 Mar 2025 ] |
| Önceki Satış Fiyatı | 110539.17 TL [ 17 Mar 2025 ] |
| Original / Jenerik | Original İlaç |
| Reçete Durumu | Normal Reçeteli bir ilaçdır. |
| Barkodu | 8699504152050 |
| Etkin Madde | Seritinib |
| ATC Kodu | L01ED02 |
| Birim Miktar | 150 |
| Birim Cinsi | MG |
| Ambalaj Miktarı | 150 |
| Antineoplastik ve İmmünomodülatör Ajanlar |
| İthal ( ref. ülke : Isvicre ) ve Beşeri bir ilaçdır. |
İLAÇ EŞDEĞERLERİ
| Eşdeğer İlaç Adı | Barkodu | İlaç Fiyatı |
|---|---|---|
| Eşdeğer bir ilaç bulunamadı |
 |
Gıda Alerjisi Her yıl milyonlarca insan yiyeceklere alerji gösteriyor. |
 |
Doğum Sonrası Depresyonu Doğum sonrası depresyonu, doğumdan sonra her on kadından biri tarafından tecrübe edilen stresli bir durumdur. |
 |
Asperger Sendromu Asperger sendromu, otistik gurubun bir bölümü olan bir özürdür. Bu genelde, gurubun daha ”yüksek” tarafında yer aldığı düşünülen kişilere uygun bir tanıdır. |