CEFORCE 0.5 G IM enjeksiyonluk çözelti hazýrlamak için toz ve çözücü Farmasötik Özellikler

İstanbul İlaç Sanayi ve Tic. A.Ş.
[ 6 October 2020 ]

İstanbul İlaç Sanayi ve Tic. A.Ş.
[ 6 October 2020 ]
Her 2 ml %1 Lidokain hidroklorür çözeltisi içeren ampulde; Lidokain hidroklorür
Sodyum klorür
Sodyum hidroksit / hidroklorik asit (pH ayarlayıcı) Enjeksiyonluk su
CEFORCE içeren çözeltiler diğer ajanlar ile karıştırılmamalı veya diğer ajanlara eklenmemelidir. Özellikle, kalsiyum içeren seyrelticiler (örneğin Ringer çözeltisi veya Hartmann çözeltisi) seftriakson flakonlarını rekonstitüe etmek için veya rekonstitüe edilmiş bir flakonu IV uygulama için daha fazla seyreltmek için kullanılmamalıdır, çünkü çökelti oluşabilir. Seftriakson ve kalsiyum içeren çözeltiler karıştırılmamalı veya aynı anda uygulanmamalıdır.
Literatürlerde seftriaksonun amsakrin, vankomisin, flukonazol, aminoglikozidler ve labetalol ile geçimsiz olduğu bildirilmiştir.
36 ay
25°C altındaki oda sıcaklığında saklayınız.
CEFORCE 0.5 g IM enjeksiyonluk çözelti hazırlamak için toz ve çözücü kutu içerisinde 1 adet flakon
+ 1 adet 2 ml %1 Lidokain HCl içeren çözücü ampul
Kullanılmamış ürünler ya da atık materyaller a€œTıbbi Atıkların Kontrolü Yönetmeliğia€ ve a€œAmbalaj ve Ambalaj Atıklarının Kontrolü Yönetmelika€lerine uygun olarak imha edilmelidir.
Kural olarak, çözeltiler hazırlandıktan sonra hemen kullanılmalıdır.
Çözeltilerin renkleri, konsantrasyon ve saklama süresine bağlı olarak açık sarı ile bal rengi arasında değişir. Solüsyonun renginin değişmesi ilacın etki ve toleransını etkilemez.
İntramüsküler enjeksiyon: İntramüsküler enjeksiyon için 0.5 g CEFORCE 2 ml %1'lik lidokain çözeltisinde çözülür ve derin intragluteal enjeksiyon şeklinde uygulanır. Her iki tarafa da 1 g'dan fazla enjekte edilmemesi önerilmektedir. Lidokain içermeyen IM enjeksiyonlar ağrılıdır. Lidokain çözeltisi asla IV uygulanmamalıdır.
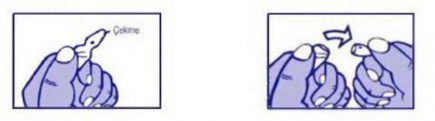
Ampulün baş kısmı ok yönünde aşağıya çekilir. Testere kullanılmasına gerek yoktur.