HIBERIX 1 þýrýnga Farmasötik Özellikler

Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
[ 5 February 2013 ]

Glaxo Smith Kline İlaçları San.Ve Tic.A.Ş
[ 5 February 2013 ]
Liyofilize Hib aşısı
Laktoz (sığır sütünden elde edilir)
Çözücü
Sodyum klorür ve enjeksiyonluk su (%0,9 serum fizyolojik solüsyonu)
HIBERIX, GlaxoSmithKline aşılarından Infanrix (DTPa aşısı) veya Tritanrix HB ( DTPw-HB aşısı) ile aynı enjektörde karıştırılabilir. Diğer enjektabl aşılar daima değişik aşılama bölgelerine uygulanmalıdırlar.
HIBERIX diğer aşılar ile aynı enjektörde karıştırılmamalıdır (onaylı kombinasyonlar hariç).
36 ay
Liyofilize aşı, +2 - +8°C arasında ışıktan korunarak saklanmalıdır. Liyofilize aşı
dondurulmaktan etkilenmez.
Çözücü, buzdolabında (+2 - +8°C arasında) ya da oda ısısında (25°C'ye kadar) saklanabilir. Dondurulmamalıdır.
Liyofilize aşı bir cam flakon içerisinde beyaz toz olarak sunulmaktadır.
Steril çözücü (serum fizyolojik solüsyon (%0,9)) gözle görülür partikül içermeyen, berrak ve renksiz sıvıdır ve kullanıma hazır enjektör içinde sunulmaktadır.
Bromobütil tip I lastik tıpalı, 3 ml'lik renksiz, tip I cam flakon ve FM27 kauçuk uç başlıklı, FM457 boromobütil tip I kauçuk tıpalı renksiz, tip I cam 1,25 ml'lik kullanıma hazır enjektörler, Avrupa Farmakopesi gereklerine uygun olarak yapılmıştır.
Hem çözücü hem de kullanıma hazırlanan aşı rekonstitüsyon veya uygulanma öncesinde herhangi bir yabancı parçacık ve/veya fiziksel görünümünde değişiklik açısından görsel olarak incelenmelidir. Bunlardan birinin görülmesi durumunda çözücü ya da kullanıma hazırlanmış aşıyı kullanmadan atınız.
Kullanıma hazırlama ve aşının uygulanması
HIBERIX, kullanıma hazır enjektördeki çözücünün tümü toz içeren flakona eklenerek hazırlanmalıdır.
Enjektöre iğne takmak için, Resim 1 ve Resim 2'de verilen talimatları dikkatlice okuyunuz.
Bununla birlikte HIBERIX enjektörü resimle gösterilen çizimden biraz farklı olabilir.
İğne
Enjektör
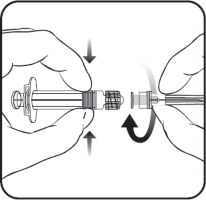
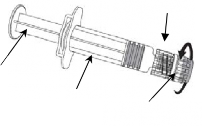
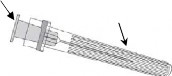
Resim 1 Resim 2
Enjektörü piston veya Luer Kilit Adaptöründen (LKA) değil, her zaman enjektörün gövdesinden tutunuz ve iğneyi şırınga ekseninde tutunuz (Resim 2'de gösterildiği şekilde). Belirtilen şekilde yapılmaması, LKA'nın bozulmasına ve sızıntı yapmasına neden olabilir.
Şırınganın birleştirilmesi sırasında LKA bozulursa, yeni bir aşı dozu (yeni şırınga ve flakon) kullanılmalıdır.
Enjektör başlığını saat yönünün tersine çevirerek açınız (Resim 1'de gösterildiği şekilde).
Aşı uygulanırken yeni bir iğne kullanılmalıdır. İğneyi enjektörden çıkartınız ve 2. basamağı
tekrar ederek enjeksiyon iğnesini takınız.
Yukarıda Geçimsizlikler bölümünde bahsedildiği üzere, HIBERIX, tek dozlu Tritanrix HB veya Infanrix aşıları ile karıştırılabilir. Bu durumda HIBERIX paketinde mevcut olan çözücü, sıvı aşı ile yer değiştirir.
HIBERIX ile beraber karıştırılmak amaçlı kullanılan aşının kabının tek dozluk kap olduğundan emin olunuz. HIBERIX paketinde bulunan çözücü içeren kullanıma hazır enjektörü kullanmadan atınız.
Kombine aşı, diğer aşı içeriğinin beyaz Hib toz içeren flakona ilave edilmesiyle sulandırılır. Hızlıca hazırlanan kombine aşı, sulandırılmış tek bileşenli HIBERIX aşısı ile aynı şekilde uygulanır.