NEULASTIM 6 mg/0.6 ml S.C. enjeksiyon için kullanýma hazýr 1 þýrýnga { Amgen } Farmakolojik Özellikler

Amgen İlaç Tic. Ltd. Şti
[ 9 May 2014 ]

Amgen İlaç Tic. Ltd. Şti
[ 9 May 2014 ]
Farmakoterapötik grubu: İmmünostimülanlar, koloni stimüle edici faktör ATC kodu: L03AA13
Etki mekanizması
İnsan granülosit koloni uyarıcı faktörü (G-CSF) kemik iliğinde nötrofil oluşumu ve salıverilmesini düzenleyen bir glikoproteindir. Pegfilgrastim rekombinant G-CSF'nin (r-metHuG-CSF) tek 20 kd polietilen glikol (PEG) moleküllü kovalent bileşiğidir. Pegfilgrastim azalmış renal klerens nedeniyle filgrastimin uzun etki süreli bir formudur. Pegfilgrastim ve filgrastimin, monositler ve/veya lenfositlerde minör yükselmelerle birlikte periferik kan nötrofil sayılarında 24 saat içinde belirgin bir artışa neden olan, aynı etki tarzına sahip oldukları gösterilmiştir. Kemotaktik ve fagositik fonksiyon testleri ile gösterildiği üzere, pegfilgrastime yanıt olarak üretilen nötrofiller, filgrastime benzer şekilde normal veya artmış fonksiyon göstermektedir. Diğer hematopoietik büyüme faktörleri ile olduğu gibi, G-CSF'nin insan endotelyel hücreleri üzerine in vitro stimülan özellikleri gösterilmiştir. G-CSF, in vitro malign hücreleri de içeren miyeloid hücrelerin gelişimini artırabilir, bazı in vitro non-miyeloid hücrelerde de benzer etkiler görülebilir.
Klinik etkililik ve güvenlilik
Doksorubisin ve dosetakselden oluşan miyelosupresif kemoterapi uygulanmakta olan yüksek riskli evre II-IV meme kanserli hastalarda gerçekleştirilen iki randomize, çift-kör pivotal çalışmada her kür başına tek doz olarak pegfilgrastim kullanılması, günlük filgrastim uygulamaları (ortanca değeri olarak 11 günlük uygulama) ile gözlenene benzer şekilde, nötropeni süresini ve febril nötropeni görülme sıklığını düşürmüştür. Büyüme faktörü desteği verilmediğinde, bu rejimin ortalama 5 ile 7 gün arasında evre 4 nötropeni süresine ve %30-40 febril nötropeni görülme sıklığına neden olduğu bildirilmiştir.
6 mg sabit doz pegfilgrastim kullanılan bir çalışmada (n = 157), evre 4 nötropeni ortalama süresi pegfilgrastim grubunda 1,8 gün olurken, filgrastim grubunda 1,6 gün olmuştur (fark 0,23 gün, %95 GA - 0,15, 0,63). Tüm çalışma boyunca febril nötropeni oranı pegfilgrastimle tedavi edilen hastalarda %13 olurken, filgrastimle tedavi edilen hastalarda %20 olmuştur (fark - %7, %95 GA - %19, %5).
Vücut ağırlığına göre ayarlanmış (100 mikrogram/kg) doz kullanılan ikinci bir çalışmada (n = 310), evre 4 nötropeni ortalama süresi pegfilgrastim grubunda 1,7 gün, filgrastim grubunda 1,8 gün olmuştur (Fark 0,03 gün, %95 GA - 0,36, 0,30). Genel febril nötropeni oranı pegfilgrastimle tedavi edilen hastalarda %9 ve filgrastimle tedavi edilen hastalarda %18 olmuştur (fark - %9, %95 GA - %16,8, -%1,1).
Meme kanserli hastalarda gerçekleştirilen plasebo kontrollü, çift-kör bir çalışmada pegfilgrastimin febril nötropeni sıklığı üzerindeki etkisi, %10-20'lik bir febril nötropeni oranıyla ilişkili olduğu bildirilen bir kemoterapi rejiminin (4 kür boyunca her 3 haftada bir 100 mg/m2 dosetaksel) uygulanmasından sonra değerlendirilmiştir. Bu çalışmada 928 hasta her siklusta kemoterapiden yaklaşık 24 saat (2. günde) sonra tek bir doz pegfilgrastim veya plasebo almak üzere randomize edilmiştir. Febril nötropeni sıklığı, plaseboyla karşılaştırıldığında pegfilgrastim almak üzere randomize edilen hastalarda önemli ölçüde düşüktür (%17'ye karşılık %1, p < 0,001). Febril nötropeni klinik tanısıyla ilişkili hastaneye yatma ve IV anti-infektif kullanımı sıklığı, pegfilgrastim grubunda plasebo grubuyla karşılaştırıldığında önemli ölçüde düşüktür (%1'e karşılık %14, p < 0,001 ve %2'ye karşılık
%10, p < 0,001).
De novo AML için kemoterapi alan hastalarda yapılan küçük bir (n = 83), faz II, randomize, çift-kör çalışmada, indüksiyon kemoterapisi sırasında uygulanan pegfilgrastim (tek doz 6 mg) ile filgrastim karşılaştırılmıştır. Ciddi nötropeniden ortanca iyileşme süresinin her iki tedavi grubunda 22 gün olduğu tahmin edilmiştir. Uzun süreli sonuç çalışılmamıştır (bkz. Bölüm 4.4).
Vinkristin, doksorubisin ve siklofosfamid (VAdriaC/IE) kemoterapisinin bir küründen sonra 100 mikrogram/kg pegfilgrastim alan pediyatrik sarkoma hastaları ile yapılan bir faz II (n = 37), çok merkezli, randomize, açık etiketli çalışmada, 0-5 yaş arası küçük çocuklarda, 6-11 yaş ve 12-21 yaş arası daha büyük çocuklara (sırasıyla 6 gün ve 3,7 gün) ve erişkinlere kıyasla ciddi nötropeni (nötrofil < 0,5 × 109/L) süresi daha uzun (8,9 gün) olmuştur. Buna ek olarak, 6-11 yaş ve 12-21 yaş arası daha büyük çocuklara (sırasıyla %70 ve %33) ve erişkinlere kıyasla 0-5 yaş arası küçük çocuklarda febril nötropeni insidansı daha yüksek (%75) olmuştur (bkz. Bölüm 4.8 ve 5.2).
Emilim:
Tek bir deri altı pegfilgrastim dozu sonrasında, pegfilgrastim doruk serum konsantrasyonu doz uygulamasının 16 ila 120 saat sonrasında ortaya çıkar.
Dağılım:
Pegfilgrastim serum konsantrasyonları miyelosupresif kemoterapi sonrasındaki nötropeni dönemi boyunca korunur.
Biyotransformasyon:
Veri yoktur.
Eliminasyon:
Pegfilgrastim başlıca olarak, yüksek dozlarda doyuma ulaşan, nötrofil aracılı klerens ile atılmaktadır. Kendini-düzenleyici bir klerens mekanizması ile tutarlı olarak, pegfilgrastim serum konsantrasyonu nötrofil tablosunda düzelmenin ortaya çıkması ile birlikte hızla düşer (Bkz. Şekil 1).
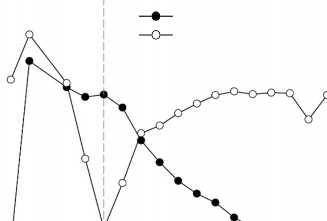
Doğrusallık/Doğrusal olmayan durum:
Pegfilgrastimin farmakokinetiği doz açısından non-lineerdir; pegfilgrastimin serum klerensi doz arttıkça düşer.
Böbrek/Karaciğer yetmezliği:
Nötrofil aracılı klerens mekanizmasına bağlı olarak, pegfilgrastimin farmakokinetiğinin böbrek veya karaciğer bozukluğu tarafından etkilenmesi beklenmez. Açık etiketli bir tek doz çalışmasında (n = 31), son dönem böbrek yetmezliği dahil çeşitli evrelerdeki böbrek yetmezliğinin pegfilgrastimin farmakokinetiğini etkilemediği gözlenmiştir.
Pediyatrik popülasyon:
NEULASTİM®'in farmakokinetiği VAdriaC/IE kemoterapisini tamamladıktan sonra 100 mikrogram/kg NEULASTİM® alan sarkoma hastası olan 37 pediyatrik hastada çalışılmıştır. En genç yaş grubunun (0-5 yaş) (EAA) (± Standart Sapma) (47,9 ± 22,5 mikrogram.saat/mL), 6-11 yaş ve 12-21 yaşlarındaki daha büyük çocuklardan
(sırasıyla (22,0 ± 13,1 mikrogram.saat/mL) ve (29,3 ± 23,2 mikrogram.saat/mL)) daha yüksek ortalama pegfilgrastim maruziyeti olmuştur (bkz. Bölüm 5.1). En genç yaş grubu (0-5 yaş) haricinde, pediyatrik gönüllülerdeki ortalama EAA, doksorubisin/dosetaksel
tedavisini tamamladıktan sonra 100 mikrogram/kg pegfilgrastim alan yüksek riskli evre II-IV
meme kanseri olan yetişkin hastalarla benzer bulunmuştur. (bkz. Bölüm 4.8 ve Bölüm 5.1). Geriyatrik popülasyon:
Sınırlı veriler, yaşlı hastalardaki (> 65 yaş) pegfilgrastimin farmakokinetiğinin erişkinlerdeki ile benzer olduğunu göstermiştir.
Tekrarlayan doz toksisitesiyle ilgili geleneksel çalışmalardan alınan preklinik veriler, lökosit sayımında artışlar, kemik iliğinde miyeloid hiperplazi, ekstramedüler hematopoez ve dalak büyümesi dahil beklenen farmakolojik etkiler göstermiştir.
Subkutan olarak pegfilgrastim verilen gebe sıçanların yavrularında advers etkiler gözlenmemiştir. Ancak önerilen insan dozunun yaklaşık 4 katı kümülatif dozlarda, pegfilgrastim verilen tavşanlarda embriyo/fetal toksisiteye (embriyo kaybı) yol açtığı gösterilmiştir. Sıçanlarla yapılan çalışmalarda pegfilgrastimin plasentayı geçebileceği görülmüştür. Sıçanlarla yapılan çalışmalarda subkutan olarak uygulanan pegfilgrastimin üreme performansını, fertiliteyi, östrus siklusunu, çiftleşme ve koitus arasındaki günler ve intrauterin sağkalımı etkilemediği gösterilmiştir. Bu bulguların insanlar açısından ilgisi bilinmemektedir.